Nuestro objetivo fue evaluar la utilidad de las herramientas FRAX y QFracture en la predicción del riesgo de fractura en un grupo de pacientes con diabetes tipo 2.
Material y métodosEstudio transversal con 78 pacientes. Se evaluó la densidad mineral ósea (DMO) por absorciometría dual por rayos X (DXA). El riesgo a 10 años de presentar cualquier fractura osteoporótica y fractura de cadera se calculó usando las escalas FRAX y QFracture. Los resultados se analizaron con el programa SPSS 15.0.
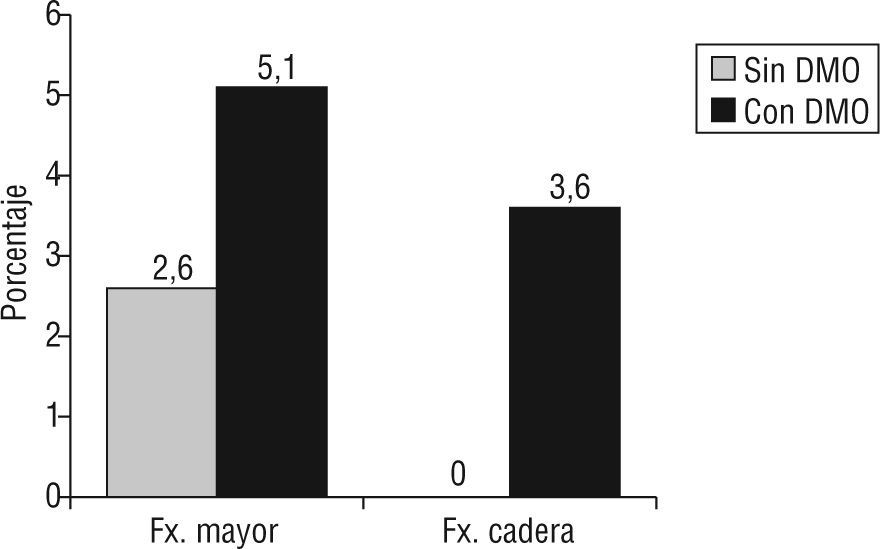
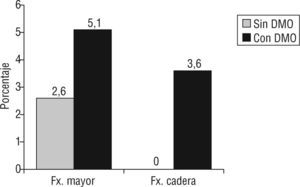
ResultadosLa edad media±desviación estándar de los pacientes fue 57,8±6,4 años; el 22,4% de los pacientes tenía criterios densitométricos de osteoporosis y el 9% tenía fractura previa por fragilidad. Se detectaron fracturas vertebrales radiográficas en un 27,7% de los pacientes. Aplicando la escala FRAX, los pacientes que cumplieron criterios de tratamiento para prevención de fractura mayor osteoporótica fueron el 2,6%, sin tener en cuenta la DMO, y el 5,1% tras introducir la DMO en cadera (p = 0,002). El 2,6% de los pacientes presentaron criterios de intervención para fractura de cadera tras añadir los datos de DMO. Según la escala QFracture, el 3,8% de los pacientes tenía alta probabilidad de cualquier fractura osteoporótica y el 1,3% de fractura de cadera.
ConclusionesEn nuestro grupo de pacientes con diabetes tipo 2 la aplicación de la escalas FRAX y QFracture clasifica a un bajo porcentaje de pacientes como candidatos a tratamiento para la osteoporosis, a pesar del alto riesgo de fractura que presentan estos pacientes como refleja la alta prevalencia de fracturas vertebrales.
To evaluate the performance of the FRAX and QFracture tools in a group of type 2 diabetes mellitus (T2DM) patients.
Material and methodsA cross-sectional study including 78 patients with type 2 diabetes. Lumbar spine and femoral bone mineral density (BMD) were measured by dual X-Ray absorptiometry (Hologic QDR 4500). Ten-year major osteoporotic fracture risk and hip fracture risk were calculated using the FRAX and QFracture tools. Results were analysed using the SPSS 15.0 program.
ResultsMean age was 57.8 years (57.8±6.4). It was found that 22.4% of patients had densitometric criteria for osteoporosis, and 9% had a previous fracture. Prevalent radiographic vertebral fractures were detected in 27.7%. Few patients were selected for treatment according to FRAX: 2.6% for major osteoporotic fracture, 5.1% after introducing hip BMD (p.002) and 2.6% for hip fracture risk only if hip BMD was added. Using QFracture, 3.8% of patients had a high probability of osteoporotic fracture, and 1.3% a hip fracture.
ConclusionsIn our group of type 2 diabetes mellitus patients, a low percentage were selected for treatment using the FRAX tool or QFracture tool despite the high risk of fracture demonstrated by high vertebral fracture rate.
La diabetes y las fracturas secundarias a la osteoporosis son importantes causas de morbimortalidad en todo el mundo. En la mayoría de los estudios epidemiológicos realizados en pacientes con diabetes tipo 2 (DM2), se ha demostrado un aumento de la densidad mineral ósea (DMO)1, a pesar de lo cual existe un riesgo de fractura incrementado de 1,5 para fractura de cadera, húmero proximal y radio distal2,3. En cuanto al riesgo de fractura vertebral, los resultados son menos uniformes, aunque la mayoría de los estudios también muestran un aumento del riesgo4. Se han propuesto diferentes mecanismos que explicarían el mayor riesgo de fractura en la DM2: menor calidad ósea debido a la glucosilación no enzimática de proteínas óseas como el colágeno tipo I y la acumulación de productos de glucación avanzada, que han demostrado alterar las propiedades biomecánicas del hueso5; aumento del riesgo de caídas por la presencia de complicaciones crónicas como la retinopatía y la neuropatía6; efectos de la hiperglucemia sobre la excreción de calcio y el sistema parathormona/vitamina D7.
Existen varios métodos disponibles para la medición de la DMO, de los cuales el que presenta mayor coste-efectividad para el diagnóstico de osteoporosis y para predecir el riesgo de fractura es la absorciometría dual de rayos X (DXA). La medición de la DMO por DXA permite establecer la presencia de osteoporosis en función de los criterios de la Organización Mundial de la Salud (OMS): normal, valores de DMO superiores a −1 desviación estándar (DE) con relación a la media de adultos jóvenes (T score > −1); osteopenia, valores de DMO entre −1 y −2,5 DE (T score entre −1 y −2,5); osteoporosis, valores de DMO inferiores a −2,5 DE (T score inferior a −2,5), y osteoporosis establecida cuando, junto con las condiciones previas, se asocia una o más fracturas por fragilidad. El acceso limitado a la densitometría no permite usarla como técnica de cribado a nivel poblacional, lo que ha favorecido el desarrollo de escalas de riesgo que tratan de identificar a los pacientes con una elevada probabilidad de fractura en los que no sería necesaria la medición de masa ósea para iniciar tratamiento, o bien a pacientes de riesgo intermedio que serían candidatos a realizar una densitometría para establecer la necesidad o no de tratamiento. Además, estas escalas de riesgo permitirían la evaluación del paciente en atención no especializada facilitando la identificación y tratamiento de más casos de una patología altamente prevalente como es la osteoporosis. Entre ellas, una de las más usadas es la escala FRAX, de gran difusión al estar respaldado por la OMS, pero que no incorpora la presencia de DM2 como factor de riesgo de fractura. La escala QFracture sí tiene en cuenta la presencia o no de diabetes tipo 2 y, por lo tanto, podría resultar más adecuada para el cálculo del riesgo de fractura en estos pacientes.
A pesar de su gran difusión y de sus ventajas potenciales, estas herramientas presentan una serie de limitaciones: diferente riesgo de fractura para un mismo paciente según la escala usada y los factores de riesgo incluidos8,9; falta de datos para países no incluidos en el desarrollo de las herramientas; diferente umbral de intervención según el riesgo de fractura absoluto en cada país10, y por último, la necesidad de conocer datos de coste-efectividad del país correspondiente para definir el umbral de intervención. Además, en el caso de nuestro país se ha criticado que las cohortes incluidas para el cálculo tuvieron una baja tasa de respuesta11 y, por lo tanto, pueden ser escasamente representativas de la población española.
Hasta el momento, no existen estudios que hayan evaluado el papel de estas escalas en la evaluación del riesgo de fractura en pacientes con DM2.
Material y métodosNuestro estudio incluyó a 78 pacientes con DM2 según los criterios diagnósticos de la Asociación Americana de Diabe tes (2003). La edad media ± DE fue de 55 ± 7 años. Desde enero de 2006 hasta diciembre de 2007, los pacientes fueron seleccionados de forma consecutiva para un estudio cuyo objetivo primario era la evaluación de factores hormonales relacionados con el riesgo de fractura. Los participantes en el estudio se seleccionaron a partir de las consultas del servicio de endocrinología situadas en el Centro Periférico de Especialidades y el propio Hospital Universitario San Cecilio, en Granada, España. Se consideraron como criterios de exclusión cualquier enfermedad (excepto osteoporosis) o tratamiento (glucocorticoides, antirresortivos, teriparatida, ranelato de estroncio, terapia estrogénica, tibolona, calcio y vitamina D) con influencia sobre el metabolismo óseo, la presencia de insuficiencia renal crónica y el diagnóstico previo de DM1.
La presencia de diferentes factores de riesgo de osteoporosis y fractura se recogió en la historia clínica: antecedente personal o familiar de fractura, hábitos tóxicos, antecedente de caídas y presencia de enfermedad cardiovascular. Además, se realizaron determinaciones bioquímicas y hormonales básicas para la exclusión de enfermedad hepática o renal, disfunción tiroidea e hiperparatiroidismo.
El protocolo de estudio fue aprobado por el comité ético del Hospital Universitario San Cecilio y se realizó de acuerdo con las directrices del protocolo de Helsinki. Todos los sujetos firmaron consentimiento informado previo a la realización del estudio.
Medición de masa óseaLa densidad mineral ósea se evaluó mediante absorciometría dual por rayos X empleando para ello el equipo modelo Hologic QDR4500. Este densitómetro utiliza radiografías digitales cuantitativas para medir de forma exacta y rápida el contenido mineral óseo en gramos y la densidad mineral ósea en g/cm2. En nuestro caso, hicimos mediciones en columna lumbar (vértebras L2, L3 y L4) y fémur proximal (cuello, trocánter y triángulo de Ward). La precisión de la medida fue superior al 1% (CV = 1,0% con DMO = 1,0 g/cm2) y la resolución espacial de 1,5 mm. A fin de evitar falsas mediciones, las vértebras fracturadas, que se identificaron mediante radiografía de columna, se excluyeron de la medición de DMO.
Estudio radiológicoSe efectuaron radiografías laterales de columna lumbar y torácica para evaluar la aparición de deformidades en los cuerpos vertebrales desde T4 a L5. Las mediciones se hicieron según los criterios de Genant: fractura de grado 1 o deformidad leve cuando existe una reducción de la altura anterior, media o posterior de la vértebra entre un 20 y 25%; fractura de grado 2 o deformidad moderada cuando la reducción es entre el 25 y el 40%, y fractura grado 3 o deformidad severa a una reducción del 40% de cualquier altura del cuerpo vertebral.
Evaluación del riesgo de fracturaEl riesgo a 10 años de presentar cualquier fractura osteoporótica y fractura de cadera se calculó usando las escalas FRAX y QFracture.
Escala FRAXEsta escala incorpora una serie de factores de riesgo con demostrada influencia sobre el riesgo de fractura: edad, sexo, peso, antecedente previo de fractura, antecedente familiar de fractura de cadera, hábito tabáquico, artritis reumatoide, tratamiento con corticoides, presencia de osteoporosis secundaria: DM1, osteogénesis imperfecta, hipertiroidismo crónico no tratado, hipogonadismo o menopausia prematura (< 45 años), malnutrición crónica o malabsorción y enfermedad hepática crónica) y consumo de alcohol. La introducción de la DMO en cadera es opcional. La escala proporciona el cálculo del riesgo a 10 años de presentar fractura mayor osteoporótica y también el riesgo de fractura de cadera. Existe una página específica para población española: http://www.sheffield.ac.uk/FRAX/tool.jsp?lang=sp.
Escala QFractureAdemás de las variables incluidas en el algoritmo FRAX, considera otros factores con influencia sobre el riesgo de fractura: historia de caídas, DM2, enfermedad cardiovascular, asma, tratamiento con antidepresivos tricíclicos y terapia hormonal sustitutiva. Además, categoriza el consumo de alcohol y tabaco (http://www.qfracture.org). Calcula el riesgo individual a 10 años de presentar cualquier fractura osteoporótica (vertebral, cadera, radio distal) y fractura de cadera pero se ha desarrollado para población inglesa y, por lo tanto, solo está validada para ese país.
Al no existir umbrales de tratamiento específicos definidos para nuestro país, clasificamos a los pacientes como candidatos a tratamiento para la osteoporosis según los siguientes criterios: FRAX para fractura mayor > 7% y para cadera > 3%, establecidos según criterios coste efectivos en población anglosajona12. Para QFracture se consideraron los valores establecidos por esta escala para población inglesa: 8,75% para mujeres y 2,11% para varones (http://www. qfracture.org).
Análisis estadísticoEl análisis estadístico de los datos se realizó empleando el programa SPSS (versión 15.0, Chicago, EE. UU.). Para describir la población de estudio se emplearon estadísticos descriptivos, incluyendo medias, frecuencias y porcentajes. Los datos se expresan como media ± DE. Se consideraron estadísticamente significativos valores de p < 0,05. La comparación de los valores del índice FRAX en las diferentes categorías se realizó usando la prueba de la t de Student. La comparación del porcentaje de pacientes con riesgo de fractura en las diferentes categorías (FRAX sin DMO frente a FRAX con DMO) se realizó mediante la prueba de la χ2.
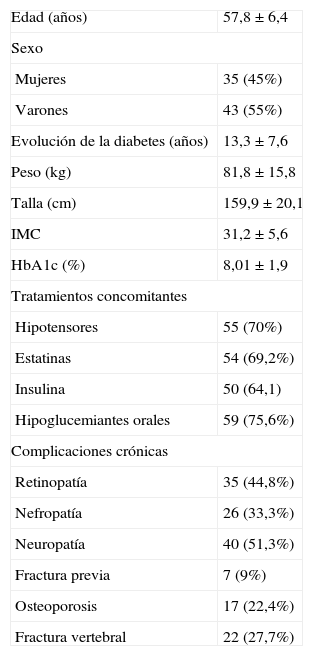
ResultadosLa edad media ± DE de los pacientes fue de 57,8 años (57,8 ± 6,4); el 44,8% eran mujeres (n = 35) y el 55,2%, varones (n = 43). El 22,4% de los pacientes tenían criterios densitométricos de osteoporosis y un 9% tenía una fractura previa por fragilidad. Se detectaron fracturas vertebrales radiográficas en un 27,7% de los pacientes (tabla 1).
Variables demográficas básicas de la población de estudio
| Edad (años) | 57,8 ± 6,4 |
| Sexo | |
| Mujeres | 35 (45%) |
| Varones | 43 (55%) |
| Evolución de la diabetes (años) | 13,3 ± 7,6 |
| Peso (kg) | 81,8 ± 15,8 |
| Talla (cm) | 159,9 ± 20,1 |
| IMC | 31,2 ± 5,6 |
| HbA1c (%) | 8,01 ± 1,9 |
| Tratamientos concomitantes | |
| Hipotensores | 55 (70%) |
| Estatinas | 54 (69,2%) |
| Insulina | 50 (64,1) |
| Hipoglucemiantes orales | 59 (75,6%) |
| Complicaciones crónicas | |
| Retinopatía | 35 (44,8%) |
| Nefropatía | 26 (33,3%) |
| Neuropatía | 40 (51,3%) |
| Fractura previa | 7 (9%) |
| Osteoporosis | 17 (22,4%) |
| Fractura vertebral | 22 (27,7%) |
HbA1c: hemoglobina glucosilada; IMC: índice de masa corporal.
Los resultados se expresan como media ± desviación estándar o n (%).
El índice FRAX fue 2,52 ± 1,95 para fractura mayor osteoporótica y 0,35 ± 0,40 para fractura de cadera. Cuando el valor de la DMO se introdujo en el cálculo el índice FRAX fue 2,77 ± 2,38 para fractura mayor osteoporótica y 0,35 ± 0,59 para fractura de cadera. No existieron diferencias en los valores obtenidos teniendo en cuenta o no los valores de DMO. Aplicando los valores establecidos para iniciar tratamiento para la osteoporosis (7% para fractura mayor osteoporótica y 3% para fractura de cadera), pocos pacientes serían seleccionados como candidatos a tratamiento. En un 2,6% de los pacientes la probabilidad a 10 años de fractura mayor osteoporótica fue superior al 7% y este porcentaje aumentó al 5,1% cuando se introdujo en el cálculo la DMO en cadera (p = 0,002). En ningún paciente la probabilidad de fractura de cadera fue superior al 3% y un 2,6% cumplió criterios cuando se añadió al cálculo la DMO en cadera (fig. 1). Según la escala QFracture, el 3,8% de los pacientes tenían alta probabilidad de cualquier fractura osteoporótica y el 1,3% de fractura de cadera.
DiscusiónEn nuestro estudio, la aplicación de la escalas FRAX y QFracture clasifica a un bajo porcentaje de pacientes como candidatos a tratamiento para la osteoporosis, a pesar de ser una población con riesgo de fractura alto, como refleja la alta prevalencia de fracturas vertebrales y la presencia de fractura previa por fragilidad. No observamos diferencias significativas en función de la escala usada. Hay que destacar que, según la mayoría de guías clínicas13–15, la presencia de una fractura previa hace que el paciente se considere de alto riesgo de presentar una nueva fractura y, por lo tanto, se recomiende iniciar tratamiento para la osteoporosis.
El desarrollo de escalas para la evaluación del riesgo de fracturas tiene una serie de ventajas potenciales, entre las que se encuentran permitir identificar los casos con mayor riesgo de fractura en los que el inicio de tratamiento para la osteoporosis se acompañaría de una mayor eficacia16. Además, permite seleccionar a pacientes de riesgo intermedio en los que realizar densitometría para determinar de forma más precisa la necesidad o no de tratamiento, y puede aplicarse en cualquier ámbito clínico. En cuanto a sus limitaciones fundamentales, está la necesidad de validación en cada país concreto (y posiblemente en cada país de acuerdo a diferencias entre regiones) y el hecho de que deban definirse umbrales de intervención específicos para cada país.
La escala FRAX por su difusión —está respaldada por la OMS— es la que más controversia ha suscitado. Aunque se han publicado datos que muestran que en población mayor de 50 años la mayoría de los pacientes clasificados de riesgo alto de fractura según FRAX presentan valores compatibles con osteoporosis en la densitometría17, otros estudios muestran que los casos de fractura estimados por FRAX son significativamente menores que las fracturas incidentes observadas durante el seguimiento18. En población española la aplicación de la escala FRAX conlleva la reducción de casos a tratar en una cohorte de pacientes con fractura por fragilidad19, aunque se ha calculado que reduciría en un 50% la necesidad de densitometría y tiene una adecuada validez diagnóstica para la presencia de osteoporosis en cadera20. Actualmente, está en marcha un estudio prospectivo en una amplia cohorte española que tiene como objetivo evaluar el valor predictivo de esta herramienta21. La escala QFracture ha tenido una menor difusión y solo existe una publicación que afirma su validez en población de Reino Unido22.
Hasta el momento, no existen estudios publicados que hayan evaluado específicamente la utilidad de estas herramientas en población con DM2. En nuestra opinión, aunque el uso de estas escalas, y concretamente de la escala FRAX, puede tener utilidad como prueba de valoración inicial de pacientes en los que por un resultado de bajo riesgo no serían necesarias más intervenciones, no sustituye al criterio clínico y no parecen ser de especial utilidad en la evaluación del paciente con DM2, al menos en el ámbito de la atención especializada. Por otra parte, la ausencia de guías especificas para la evaluación y tratamiento de la osteoporosis en pacientes con diabetes tampoco nos permite formular recomendaciones más específicas, aunque quizá sí deberíamos realizar una recogida de factores clínicos de riesgo de fractura, antecedente personal o familiar de fractura por fragilidad, y probablemente realizar una radiografía de columna para descartar la presencia de fracturas vertebrales en la evaluación del paciente con DM2.
Nuestro estudio presenta una serie de limitaciones. En primer lugar, el tamaño muestral. En segundo lugar, la inclusión de pacientes referidos para evaluación y tratamiento de la diabetes al Hospital Universitario San Cecilio, lo que podría hacer que nuestra muestra no fuera totalmente representativa de la población global de pacientes con DM2. En consecuencia, son necesarios estudios prospectivos más amplios para determinar la utilidad de estas escalas en la evaluación del paciente con DM2. Sin embargo, creemos que la ausencia de datos publicados al respecto en población con diabetes y el estudio a través de densitometría y radiología vertebral de nuestra muestra dan validez a nuestros resultados.
En conclusión, en nuestro grupo de pacientes con DM2 la aplicación de la escalas FRAX y QFracture clasifica a un bajo porcentaje de pacientes como candidatos a tratamiento para la osteoporosis, a pesar del alto riesgo de fractura que presentan estos pacientes como refleja la alta prevalencia de fracturas vertebrales. Son necesarios estudios más amplios para establecer la validez de estas escalas en la evaluación del riesgo de fractura en pacientes con DM2.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.