Adolescente de 16 años con aumento de volumen en tercio superior de la cara medial del muslo izquierdo.
1.1AntecedentesMadre de 36 años sana, dedicada al hogar. Padre de 42 años, empleado, tabaquismo positivo y alcoholismo social. Hermano de 11 años sano.
Originarios y residentes del Estado de México (Tlalnepantla), residió 10 años en Tucson, Arizona. Habitó en casa prestada con todos los servicios. Alimentación referida como adecuada en cantidad y calidad.
Desarrollo psicomotor. Referido como adecuado. Cursaba segundo año de preparatoria con promedio de 9.
Producto de la G II con control prenatal referido como regular. Nacida vía vaginal, lloró y respiró al nacer, pesó 3,800g.
Traumatismo craneoencefálico leve a los 4 años. Varicela a los 11 años. Se tomó biopsia en región inguinal derecha el 18 de septiembre de 2013 en Tucson, Arizona. Alérgicos negados.
Exámenes de laboratorio. Biometría hemática: hemoglobina 9.60g/dl, hematocrito 26.9%; volumen corpuscular medio 85.70 fl, concentración de hemoglobina corpuscular media 30.50g/dl; eritrocitos 3.15 x 100/μl; leucocitos 0.20 x 103/μl; plaquetas 26 x 103/μl; neutrófilos 17.60%; linfocitos 23.5%, eosinófilos 58.90%, monocitos 0, basófilos 0.
Química sanguínea: glucosa 91mg/dl, fosfatasa alcalina 129 U/l, bilirrubinas totales 2.52mg/dl, bilirrubina indirecta 1.11mg/dl, bilirrubina directa 1.41mg/dl; albúmina 1.6g/dl, globulina 2.1g/dl, aspartato aminotransferasa 13 U/l; alanina aminotransferasa 20 U/l; sodio 139 mmol/l, potasio 2.8 mmol/l; calcio 7.2mmol/l, fósforo 3.2mg/dl, cloro 101mg/dl; creatinina 1.0mg/dl. Tiempo de protrombina 31.5 s, relación internacional normalizada 2.44, tiempo parcial de tromboplastina 48 s, fibrinógeno 420mg/dl.
Inició con aumento de volumen en tercio superior de la cara medial del muslo izquierdo que provocó limitación de la movilidad, sin referir tiempo de evolución. Se realizó una biopsia, y se informó tumor de células pequeñas y redondas compatible con sarcoma de Ewing, con BCL2, vicentina y Ki67 positivos, sin especificar más datos. Se realizó una tomografía axial computarizada (TAC) en tres regiones. En la región inguinal izquierda se observó un tumor de tejidos blandos que medía 2.5 x 2.7cm, adyacente a los vasos sanguíneos femorales. Otro tumor hipodenso que involucraba al glúteo menor izquierdo de 7.2 x 5.7 x 9.2cm, adyacente al iliaco ipsilateral. El músculo iliaco izquierdo con aumento de volumen y afección de los tejidos blandos adyacentes, que midió 3.5 x 5.7 x 9.2cm. Se encontró un nódulo pulmonar de 1.2 x 1 x 1.4cm, y dos nódulos pequeños en lóbulo superior derecho, mediastino y ganglios linfáticos abdominales, sin lesiones aparentes. Fue referida al Hospital Infantil de México Federico Gómez (HIMFG). Se realizó resonancia magnética nuclear (RMN) de miembro inferior que mostró imagen de aspecto sólido de 6.5 x 5.1 x 6.4cm a nivel de glúteo menor. A nivel del iliaco ipsilateral se observaron imágenes nodulares que se extendían hasta el paquete neurovascular inguinal. Posteriormente se realizó una gammagrafía con talio-201 (201Tl), y se observó tumor en hipogastrio con poca captación en zonas quísticas o necróticas en las partes blandas de glúteo izquierdo y con probables metástasis óseas.
Inició esquema de quimioterapia con vincristina, doxorrubicina y ciclofosfamida, y continuó con un segundo ciclo. Se realizó RMN de control. En las secuencias T1 se observaron imágenes de intensidad intermedia en relación con sangrado; en T2 se observó gradiente heterogéneo hiperintenso, e infiltración a los músculos. En piso pélvico se observó una imagen con las mismas características. La lesión infiltraba el hueso iliaco.
Cuando ingresó para el tercer ciclo de quimioterapia, se encontró con deterioro del estado neurológico, frecuencia cardiaca 134/min, frecuencia respiratoria de 52/min. Al aplicar la quimioterapia, mejoraron las condiciones generales. Se agregaron nistagmos, por lo que se difirió su egreso. Fue valorada por el Servició de Neurología por visión borrosa espontánea breve; 12h después, se agregaron movimientos oculares horizontales persistentes. En la exploración neurológica se encontró alerta, activa, cooperadora, orientada en persona, tiempo y espacio, con lenguaje coherente y fluido, claro, gnosias, cálculo, abstracción y memoria conservados. Se concluyó que el nistagmo era probablemente de origen central, medicamentoso. Presentó candidiasis oral, que fue tratada con nistatina. Después presentó crisis convulsivas tónico-clónicas de un minuto de duración, que cedieron con la administración de diazepam. Presentó datos de sepsis que se manejaron con meropenem, vancomicina, ampicilina y anfotericina. Presentó picos febriles de 39.5°C.
Al día siguiente presentó paro cardiorrespiratorio que fue tratado con ventilación con presión positiva, aminas vasoactivas, milrinona, norepinefrina y vasopresina. Remitió el paro cardiorrespiratorio. Permaneció intubada. Se agregó epistaxis, por lo que se colocó taponamiento anterior. Se administró plasma fresco congelado, sin mejoría. Se agregó nutrición parenteral al tratamiento. Presentó deterioro de la función renal con creatinina de 1.6mg/dl. Se diagnosticó falla orgánica múltiple.
Nuevamente presentó epistaxis, hipotensión y paro cardiorrespiratorio. Con el consentimiento del padre, se detuvieron las maniobras de resucitación. Los diagnósticos clínicos finales fueron sarcoma de Ewing primario de piso pélvico tratado y falla orgánica múltiple.
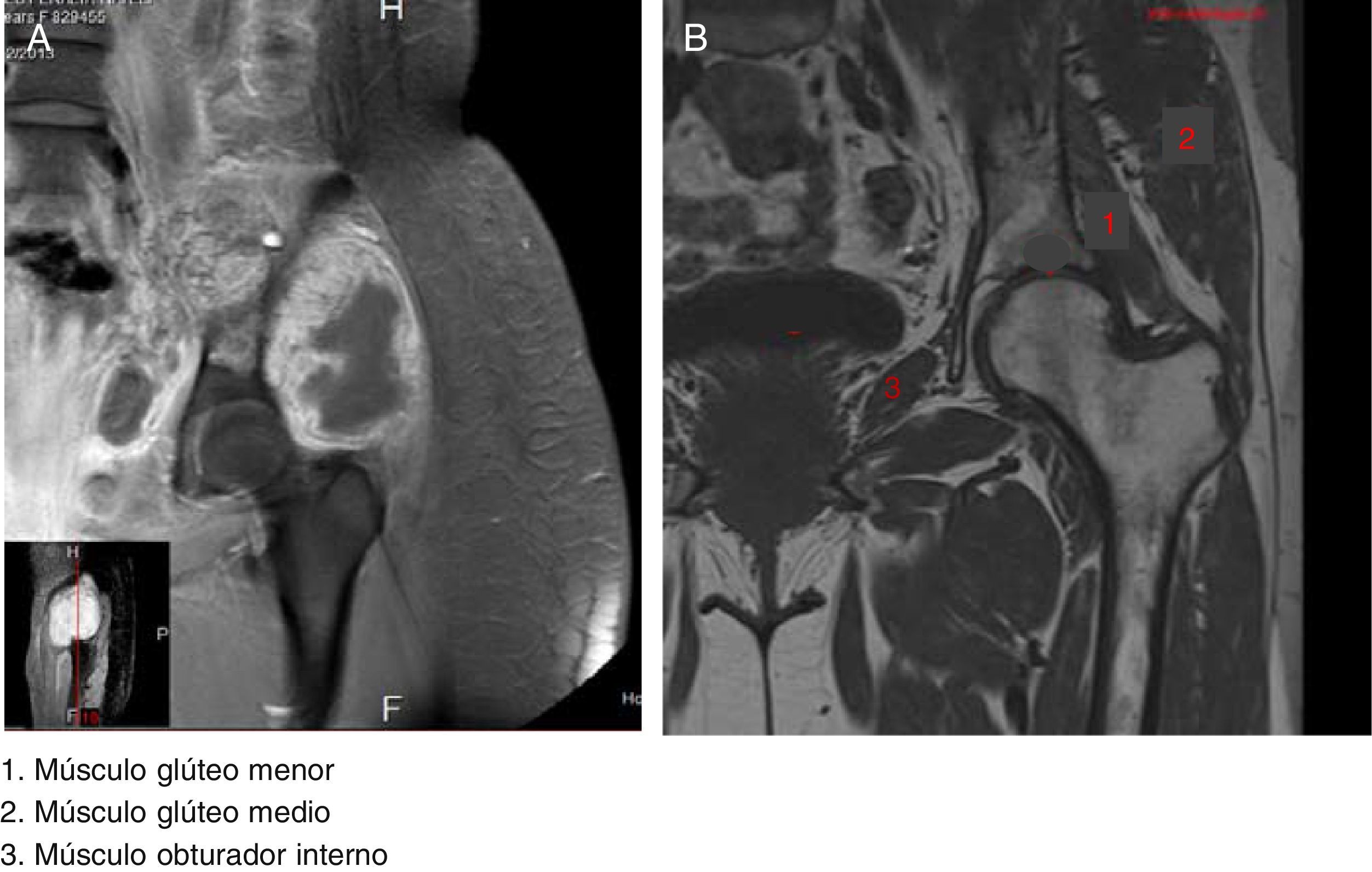
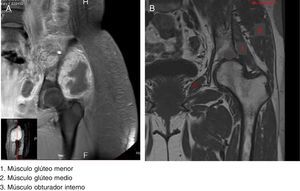
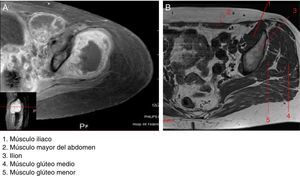
2ImagenologíaSe muestra una imagen de RMN que corresponde a un T1 con gadolinio donde se comparan los grupos musculares que estuvieron implicados en el padecimiento de la paciente (fig. 1A) con los grupos musculares sin afectación (fig. 1B). El músculo etiquetado con el número 1 es el glúteo menor. Se observan los diferentes componentes del fémur, glúteo medio y obturador interno. En relación con la neoplasia, la lesión es hipointensa; la administración del medio de contraste presenta un reforzamiento periférico con edema de los tejidos blandos adyacentes. La lesión infiltra y compromete al iliaco y parte del obturador interno. La vejiga urinaria esta desplazada hacia el lado derecho.
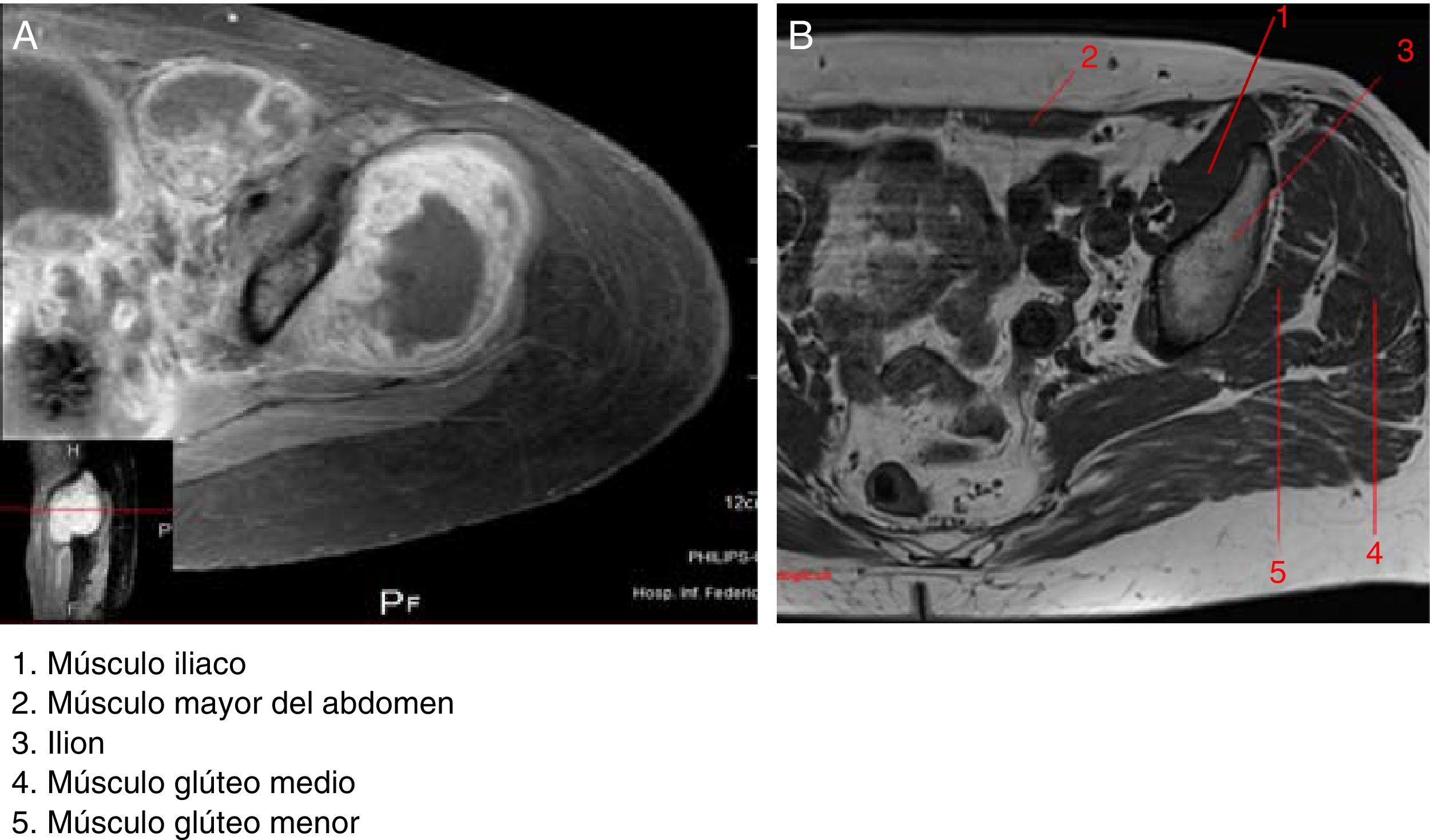
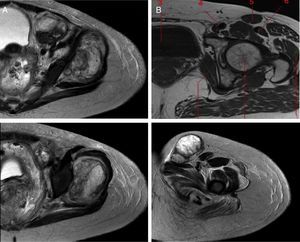
En la figura 2 se observa un T1 con administración del medio de contraste donde se hace evidente que los filetes musculares están afectados por el tumor (fig. 2A). La lesión infiltra los grupos musculares 4 y 5, que son el glúteo medio y el glúteo menor, respectivamente (fig. 2B). El músculo mayor del abdomen se encuentra desplazado por el edema del mismo y del músculo iliaco. Este músculo se observa afectado por la tumoración. En el piso pélvico existe edema e hiperemia de los diferentes componentes musculares, y el músculo pubocoxígeo también muestra edema.
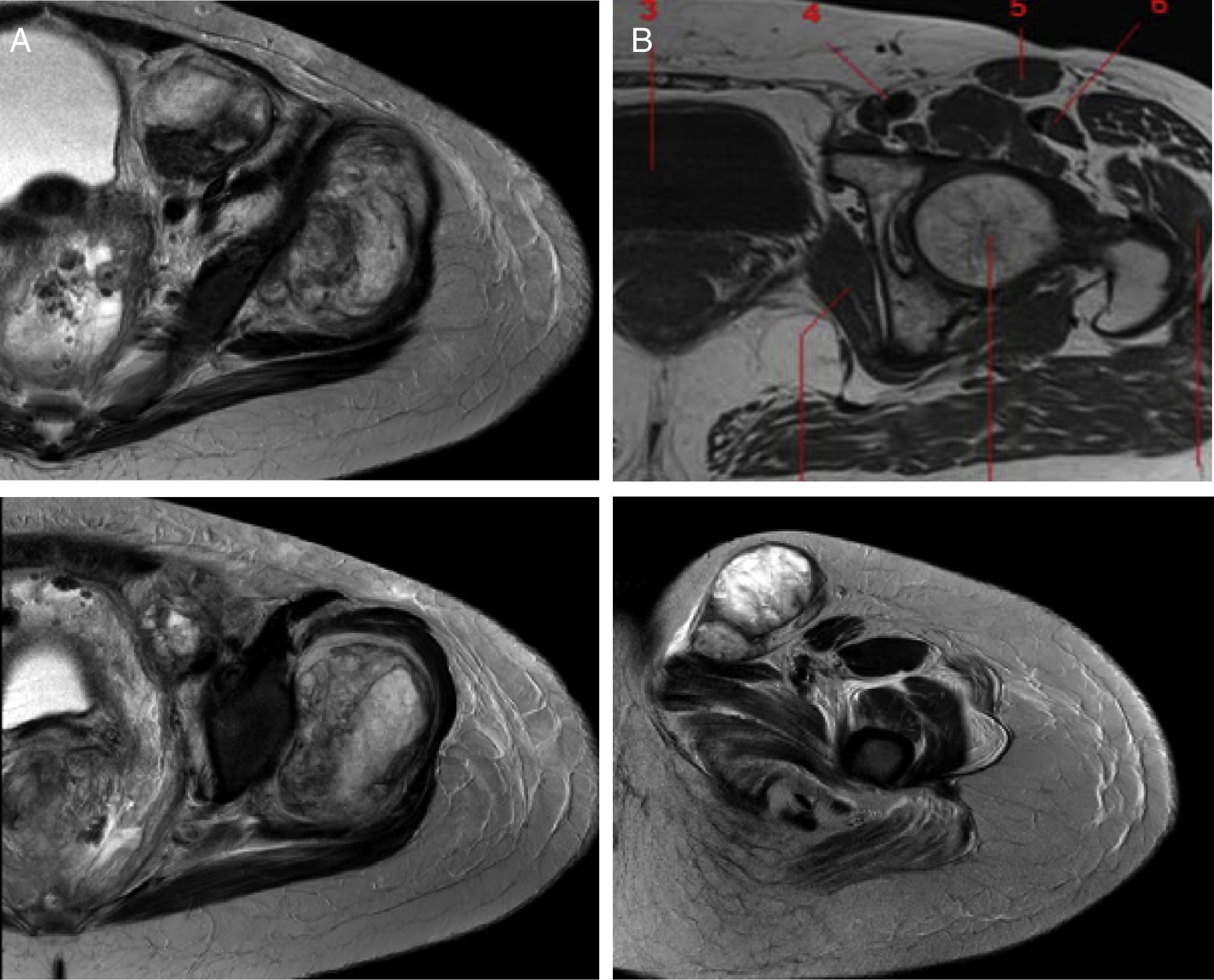
La figura 3 corresponde a T2, donde se muestra la infiltración de la lesión tumoral que provoca estriación del tejido adiposo adyacente. La lesión es nodular, se encuentra adyacente a los vasos femorales y se extiende a través del canal inguinal. La vejiga urinaria sigue desplazada a la derecha.
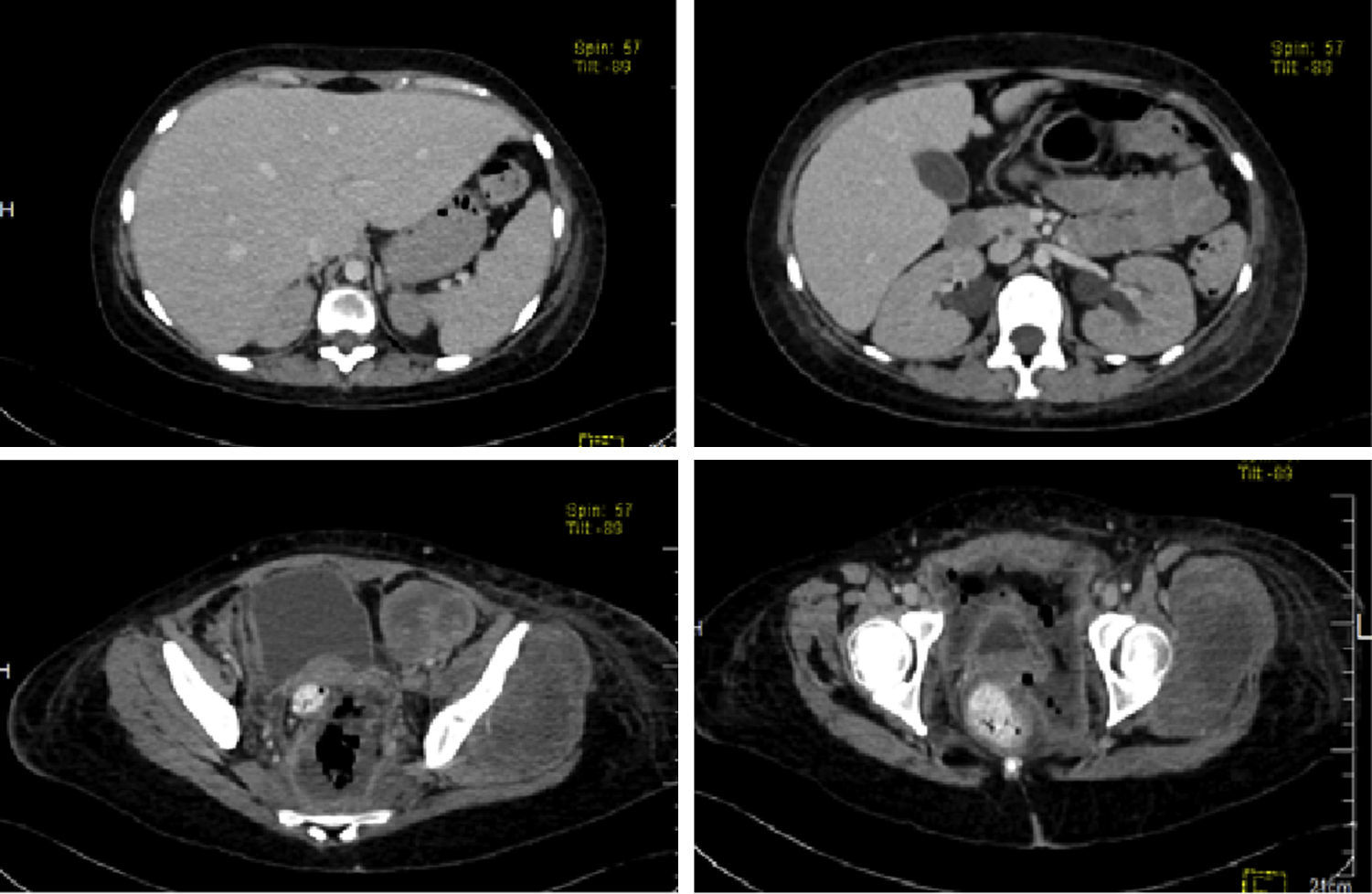
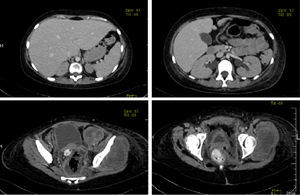
Se realizó una TAC con medio de contraste donde se observó el hígado aumentado de tamaño a expensas del lóbulo izquierdo. La vesícula biliar sin alteración e hidronefrosis bilateral. En cortes inferiores, la tumoración está presente. Hay dos cortes a nivel más caudal donde es claro el desplazamiento de la vejiga y del útero por el tamaño del tumor. Se observó también parte de colon sigmoides, y el ámpula rectal discretamente desplazada hacia la derecha por estas lesiones (fig. 4).
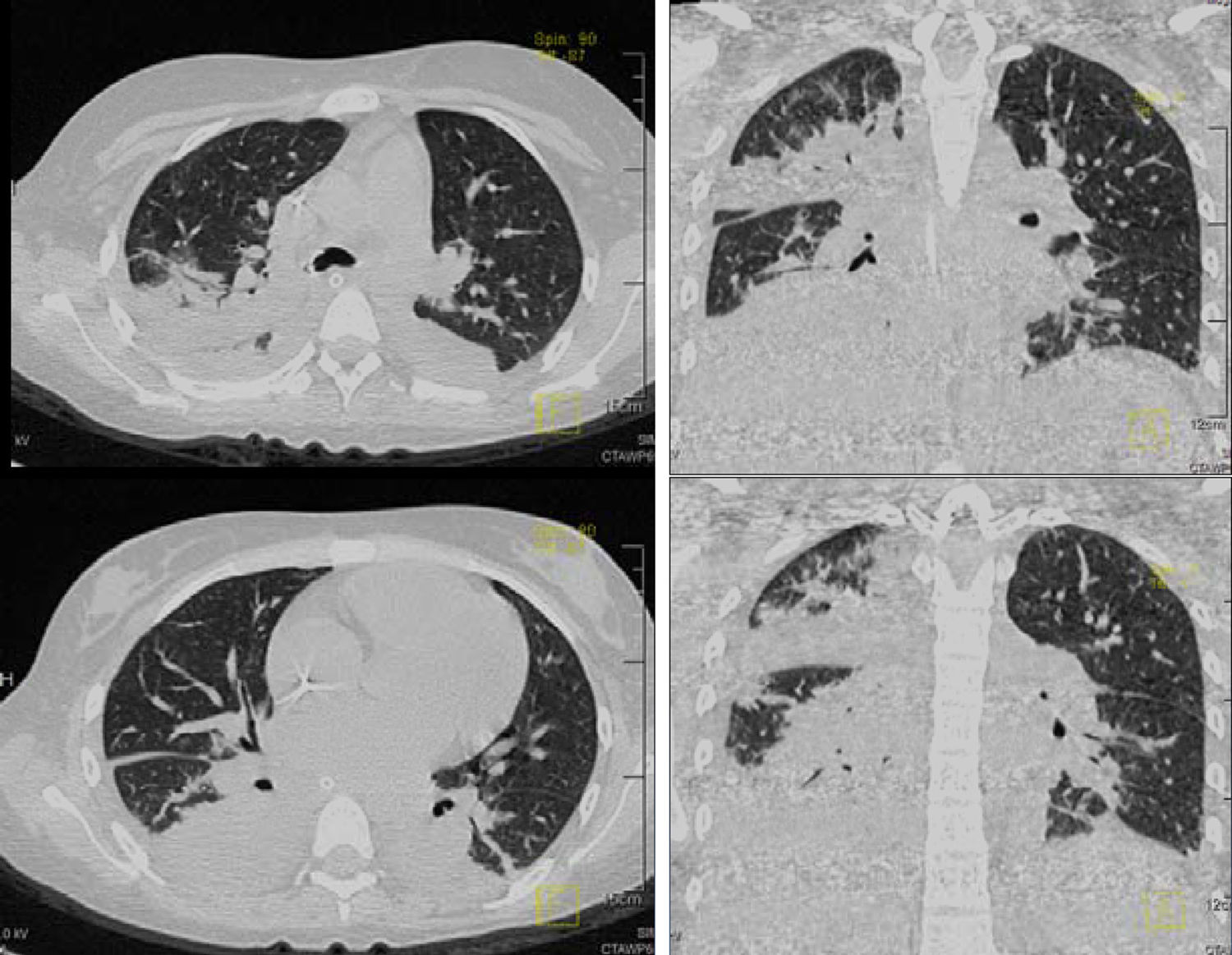
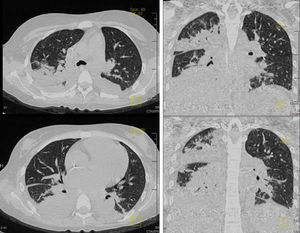
Las diferentes imágenes en cortes axiales y coronales de tórax demostraron consolidación en la porción posterior de ambos pulmones, broncograma aéreo e infiltrados bilaterales, más aparentes del lado derecho que del lado izquierdo (fig. 5). Se hizo un rastreo dirigido específicamente para descartar o corroborar que la paciente tuviera o no datos de metástasis, que se descartaron. En la ventana para pulmón y mediastino se observaron conglomerados ganglionares (sobre todo en mediastino superior), derrame pleural de lado derecho, broncograma aéreo y un catéter que llega a cavidades derechas con consolidación basal bilateral de predominio derecho.
Los diagnósticos radiológicos fueron los que se mencionan a continuación:
- •
Lesión tumoral que infiltra el glúteo menor, parte del glúteo medio, el obturador interno, el iliaco y los músculos pubocoxígeos y puborectales
- •
Hepatomegalia
- •
Hidronefrosis bilateral
- •
Consolidación pulmonar bilateral de predominio derecho
- •
Derrame pleural
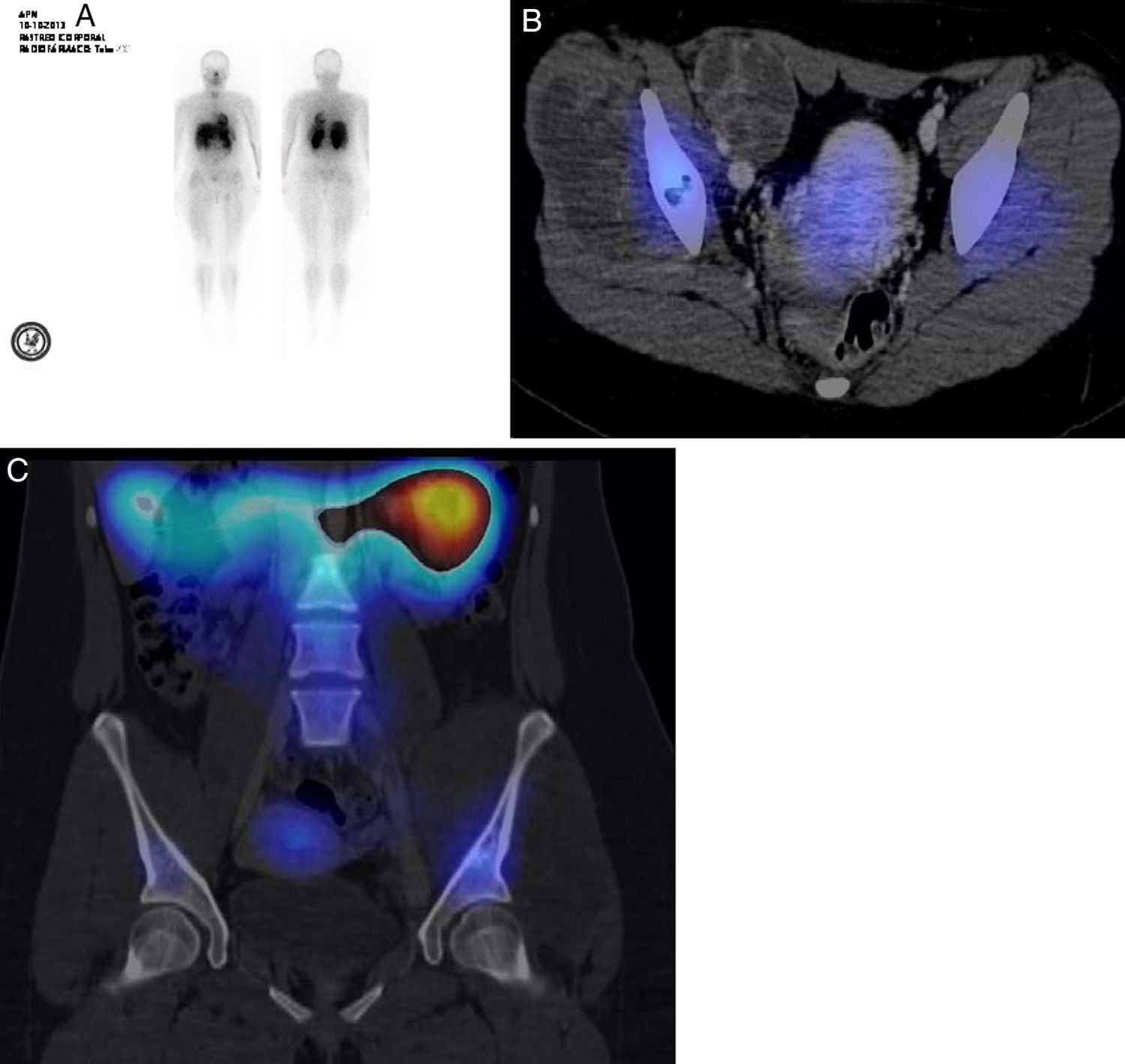
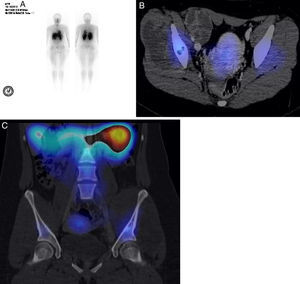
Se practicó un SPECT-TAC de talio-201 de una paciente con diagnóstico de sarcoma de Ewing de piso pélvico. En el estudio de rastreo completo no se encontraron, en pulmón, imágenes que sugirieran metástasis. Debido a las captaciones mayores que se observaron (fig. 6A), se tomó la decisión de practicar el estudio SPECT-TAC con fusión, donde se pudo observar que parte del hueso iliaco izquierdo presentaba una zona de aumento de captación (fig. 6B). En la lesión del hueso no hay captación, lo que sugiere que sean sitios de necrosis. En el hueso iliaco se observó afectación con zonas sin captación de radiotrazador (fig. 6C). Múltiples factores pueden influir para la captación del talio, como la vascularización del tumor, la celularidad y la tasa metabólica del tumor. El talio es efectivo en la detección tumoral, y da la posibilidad de diferenciar entre un tumor residual, una recidiva local, necrosis o fibrosis cicatrizada1. En los pacientes con tumores óseos se ha utilizado para evaluar la respuesta a la quimioterapia preoperatoria, y hacer la correlación con el grado histológico y la necrosis tumoral con un valor predictivo positivo de 88 y valor predictivo negativo de 942. Destaca que los valores de radiación a la que los pacientes se someten son niveles sumamente bajos, similares a la radiación que absorbe el paciente cuando se realiza una tomografía, PET o SPECT.
3Presentación del casoDe acuerdo con los datos referidos en la historia clínica, se integraron los siguientes diagnósticos sindromáticos:
- •
Síndrome tumoral, con base en un aumento progresivo de volumen en el tercio proximal del muslo izquierdo que provocó limitación funcional.
- •
Durante su evolución desarrolló síndrome de respuesta inflamatoria sistémica, basado en taquicardia, polipnea e hipotermia.
- •
Síndrome hemorrágico, con base en epistaxis y trombocitopenia.
- •
Síndrome anémico, caracterizado por palidez de tegumentos y cifras de hemoglobina y hematocrito por debajo de los valores normales para la edad.
- •
Síndrome de insuficiencia respiratoria, caracterizado por polipnea. Posteriormente, incremento del deterioro ventilatorio que requirió de intubación orotraqueal.
- •
Síndrome infeccioso, con base en neutropenia, hipotermia y con foco en la cavidad abdominal.
- •
Síndrome convulsivo, por movimientos tónico-clónicos de extremidades, así como pérdida del estado de alerta.
- •
Síndrome depresivo, con base en aumento de la sensibilidad, tristeza y desesperanza.
Acorde con estos diagnósticos sindromáticos se integraron los siguientes diagnósticos nosológicos:
- •
Probable sarcoma de Ewing extraóseo, pélvico, versus rabdomiosarcoma, por síndrome tumoral con reporte histopatológico de tumor de células pequeñas, redondas y azules, así como la edad y el sitio de presentación.
- •
Colitis neutropénica, por síndrome infeccioso, dolor y distensión abdominal, evacuaciones disminuidas de consistencia, evidencia en imagen por ultrasonido y tomografía de abdomen de incremento en el grosor de la pared de colon ascendente.
- •
Choque séptico, con datos de respuesta inflamatoria sistémica, por lo que requirió manejo con solución cristaloide y vasopresor.
Se trató de una adolescente que presentó, como manifestación inicial, un incremento de volumen en el muslo izquierdo y limitación funcional para la deambulación. Fue valorada inicialmente en un hospital de Tucson, Arizona, donde se realizó la biopsia de la lesión, que se informó como tumor de células pequeñas, redondas y azules.
Dentro del abordaje de los pacientes con tumores de partes blandas existen diagnósticos diferenciales que, de acuerdo con las características clínicas de la paciente así como el tiempo de evolución, pueden incluir etiología neoplásica; por ejemplo, sarcoma de partes blandas, rabdomiosarcomas, otros sarcomas diferentes al rabdomiosarcoma o tumor neuroectodérmico primitivo (puede ser de origen óseo o extraóseo). Cuando el diagnóstico diferencial se acompaña de signos como eritema y limitación funcional, deben considerarse como posibles manifestaciones de infección de partes blandas u osteomielitis, sobre todo cuando se presentan en esta región anatómica. Los síntomas como dolor intenso progresivo que provoca la limitación funcional, así como el aumento de volumen, deben ser analizados por el médico de primer contacto, quién deberá solicitar un ultrasonido de la zona afectada como estudio inicial en caso de que estén involucradas partes blandas y radiografías comparativas en caso de afección ósea, para referir de forma inmediata al especialista. En este caso se describió la referencia tardía (con un mes de evolución de dicha sintomatología). La familia de tumores de células pequeñas, redondas y azules representa un grupo de neoplasias de apariencia embrionaria que carecen de criterios morfológicos precisos que permitan su identificación específica. Este término se reserva para las neoplasias que involucran al sistema esquelético y tejidos blandos e incluyen diversas estirpes biológicas en niños, adolescentes y adultos jóvenes; dentro de estos tumores se encuentran el sarcoma de Ewing, rabdomiosarcomas, neuroblastomas y linfoma linfoblástico, entre otros. Por la edad, las características clínicas, el sitio de presentación, así como los estudios de imagen, se considera como posibilidad diagnóstica un sarcoma de partes blandas, y en este rubro el sarcoma de Ewing extraóseo. Esta es una neoplasia que se presenta en un amplio intervalo de edades, desde lactantes hasta adultos mayores, con un pico de incidencia en la segunda década de la vida (tal fue el caso de la paciente); surge con mayor frecuencia en el tejido óseo pero también se desarrolla en los tejidos blandos. El sarcoma de Ewing a menudo expresa una traslocación balanceada que implica la fusión del gen EWS-FLI1, t(11;22)(q24;q12) que está descrita hasta en el 85% de los pacientes. Al momento del diagnóstico, se menciona que hasta el 34% de los pacientes con sarcoma de Ewing óseo cuenta con metástasis a distancia, y hasta en el 29% de los que presentan sarcoma de Ewing extraóseo, como lo reportado en este caso. Se tiene mejor pronóstico si la metástasis implica únicamente el pulmón, en comparación con hueso y médula ósea. En el caso de sarcoma de Ewing, la enfermedad metastásica es el factor pronóstico que tiene mayor peso, seguido del tamaño del tumor3–6. El peor pronóstico se considera si este es > 8cm o > 260cm3, como en este caso. También influyen el sitio de presentación (los pélvicos presentan menor respuesta al tratamiento) y, finalmente, la edad. Se ha establecido la edad (> 15 años) como un factor de mal pronóstico para la supervivencia, que junto con la enfermedad metastásica son los factores más importantes a considerar. El tratamiento multimodal con quimioterapia, cirugía y radioterapia ha logrado incrementar la tasa de supervivencia global, del 10% al 50% en la actualidad. Como segunda posibilidad diagnóstica se consideró el rabdomiosarcoma, neoplasia que se encuentra dentro de la categoría de tumores de células pequeñas, redondas y azules. Este es el tumor de tejidos blandos más frecuente y representa aproximadamente el 3.5% de los casos de cáncer en pediatría. Aunque los sitios primarios más frecuentes son cabeza y cuello, hasta el 20% se puede presentar en las extremidades; de estos, el 80% de los pacientes son mayores de 10 años de edad (como en el caso presentado). Aquí también existen diversos factores pronósticos, como la edad, el sitio de origen, la resecabilidad, la presencia de metástasis y la histopatología, entre otros. Para realizar el diagnóstico diferencial, es necesario identificar datos característicos del linaje miogénico genético tanto por microscopía de luz y electrónica como por inmunohistoquímica y biología molecular. La identificación de rabdomioblastos característicos, por microscopía de luz, y proteínas de músculo esquelético como desmina, actina, mioglobina, proteínas bandas Z y miosina, por inmunohistoquímica, es indispensable para clasificar un rabdomiosarcoma. En el caso de sarcoma de Ewing, mediante inmunohistoquímica se identifican la proteína S100, la enolasa neuronal específica y el CD99. Sin embargo, en este caso, no se contó con dichos estudios.
La paciente recibió solamente tres ciclos de quimioterapia en un periodo de 5 meses, ya que desarrolló toxicidad secundaria que la llevó a diversas complicaciones infecciosas. Esto es de suma importancia, ya que en la literatura se recomiendan ciclos cada 21 días y se sugiere lograr el control local en un periodo no mayor de 12 semanas, situación que no fue factible establecer en esta paciente por las múltiples complicaciones3.
Durante su evolución presentó evacuaciones disminuidas de consistencia, así como dolor y distensión abdominal. Cuando se realizó la imagen, ultrasonido y TAC de abdomen, que corroboraron el incremento del grosor de la pared del colon ascendente por encima de 4mm, se concluyó el diagnóstico de colitis neutropénica. Dicha patología puede ser secundaria al efecto tóxico de la quimioterapia sobre la mucosa y tejido muscular intestinal, que provoca la invasión bacteriana de la pared intestinal —secundaria a la neutropenia—, la disminución de la motilidad intestinal y colestasis, entre otros mecanismos. Aunque no se reportó el aislamiento de algún germen, los principalmente asociados incluyen Clostridium difficile, Pseudomonas aeruginosa, Escherichia coli y enterobacter. Esta complicación es un factor de morbilidad y de mortalidad de suma importancia en la población pediátrica. El diagnóstico es clínico y se apoya en la radiología con imagen de ultrasonido. El uso de la TAC permite confirmar el diagnóstico y demostrar alguna complicación asociada.
Hubo incremento en las cifras de creatinina, que requirió del ajuste de la dosis de medicamentos, y datos que sugirieron tubulopatía renal, por lo que también se requirió aporte de fósforo, magnesio y potasio. Existen múltiples factores que pudieron condicionarla; entre ellos, la sepsis y el uso de fármacos nefrotóxicos, como los antimicrobianos utilizados y los agentes químicos terapéuticos. El empleo de ciclofosfamida puede ocasionar alteraciones a nivel renal (como necrosis tubular), pero no es común, y mucho menos factible para la dosis que recibió esta paciente, por lo que es más probable que dichas alteraciones fueran secundarias a la sepsis.
Finalmente, presentó crisis convulsivas. En este caso se pueden considerar factores etiológicos. Una posibilidad, ante la trombocitopenia que presentó, sería la hemorragia intracraneal que puede condicionar parte de las alteraciones neurológicas. Por otra parte, se utilizaron fármacos que pueden producir trastornos neurológicos; uno de ellos, la ciclofosfamida, es considerada como uno de los medicamentos que pueden condicionar encefalopatía. Las manifestaciones son diversas e incluyen alteraciones el estado de conciencia, agitación psicomotriz, crisis convulsivas y síntomas cerebelosos. La presencia de estos síntomas y signos depende la dosis del fármaco. En este caso se empleó una dosis de 4.1g/m2SC, que es una dosis intensa. Existió evidencia de enfermedad renal previa que predispone el incremento del riesgo. Otro fármaco que produce encefalopatía es la vincristina, aunque su toxicidad más conocida es la polineuropatía periférica (de inicio distal y evolución ascendente), y puede manifestarse como una mononeuritis múltiple y afectar incluso nervios craneales. La presencia de nistagmos podría considerarse como secundaria a la desmielinización de áreas específicas en el sistema nervioso central o en el nervio óptico por el uso de dicho medicamento. En este caso, se considera que cursó con una encefalopatía de origen multifactorial.
Dentro de las complicaciones que deterioraron la evolución de la paciente, se encuentran las infecciosas, que llevaron a la administración de antibióticos de amplio espectro. Posteriormente, desarrolló una infección micótica que presentó, en varias ocasiones, datos de sepsis grave y choque séptico, por lo que requirió un manejo con solución cristaloide, aminas y diversos esquemas antimicrobianos (incluyendo anfotericina b, vancomicina, meropenem, ciprofloxacina y amikacina). A pesar de lo anterior, persistió con la sintomatología, que finalmente la llevó a presentar paro cardiorrespiratorio.
Los diagnósticos finales se proponen a continuación:
- •
Probable sarcoma de Ewing extraóseo pélvico versus rabdomiosarcoma metastásico a pulmón
- •
Choque séptico
- •
Colitis neutropénica
- •
Insuficiencia respiratoria
- •
Como causa de muerte, se propone choque séptico y colitis neutropénica.
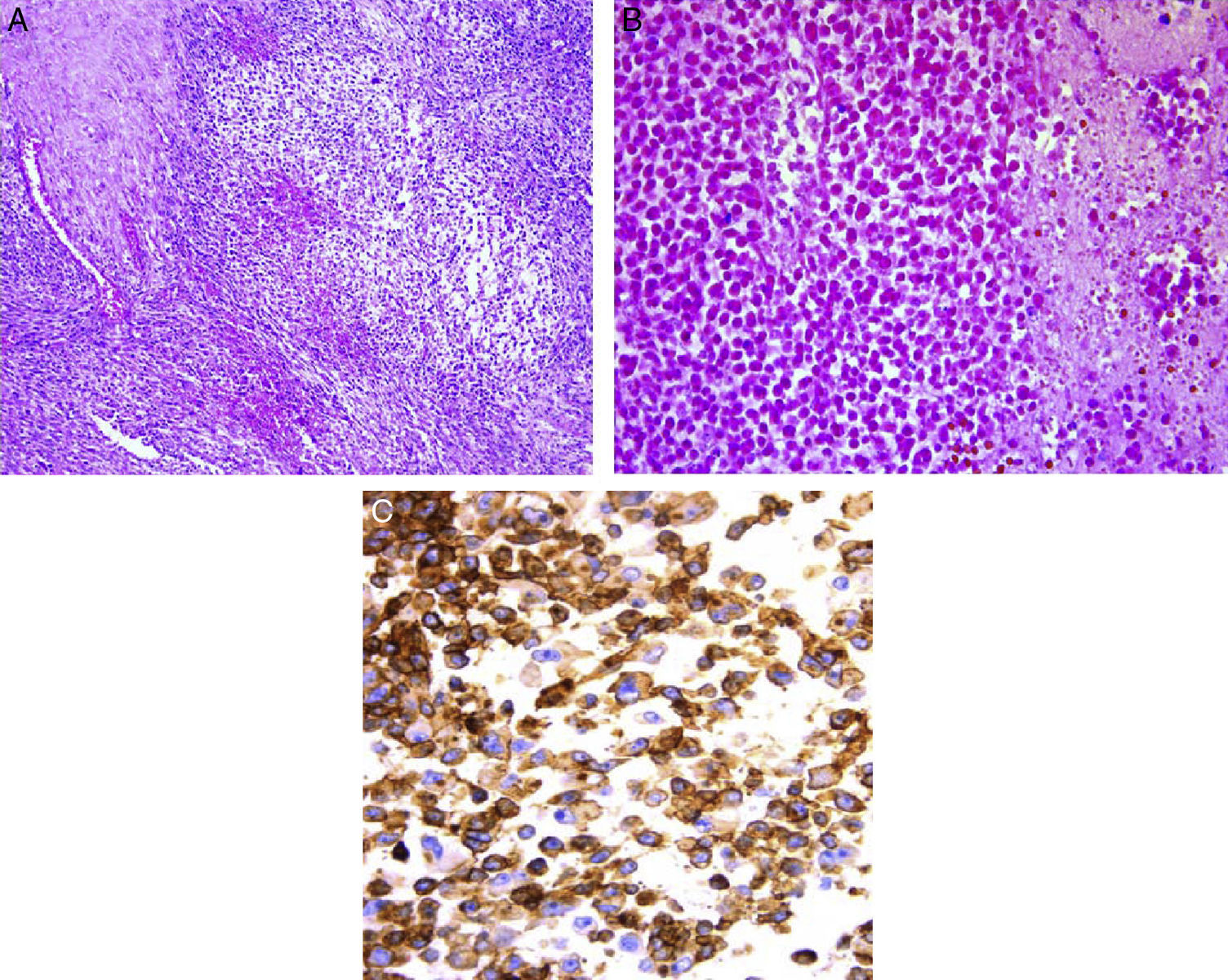
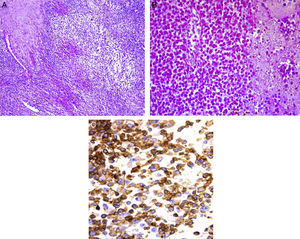
En el estudio post mórtem se encontró una paciente con obesidad y edema generalizado, más acentuado en las extremidades, así como zonas extensas de equimosis en tórax y abdomen. En la región glútea tenía una escara por decúbito. Por el estudio microscópico, el tumor correspondió a una neoplasia celular constituida en su mayoría por células pequeñas de aspecto inmaduro que, en vista panorámica, mostraron una disposición de forma nodular. A mayor aumento se observó que estas células eran redondas, con núcleos redondos e hipercromáticos y escaso citoplasma (fig. 7A). En otras áreas se identificaron zonas de necrosis con fantasmas celulares (fig. 7B). La necrosis correspondió aproximadamente al 50% del tejido estudiado. Es indispensable complementar el estudio de los tumores de células pequeñas, redondas y azules con inmunohistoquímica. En este caso se utilizó el anticuerpo CD 99. En las células neoplásicas, la reacción fue positiva en la membrana y difusa, aproximadamente en el 99% de las células (fig. 7C). Se probó también el anticuerpo FLI1, que es un marcador que se expresa de forma nuclear. Se analizó un amplio panel de anticuerpos por inmunohistoquímica, para descartar otros tumores y realizar el diagnóstico diferencial de las neoplasias de niños y adolescentes que se presentan en esa localización. Los hallazgos morfológicos y de inmunohistoquímica apoyaron el diagnóstico de sarcoma de Ewing/tumor neuroectodérmico primitivo periférico. Como ya se comentó, estas neoplasias corresponden a la familia de tumores que se conoce como familia de tumores de Ewing/tumor neuroectodérmico primitivo periférico, y que son un espectro clínico patológico de una misma entidad, con características histopatológicas, inmunohistoquímicas y genéticas comunes que tienen como base la translocación t(11;22). Esta familia de tumores incluye entidades que antes se conocían con los nombres de sarcoma de Ewing óseo, extraóseo, tumor neuroectodérmico primitivo periférico de tejidos blandos y tumor de Askin.
Los pulmones mostraron, en las superficies de corte, áreas de color café oscuro correspondientes a zonas de hemorragia, que afectaron el 70% del parénquima pulmonar. Se identificó una lesión de color blanco, bien delimitada, nodular y rodeada por un halo color café obscuro de hemorragia. Microscópicamente, correspondió a un nódulo metastásico (fig. 8).
En otras áreas se observó edema e infiltrado inflamatorio dentro de los bronquios y de los bronquiolos, al igual que en los espacios alveolares. El infiltrado inflamatorio principalmente correspondió a linfocitos.
El aspecto macroscópico del esófago mostró afección difusa con zonas de ulceración, hemorragia y fibrina adherida a la superficie. Microscópicamente, se observó una ulceración con necrosis del epitelio, fibrina adherida, edema y fibrosis con presencia de bacterias cocoides. No se identificaron otros organismos. La laringe mostró extensas zonas de hemorragia y de ulceración.
La médula ósea, hipocelular, con disminución de las tres series hematopoyéticas. La serie mieloide era la más disminuida y no se identificaron megacariocitos. El estroma no tenía fibrosis; sin embargo, mostraba edema y hemorragia importante.
En el corazón se observó hemorragia petequial en el epicardio; al corte, el ventrículo izquierdo mostraba leve hipertrofia, que se corroboró a nivel microscópico. Los cardiomiocitos con citoplasmas amplios y los núcleos pleomórficos e hipercormáticos.
El hígado presentaba aumento en su peso, con aspecto granular y áreas más obscuras de color café rojizo que alternaban con áreas más claras, que microscópicamente corresponden a congestión.
El intestino delgado conservaba sus pliegues y la mucosa mostraba congestión vascular. En el colon había edema y zonas dilatadas; la mucosa no presentó alteración.
Los riñones conservaban la relación médula-corteza, con ligera dilatación del sistema pielocalicial. Microscópicamente, se identificaron congestión vascular de predominio medular y datos de necrosis tubular aguda.
El estudio del encéfalo mostró congestión de los vasos meníngeos, y no se identificaron zonas de hemorragia ni metástasis.
4.1Diagnósticos finalesSarcoma de Ewing/tumor neuroectodérmico primitivo periférico extraóseo con metástasis a pulmón y cambios post tratamiento.
4.2Alteraciones concomitantes- •
Daño tóxico a la médula ósea
- •
Esofagitis ulcerada aguda
- •
Laringotraqueitis aguda ulcerada
- •
Neumonía aguda bilateral
- •
Hepatomegalia congestiva
- •
Colestasis hepática leve
- •
Hemosiderosis hepática y esplénica grado 3
- •
Edema cerebral leve
- •
Datos anatómicos de choque
- •
Daño alveolar agudo
- •
Necrosis tubular aguda
- •
Miopatía visceral hipóxico isquémica en tubo digestivo y vejiga
Hemorragia pulmonar con los cultivos post mórtem negativos.
5Comentarios finales5.1Departamento de OncologíaLos tumores neuroectodérmicos primitivos, óseos o extraóseos, son neoplasias altamente agresivas. El tratamiento que debe darse es intenso. Se mencionó que solo se administraron tres ciclos de quimioterapia en un lapso aproximado de 5 meses. Se requirió la administración de un esquema intenso por la localización, el tamaño del tumor y la edad de la paciente, que implicaba dar las dosis más altas permisibles de estos esquemas, aprobados a nivel internacional. Incluso, las dosis de ciclofosfamida que se administraron estuvieron muy cerca de las dosis que se utilizan en el trasplante de células progenitoras hematopoyéticas. El plan de tratamiento para estos tumores es de tres ciclos de quimioterapia alternando cada 3 o 4 semanas, dependiendo la tolerancia de la médula ósea; la mielosupresión se espera hasta máximo 28 días. Se utilizaron tres fármacos con dosis altas; uno de ellos fue ciclofosfamida a 4.1g totales por ciclo. Suponiendo que cursaba la novena semana de tratamiento, la paciente estaba próxima ser valorada, lo que ya no se pudo realizar por su deceso. Sin embargo, el factor pronóstico de necrosis del 50% era muy malo, ya que se espera más del 90% de necrosis para considerar que la respuesta de la quimioterapia es adecuada. Tal vez existe la pregunta del por qué no se modificó el esquema de quimioterapia; la respuesta es porque se estaba utilizando el esquema más intenso para tratar este tipo de tumores en esa localización y en ese grupo etario.
5.2Departamento de Cirugía OncológicaEste tumor, como ya se ha dicho repetidamente, es de alto riesgo tanto por la pobre respuesta al tratamiento como por la localización y el tamaño. Si bien el gammagrama no demostró alteración significativa en el espesor del hueso iliaco, el plan quirúrgico hubiera implicado una resección amplia, incluyendo parte del hueso iliaco para disminuir el riesgo de recaída local, la disección ganglionar iliaca femoral y la consolidación con radioterapia. Por el grado de respuesta, muy probablemente hubiera sido necesario añadir también el trasplante de células hematopoyéticas una vez controlada la enfermedad, incluyendo la enfermedad metastásica pulmonar. Este caso representaba un reto quirúrgico, porque la técnica implica extirpar una parte de la pelvis y la reconstrucción.
5.3Departamento de Psiquiatría y Medicina del AdolescenteLa importancia de los factores emocionales está claramente determinada para la génesis de la evolución y desenlace de casi todas las enfermedades. En el caso de los pacientes oncológicos, la presencia de problemas psicopatológicos está estrechamente relacionada con el dolor y algunos otros síntomas. Sin duda, de todos los pacientes hospitalizados, los oncológicos son los que presentan más índices de psicopatología. En este caso, la predicción era mala en el sentido de que algunos de los factores que pueden predecir la presencia de psicopatología tienen que ver con la naturaleza del tumor, pero también con la psicopatología previa en la familia.
5.4Departamento de Terapia IntensivaEl manejo de estos pacientes en el servicio de Terapia Intensiva es de apoyo. Consiste en una primera fase de contacto, independientemente de la patología con la que llegue el niño oncológico, en la que se brinda todo el apoyo para que se cumpla la primera fase de tratamiento y se determine el pronóstico. Después de esta primera fase, y si el niño responde o no al tratamiento terapéutico, se decide, en conjunto con el servicio tratante, si el niño es meritorio o no de ingresar a la terapia. En esa circunstancia, quienes deben determinar si el paciente va a requerir el apoyo del departamento de Terapia Intensiva son, principalmente, los Departamentos de Oncología y Cirugía Oncológica. En Terapia Intensiva, con base en la información que los médicos y cirujanos oncólogos proporcionen, se determina si se acepta al paciente. En caso de ser aceptado, se decide en conjunto el apoyo que se le va a brindar. En este caso, la paciente no había terminado la primera fase del tratamiento, por lo que estaba indicado proporcionarle toda la asistencia posible y darle la máxima oportunidad de vencer a la enfermedad. Esta es la política del Departamento de Terapia Intensiva del Hospital Infantil de México Federico Gómez desde hace 20 años. Esta Terapia Intensiva, orgullosamente, fue la primera que recibió niños oncológicos en el país y, hasta este día, continúa con muy buenos resultados.
5.5Cuidados paliativosEsta paciente es un ejemplo muy claro de los problemas que presentan los pacientes oncológicos hoy en día, ya que con los recursos terapéuticos actuales es muy difícil declarar incurable aun paciente. Siempre hay la posibilidad de que responda a un tratamiento adecuado. Además, no solamente se ejemplifica esta situación, si no que a pesar de que no se llegó a declarar incurable (porque no se terminó el tratamiento), se comenzaron los cuidados paliativos, que fueron fundamentalmente de tipo psicológico. Estos aspectos, además del apoyo espiritual, el apoyo del control del dolor, deben aplicarse a todos los pacientes oncológicos, aun cuando todavía no se declaren incurables.
Se puede concluir que el diagnóstico inicial, temprano y de manera oportuna, y el manejo multidisciplinario de los pacientes con tumores del sistema músculo-esquelético son de suma importancia e inciden en el pronóstico, la supervivencia y calidad de vida.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.