Paciente masculino de 8 años de edad que recibió diagnóstico de leucemia linfoblástica aguda (LLA).
1.1AntecedentesMadre de 29 años de edad, escolaridad primaria, ayudante de limpieza, soltera, toxicomanías negadas. Padre fuera de núcleo familiar, se desconocen antecedentes. Un hermano de 9 años de edad, sano. Dos medios hermanos por rama materna de 6 y 12 años de edad, sanos.
Residente de Tultitlán, Estado de México. Habitaba en casa de cinco cuartos con agua, luz y drenaje, en la que cohabitaban 20 personas. Convivía con borregos, gallinas, gatos, perro y conejo. Su alimentación consistía en cuatro comidas al día, con alto consumo de carbohidratos simples. Desarrollo psicomotor de acuerdo con la edad. Acudía al tercer grado primaria y tenía buen aprovechamiento escolar. Inmunizaciones: faltaron la cuarta dosis de la vacuna pentavalenten y la primera y segunda dosis de vacuna triple viral.
Producto de la tercera gesta. Acudió a control prenatal irregularmente a partir del segundo trimestre. La madre ingirió hematínicos a partir del segundo trimestre. Asistió a cinco consultas, y cuatro ultrasonidos obstétricos (USG) fueron referidos normales. Cursó con cervicovaginitis de repetición a partir de segundo trimestre, sin tratamiento. El producto se obtuvo vía vaginal a las 42 semanas de gestación (SDG). Respiró y lloró al nacer. Apgar 8/9, Capurro 42 SDG, peso 2700g, talla 47cm. No requirió maniobras avanzadas de reanimación. El binomio egresó a las 24h sin complicaciones. Se negaron alergias, antecedentes quirúrgicos, traumáticos, transfusionales y hospitalizaciones previas.
1.2Padecimiento finalAsistió por primera vez al Hospital Infantil de México Federico Gómez (HIMFG) por palidez, astenia y adinamia de 3 meses de evolución, fiebre diaria, nocturna, de 15 días de evolución. Se documentó síndrome infiltrativo por presencia de adenopatías cervicales, axilares e inguinales. Biometría hemática inicial con hemoglobina (Hb) de 3.6; hematocrito de 12.5; leucocitos, 88,100; neutrófilos, 16%; linfocitos, 5%; monocitos, 2%; blastos, 76%; plaquetas, 52,000; deshidrogenasa láctica (DHL), 440; fósforo, 5.1. Se realizó aspirado de médula ósea (AMO) con los siguientes resultados: blastos, 91%; morfología, L2 (FAB). Inmunofenotipo: CD19, 98.7%; CD2, 98.9%; CD7, 94.2%; CD13, 89.6%; CD15, 96.7%; mieloperoxidasa, 0.2% (inmunofenotipoT). Panel de traslocaciones: negativo. Líquido cefalorraquídeo (LCR) con linfocitos y monocitos. Se inició administración de soluciones de hiperhidratación 3500/50 mEq HCO3 y alopurinol 300mg/m2sc/día y ventana esteroidea con dexametasona 6mg/m2/día por 8 días. La biometría hemática en el octavo día de la ventana esteroidea mostró mala respuesta al tratamiento. Los blastos absolutos fueron de 44,190, por lo que se inició de inducción a la remisión. Cursó con elevación de la cuenta leucocitaria hasta 154,800, manteniéndose hospitalizado para vigilancia. Recibió quimioterapia con vincristina 2mg/m2/día, daunorrubicina 25mg/m2/día, L-asparaginasa 10,000 U/m2/día, dexametasona 6mg/m2/día. Egresó sin eventualidades. Posteriormente, se realizó AMO y quimioterapia con vincristina. Un día después se realizó quimioterapia con L-asparaginasa.
Ingresó dos días después con fiebre de 38.2°C, acompañada de diaforesis. Presentó dolor abdominal de 8h de evolución posterior a la ingesta de alimentos, de inicio súbito, progresivo, tipo cólico, generalizado, intensidad 8/10, sin atenuantes o agravantes. Vómito en seis ocasiones, precedido de náusea y arqueo, cantidad moderada. Las evacuaciones fueron disminuidas en consistencia: en cinco ocasiones, de cantidad moderada, con abundante moco, semilíquidas.
Los datos de la exploración física fueron los siguientes: peso 21kg, talla 120cm, frecuencia cardiaca 194/min, frecuencia respiratoria 30/min, tensión arterial 80/23mmHg, temperatura 38.6°C, llenado capilar 3 s. Masculino de edad aparente similar a la cronológica, cráneo normocéfalo, pupilas isocóricas, normorreflécticas, conductos auditivos externos permeables, membranas timpánicas integras, narinas permeables, cavidad oral ligeramente deshidratada, faringe normocrómica, cuello sin megalias, tórax con adecuados movimientos ventilatorios, campos pulmonares bien ventilados, ruidos cardiacos rítmicos de buena intensidad. Presentó abdomen globoso, perímetro abdominal 62cm, con resistencia voluntaria, doloroso a la palpación media y profunda. Mostró peristalsis disminuida, timpánico a la percusión, sin megalias, genitales fenotípicamente masculinos, Tanner 1, extremidades frías, pulsos débiles, llenado capilar 3 s. Ante la revisión neurológica se mostró alerta, activo, reactivo, sin datos de focalización o movimientos anormales.
Los datos de laboratorio reportaron Hb de 8.2g/dl; hematocrito, 23.2%; leucocitos, 800/μl; neutrófilos, 0.4%; linfocitos, 98%; monocitos, 0.6%; plaquetas, 9,000. La gasometría arterial mostró los siguientes valores: pH, 7.35; PO2, 45.8mmHg; PCO2, 27.5mmHg; HCO3, 14.9mmol/l; lactato, 5.1mmol/l; saturación del 73%.
Se inició manejo en urgencias con ayuno, tres cargas con solución cristaloide a 20ml/kg/dosis, adrenalina 0.1μg/kg/min, meropenem 100mg/kg/día y vancomicina 40mg/kg/día. Persistió con datos de choque, por lo que se decidió realizar intubación orotraqueal. El paciente presentó hipotensión durante la intubación, por lo que se inició tratamiento con norepinefrina (0.1μg/kg/min), albúmina al 5% (10ml/kg/dosis), hidrocortisona (100mg/m2SC/día). Se colocó sonda nasogástrica (SNG) para drenar material fecaloide y biliar.
El paciente presentó distensión abdominal con resistencia muscular, signo de la ola positivo, presión intraabdominal de 19 mmH2O, por lo que se colocó catéter Tenckhoff+catéter venoso central femoral. Se drenaron 1000ml de líquido citrino. Posteriormente, el paciente persistió con datos de choque mixto, por lo que se realizó laparotomía exploratoria (LAPE), hemicolectomía derecha, colocación de bolsa de Bogotá e ileocolostomía. Se observaron los siguientes hallazgos: íleon y colon dilatados de forma generalizada, peritonitis leve, ciego con área de isquemia y necrosis. El paciente ingresó a terapia quirúrgica y presentó derrame pleural izquierdo; se colocó sello pleural, que drenó 350ml de material claro, y sonda orogástrica, para drenar material verdoso biliar. Presentó datos de coagulación intravascular diseminada complicada. Se realizó plasmaféresis por trombocitopenia y falla orgánica múltiple.
Tres días después de su ingreso, se disminuyó el apoyo aminérgico, la norepinefrina y la adrenalina. El paciente recibió furosemida en infusión a 200μg/kg/h. Presentó valor de uresis de 2.7ml/kg/h, balance hídrico +39, índice de sobrecarga hídrica de 19%, abdomen sin peristalsis. Recibió terapia antifúngica empírica con anfotericina B de complejos lipídicos 3mg/kg/día; se solicitó abordaje.
Días después, el paciente presentó balance acumulado de 2696ml, sin apoyo aminérgico, pero con sobrecarga hídrica, por lo que se realizó hemodiálisis extendida. Se reportó el incremento de los parámetros ventilatorios, incremento de secreciones con cambios en las características de las mismas, estertores crepitantes, radiografía con infiltrado alveolar de predominio derecho y biometría hemática con hemoglobina de 10g/dl; leucocitos, 1,000/μl; neutrófilos, 70%; linfocitos, 28%; plaquetas, 39,000. Se diagnosticó neumonía nosocomial y se agregó trimetoprima/sulfametoxazol (TMP/SMX) a una dosis de 20mg/kg/día.
Cuatro días después disminuyeron los parámetros ventilatorios y las aminas. El paciente presentó fiebre de 38.5°C, taquicardia, sangrado por cánula orotraqueal y estomas de colostomía. A la exploración física presentó placa blanquecina en el paladar, extremidades superiores e inferiores con lesiones violáceas induradas de aproximadamente 0.5cm. La radiografía mostró infiltrado alveolar difuso en el hemotórax izquierdo, atelectasia apical derecha. Se decidió ampliar la cobertura antibiótica para microorganismos multiresistentes con colistina a 5mg/kg/día. Se realizó una biopsia en sacabocado de 4mm y, al día siguiente, tomografía axial computarizada (TAC) de tórax, donde se observaron tres lesiones redondeadas periféricas en hemitórax derecho. El reporte del antígeno galactomanano fue de 2.1 (positivos>0.5). Se integró diagnóstico de probable aspergilosis invasora y se inició tratamiento con voriconazol a una dosis de 6mg/kg cada 12h (impregnación) y 4mg/kg cada 12h (mantenimiento). Se suspendió el tratamiento con TMP/SMX.
A las 48h se encontró hipodermitis neutrofílica con vasculitis séptica en la biopsia de piel, probablemente debida a aspergilosis. Se integró diagnóstico de aspergilosis diseminada a pulmón y piel. El paciente completó 14 días con meropenem/vancomicina. Se suspendió colistina ante la ausencia de cultivos con microorganismos multiresistentes. Continuó con voriconazol y anfotecina B.
Se reinició la terapia con norepinerfina y se agregó aminofilina. El paciente continuó con ventilación mecánica en fase III, infusión de furosemida y manejo con hidrocortisona. Requirió transfusiones de plaquetas por trombocitopenia. Dos días después reinició con picos febriles, taquicardia, nuevas lesiones violáceas-necróticas en región palpebral izquierda y cara anterolateral de muslo derecho. El valor de galactomamanos fue de 1.1. En el examen directo del broncoaspirado se observaron hifas septadas macroxifonadas hialinas. Se decidió cambiar la terapia combinada a voriconazol y caspofungina y suspender anfotericina B. Se contaba con cuatro hemocultivos centrales y dos periféricos sin desarrollo de bacterias.
Una semana después el paciente continuaba con índice de sobrecarga hídrica de 10%, ventilación mecánica en fase III con incremento de parámetros ventilatorios; la radiografía de tórax se observaba con consolidación total de pulmón izquierdo, abundantes secreciones espesas por cánula y tapones mucosos con restos de sangre, con estrategia de hipercapnia permisiva por daño pulmonar extenso. Las pruebas de función hepática y renal fueron normales. El paciente se encontró afebril, con múltiples nódulos en piel que se ulceran al abrirse. Se suspendió norepinefrina y se mantuvo tratamiento sin aminas.
Veinticinco días posteriores al ingreso el paciente presentó hemorragia pulmonar masiva con sangrado abundante en cánula orotraqueal y deterioro hemodinámico inmediato; presentó asistolia y paro cardiorrespiratorio que no revirtió a maniobras de reanimación. Un día posterior al deceso se reportó cultivo de aspirado endotraqueal con identificación de Aspergillus flavus.
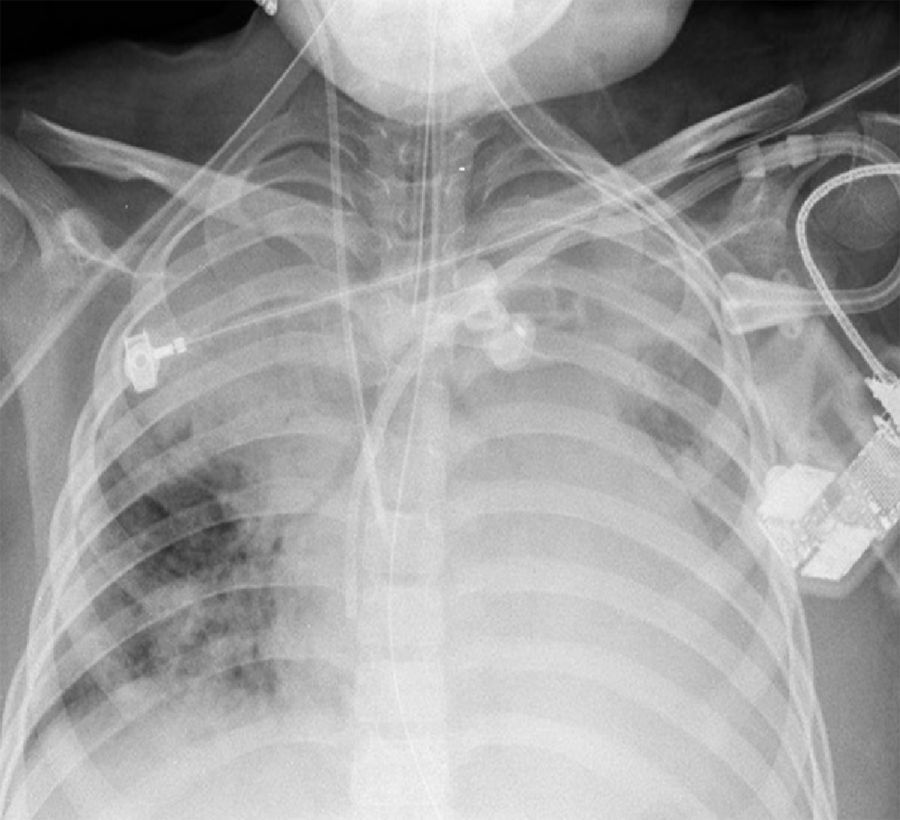
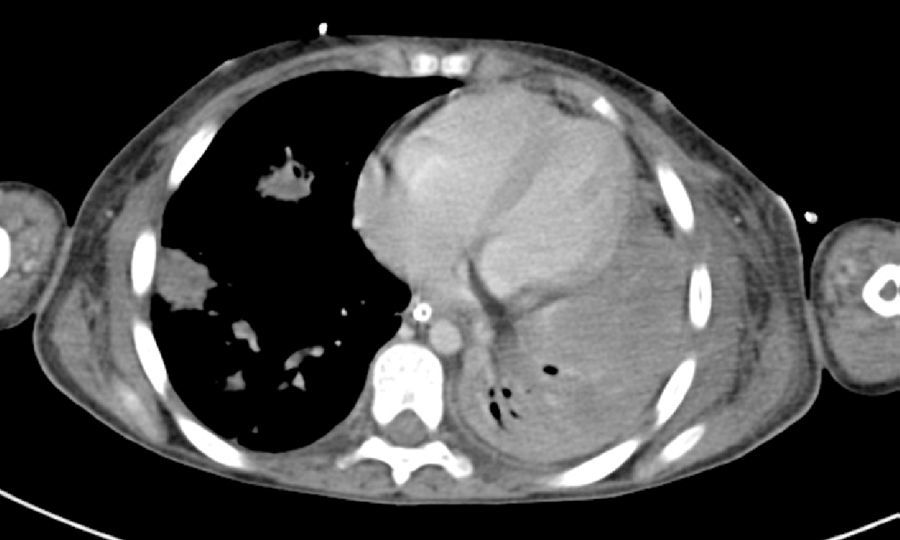
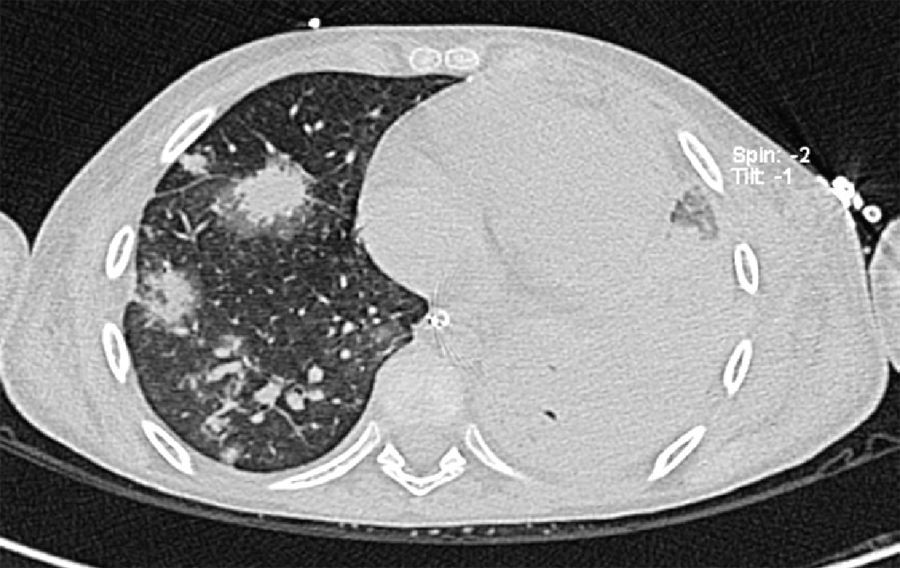
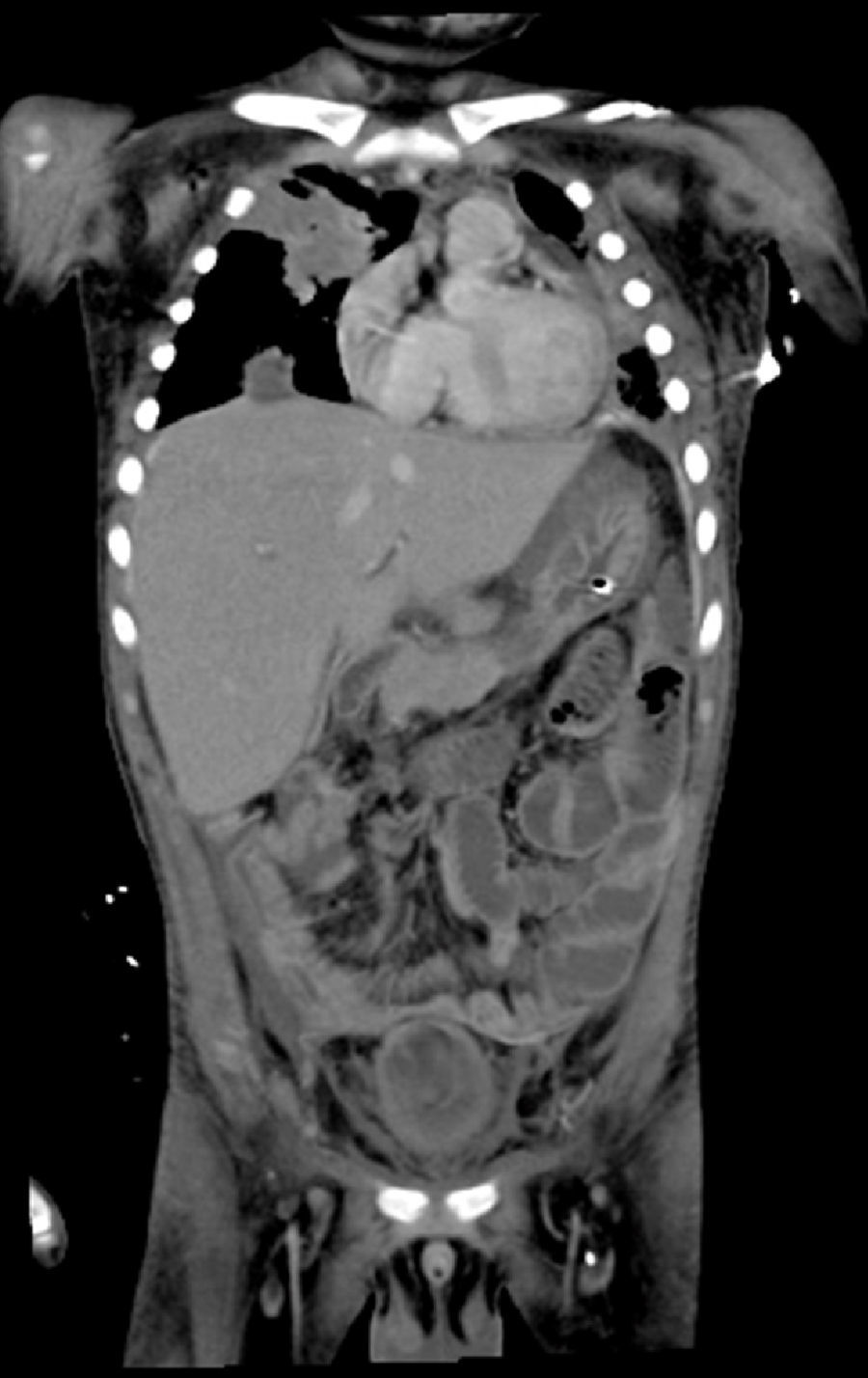
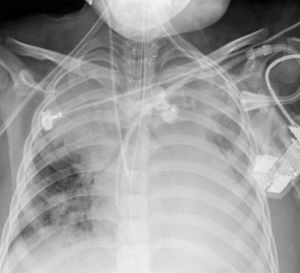
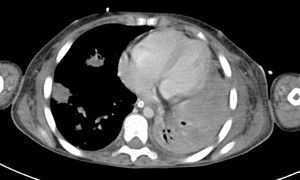
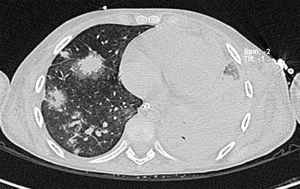
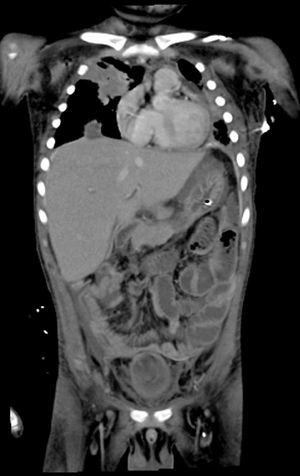
2Presentación del casoEn la placa de tórax se observó un patrón de vidrio despulido en el pulmón derecho, con una sonda pleural que se proyecta en el hemitórax izquierdo, punta distal en el ápice pulmonar del mismo lado, presencia de cánula endotraqueal, catéter con acceso yugular derecho y extremo distal en la aurícula ipsilateral, así como catéter subclavio izquierdo con extremo distal en la misma topografía de la aurícula. Se observó también radiopacidad en el ápice pulmonar derecho, sugestiva de atelectasia, que persistió con obliteración del ángulo costo diafragmático del lado izquierdo. Se identificaron imágenes nodulares proyectados sobre la región parahiliar y basal del lado derecho, así como datos de congestión (fig. 1). Se realizó una tomografía computada (TC) en ventana para mediastino con fase de contraste IV, donde se identificaron zonas de ocupación broncoalveolar con broncograma aéreo. En los cortes más inferiores se observaron los nódulos que se referían ya en la placa simple, proyectados sobre la región basal del lado izquierdo con broncograma aéreo (fig. 2). En la ventana pulmonar se observó la ocupación broncoalveolar en ambos pulmones y las zonas o nódulos que confluyeron en muchas sobre la misma región de ocupación broncoalveolar. Se detectó un halo hipodenso alrededor de esta, y un trayecto vascular que llegaba al mismo. Esto corresponde a la posible formación de trombos alrededor de esta lesión nodular, probablemente de origen micótico (fig. 3). Persistió también la ocupación broncoalveolar en la región basal del lado izquierdo. Se hicieron cortes a nivel del abdomen, donde se observó engrosamiento de la mucosa del intestino, derivaciones intestinales tanto del delgado como del grueso; la grasa mesentérica mostró estriación, que podría corresponder a un proceso de tipo infeccioso o inflamatorio (fig. 4). Se detectó una ectasia piélica del riñón derecho y estriación de la grasa del mesenterio a nivel del hueco pélvico.
Con base en los datos radiológicos, se concluyó que se trataba de un proceso neumónico de posible origen micótico, probablemente aspergilomas. No se descartó sobreinfección pulmonar agregada a estas zonas de consolidación; además, existía una sobrecarga hídrica y un proceso inflamatorio del intestino.
3DiscusiónEl presente caso trata de un paciente masculino de 8 años de edad que acudió al HIMFG un mes antes de su deceso al integrarse diagnóstico de leucemia linfoblástica aguda. Esta patología es el cáncer más frecuente identificado en la edad pediátrica, con una incidencia de hasta el 40%. La sintomatología inicial es insidiosa; sin embargo, existen datos clínicos y de laboratorio que permiten sospechar el diagnóstico, los cuales son reflejo de la infiltración de las células neoplásicas a nivel de la médula ósea y del organismo.
Al diagnóstico, el paciente debutó con síndrome anémico al presentar astenia, adinamia, Hb de 3.6g/dl, así como síndrome infiltrativo al presentar adenopatías cervicales, axilares e inguinales. Se realizó AMO que reporto la presencia del 91% de blastos. Se catalogó como de alto riesgo al presentar cuenta leucocitaria mayor de 100,000 (de acuerdo con los criterios de Roma), inmunofenotipo T (de acuerdo con la clasificación inmunológica), además de mala respuesta a ventana esteroidea al reportarse más de 1000 blastos en sangre periférica al octavo día de tratamiento con esteroide. Por lo anterior, se decidió iniciar esquema de quimioterapia con protocolo HIMFG 2003 para leucemias de alto riesgo. Este protocolo consiste en cuatro fases: una fase de inducción a la remisión, una fase de intensificación, una fase de consolidación y una fase de mantenimiento. Para la fase de inducción a la remisión se utilizan cuatro fármacos durante 4 semanas: un alcaloide de la vinca (vincristina), una antraciclina (daunorubicina), un fármaco tipo enzima (L-asparginasa) y un esteroide.
Al ingreso a urgencias, el paciente se encontraba en la tercera semana de inducción a la remisión, la cual tiene como objetivo reducir la carga tumoral en el 99%, restaurar la hematopoyesis y mejorar el estado funcional de la medula ósea, objetivos que muy probablemente no se lograron dado que el resumen clínico no reporta los resultados de las evaluaciones semanales, desconociéndose el estado de la enfermedad al ingreso. No se descarta que la pancitopenia que el paciente presentó estuviera asociada con la actividad de la enfermedad y no fuera secundaria al efecto citotóxico de los fármacos quimioterapéuticos administrados.
El paciente presentó estado de choque (de acuerdo con la valoración realizada en urgencias), el cual se puede clasificar como de tipo distributivo séptico por las condiciones clínicas al ingreso. De acuerdo con la American Heart Association, este se caracteriza por la mala distribución de flujo sanguíneo que causa un estado de hipoperfusión tisular y metabolismo anaerobio. Las manifestaciones clínicas del paciente al ingreso fueron taquicardia e hipotensión con diferenciales amplias y una gasometría que reportó acidosis metabólica, con lactato de 5.1 y un exceso de bases actual (EB) de -9.4mmol/l. Se le administraron cargas con solución cristaloide, con el objetivo de mejorar la precarga que se encontraba disminuida por causa de la vasodilatación inicial. Como mecanismo compensatorio reflejo, conforme el choque progresó, hubo disminución del gasto cardiaco y presencia de disfunción miocárdica inducida por sepsis.
En este caso, después de la administración de tres cargas con solución cristaloide, fue necesario el tratamiento con adrenalina y norepinefrina debido a la disfunción cardiovascular que presentaba.
Se identificó el foco de la infección en el abdomen, integrándose colitis neutropénica, la cual se considera como una urgencia oncológica infecciosa que se presenta del 65 al 75% de pacientes con neoplasias hematológicas y se caracteriza por la presencia dolor abdominal (90%), fiebre (84%) y diarrea (72%), sintomatología que presentaba el paciente. Este padecimiento se ve condicionado por una combinación de factores como la presencia de mucositis, sobrecrecimiento bacteriano, edema de la pared del intestino y disminución de la perfusión. Se puede presentar hasta 2 semanas posteriores al inicio de quimioterapia citotóxica o en el nadir de la quimioterapia. El paciente de este caso se encontraba en la tercera semana de tratamiento citotóxico.
De acuerdo con los criterios de Schaberger, que indican la necesidad de cirugía en pacientes con colitis neutropénica, el paciente persistió con deterioro hemodinámico progresivo a pesar del uso de aminas. Esto se tradujo en un choque séptico refractario a aminas, ameritando la realización de laparotomía exploratoria, lo que permitió la detección de la dilatación de íleon y colon y la presencia de áreas de isquemia y necrosis en ciego, por lo que se realizó hemicolectomía e ileostomía.
Al persistir con fiebre y datos de respuesta inflamatoria 72h después del inicio de los antibióticos, se decidió agregar de manera empírica por ruta crítica un tratamiento antifúngico. Los factores de riesgo identificados en nuestro paciente fueron la cirugía previa, el uso de antibióticos de amplio espectro y la neutropenia profunda. Tomando en cuenta que el principal agente que condiciona infecciones fúngicas y que vive de manera saprofita en las mucosas es Candida, se decidió iniciar tratamiento con anfotericina B de acuerdo con las guías de fiebre y neutropenia propuestas por la Infectious Diseases Society of America en 2010. Al presentar en la exploración física estertores crepitantes, infiltrado alveolar derecho en la radiografía de tórax y ameritar incremento de los parámetros ventilatorios, se integró neumonía nosocomial al diagnóstico. Dentro de las etiologías a considerar en un paciente inmunocomprometido se encuentra la infección por Pneumocystis jirovecii. Esta se caracteriza por presentar un curso subagudo con síntomas insidiosos, como tos de tipo no productiva, disnea y fiebre, asociado con hipoxemia y elevación de la DHL >500, los cuales son indicadores comunes, aunque no específicos, y se asocian con características radiológicas como la presencia de un infiltrado alveolar e intersticial difuso. Sin embargo, el diagnóstico preciso amerita el lavado broncoalveolar, con el fin de demostrar la presencia de quistes o trofozoítos. Dicho estudio no se realizó en el paciente, por lo que se decidió iniciar cobertura empírica con TMP/SMX. Posteriormente se documentó cuadro de infección por virus de herpes simple, iniciándose tratamiento con aciclovir. De acuerdo con las guías comentadas, únicamente está indicado el tratamiento de las infecciones virales si hay evidencia de actividad de la enfermedad, como en el caso de este paciente, en quien se documentó mediante la prueba de Tzank y las lesiones dérmicas características.
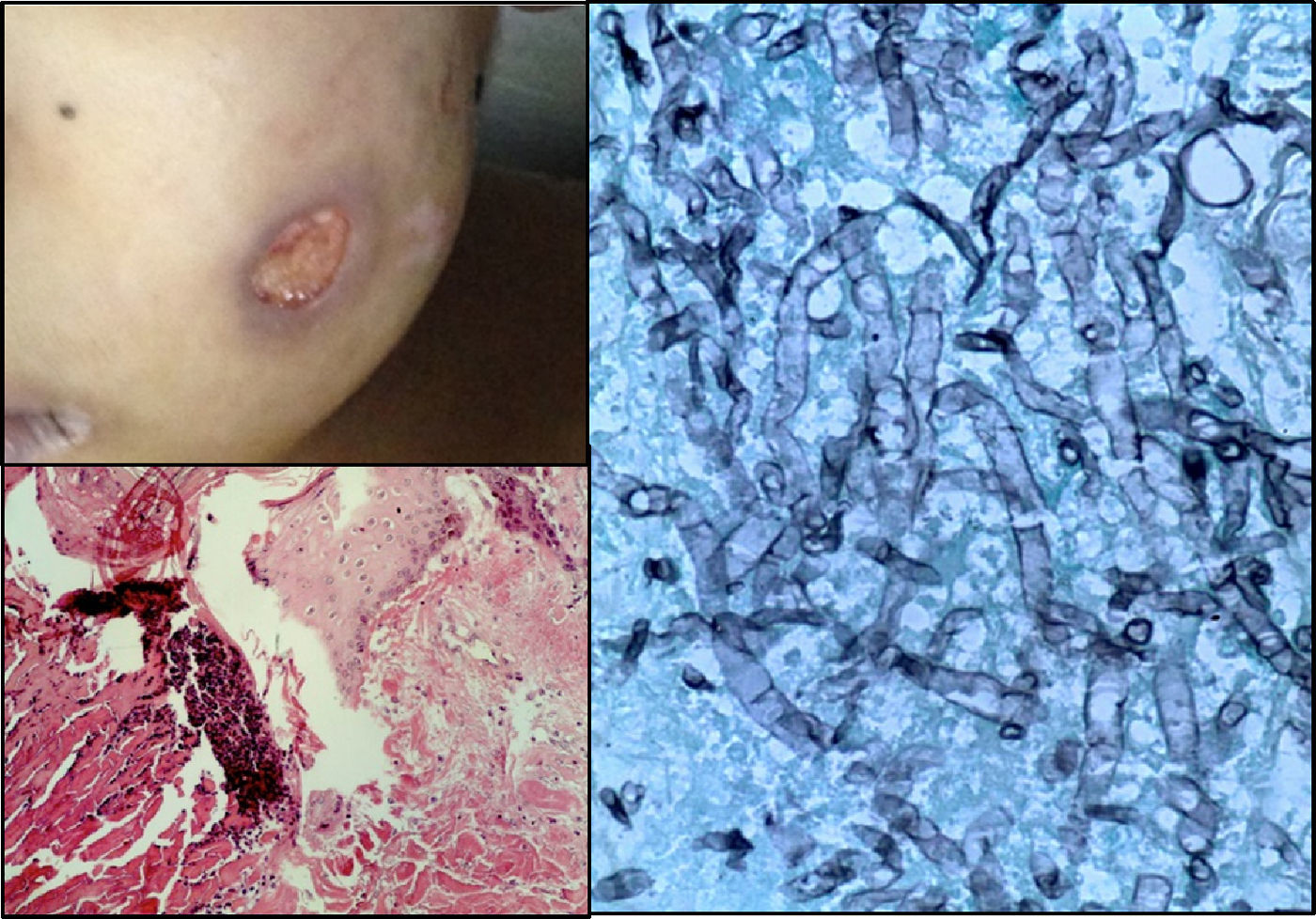
Cinco días posteriores al inicio del tratamiento empírico contra P. jirovecii, el paciente continuó con fiebre y datos de respuesta inflamatoria sistémica, identificándose la presencia de una lesión blanquecina en paladar y lesiones violáceas en extremidades a la exploración física. Dichas lesiones obligaron a descartar una micosis sistémica al ser un paciente inmunocomprometido gravemente y prolongado bajo intensa presión antibiótica. Fue necesario el abordaje diagnóstico, teniendo como principal sospecha una aspergilosis, y como diagnósticos diferenciales la presencia de Fusarium, Zigomicetos y Scedosporium. En la actualidad, la aspergilosis es considerada la causa más común de mortalidad por neumonía infecciosa en pacientes inmunocomprometidos. La especie más frecuentemente identificada es el Aspergillus fumigatus1,2. De acuerdo con el Grupo Cooperativo de la Organización Europea para la Investigación en el Tratamiento del Cáncer, se definieron tres niveles de certeza de la aspergilosis invasiva: comprobada, probable y posible. Estas definiciones se han desarrollado con el fin de mantener la consistencia en los estudios clínicos y epidemiológicos, y no impulsar las decisiones terapéuticas. La aspergilosis comprobada requiere la documentación histopatológica de la infección y un resultado positivo del cultivo de una muestra tomada de un sitio normalmente estéril. La aspergilosis probable requiere el cumplimiento de ciertos signos en tres categorías: factores relacionados con el anfitrión, manifestaciones clínicas y datos microbiológicos3. Dado que para establecer el diagnóstico se necesita una muestra de lavado broncoalveolar para cultivo, aspiración percutánea o biopsia, se han establecido métodos alternos como la detección de galactomananos. Estos son un componente de la pared del Aspergillus que se libera durante la angioinvasión y se detecta en sangre periférica, llegando a tener una sensibilidad del 61% y una especificidad del 93%. Los estudios de imagen se utilizan para determinar el sitio de la infección, el número y tamaño de las lesiones. La TAC es el estudio de elección que permite distinguir características típicas más no específicas, como lesiones o infartos en forma de cuña, signo de halo definido como un nódulo mayor de 1cm rodeado por un área de opacidad y el signo del cuarto creciente4. La infección del paciente se catalogó como fúngica invasora comprobada al contar con imágenes radiológicas sugestivas, examen directo de aspirado endotraqueal con presencia de hifas septadas macrosifonadas hialinas, galactomananos positivos y biopsia de piel que reportó vasculitis por aspergilosis.
La terapia inicial de la aspergilosis invasiva es voriconazol. Para la terapia de rescate en pacientes que no responden a la monoterapia con voriconazol o anfotericina B liposomal, se sugiere el uso de un régimen antimicótico combinado5. En estos pacientes se sugiere la adición de una equinocandina, como la caspofungina. Esta combinación de antifúngicos ha evidenciado un impacto positivo en la supervivencia comparada con monoterapia con triazoles. La duración de la terapia antifúngica depende de la ubicación de la infección, la enfermedad subyacente del paciente, la necesidad de una inmunosupresión adicional y la respuesta al tratamiento. La terapia antifúngica generalmente se mantiene hasta que todos los signos y síntomas de la infección se han resuelto, así como hasta la desaparición de los hallazgos por imagen.
La aspergilosis pulmonar presenta una mortalidad de entre el 75 y el 92%, siendo la hemoptisis masiva la principal causa directa de mortalidad hasta en el 80%. Los factores de mal pronóstico que se han identificado son el inmunocompromiso prolongado, el uso de esteroides, el sitio y la extensión de la infección y el uso de ventilación mecánica; estos factores estaban presentes en el paciente de este estudio6.
En conclusión, la evolución del paciente fue tórpida a consecuencia del inmunocompromiso severo en el que se encontraba, que puede ser atribuido al tratamiento o a la actividad de la enfermedad, lo que le condicionó un riesgo elevado de infecciones. Dentro de estas infecciones se cuenta la aspergilosis invasiva, que condicionó hemorragia pulmonar y secundariamente choque mixto (hipovolémico y séptico).
De acuerdo con la evolución del paciente se integraron los siguientes diagnósticos finales:
- 1.
LLA de alto riesgo por inmunofenotipo T, cuenta leucocitaria y mala respuesta a esteroide.
- 2.
Colitis neutropénica.
- 3.
Choque séptico refractario a aminas.
- 4.
Aspergilosis pulmonar invasora.
Causa directa de la muerte: hemorragia pulmonar y choque hipovolémico.
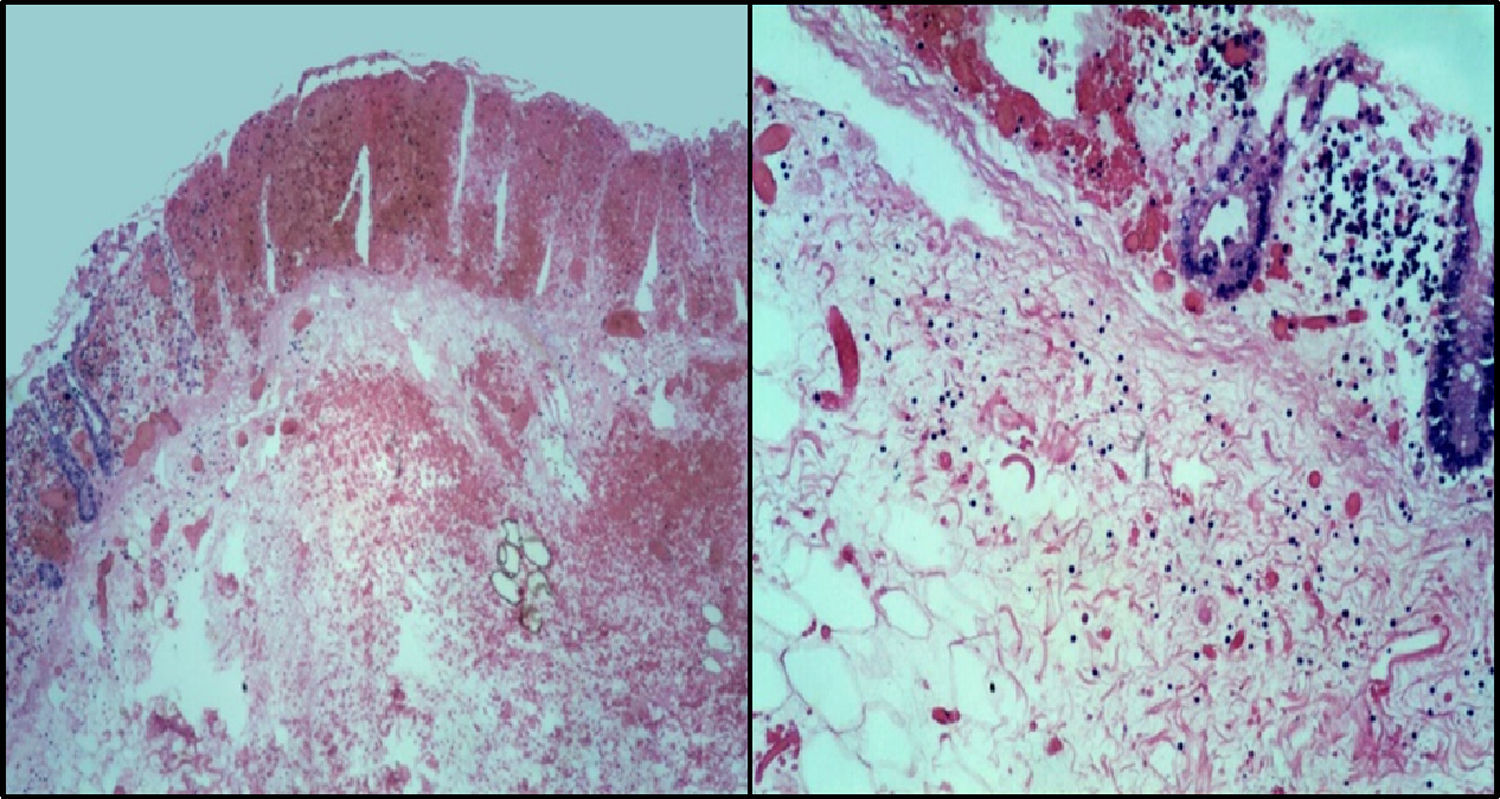
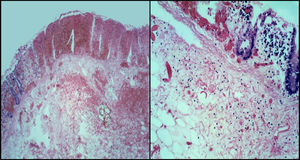
4PatologíaEn los hallazgos de patología, el paciente contaba con un estudio pre mórtem que correspondió a un segmento de intestino que midió 20cm. De ellos, 6cm correspondieron a íleon terminal y el resto a ciego y colon ascendente. La imagen macroscópica era de un colon necrótico-hemorrágico, con mucosa edematosa con espesor de la pared de 0.4cm (fig. 5).
La fisiopatología de la colitis neutropénica está relacionada con la neutropenia grave que permite el crecimiento de bacterias enteropatógenas, las cuales producen toxinas que dañan el epitelio de la mucosa provocando necrosis, aunado al efecto citotóxico de los quimioterapéuticos. Estos cambios se traducen histológicamente como necrosis extensa con hemorragia reciente, edema importante de submucosa y grados variables de daño a la pared que pueden condicionar microperforaciones o perforaciones completas de la pared intestinal.
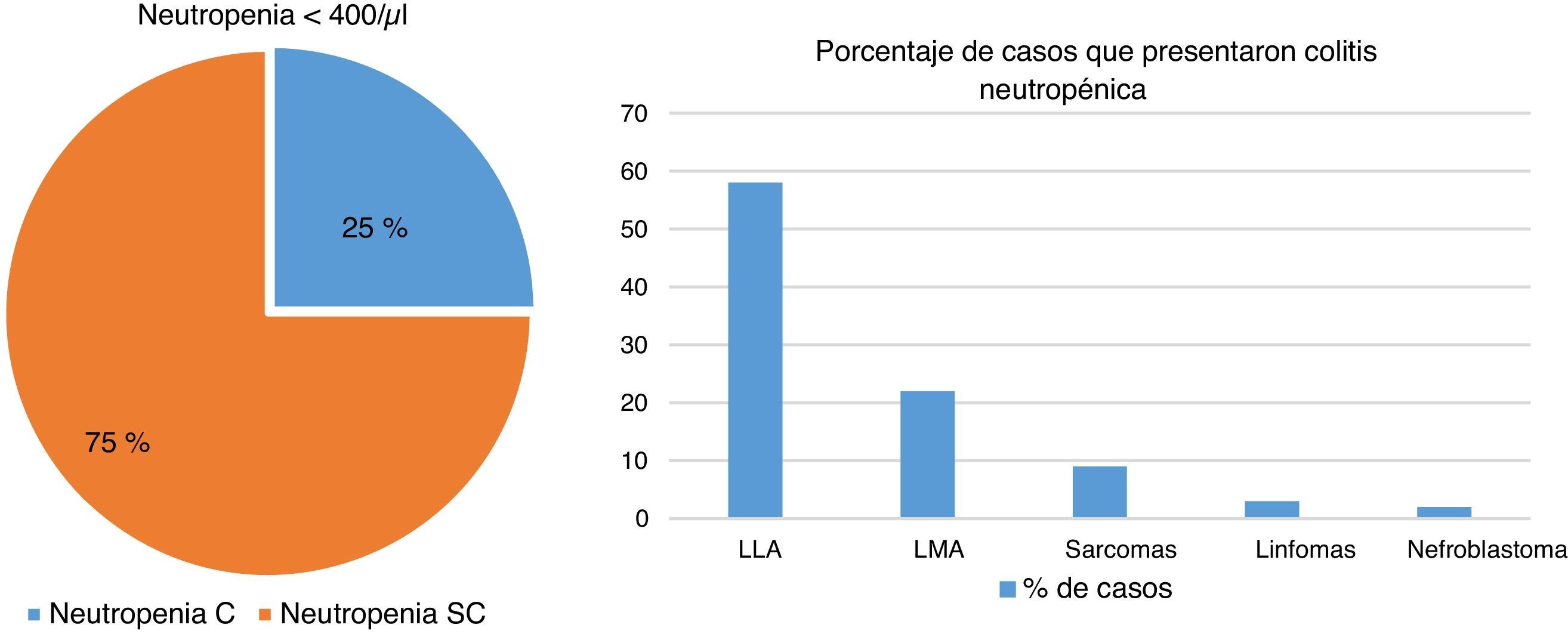
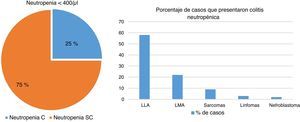
En el servicio de Patología se realizó un estudio de más de 240 autopsias de pacientes que cursaban con alguna inmunodeficiencia, constatando que hasta el 25% de pacientes inmunocomprometidos cursaban con colitis neutropénica. De ellos, casi el 60% estaban asociados con LLA, el 22% con leucemia mieloide aguda (LMA) y el resto con sarcomas, linfomas o nefroblastomas (fig. 6).
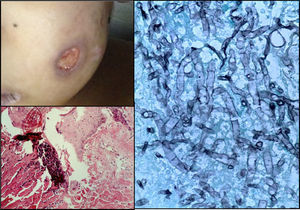
En el estudio post mórtem, el paciente presentó una cicatriz abdominal de 25cm, lesiones eritemato-violáceas principalmente en los dedos de las manos y de los pies, en los brazos y mejilla izquierda; algunas de ellas se observaban cavitadas con un fondo de fibrina y hemorragia (fig. 7).
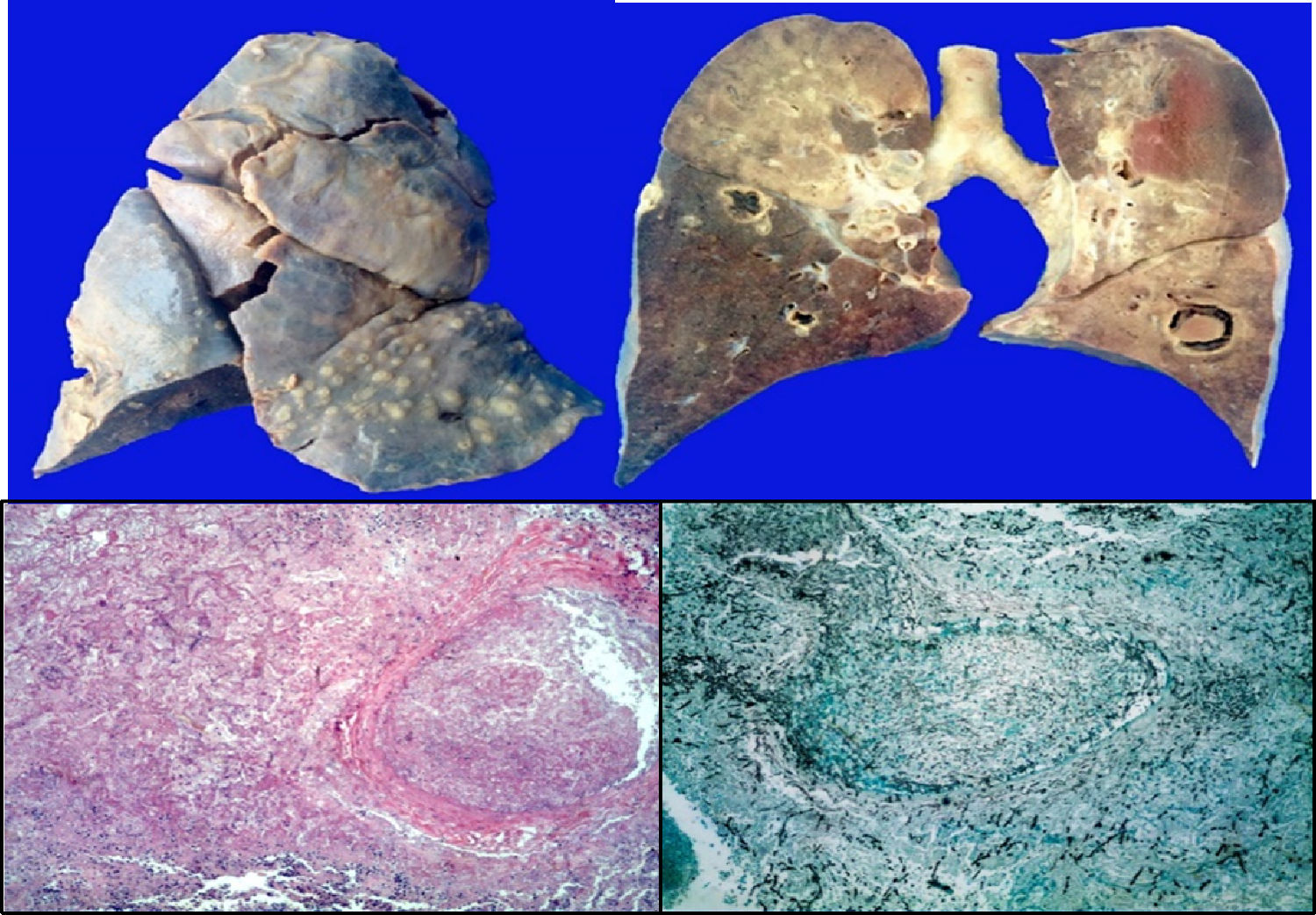
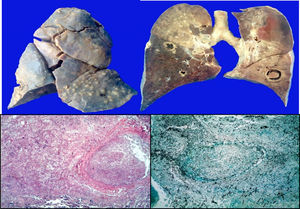
Los pulmones presentaron engrosamiento difuso de la pleura visceral con áreas de fibrosis extensa y lesiones nodulares granulomatosas. En los cortes seriados del parénquima pulmonar se observaron extensas áreas de necrosis y hemorragia prácticamente en el 100%, con múltiples áreas cavitadas pseudoquísticas; algunas con fondo necrótico, otras con fondo hemorrágico. En los cortes histológicos, estos correspondían a infartos secundarios provocados por émbolos sépticos de hifas (fig. 8).
En otras áreas donde el parénquima estaba mejor conservado, se observaron regiones extensas de hemorragia con engrosamiento de los tabiques interalveolares y formación de membranas hialinas.
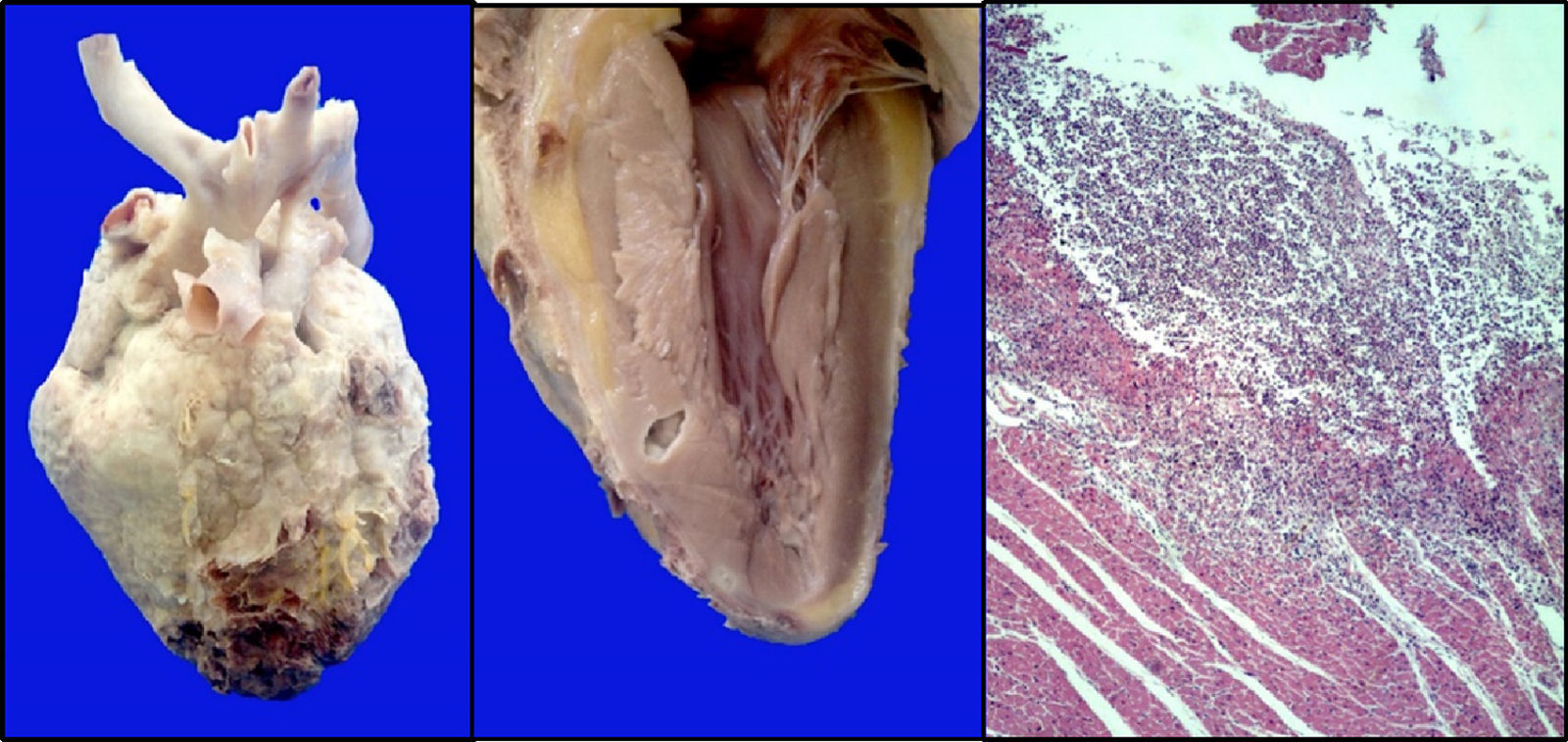
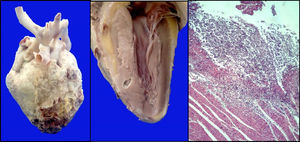
El corazón presentó pericarditis fibrinosa con áreas de hemorragia y necrosis en el ápex. En el corte en el tabique interventricular se observaron abscesos definidos con un halo claro; en los cortes histológicos, se observó infiltrado inflamatorio linfocitario con evidencia de las hifas de Aspergillus (fig. 9).
La cavidad abdominal presentaba múltiples adherencias; el estómago, con los pliegues engrosados, edematosos, con áreas de hemorragia y dos perforaciones: la mayor de 1.4cm en el fondo y la menor de 0.4cm. Los cortes histológicos evidenciaron granulomas con hifas de Aspergillus.
El intestino delgado, colon y estomas presentaban pérdida focal de los pliegues de la mucosa, y áreas de aspecto mucinoso con una coloración verdosa. En los cortes histológicos, la mucosa estaba parcialmente conservada; en la capa serosa se observó depósito de fibrina, infiltrado inflamatorio y la presencia de hifas de Aspergillus.
El diafragma presentó múltiples áreas de necrosis que microscópicamente correspondían a zonas donde había invasión por el hongo.
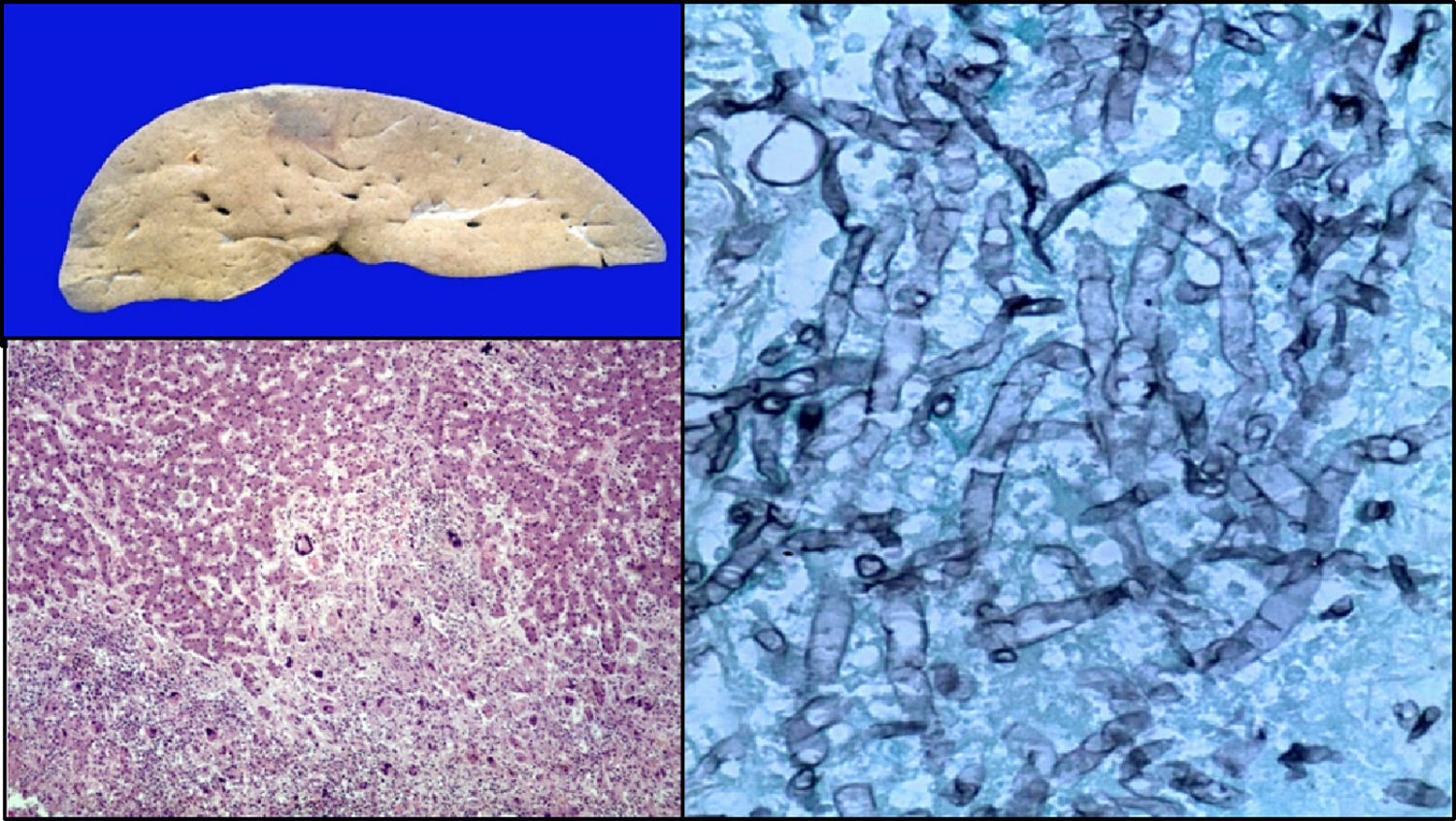
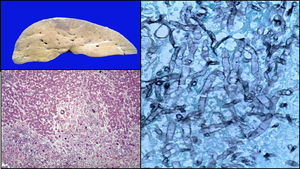
El hígado era de color café-amarillo. En regiones subscapulares, la coloración era violácea-verdosa; los cortes histológicos correspondían a necrosis con formación de células gigantes en relación a las hifas de Aspergillus. El resto del parénquima presentaba datos de choque, caracterizados por esteatosis micro y macrovesicular, dilatación y congestión de los sinusoides (fig. 10).
El páncreas presentó datos histológicos de daño secundarios a los quimioterapéuticos, caracterizados por pancreatitis crónica y bandas de tejido fibroconectivo que formaban nódulos de acinos pancreáticos.
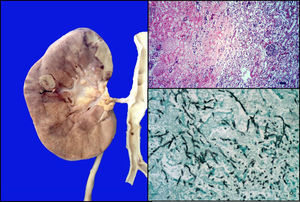
El riñón derecho presentó una lesión nodular de aproximadamente 1cm en la unión de corteza con la médula; en los cortes histológicos, correspondía a zonas de infarto secundarias a la trombosis de los vasos por hifas de Aspergillus (fig. 11).
La médula ósea tenía una celularidad aproximada del 80%, con presencia de las tres series hematopoyéticas de maduración adecuada; no se observó infiltración neoplásica o formación de granulomas por las hifas de Aspergillus.
Los ganglios linfáticos se observaron con depleción del tejido linfoide y numerosos macrófagos con hemofagocitosis por activación macrofágica secundaria a la infección por el hongo.
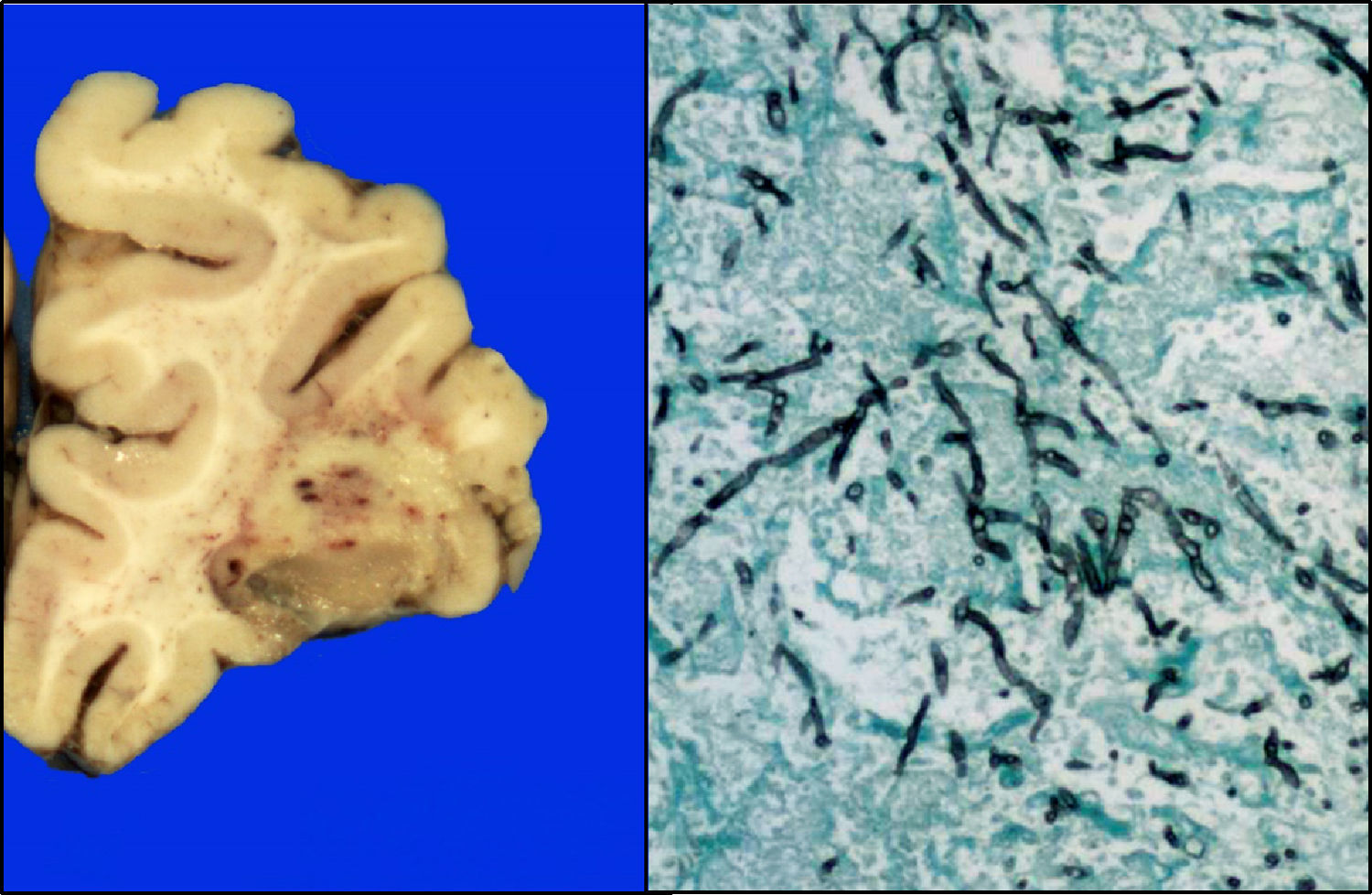
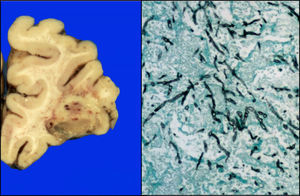
El cerebro presentó datos de edema, circunvoluciones anchas, vasos congestivos; en la cara basal se observaba congestión de las meninges, opacas. En los cortes histológicos, principalmente en la región frontal, parietal y temporal, se observaron áreas parcialmente definidas con un material mucinoso-verdoso y áreas de hemorragia, que a los cortes histológicos correspondían a la formación de granulomas con necrosis y la presencia de hifas (fig. 12).
El diagnóstico principal fue de LLA inmunofenotipo T, asociada con aspergilosis diseminada con émbolos sépticos en pulmón, corazón, diafragma, peritoneo, hígado, estómago, cerebro y piel. Además, traqueítis aguda ulcerada, colitis neutropénica en estatus poscolectomía, peritonitis crónica activa, síndrome de activación macrofágica en los ganglios y una pancreatitis crónica, probablemente por el tratamiento. También se diagnosticaron datos histopatológicos de choque (miopatía visceral hipóxica, necrosis tubular aguda, encefalopatía hipóxica y daño alveolar difuso). La causa de la muerte fue choque séptico.
5Comentarios finales5.1InfectologíaAspergillus es un hongo filamentoso, hialino y ubicuo. Constituye la primera causa de infección fúngica por hongos filamentosos y la segunda causa (solo después de Candida) de infección fúngica invasora6.
La aspergilosis invasora ha emergido en los últimos años como causa importante de morbilidad y mortalidad en pacientes inmunocomprometidos; los pacientes pediátricos inmunocomprometidos, particularmente aquellos con una disminución profunda y prolongada en el número de neutrófilos, son los principalmente afectados, con una mortalidad reportada entre el 50 y el 100% en caso de no recibir tratamiento7–9.
Una vez que se ha establecido la posibilidad diagnóstica de aspergilosis invasora, se dispone de varios estudios diagnósticos. Debe recordarse que las muestras más fidedignas serán las obtenidas de sitios estériles o profundos. El examen microscópico directo incrementa notablemente la sensibilidad del cultivo. Si bien su sensibilidad global no es alta, alrededor del 50%, la visualización de hifas tabicadas, macrosifonadas y que se ramifican en ángulo agudo en un paciente de riesgo será altamente sugestivo de aspergilosis invasora10.
El galactomanano es un polisacárido componente de la pared celular del hongo, que se libera principalmente durante la angio-invasión, y su detección en suero y lavado bronquio-alveolar a través de un inmunoensayo enzimático (ELISA) es útil11,12. En lavado bronquio-alveolar tiene una sensibilidad superior al 70%, y en suero, del 57-71%, y una especificidad variable del 66 al 89%. En 2008, en la revista Anales de Oncología, se reportó que dos pruebas consecutivas positivas incrementan significativamente la exactitud de la prueba, con una sensibilidad del 92.1% y una especificidad del 97.5%.
El estándar de oro siempre será la identificación de la infección fúngica por hongos filamentosos en cultivos de sitios estériles.
Antes de la terapéutica de primera línea con voriconazol, la mortalidad por aspergilosis pulmonar invasiva era mayor al 60%13. El voriconazol ha incrementado la supervivencia. En varios análisis que se han realizado después del manejo terapéutico con voriconazol, se ha observado que la enfermedad diseminada incrementa, al menos, tres veces más la posibilidad de muerte (del 66 al 90% de mortalidad)14. Se ha observado que cuando los pacientes con cáncer tienen una enfermedad invasiva por hongos, puede disminuir su mortalidad.
Los estudios epidemiológicos no han demostrado que la doble terapia antifúngica sea superior a la monoterapia15. Existe un ensayo clínico aleatorizado en adultos donde se compara el tratamiento con una equinocandina (la anidulafungina, aún no aprobada en niños) combinada con voriconazol contra la monoterapia con voriconazol. Dicho estudio no demostró que la doble terapia fuera mejor que la monoterapia, y tampoco lo hizo en los estudios epidemiológicos. Por esto, el nicho de la doble terapia serían los pacientes que tienen enfermedad refractaria al tratamiento4. Esta se considera como la que recibió al menos siete días de tratamiento en forma apropiada y existe evidencia de empeoramiento. Se debe ser cuidadoso con esta definición, ya que puede haber un síndrome similar al que se observa en la reconstitución inmunológica con VIH, donde el hecho de que haya una recuperación de neutrófilos en una enfermedad infecciosa, potencialmente puede llegar a tener un efecto paradójico. Una vez que se establece que es una enfermedad refractaria, debe administrarse un tratamiento de rescate o de salvamiento. Existen dos posibilidades: cambiar la clase del fármaco a monoterapia o dar terapia combinada. En cuanto a la monoterapia en tratamiento de rescate, la anfotericina B es inferior; ofrece una sobrevida de apenas el 30-39% en enfermedad refractaria. Los nuevos azoles, como el posaconazol, tienen una eficacia de alrededor del 45% en enfermedad refractaria. En un metanálisis de hace 3 años se reportó que la terapia combinada disminuye la mortalidad en comparación con la monoterapia. Ante la pregunta lógica de qué fármacos administrar en terapia combinada, las dos opciones son un azol con anfotericina o un azol con equinocandinas. En los modelos animales se ha descrito un antagonismo y sinergismo con voriconazol y anfotericina B; aunque en las guías clínicas se mencionan como una opción, probablemente no sea la mejor terapia. Aparentemente, la combinación de voriconazol con caspofugina es la mejor opción terapéutica, y el nicho sería el paciente que ya tiene una enfermedad documentada por Aspergillus y que es refractario al tratamiento con monoterapia con voriconazol4.
5.2Terapia intensivaSin duda, los niños con cáncer que ingresan a cuidados intensivos son un reto. La mortalidad por choque séptico en terapia intensiva es del 10% en la población general, lo cual se acerca a las metas internacionales; sin embargo, en los pacientes oncológicos se presenta una mortalidad del 20 al 22%. Esto es perfectible dado que en otros centros, como el St. Jude Children's Research Hospital, el porcentaje de pacientes oncológicos con estas características que fallece es del 15 al 17%.
Los factores identificados de mayor riesgo de mortalidad al ingresar a la unidad de terapia intensiva pediátrica (UTIP) son neutropenia profunda y prolongada, requerimiento desde el ingreso de soporte inotrópico, vasopresor concomitante a la ventilación, insuficiencia renal aguda al ingreso, valor de riesgo pediátrico de mortalidad (PRISM III, por sus siglas en inglés) alto, infecciones fúngicas y trasplante de médula ósea. Este paciente, además de tener sepsis abdominal, presentaba seis de estos siete criterios. En caso de ingresar a terapia, se debe ser muy agresivos con el tratamiento y cautelosos con la reanimación hídrica, ya que el consenso recomienda administrar de dos a tres cargas, aunque no es una regla. Se debe ser muy cuidadosos al administrar los líquidos, ya que en las evidencias radiológicas y patológicas se observan las consecuencias que da una reanimación hídrica excesiva. Es muy importante que en estos niños toda la reanimación sea en terapia intensiva, porque en ocasiones presentan hepatomegalia. Para este procedimiento se utiliza un monitoreo invasivo para decidir la cantidad de líquidos, la variabilidad de pulso, los sistemas pico, las pruebas pasivas de elevación de piernas y mediciones ecocardiográficas de la colapsabilidad de la vena cava. Todo esto ayuda a guiar el manejo; en este caso, las opciones finales de manejo serían la terapia de reemplazo plasmático y la terapia de reemplazo lento. También puede realizarse plasmaféresis, con el fin de mejorar el perfil de citocinas, la inflamación y, sobre todo, mejorar la microangiopatía trombótica que presentan estos niños y que es la causante de la disfunción orgánica.
Por otro lado, en la historia del paciente se refiere hasta el 25% de sobrecarga hídrica, y está reportado que un valor mayor al 10% en la reanimación inicial del choque séptico es un factor asociado con la mortalidad. Esto es importante porque esta sobrecarga es la que no permitió extubar rápidamente al paciente y, por ende, provocó todas las consecuencias que se presentaron. El cuadro inicial (sepsis abdominal) se atendió mediante cirugía y el paciente mejoró y llegó a estar en condiciones favorables, pero la suma de los factores perfectibles mencionados fue lo que desencadenó este final desafortunado.
5.3NefrologíaPara la Red Internacional para la Falla Renal Aguda, los pacientes que están en terapia intensiva tienen una posibilidad del 30 al 80% de desarrollar una falla renal; esto aumenta la morbimortalidad y el tiempo de estancia en unidades de cuidados intensivos. Para valorar la falla renal, se tienen criterios tanto clínicos como metabólicos. En este paciente es muy claro que el criterio metabólico no aplicaba. Nunca llegó a tener elevación de creatinina, tuvo acidosis metabólica, pero no tuvo un descontrol metabólico importante; además, a pesar de tener un gasto urinario adecuado, presentaba un porcentaje importante de sobrecarga hídrica. No necesariamente se deben presentar todos los criterios para decidir una terapia de reemplazo renal, sino que con la sobrecarga hídrica está indicado iniciar la terapia de reemplazo renal.
Dentro de las terapias de reemplazo renal lentas continuas, el paciente requería hemofiltración para retirar volumen a la brevedad. El riñón estaba depurando a pesar de tener el daño que comenta la descripción patológica, pero necesitaba un apoyo hemodinámico bastante intenso.
5.4OncologíaLa supervivencia general de los pacientes con LLA es del 65 al 70%. El porcentaje esperado de mortalidad en fase de inducción a la remisión es solamente del 1%. En el HIMFG se ha descrito un porcentaje de mortalidad del 1.5 al 2% en esta etapa. Si la mortalidad es mayor al 1% en esta etapa, existen oportunidades de mejora.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.