El síndrome de la cimitarra consiste en una rara malformación, caracterizada por una conexión anómala parcial de una o ambas venas pulmonares derechas a la vena cava inferior, hipoplasia de pulmón derecho y circulación sistémica desde la aorta descendente. El síndrome de la cimitarra en ocasiones se asocia con otras malformaciones congénitas, entre las que se incluye la persistencia del conducto arterioso (PCA).
Caso clínicoPaciente de sexo femenino de cuatro años de edad con síndrome de la cimitarra, variedad “adulto”, asociado con PCA sintomático. Se realizó exitosamente oclusión del conducto mediante un asa arteriovenosa femoral con un dispositivo Amplatzer® PDA, sin complicaciones.
ConclusionesEl manejo del síndrome de la cimitarra es complejo y amerita de un estudio hemodinámico completo para determinar el tratamiento adecuado. La hipertensión arterial pulmonar es un factor de mal pronóstico.
Scimitar syndrome consists in a rare malformation characterized by a partial abnormal connection in one or both right pulmonary veins to the inferior vena cava, right lung hypoplasia and systemic circulation from the descending aorta. Scimitar syndrome is occasionally associated to other congenital malformations, such as patent ductus arteriosus (PDA).
Case reportWe report a 4-year-old patient with “adult” variety of scimitar syndrome associated to symptomatic PDA, which was successfully occluded using retrograde guidewire-established femoral arteriovenous loop with an Amplatzer® PDA occluder, without complications.
ConclusionsScimitar syndrome is complex and requires a complete hemodynamic study for the determination of the appropriate treatment. Pulmonary arterial hypertension is a factor associated with poor prognosis.
La persistencia del conducto arterioso (PCA) es considerada una de las malformaciones cardiovasculares congénitas más frecuentes, con una incidencia de 5.3 a 11% de todas las lesiones cardiacas congénitas1. En el Hospital Infantil de México Federico Gómez (HIMFG), según el archivo de bioestadística, la PCA es la segunda cardiopatía congénita más frecuente, solamente superada por la comunicación interventricular.
Por otro lado, el síndrome de la cimitarra (SC) consiste en una rara malformación, caracterizada por la conexión de las venas pulmonares derechas a la vena cava inferior (que da el aspecto clásico de sable curvo musulmán en una radiografía), hipoplasia del pulmón derecho con dextroposición cardiaca y presencia de circulación sistémica colateral anormal, desde la aorta descendente hasta la base del pulmón derecho. La incidencia reportada es de 1 a 3 por 100,000 pacientes nacidos vivos y del 3 al 5% de todas las conexiones anómalas parciales de venas pulmonares2. Pese a la rareza de esta condición, se ha reportado la coexistencia de SC con malformaciones del tipo de la tetralogía de Fallot, coartación aórtica, hipoplasia ventricular izquierda y doble vía de salida de ventrículo derecho3. Por otro lado, otras malformaciones, tal como la comunicación interatrial o la PCA, se consideran asociaciones frecuentes a SC, y en ocasiones son necesarias para mantener la estabilidad hemodinámica en el paciente.
La indicación terapéutica para SC, así como el plan quirúrgico son muy complejos y deben diseñarse de acuerdo con los síntomas clínicos y las anomalías asociadas. En términos generales, se han descrito dos condiciones clínicas de SC: la forma infantil, en la que predomina la hipertensión arterial pulmonar (HTP), que incrementa considerablemente el riesgo de mortalidad, y la forma adulta, que evoluciona mejor con menos o nulos síntomas en los que, en ausencia de HTP, el tratamiento quirúrgico puede llegar a ser irrelevante.
Se describe el caso de una paciente de 4 años de edad que presentó PCA moderada y a la que se le colocó un dispositivo Amplatzer® PDA mediante un asa arteriovenosa, ya que la angulación exagerada por la dextroposición cardiaca impidió la colocación anterógrada habitual de guía y vaina.
2Caso clínicoPaciente de sexo femenino, preescolar de 48 meses de edad, producto del IV embarazo normoevolutivo, peso de 2,900 g y talla de 48 cm al nacer. La madre refiere bronconeumonía al año de edad, sin complicaciones. La paciente, asintomática, fue enviada al HIMFG a los 18 meses de edad por la presencia de un soplo cardiaco. Los estudios iniciales revelaron radiografía de tórax con dextroposición cardiaca, situs solitus y flujo pulmonar aumentado; el electrocardiograma mostró hipertrofia ventricular derecha; el ecocardiograma Doppler codificado en color confirmó SC asociado a un conducto arterioso moderado, comunicación interatrial de 5 mm de diámetro y conexión de venas pulmonares derechas a la vena cava inferior. Con base en los datos anteriores, se decidió realizar el cierre del conducto arterioso mediante cateterismo.
Al momento del ingreso para el cateterismo cardiaco, la paciente presentó facies normal, peso de 15.7 kg y talla de 108 cm, clase funcional I de Ross sin cianosis ni hipocratismo digital, pulsos amplios en las cuatro extremidades, hiperactividad precordial paraesternal derecha con deformidad precordial por aumento de volumen del hemitórax izquierdo y frémito en hueco supraesternal. No se detectaron visceromegalias; la auscultación reveló un soplo continuo IV/VI en el segundo espacio intercostal derecho. El pulmón izquierdo presentó ventilación normal, y a la auscultación se detectaron el soplo y los ruidos cardiacos en el hemitórax derecho.
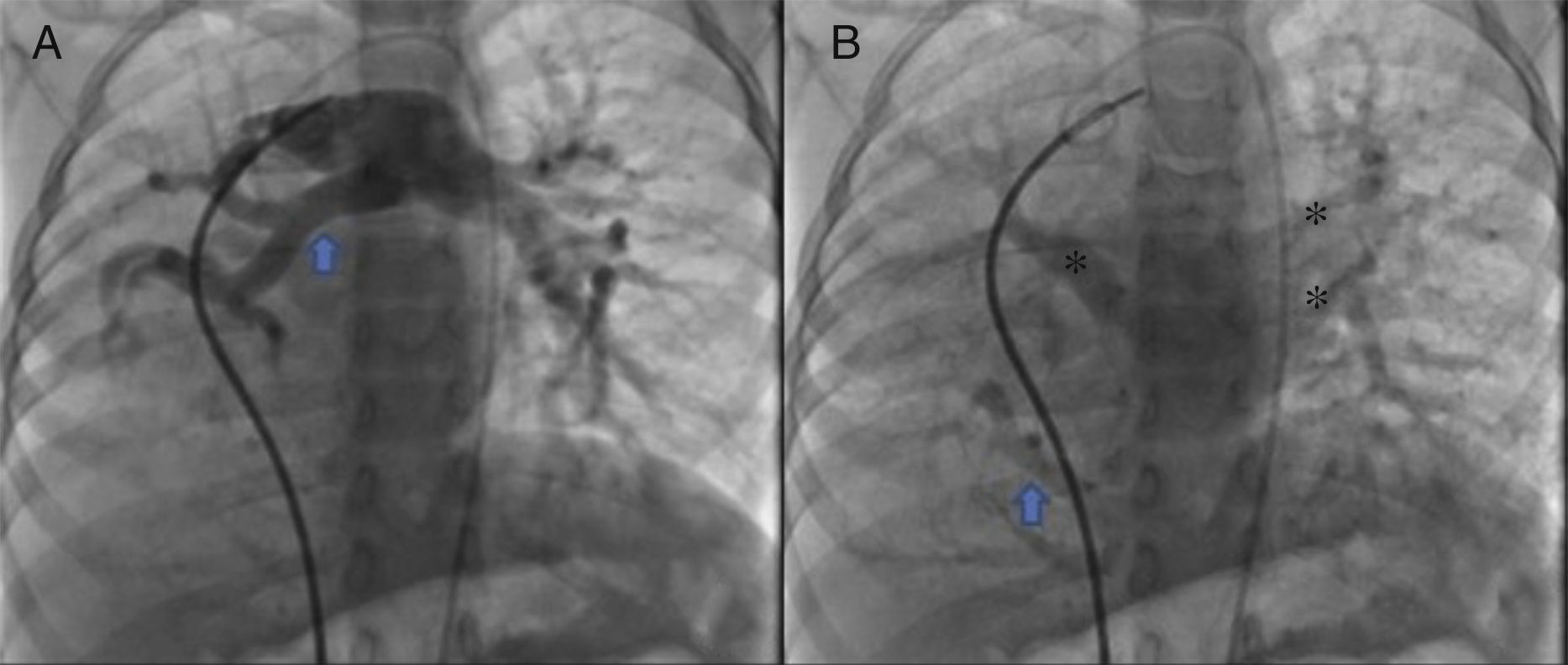
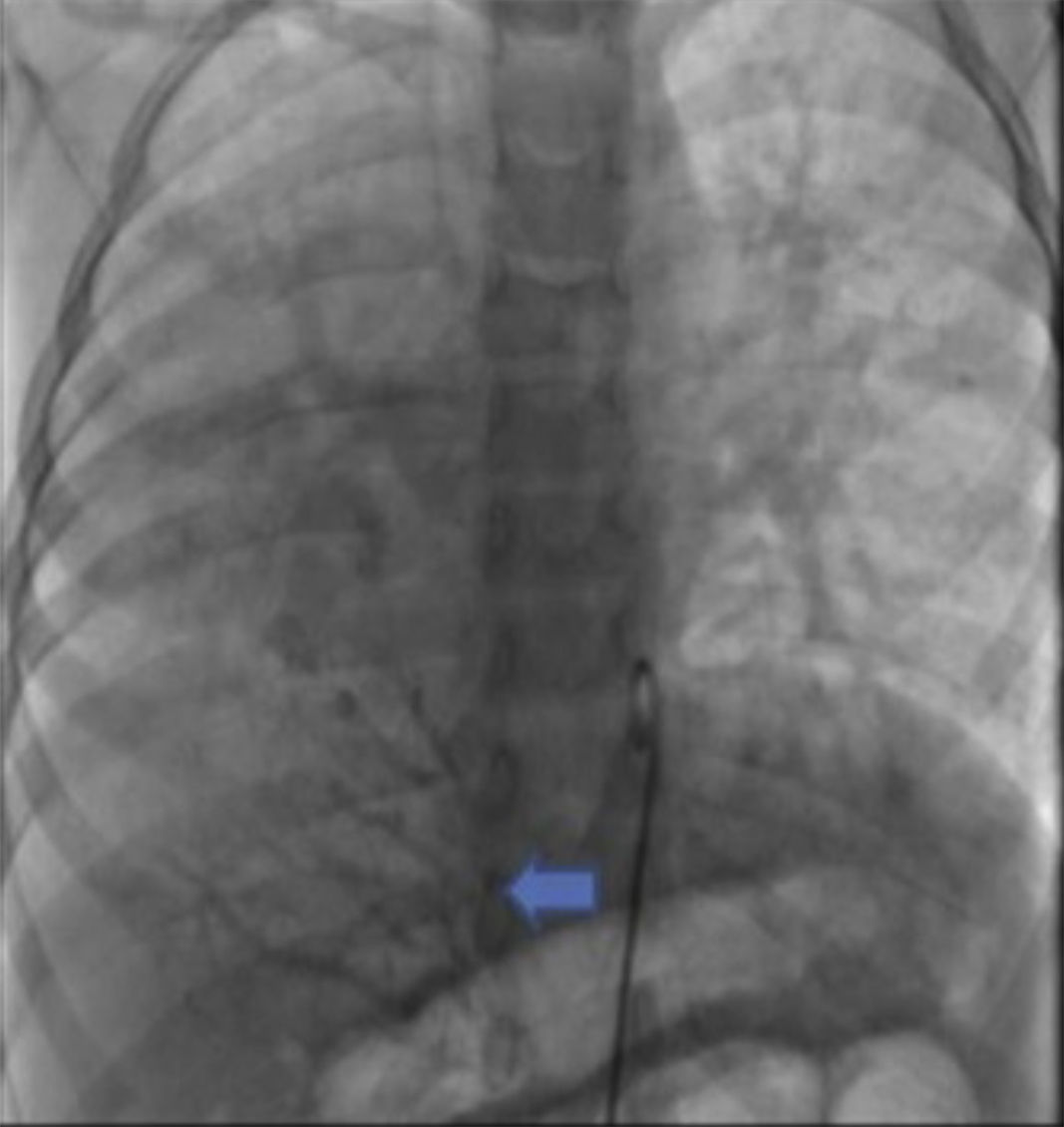
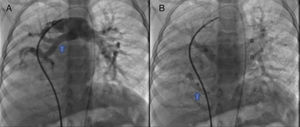
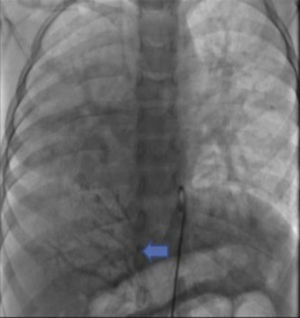
Se obtuvo el consentimiento firmado por los padres de la paciente y se procedió al cateterismo cardiaco según el protocolo establecido en el laboratorio de hemodinámica del HIMFG, que consiste en administración de anestesia general balanceada e intubación orotraqueal. Se tomaron muestras para oximetría y presiones en cada cavidad sondeada, obteniéndose los siguientes datos: presión arterial pulmonar de 38/14 con media de 27 mmHg contra la aórtica de 70/26/45; saturación de 74% en la vena cava superior y de 86% en la vena cava inferior, debido al drenaje de la vena pulmonar derecha (esta saturación se mantuvo hasta la arteria pulmonar). La presión media en los atrios fue de 4 mmHg, al igual que en la vena pulmonar inferior derecha sondeada desde la vena cava inferior; la saturación en las cavidades izquierdas fue estable en 95%. Con estos datos, se obtuvo una resistencia vascular pulmonar de 1.95μW, resistencia vascular sistémica de 12.4μW, gasto pulmonar (QP) de 8.09 l/min, gasto sistémico (QS) de 2.32 l/min (QP/QS=3.4:1), lo cual indica un gran cortocircuito de izquierda a derecha a través del conducto arterioso y resistencia vascular pulmonar baja. Las angiografías mostraron proyección frontal con inyección de contraste en tronco pulmonar; se demostró que las ramas pulmonares son confluentes (fig. 1A) con hipoplasia difusa discreta de la rama derecha (8.1 mm de diámetro con valor Z de -2 vs 14.4 mm de diámetro de la rama izquierda con valor Z de +2). En la fase de levoangio (fig. 1B) se observó que las venas pulmonares izquierdas y la superior derecha drenaban al atrio izquierdo, y la vena pulmonar inferior derecha drenaba directamente a la vena cava inferior con flujo escaso, sin evidencia de obstrucción. La angiografía frontal en la aorta descendente mostró escaso flujo sanguíneo a la base del pulmón derecho (fig. 2), concretamente a los segmentos 4, 5 y 10.
A. Proyección frontal con inyección de contraste en tronco pulmonar; se demuestra que las ramas pulmonares son confluentes, con discreta hipoplasia difusa de la rama derecha (flecha). B. Al levoangio, se observa que las venas pulmonares izquierdas y la superior derecha drenan al atrio izquierdo (*) y la vena pulmonar inferior derecha drena directamente a la vena cava inferior con flujo escaso, sin evidencia de obstrucción (flecha).
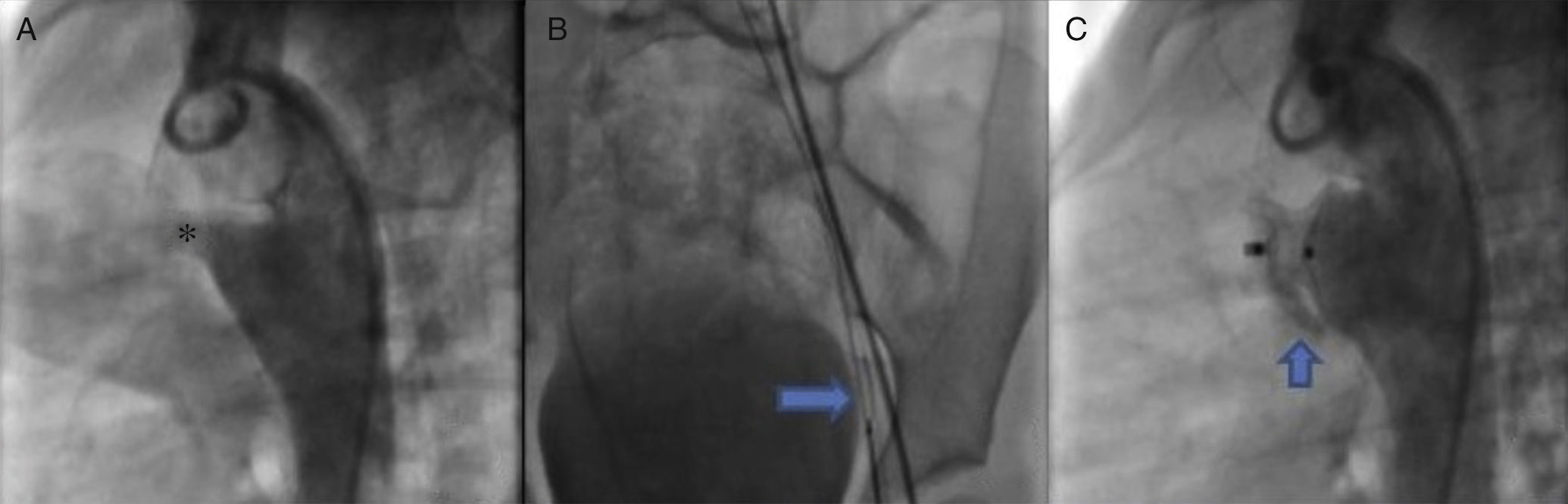
Una vez que se determinó que las lesiones asociadas eran insignificantes, se practicó una angiografía lateral de la aorta descendente, en la que se detectó un conducto arterioso de tipo cónico de 4.6 mm de diámetro en la boca pulmonar, 19.49 mm en la aorta y longitud de 16.04 mm (fig. 3A), por lo que se decidió ocluir con un dispositivo Amplatzer® PDA 12/10.
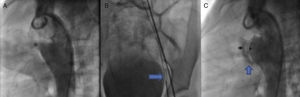
A. A través de la arteria femoral, se introdujo un catéter MPB hasta la ampolla del conducto arterioso. B. A través de este se colocó una guía de recambio 0.025” × 260cm hasta el tronco pulmonar, donde fue lazada con un sistema Amplatz GooseNeck Snare de 10mm y fue exteriorizada por vía venosa, estableciendo el asa arteriovenosa. C. Angiografía para comprobar la correcta posición del conducto.
De acuerdo con el protocolo de cierre de conducto arterioso, se introdujo un catéter MPB de 5Fr hasta el tronco pulmonar; mediante una guía hidrofílica de 0.032” in se intentó el acceso al conducto arterioso; sin embargo, no se logró. Se obtuvieron resultados similares al utilizar catéteres Judkins derecho y multipropósito, por lo que se decidió establecer un asa arteriovenosa. A través de la arteria femoral, se introdujo un catéter MPB hasta la ampolla del conducto arterioso, y a través de este se colocó una guía de recambio de 0.025” × 260 cm hasta el tronco pulmonar, donde fue lazada con un sistema Amplatz GooseNeck Snare de 10 mm y fue exteriorizada por vía venosa, estableciendo así el asa arteriovenosa (fig. 3B). Esta condición proporcionó la estabilidad suficiente para la introducción de una vaina Mullins 8 Fr, logrando la oclusión exitosa del conducto arterioso. Diez minutos después de la liberación del dispositivo, se practicó una angiografía, en la que se comprobó la correcta posición del mismo, además de un cortocircuito residual mínimo (fig. 3C) que desapareció 24 h después de la intervención (comprobado mediante ecocardiografía). La presión pulmonar posterior al cierre del conducto arterioso descendió a 30 mmHg.
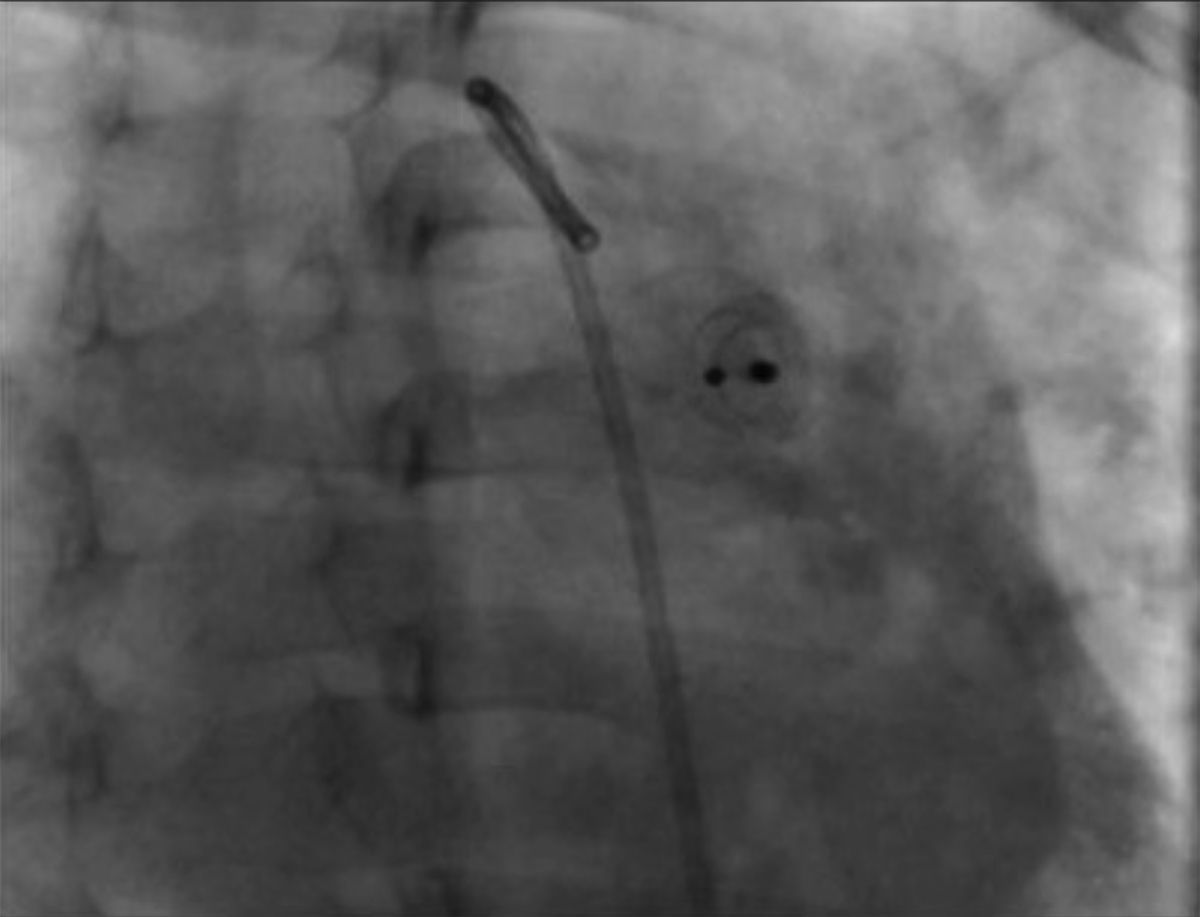
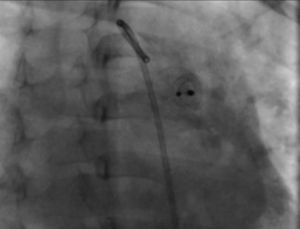
Durante el seguimiento radiográfico y ecocardiográfico efectuado a las 24 h, 1, 3 y 6 meses, el dispositivo se encontró en su posición original y sin cortocircuito residual (fig. 4).
3DiscusiónEl cierre por cateterismo del conducto arterioso ha sido una alternativa a la cirugía desde 1967, cuando Portsmann y colaboradores lograron la oclusión de un conducto arterioso mediante un tapón de polivinil alcohol (ivalon)4. Este hecho marcó el inicio de una serie de investigaciones con diversos instrumentos que actualmente permiten un alto grado de éxito en el tratamiento percutáneo de PCA. En 1998, Masura y colaboradores marcaron el comienzo de la experiencia clínica con el dispositivo Amplatzer®, fabricado con una aleación de níquel y titanio (nitinol), que ha demostrado ser exitoso y versátil en lesiones de moderado y gran tamaño5. Al inicio de esta experiencia, el dispositivo se indicaba para conductos arteriosos pequeños y relativamente largos6; sin embargo, las modificaciones efectuadas a los dispositivos actuales permiten su aplicación en estructuras grandes, cortas, e incluso en aquellos pacientes con hipertensión arterial pulmonar, ampliando sus indicaciones a adultos mayores con conductos calcificados o en pacientes de riesgo para toracotomía.
El repertorio de dispositivos actuales es amplio y permite una selección apropiada de acuerdo con su morfología, particularmente cuando son cónicos. En la actualidad, la indicación quirúrgica ha disminuido paulatinamente, limitándose a pacientes prematuros o muy pequeños severamente sintomáticos, cuando hay dificultad para el empleo de vainas y guías extra rígidas o en conductos de forma tubular o muy cortos, ya que en estas condiciones los dispositivos no tienen una estructura que les brinde soporte o pueden protruir y obstruir la aorta descendente7.
Por otra parte, el cuadro clínico del SC es variado y dependiente de las anomalías que lo conforman. En 1976, Folger reportó diversas anomalías extra cardiacas8, como pulmón en herradura y de tipo anatómicas del bronquio derecho, que incluyen diversos grados de hipoplasia y pueden resultar en una limitante quirúrgica, particularmente en casos con HTP. En el inicio de la década de los 90, Dupuis y colaboradores publicaron dos artículos9,10 en los que diferenciaban las manifestaciones clínicas en los tipos “adulto” e “infantil” de SC en 147 individuos; la principal diferencia reportada fue que en el grupo con SC infantil (25 casos) predominó la HTP secundaria a estenosis de la conexión anómala, al secuestro pulmonar, a la hipoplasia del pulmón derecho o a las anomalías asociadas (principalmente obstrucciones izquierdas) que ensombrecían el pronóstico. En contraste, en 122 casos de SC tipo adulto, los datos clínicos fueron mínimos, con presión pulmonar normal en 94 de ellos, levemente elevada en 28 y buena evolución a largo plazo.
Para tomar una decisión terapéutica en pacientes con SC, deben considerarse algunos aspectos fisiopatológicos:
- a)
El tipo y gravedad de las anomalías asociadas; en este caso, PCA de tamaño moderado, que fue responsable del discreto aumento en la presión arterial pulmonar.
- b)
La cantidad de volumen circulante a través de la conexión anómala a la vena cava inferior; en este caso, el volumen era escaso y no ocasionaba alteraciones hemodinámicas.
- c)
La presencia de obstrucción en la conexión anómala, que se descartó para este caso.
- d)
La magnitud de la circulación vicariante entre la aorta descendente y la base del pulmón derecho; en esta paciente era mínima y no ocasionó datos clínicos como insuficiencia cardiaca, infección o hemoptisis.
- e)
Alteraciones en el bronquio derecho, que en este caso fueron descartadas.
Fue evidente que los síntomas clínicos eran secundarios exclusivamente a la PCA, por lo que se decidió realizar el cierre por cateterismo con un dispositivo Amplatzer. En el caso reportado, la paciente cursaba con hipoplasia del pulmón derecho y dextrocardia extrínseca, por lo que se condicionó una angulación excesiva del conducto arterioso con respecto a la arteria pulmonar y fue imposible canular de manera anterógrada a la aorta ascendente a través del conducto arterioso. Por esta razón, se decidió establecer un asa arteriovenosa que permitiera posicionar una vaina para la colocación de un dispositivo en el conducto arterioso. Los reportes en la literatura de esta técnica11,12 refieren que las principales indicaciones son la tortuosidad y la calcificación del conducto arterioso en pacientes adultos, en los que la manipulación excesiva puede ocasionar la ruptura del conducto arterioso, por lo que al establecer un asa arteriovenosa se minimiza este riesgo; conductos con boca pulmonar muy pequeña que dificulta el paso de una guía a través del conducto de manera anterógrada y angulación excesiva del conducto arterioso, como en el caso que se reporta en este trabajo.
En la experiencia desarrollada en el laboratorio de hemodinámica del HIMFG, este caso es el primero en más de 200 PCA tratados de manera percutánea en el que se cierra un conducto arterioso mediante un asa arteriovenosa. La mayoría de los casos se presentan en pacientes preescolares, escolares y en algunos adolescentes en los que no se ha presentado la calcificación que se describe en el adulto mayor. En los casos con bocas pulmonares minúsculas, se prefiere el empleo de espirales de Gianturco para su oclusión, y hasta la fecha se han obtenido excelentes resultados.
De acuerdo con la experiencia en el HIMFG, se ha notado que al emplear guías hidrofílicas y catéteres multipropósito tipo MPB se facilita el acceso anterógrado al conducto arterioso y aorta descendente para el posterior intercambio por guías extra rígidas y vainas gruesas para el implante definitivo de dispositivos.
En conclusión, se reporta un caso con SC del tipo adulto, cuyo cuadro clínico era debido a la PCA. Durante el seguimiento, 6 meses después, la paciente se encontró asintomática, con oclusión total del conducto arterioso, comunicación interatrial de 6 mm de diámetro con cortocircuito discreto de izquierda a derecha y presión pulmonar de 24 mmHg (determinada mediante ecocardiograma). La paciente se mantiene en vigilancia para determinar la necesidad del cierre de la comunicación interatrial a través de cateterismo.
Para concluir, se sugiere que el plan terapéutico en casos de SC debe ser individualizado, y los procedimientos requeridos deben determinarse con toda precisión, incluyendo desde la corrección de la conexión anómala parcial de venas pulmonares, el cierre de la comunicación interatrial que usualmente se asocia al síndrome, la embolización de la circulación vicariante aorto pulmonar, hasta casos extremos de neumonectomía cuando el SC se asocia con alteraciones bronquiales, o simplemente brindar tratamiento paliativo por HTP.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.