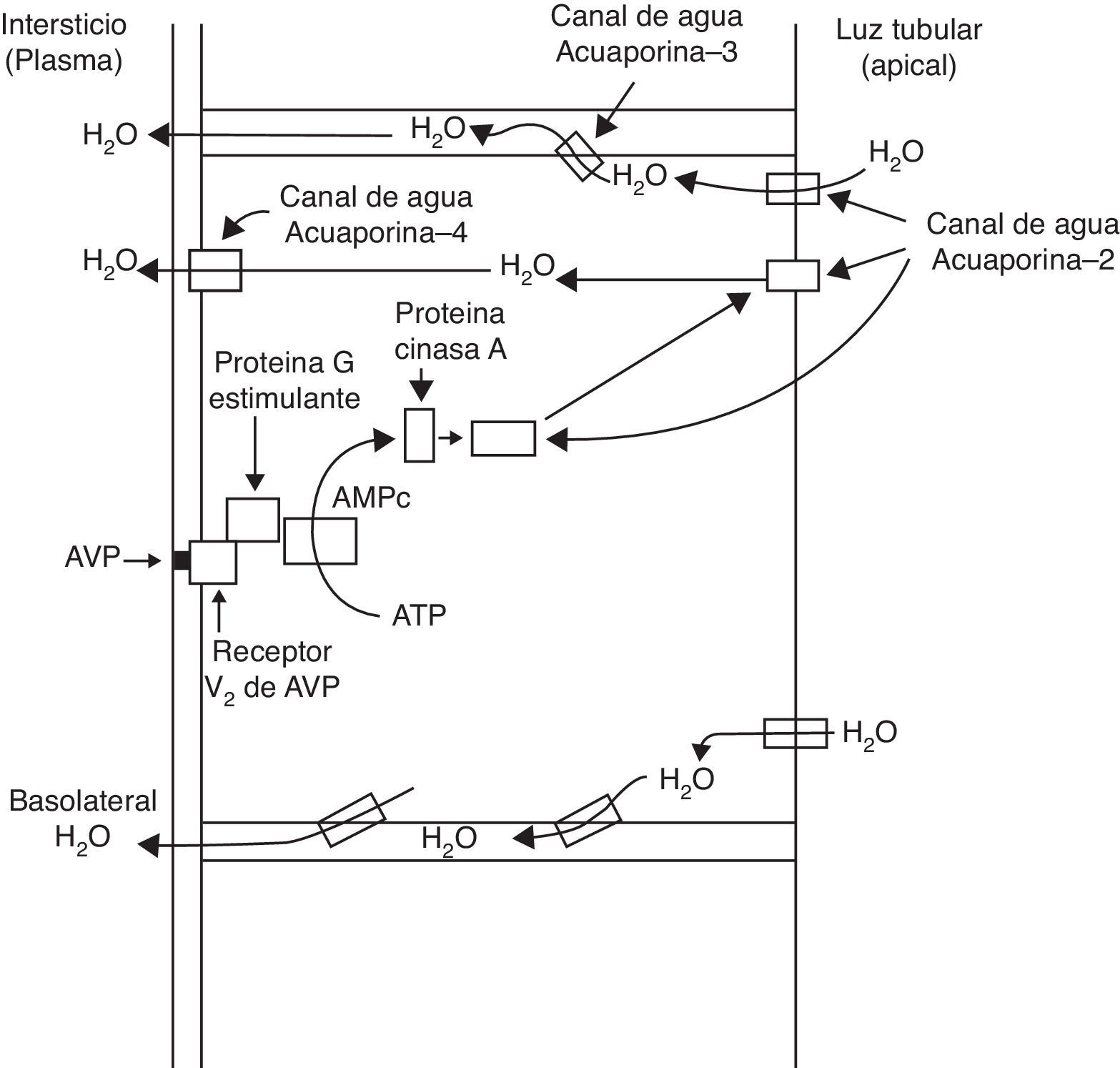
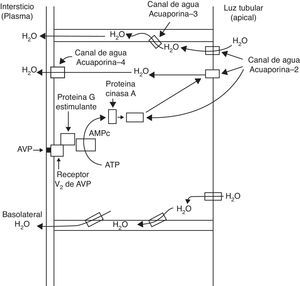
La hormona antidiurética arginina vasopresina (AVP) es liberada de la hipófisis, y regula la reabsorción de agua en las células principales del túbulo colector renal. La unión de la AVP al receptor tipo 2 de la AVP en la membrana basolateral induce la translocación de los canales acuosos de la acuaporina-2 hacia la membrana apical de las células principales de los túbulos colectores, induciendo la permeabilidad al agua de la membrana. Lo anterior da como resultado la reabsorción de agua en el túbulo colector de la nefrona, bajo la influencia de un gradiente osmótico.
La diabetes insípida nefrogénica es causada por la resistencia parcial o total al efecto de la AVP. La diabetes insípida nefrogénica congénita es una alteración asociada con mutaciones en los genes AVPR2 o AQP2, ocasionando la incapacidad del paciente para concentrar la orina. La diabetes insípida nefrogénica adquirida o secundaria puede ser causada por desbalances electrolíticos (hipercalcemia, hipokalemia), enfermedades renales o extrarrenales y fármacos (toxicidad por litio).
En este artículo se revisan las causas, manifestaciones clínicas, diagnóstico y tratamiento de los pacientes con diabetes insípida nefrogénica. También, con base en la comprensión de los mecanismos íntimos de la alteración, se exploran nuevas estrategias terapéuticas.
The anti-diuretic hormone arginine-vasopressin (AVP) is released from the pituitary and regulates water reabsorption in the principal cells of the kidney collecting duct. Binding of AVP to the arginine-vasopressin receptor type-2 in the basolateral membrane leads to translocation of aquaporin-2 water channels to the apical membrane of the principal cells of the collecting duct, inducing water permeability of the membrane. This results in water reabsorption in the collecting duct of the nephron following an osmotic gradient.
Nephrogenic diabetes insipidus is caused by partial or complete renal resistance to the effects of AVP. Congenital nephrogenic diabetes insipidus is a disorder associated with mutations in either the AVPR2 or AQP2 gene, causing the inability of patients to concentrate their urine. Acquired nephrogenic diabetes insipidus can be caused by electrolyte imbalances (e.g., hypercalcemia, hypokalemia), renal/extra-renal diseases and drugs (e.g., lithium toxicity).
This article reviews the causes, clinical manifestations, diagnosis and treatment of patients with nephrogenic diabetes insipidus. Based on more in-depth mechanistic understanding, new therapeutic strategies are current being explored.
La diabetes insípida es una enfermedad que se caracteriza por la eliminación de volúmenes elevados de orina muy diluida. Este trastorno es causado por la insuficiencia de la neurohipófisis para secretar cantidades adecuadas de arginina vasopresina (AVP), llamada también hormona antidiurética (diabetes insípida neurogénica o central), o por incapacidad del riñón para responder a la AVP circulante (diabetes insípida nefrogénica)1.
La AVP ejerce efectos importantes en la excreción de orina y, con ello, en el equilibrio hídrico. Se trata de un péptido compuesto por nueve aminoácidos con una estructura anular y un enlace disulfuro. La AVP se sintetiza por neuronas de gran cuerpo (magnocelulares) situadas en los núcleos supraóptico y paraventricular del hipotálamo; su síntesis se acompaña de la generación de una proteína específica de unión llamada neurofisina ii. La AVP se une a la neurofisina y, como tal, es transportada por los axones del fascículo hipotálamo-hipofisario a razón de 2 o 3mm/h hasta la neurohipófisis, donde los complejos hormonales son almacenados en forma de gránulos en las terminaciones nerviosas hasta su utilización. Cuando se recibe el estímulo adecuado, la hormona se secreta junto con la neurofisina por medio de exocitosis; el proceso de secreción requiere la entrada de calcio a través de la membrana. Una vez ocurrido lo anterior, la membrana del gránulo es reformada por la célula después del recubrimiento y formación de microvesículas1,2.
La acción biológica más importante de la AVP es la conservación del agua corporal mediante la reducción del gasto urinario. Este efecto antidiurético se obtiene promoviendo la reabsorción del agua en el túbulo colector de la nefrona. La AVP induce antidiuresis mediante su interacción con los receptores V2 de la AVP en el riñón; el incremento de la permeabilidad al agua en el túbulo colector de la nefrona implica la acción del canal hídrico acuaporina-2 en las membranas apicales de las células principales de este segmento tubular renal.
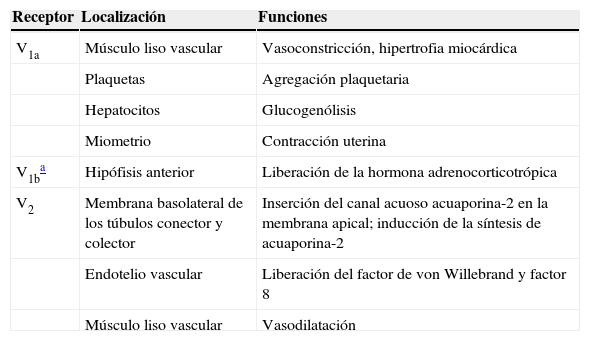
Los receptores de la AVP difieren tanto en su localización como en sus funciones (tabla 1)1. El receptor V1a de la AVP activa la fosfolipasa C e incrementa el calcio citosólico libre. El receptor V2, que se encuentra en el endotelio vascular y en las células principales de los túbulos conectores y colectores de la nefrona, induce la liberación de los factores 8 y de von Willebrand, y media el efecto hidroosmótico de la AVP. La unión de la AVP al receptor V2 activa el sistema de la adenilciclasa Gs e incrementa los niveles intracelulares del 3’,5’-adenosina monofosfato cíclico (AMPc). Este último, a su vez, activa la proteína cinasa A, la cual fosforila el canal acuoso preformado de la acuaporina-2 localizado en las vesículas intracelulares. Esta fosforilación promueve el movimiento de las vesículas hacia la membrana apical de la luz tubular, lo cual conduce a la formación exocítica de las vesículas de acuaporina-2 en la membrana celular2,3.
Localización y funciones de los receptores de arginina vasopresina
| Receptor | Localización | Funciones |
|---|---|---|
| V1a | Músculo liso vascular | Vasoconstricción, hipertrofia miocárdica |
| Plaquetas | Agregación plaquetaria | |
| Hepatocitos | Glucogenólisis | |
| Miometrio | Contracción uterina | |
| V1ba | Hipófisis anterior | Liberación de la hormona adrenocorticotrópica |
| V2 | Membrana basolateral de los túbulos conector y colector | Inserción del canal acuoso acuaporina-2 en la membrana apical; inducción de la síntesis de acuaporina-2 |
| Endotelio vascular | Liberación del factor de von Willebrand y factor 8 | |
| Músculo liso vascular | Vasodilatación |
Fuente: Velásquez1.
Como resultado del proceso descrito, la membrana de la célula tubular renal que mira hacia la luz tubular, normalmente impermeable al agua, se hace permeable. Así, bajo el influjo del gradiente osmótico del sodio, el agua es reabsorbida transcelularmente, ingresa en la célula a través del canal de agua acuaporina-2 y sale de la célula hacia el intersticio a través de la acuaporina-3 y la acuaporina-4, la cual se ubica en la membrana celular basolateral (fig. 1)1. Al concluir el efecto de la AVP, ocurre endocitosis de los canales acuosos, restaurándose la impermeabilidad al agua de la membrana apical o luminal4.
Las acuaporinas son una familia de canales de agua proteicos. La primera acuaporina fue identificada en los eritrocitos en 1991 y fue denominada acuaporina-15. En los últimos 20 años se han descrito al menos 13 acuaporinas en los mamíferos6. Ocho acuaporinas son expresadas en el riñón; cinco de ellas, las acuaporinas 1, 2, 3, 4 y 7, tienen un papel importante en la regulación del balance hídrico corporal. Particularmente la acuaporina-2 es regulada por la AVP7. La AVP presenta una variedad de acciones menos importantes, entre las que se encuentran vasoconstricción arteriolar, hipertrofia miocárdica, inducción de la agregación plaquetaria, glucogenólisis y liberación de la hormona adrenocorticotrópica (tabla 1)3.
2CausasComo se ha mencionado previamente, la diabetes insípida nefrogénica es un síndrome clínico debido a un defecto o resistencia de los túbulos renales para concentrar la orina, al estímulo de concentraciones plasmáticas normales o incluso elevadas de AVP8. Se clasifica en primaria o secundaria. La forma primaria o congénita es hereditaria. La forma secundaria es la que se observa como parte del cuadro clínico de diversas nefropatías (tabla 2).
Causas de diabetes insípida nefrogénica
| Primaria o congénita |
| Recesiva ligada al cromosoma X |
| Autosómica dominante |
| Autosómica recesiva |
| Secundaria o adquirida |
| Nefropatías tubulointersticiales primarias |
| Nefronoptisis juvenil |
| Riñón poliquístico |
| Hidronefrosis |
| Acidosis tubular renal distal |
| Síndrome de Fanconi |
| Hipercalciuria idiopática |
| Amiloidosis renal |
| Nefropatías tubulointersticiales secundarias |
| Nefropatía kaliopénica |
| Hipercalcemia (nefrocalcinosis) |
| Anemia de células falciformes |
| Infección por el virus de la inmunodeficiencia humana |
| Agentes medicamentosos: carbonato de litio, metoxifluorano, anfotericina B, fenacetina, demeclociclina, difenilhidantoína |
Aproximadamente en el 90% de los pacientes con diabetes insípida nefrogénica congénita el modo de herencia es recesivo ligado al cromosoma X9. Estos pacientes presentan mutaciones inactivantes en el gen que codifica el receptor V2 de la AVP (AVPR2); este gen se ha localizado en la región Xq28. Estas mutaciones llevan al atrapamiento intracelular del receptor y a la imposibilidad de alcanzar las membranas celulares en contacto con el plasma. Hasta el momento se han descrito más de 220 diferentes mutaciones del gen que codifica el AVPR210–13. En esta variante, casi todos los pacientes son del sexo masculino. En mujeres que presentan la mutación del AVPR2, la expresión fenotípica del defecto puede estar ausente, parcialmente presente o completa12.
Aproximadamente el 10% de los pacientes muestra herencia autosómica recesiva. En estos casos, se han observado mutaciones del gen que codifica la acción de la acuaporina-2 (AQP2), lo cual condiciona la falta de respuesta de las células principales de los túbulos colectores de la nefrona a la acción de la AVP12,14.
Finalmente, se han estudiado miembros de algunas familias con la variante autosómica dominante de la diabetes insípida congénita, en quienes también se han identificado mutaciones del gen de la acuaporina-215. Se presenta en menos de 1% de los pacientes con diabetes insípida nefrogénica congénita. Estos pacientes muestran característicamente una forma clínica menos grave de la diabetes insípida12.
2.2Diabetes insípida nefrogénica secundariaEn los pacientes con nefropatías tubulointersticiales primarias se observan frecuentemente alteraciones anatómicas en la médula renal que modifican el gradiente osmolar dependiente de la acción de los mecanismos de multiplicación de contracorriente, y condicionan el desarrollo de poliuria1.
De esta manera, se han descrito cuadros de diabetes insípida nefrogénica en pacientes con nefronoptisis juvenil (antes del desarrollo de la insuficiencia renal crónica), en pacientes con enfermedad renal poliquística, acidosis tubular renal distal, síndrome de Fanconi, hipercalciuria idiopática y amiloidosis renal1,16–18.
Ocasionalmente, algunos pacientes urópatas presentan poliuria hipostenúrica no dependiente de carga de solutos durante periodos prolongados, después de la corrección quirúrgica de la obstrucción urinaria; con frecuencia, en estos pacientes se observa displasia renal e insuficiencia renal crónica1. En los pacientes con obstrucción del tracto urinario se ha demostrado la disminución de la expresión de las acuaporinas-1 a 4 y de la función de los principales transportadores de sodio a nivel tubular renal (Na-K-ATPasa, NKCC1, NCC)12.
Entre los diversos grupos de pacientes con diabetes insípida nefrogénica por una tubulopatía intersticial secundaria, uno de los más importantes es el formado por individuos con nefropatía kaliopénica, que se presenta en niños con desnutrición grave. Se ha podido demostrar que en más del 75% de los niños desnutridos con kaliopenia no hubo una respuesta oligúrica adecuada durante estados de deshidratación aguda1. El estudio histológico renal muestra lesiones caracterizadas por degeneración vacuolar de las células epiteliales del túbulo contorneado proximal. En estos pacientes existe una reducción en la concentración de sodio y solutos totales en el intersticio de la médula renal. También se ha demostrado la reducción de la expresión de la acuaporina-2 y de la función de los transportadores de sodio en el túbulo renal: NKCC2, NCC, canales epiteliales de sodio. Una alteración del funcionamiento tubular renal semejante se ha observado en los pacientes con hipercalcemia que desarrollan el cuadro de diabetes insípida nefrogénica12. En pediatría se han descrito los cuadros de hipercalcemia asociados a diabetes insípida nefrogénica en pacientes con intoxicación por vitamina D19. El defecto en la capacidad de concentración urinaria habitualmente persiste hasta la corrección del problema metabólico de fondo.
Durante un episodio de crisis en los pacientes con anemia de células falciformes puede ocurrir incremento de la viscosidad sanguínea en los vasa recta de la médula renal, alterando los mecanismos multiplicador o intercambiador de contracorriente, disminuyendo la hipertonicidad de la médula renal y ocasionando poliuria con resistencia a la hormona antidiurética1. Asimismo, se ha observado el desarrollo de diabetes insípida nefrogénica hasta en el 12% de los pacientes con infección por el virus de la inmunodeficiencia humana que desarrollan nefropatía tubulointersticial20.
Diversos agentes medicamentosos afectan la capacidad renal para concentrar la orina e inducen grados variables de poliuria. La alteración inducida por estas sustancias se produce por inhibición de la actividad de la adenilciclasa y del AMP cíclico en el túbulo colector, y es habitualmente reversible al suspender la administración del medicamento.
Sin embargo, en los pacientes que reciben tratamiento prolongado con sales de litio (por ejemplo para el tratamiento de desórdenes bipolares) se han observado alteraciones en la regulación de la acuaporina-2, el canal epitelial de sodio y los transportadores de urea (UT-A1 y UT-B), con lesión y pérdida de las células principales del túbulo colector de la nefrona, lo cual puede producir una lesión irreversible del mecanismo de concentración urinaria21,22. Por otro lado, en los pacientes que reciben tratamientos cortos con sales de litio se puede observar recuperación completa de la alteración tubular renal23.
3Manifestaciones clínicasLos recién nacidos con diabetes insípida congénita habitualmente presentan peso normal al nacimiento, aunque algunos embarazos son complicados, en ocasiones, con polihidramnios. El defecto de concentración de la orina está presente desde el nacimiento, por lo que las manifestaciones clínicas pueden observarse desde las primeras semanas de vida. Los lactantes alimentados con leche materna pueden no presentar tempranamente episodios de deshidratación, debido a que la leche materna tiene bajo contenido de sal y proteínas y, por consiguiente, tiene una baja carga osmolar. Con el inicio de la administración de fórmulas con leche de vaca aumenta la carga osmolar al riñón y crece la demanda de agua libre, la cual no puede ser suplida por la ingesta, por lo que se inician los episodios de deshidratación hipernatrémica12.
Característicamente, se presentan poliuria y polidipsia como síntomas predominantes, los cuales, como se ha mencionado, pueden comenzar en edades muy tempranas; incluso, desde la etapa de recién nacido en las formas hereditarias.
Se define la poliuria como la emisión de volúmenes urinarios superiores a 3ml/kg/h o 90-100ml/m2/h. Lo anterior representa volúmenes de orina mayores de 2,500ml/m2/24h o de 50ml/kg/24h1.
En las formas de presentación precoces, el lactante presenta llanto persistente e irritabilidad, que cede con la ingestión de agua o leche diluida. Se observan, asimismo, vómitos, estreñimiento y falla para progresar en peso y talla debido a la menor ingestión de nutrientes por la polidipsia9. Durante la evolución del padecimiento se pueden presentar episodios repetidos de deshidratación grave, comúnmente de tipo hipernatrémico, acompañados de pérdida de peso, fiebre, crisis convulsivas e, incluso, estado de coma. Otras manifestaciones incluyen el estreñimiento, la nicturia y la enuresis nocturna en niños mayores. El retraso mental, cuando se presenta, es consecuencia de los episodios repetidos de deshidratación hipernatrémica y los tratamientos de rehidratación muy enérgicos que pueden condicionar el desarrollo de edema cerebral24. Además se ha descrito la presencia de calcificaciones intracraneales, más frecuente en niños que ya presentan retardo mental, probablemente a consecuencia de episodios de hemorragia y necrosis12.
En niños mayores, la sed intensa se asocia con la poliuria con volúmenes de varios litros y que en ocasiones se manifiesta por enuresis; el crecimiento se detiene y ocurre anorexia, con predilección para la ingesta de agua pura y fría. Lo anterior condiciona el adelgazamiento progresivo. Los pacientes presentan apatía y fácil irritabilidad, y su desempeño en la escuela es deficiente1.
La poliuria persistente puede dar como resultado el desarrollo de megavejiga, hidrouréter e hidronefrosis1,24. En algunos niños se ha observado que el alto flujo urinario induce el desarrollo de una vejiga trabeculada en ausencia de obstrucción infravesical; los estudios de urodinamia muestran una vejiga distendida con vaciamiento lento e incompleto, que agrava el deterioro de la función renal, por lo que se han requerido procedimientos como la cistostomía para asegurar el vaciamiento vesical25. Por otro lado, se ha informado de casos de pacientes con diabetes insípida nefrogénica que además presentan obstrucción del tracto urinario inferior (valvas uretrales inferiores). Estos casos permiten enfatizar que los estudios de los pacientes con diabetes insípida nefrogénica e hidronefrosis deben también descartar causas obstructivas urinarias agregadas26,27.
4DiagnósticoGeneralmente la osmolaridad urinaria varía entre 50 y 200mOsm/kg H2O y la densidad urinaria entre 1.001 y 1.005. Se ha mencionado que los volúmenes urinarios son habitualmente superiores a 2,500ml/m2/24h de una orina transparente e incolora.
En sangre puede observarse el incremento de las concentraciones séricas de sodio, cloro y urea, debido al balance negativo de agua, y una tendencia a la hiperosmolaridad sérica.
Bajo estas condiciones, es conveniente realizar una prueba de concentración urinaria, que consiste en estimular la máxima capacidad de concentración renal en respuesta a la restricción hídrica. Esta prueba es de suma utilidad para establecer el diagnóstico de diabetes insípida de cualquier etiología y diferenciarlo de la polidipsia compulsiva o potomanía. En esta última, el paciente, generalmente por trastornos de tipo psicógeno, ingiere grandes cantidades de agua y otros líquidos, lo que promueve una poliuria compensadora, y se observa un cuadro clínico semejante al de la diabetes insípida pero sin afectarse completamente el poder de concentración renal. Este cuadro ha sido descrito incluso en lactantes1.
En niños pequeños con poliuria significativa y posible diagnóstico de diabetes insípida neurogénica o nefrogénica primaria deberá realizarse la prueba de privación hídrica, bajo vigilancia estricta, para evitar un cuadro de deshidratación grave.
El procedimiento de la prueba se describe a continuación1,16.
- a)
Se inicia la prueba a partir de las 8 a.m., con vigilancia estricta del peso después de cada micción y de los signos clínicos de deshidratación. Debe controlarse el peso y el volumen urinario cada hora; si la poliuria es importante, el control de peso deberá realizarse cada 30min16. Para las muestras de orina obtenidas deberán determinarse la osmolaridad y la densidad. Cuando el paciente ha perdido el 3% de su peso inicial, se debe colectar muestra para osmolaridad sérica y urinaria, así como para densidad de la orina.
- b)
En condiciones normales se debe observar incremento en la osmolaridad urinaria con niveles superiores a 800mOsm/kg H2O o densidades de 1.020 o superiores en niños y adolescentes. En lactantes se debe observar osmolaridad superior a 500mOsm/kg H2O o densidad mayor de 1.01528.
- c)
Cuando la prueba de concentración ha revelado un defecto de la capacidad de concentración renal, se deberá efectuar la prueba de respuesta a la AVP. Mediante esta prueba se podrá diferenciar una diabetes insípida neurogénica de una nefrogénica. La prueba de AVP consiste en la administración de vasopresina acuosa por vía subcutánea11 en dosis de 10μU/kg o 1U/m2, o bien, de 1-desamino-8-D-arginina vasopresina, la hormona antidiurética biosintética, por vía intranasal, en dosis de 10μg en preescolares y de 20μg en escolares, seguida de la colección de orina cada hora durante 2h. En estas muestras de orina se determinará la osmolaridad y densidad, y el volumen emitido.
- d)
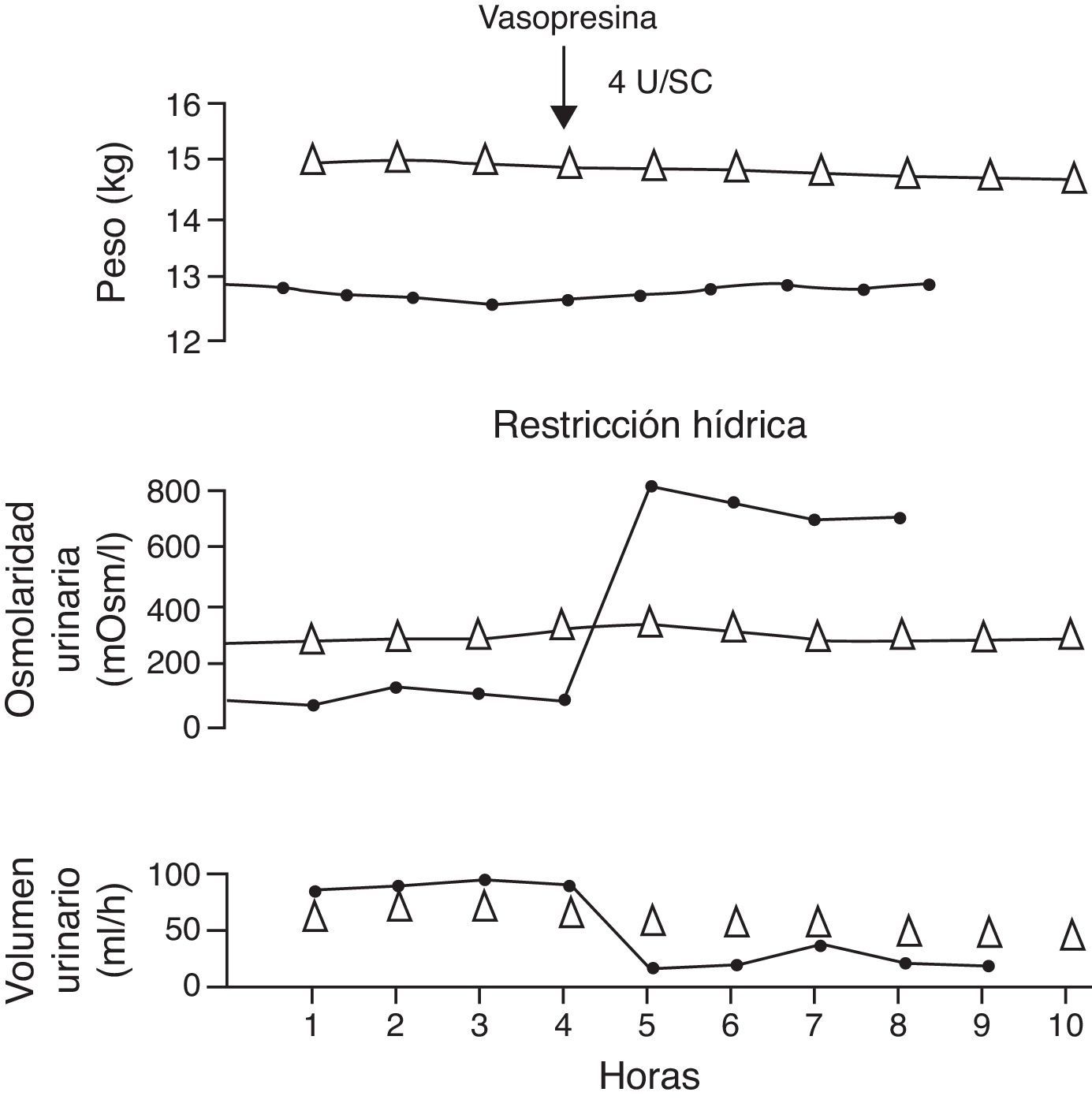
La reducción del volumen y el aumento de la osmolaridad y densidad urinarias después de la administración de vasopresina son indicativas de la capacidad renal de concentración y permiten realizar el diagnóstico de diabetes insípida central o neurogénica (la respuesta normal lleva la osmolaridad urinaria a más de 800mOsm/kg H2O o más de 50% de la osmolaridad basal16 con densidad mayor de 1.020). A manera de ejemplo, si la prueba de deshidratación llevó a la producción de orina con osmolaridad de 200mOsm/kg H2O, y con la aplicación de la AVP esta se eleva a más de 800mOsm/kg H2O o más del 50% de la osmolaridad basal, se establece el diagnóstico de diabetes insípida neurogénica o central.
- e)
Por el contrario, la persistencia de la falta de respuesta corresponde a los casos de diabetes insípida nefrogénica (fig. 2)1,29. En estos pacientes puede ocurrir un ligero aumento de la osmolaridad urinaria, pero este incremento habitualmente es menor de 150mOsm/kg H2O o menor del 20% de los valores basales1,16. La osmolaridad urinaria, por lo común, permanece por debajo de 200mOsm/kg H2O. En los pacientes con diabetes insípida nefrogénica secundaria, la osmolaridad urinaria obtenida después de la administración de la AVP habitualmente es mayor que la observada en niños con diabetes insípida nefrogénica congénita12.
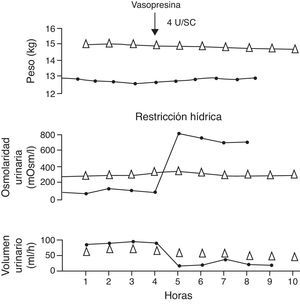
Figura 2.Prueba de concentración urinaria en dos niños con diabetes insípida. El paciente con diabetes insípida neurogénica (línea continua con círculos negros) presentó reducción del volumen con incremento de la osmolaridad urinaria después de la administración de vasopresina. En cambio, en el paciente con diabetes insípida nefrogénica (línea con triángulos) no se observó ninguna respuesta.
Fuente: Dorantes29. Reproducida con autorización.
(0.1MB).
Se ha demostrado una correlación directa entre los niveles plasmáticos de AVP determinados por radioinmunoanálisis y la osmolaridad plasmática después de una prueba de concentración en sujetos normales. También se han demostrado niveles inadecuadamente bajos para la osmolaridad plasmática en pacientes con diabetes insípida neurogénica y niveles elevados de vasopresina en aquellos con diabetes insípida nefrogénica1,29.
5TratamientoNo existe un tratamiento específico cuando se trata de una alteración primaria. Por lo tanto, la ingesta de líquido es fundamental para impedir el efecto deletéreo de los episodios repetidos de deshidratación. Debido al riesgo del desarrollo de vejigas urinarias muy distendidas por la poliuria, debe indicarse el vaciamiento de la vejiga con regularidad para asegurar que la máxima capacidad vesical se mantenga dentro del rango normal.
Los lactantes, con frecuencia, no pueden beber la cantidad suficiente de líquidos para compensar las pérdidas urinarias. En estos casos, es útil reducir el aporte de sodio en la dieta (1mEq/kg/día) con el objeto de disminuir la carga de solutos. No es recomendable reducir el aporte proteico pues se puede propiciar desnutrición1.
Los diuréticos, como la hidroclorotiacida (1 a 2 y hasta 4mg/kg/día), fueron la primera clase de medicamentos efectivos en reducir el volumen urinario. Cuando se combina con la reducción en la ingestión de sal, la hidroclorotiacida puede reducir el volumen urinario del 20% al 50% de los valores basales. Sin embargo, la hipokalemia producida por la hidroclorotiacida puede comprometer la capacidad de concentración urinaria de los pacientes con diabetes insípida nefrogénica. Por ello, en ocasiones, es necesario administrar un suplemento de potasio1,29.
En el momento actual existe suficiente evidencia para indicar el tratamiento continuado de hidroclorotiacida y amilorida (0.3mg/kg/día), un diurético ahorrador de potasio o un inhibidor de la síntesis de prostaglandinas, como la indometacina (2mg/kg/24h). Debido a la elevada frecuencia con la que la indometacina produce efectos colaterales, como complicaciones gastrointestinales (anorexia, náuseas, vómitos, dolor abdominal, ulceraciones y perforación intestinal, hemorragia), alteraciones hematológicas (neutropenia, trombocitopenia, anemia) y disfunción renal, se ha sugerido la primera combinación como el tratamiento de elección en estos pacientes, particularmente en niños de 4-6 años. Los niños menores no toleran bien la amilorida debido a sensación nauseosa persistente, por lo que es probable que requieran la combinación con indometacina en los primeros años de vida1,12,29.
Se ha propuesto que el efecto aparentemente paradójico de la hidroclorotiacida ocurre debido a que, en ausencia de AVP, la hidroclorotiacida luminal aumenta la permeabilidad osmótica y dilucional del agua en los conductos colectores de la nefrona que atraviesan la médula renal interna, a través de la estimulación no dependiente de AVP de la acuaporina-210,30. Además, se ha propuesto que el estado de hipovolemia inducido por el efecto diurético de las tiacidas, por inhibición del cotransportador sodio-cloro en los túbulos renales, estimula el sistema renina-angiotensina ii-aldosterona, lo cual induce mayor reabsorción de sodio y agua (vía acuaporina-1) en los túbulos proximales de la nefrona. Cuando se administran prostaglandinas, disminuye el efecto de las tiacidas. Lo anterior puede explicar por qué la indometacina potencia el efecto de las tiacidas en los pacientes con diabetes insípida nefrogénica1,30.
Recientemente se han realizado estudios para el tratamiento de la diabetes insípida nefrogénica congénita a través de la estimulación farmacológica, promoviendo el transporte del AVPR2 retenido en el citoplasma de la célula tubular renal a la membrana plasmática, donde podría desarrollar su función. Otros estudios están dirigidos a lograr la estimulación directa del AVPR2 retenido, o estimular directamente la función de la acuaporina-2 sin necesidad de la participación del AVPR212,21,31–36.
Por otro lado, se han publicado diversos estudios en los que se ha investigado el efecto de la prostaglandina E2 o de agonistas relacionados (como los receptores prostanoides EP2 y EP4) en animales de experimentación. Estos inducen, paradójicamente, el incremento en la actividad del AMPc, en forma independiente de la acción de la AVP, con la fosforilación de la acuaporina-2 y su inserción en la membrana tubular de la nefrona2,34. Lo anterior podría proveer una nueva modalidad terapéutica en pacientes con diabetes insípida nefrogénica ligada al cromosoma X.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.