La infección del tracto urinario en los niños es reconocida como una causa de morbilidad y de condiciones médicas crónicas, por lo que resulta indispensable conocer con claridad la patogénesis de esta enfermedad. Sin embargo, la resistencia creciente complica su tratamiento ya que aumenta la morbilidad, los costos, la estancia hospitalaria y el uso de fármacos de mayor espectro antimicrobiano. El propósito de este estudio fue determinar la susceptibilidad antimicrobiana de los uropatógenos aislados en niños.
MétodosSe incluyeron en el estudio 457 niños que asistieron a la consulta externa y a urgencias del Hospital Infantil de México Federico Gómez, con síntomas de infección del tracto urinario baja no complicada. La orina fue tomada a la mitad del chorro o por cateterismo, y se realizó la identificación y la susceptibilidad antimicrobiana.
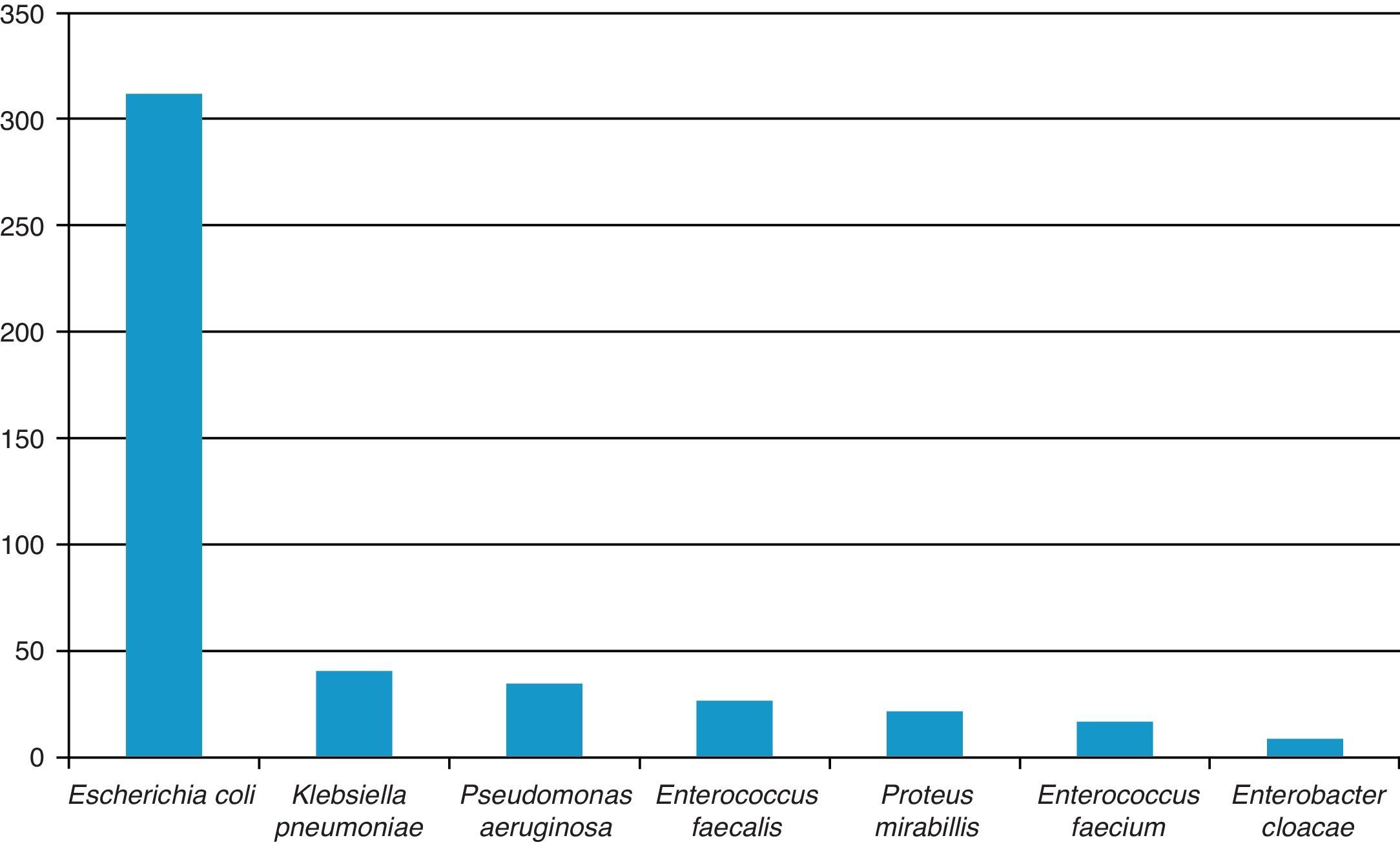
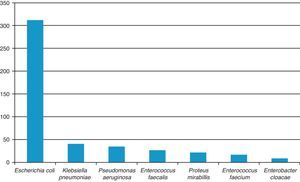
ResultadosLos patógenos aislados con mayor frecuencia fueron: Escherichia coli (E. coli) (312, 68.3%), Enterococcus spp. (42, 11%), Klebsiella pneumoniae (K. pneumoniae) (40, 8.7%), Pseudomonas aeruginosa (P. aeruginosa) (34, 7.5%), Proteus mirabilis (P. mirabilis) (21, 4.5%), Enterobacter cloacae (8, 1.7%). La resistencia para trimetoprima/sulfametoxazol fue del 73.7, 62.2, 100, 52, 50%,respectivamente, para E. coli, K. pneumoniae, P. aeruginosa, P. mirabilis y Enterobacter spp., del 92.5% para Enterococcus faecalis (E. faecalis) y del 49.9% para Enterococcus faecium (E. faecium). Para ampicilina fue del 86.3, 45, 100, 47.9 y 66.6% para las mismas bacterias, respectivamente. Para ciprofloxacina del 33.8, 9, 18.8, 0 y 0%; para nitrofurantoína del 4.4, 13, 97.7, 70, 0% para enterobacterias, del 0% para E. faecalis y del 16.7% para E. faecium.
ConclusionesLos antimicrobianos frecuentemente prescritos para el tratamiento empírico de la infección del tracto urinario no complicada demuestran resistencia importante o baja susceptibilidad cuando se les probó frente a las cepas aisladas.
Urinary tract infection in children is well recognized as a cause of acute morbidity and chronic medical conditions. As a result, appropriate use of antimicrobial agents, however, increases antibiotic resistance and complicates its treatment due to increased patient morbidity, costs, rates of hospitalization, and use of broader-spectrum antibiotics. The goal of this study was to determine antibiotic susceptibility to commonly used agents for urinary tract infection against recent urinary isolates.
MethodsA total of 457 consecutive children attending the emergency room at the Hospital Infantil de México Federico Gómez with symptoms of uncomplicated lower urinary tract infection were eligible for inclusion. Patients who had had symptoms for≥7 days and those who had had previous episodes of urinary tract infection, received antibiotics or other complicated factors were excluded. Midstream and catheter urine specimens were collected. All isolates were identified and the in vitro activities of antimicrobials were determined.
ResultsThe most frequently isolated urinary pathogens were as follows: Escherichia coli (E. coli) (312, 68.3%), Enterococcus spp. (42, 11%), Klebsiella pneumoniae (K. pneumoniae) (40, 8.7%), Pseudomonas aeruginosa (P. aeruginosa) (34, 7.5%), Proteus mirabilis (P. mirabilis) (21, 4.5%), Enterobacter cloacae (8, 1.7%). The resistance to trimetoprim/sulfametoxazol (%) was 73.7, 62.2, 100, 52, and 50, respectively, for E. coli, K. pneumoniae, P. aeruginosa, P. mirabilis and Enterobacter spp., 92.5 for Enterococcus faecalis (E. faecalis) and 49.9 for Enterococcus faecium (E. faecium). Ampicillin was 86.3, 45, 100, 47.9, and 66.6% for the same strains, ciprofloxacin 33.8, 9, 18.8, 0, 0%, nitrofurantoin 4.4, 13, 97.7, 70, 0%; to E. faecalis 0% and 16.7% to E. faecium.
ConclusionsFrequently prescribed empirical agents for uncomplicated urinary tract infection demonstrate lowered in vitro susceptibilities when tested against recent clinical isolates.
La frecuencia de la infección del tracto urinario (ITU) puede variar según la edad y el sexo del paciente. La infección sintomática ocurre en uno por cada 1,000 recién nacidos y menores de un mes de edad, siendo más común en los varones (relación 2.7:0.7) hasta el primer año de vida. Generalmente, el riesgo de ITU durante la primera década de la vida es del 1% para varones y del 3% para las mujeres. Sin embargo, en la segunda década de la vida predomina en las niñas, con una relación de 4:11–3.
La infección aguda no complicada del tracto urinario es una de las infecciones bacterianas más frecuentes, la cual es responsable de una morbilidad importante, así como de costos de atención elevados. Aunque a menudo puede ser autolimitada y tratada con facilidad con antimicrobianos, con frecuencia no se resuelve completamente y puede ser causa de recurrencias, a pesar del uso de antibióticos.
Los pacientes con cistitis/uretritis presentan síntomas urinarios bajos (urgencia, disuria y frecuencia), causados por la inflamación del epitelio de la mucosa donde se adhieren los uropatógenos. La infección urinaria alta es la consecuencia de la presencia de un patógeno en el riñón o en el uréter, que se ha extendido desde la vejiga o la uretra. Los pacientes con pielonefritis presentan síntomas urinarios altos, acompañados de otros datos sistémicos (fiebre elevada, dolor abdominal en el flanco, pesadez pélvica), ocasionados por la inflamación del parénquima renal3–7.
Los niños con infección urinaria habitualmente se presentan sin los signos y síntomas considerados como los clásicos presentes en los adultos. Asimismo, en función de la edad, hay variaciones: niños<3 meses de edad a menudo se presentan con síntomas inespecíficos que incluyen fiebre, rechazo a la alimentación, náuseas con o sin vómito, irritabilidad, letargia, orina de mal olor e ictericia. Los niños de entre 3 meses y 2 años de edad tienen síntomas más específicos como orina turbia, de mal olor, frecuencia aumentada de micciones, hematuria con signos no específicos, fiebre, vómito, anorexia y dificultad para ganar peso. Los niños de entre 2 a 5 años se presentan con dolor abdominal y fiebre. Los niños mayores de 5 años, en su mayoría, se presentan con disuria, aumento en la frecuencia de las micciones y urgencia. Aproximadamente del 7-8% de las niñas y el 2% de los niños tienen una infección del tracto urinario durante los primeros 8 años de vida2,3,8–10.
Un componente de apoyo al diagnóstico lo representa el examen de la orina: la presencia de reacciones positivas para documentar nitritos, y la observación en fresco de células inflamatorias (leucocitos) y bacterias3,7.
El aislamiento del patógeno es esencial para el diagnóstico definitivo. Por lo tanto, es importante considerar los siguientes puntos: 1) la toma de la orina debe ser previa a la administración de antimicrobianos;2) la colección de una muestra apropiada para cultivo puede obtenerse por medio del chorro medio, por paso de sonda uretral o por punción suprapúbica; y 3)la cateterización uretral, procedimiento invasivo que se indica solamente en niños muy pequeños.
Se acepta como positivo un cultivo con ≥50,000UFC de una sola especie bacteriana. Usualmente, el resultado del cultivo no se tiene antes de 24h. Por este motivo, la administración de antimicrobianos es de manera empírica. El tratamiento temprano tiene como propósito erradicar el patógeno, prevenir la urosepsis y reducir el daño renal9–11.
Escherichia coli (E. coli) continúa siendo el agente etiológico más frecuente de la ITU y hacia esta se dirige el tratamiento empírico inicial; sin embargo, en los últimos años, se ha demostrado su resistencia gradual hacia los fármacos considerados como habituales de primera línea de selección para prescribir el régimen terapéutico; esta situación también es frecuente para otros uropatógenos11–18.
En México se reportó en 2010,a través del Sistema Nacional de Vigilancia Epidemiológica, que las infecciones de vías urinarias ocuparon el tercer lugar dentro de las principales causas de morbilidad19. Estos informes no han especificado la susceptibilidad antimicrobiana en niños.
Por lo anterior, el propósito de este trabajo fue determinar la susceptibilidad a los fármacos antimicrobianos comúnmente utilizados para el tratamiento de la infección urinaria aguda no complicada frente a uropatógenos aislados en una población infantil que asistió al servicio de Urgencias del Hospital Infantil de México Federico Gómez del 2008 al 2012.
2MétodosSe diseñó una cédula para recolectar los datos demográficos de cada unidad experimental: edad, sexo, antecedentes urinarios previos, antecedentes de tratamientos antimicrobianos recientes, presencia de patología de base coincidente con el padecimiento actual; así como toma de una muestra de orina con resultado e interpretación de leucocito esterasa, nitritos, células y bacterias.
El estudio se llevó a cabo en las muestras de orina de niños hospitalizados en el servicio de Urgencias del Hospital Infantil de México Federico Gómez. Los padres o responsables fueron informados de los riesgos y beneficios, y firmaron de forma voluntaria el consentimiento de los diversos procedimientos a realizar.
2.1Criterios de inclusión o eliminaciónEl criterio de inclusión fue la disponibilidad de la información general de cada paciente. No se aceptaron niños con patología urinaria de base y antecedentes de cuadros repetidos de ITU, así como aquellos con sondas de drenaje. Tampoco se incluyeron niños con antecedentes de infección de vías urinarias≥7días de evolución, niños con antecedentes de tratamientos recientes (7 a 14 días previos) o actuales de antimicrobianos. Para la definición de caso se debió considerar que la infección urinaria fue adquirida en la comunidad.
2.2Toma de la muestra de orinaLa colección de orina a la mitad del chorro se realizó en niños que pudieron, por su edad, cooperar en la toma. En niños menores de 2 años de edad, la obtención fue por medio de sonda transuretral, previa asepsia de la zona perineo-genital. Para minimizar la contaminación de arrastre hacia el interior, se eliminó una parte del chorro inicial.
2.3Interpretación del cultivoLa presencia de un uropatógeno se consideró de interés clínico cuando se obtuvo un crecimiento≥50,000UFC de una sola especie y, ocasionalmente, dos bacterias con cuantía semejante14. Únicamente se consideró una toma positiva en cada paciente.
2.4Identificación microbiológicaSe estudiaron las muestras de orina de pacientes pediátricos con datos clínicos de infección de vías urinarias. Una vez obtenida la muestra de orina, se utilizó el método de dilución (1:100). De esta dilución, se tomaron 100μl para inocular una placa de agar-cistina libre de electrolitos dextrosa con ayuda de un ángulo de vidrio estéril, extendiendo la muestra uniformemente en toda la superficie del medio de cultivo. Se mantuvo la caja hacia arriba durante 5min para que se absorbiera el inóculo. Rotada la caja, se incubó a 35±1°C durante 24-48h bajo condiciones de aerobiosis. Se realizó la identificación de las colonias según la morfología y la identificación por el sistema Vitek 2XL (BioMérieux).
2.5Susceptibilidad antimicrobianaLas pruebas de susceptibilidad a los antibióticos se determinaron de acuerdo con los lineamientos del Clinical and Laboratory Standards Institute20,21, utilizando el sistema automatizado Vitek 2XL (BioMérieux) y el método de Kirby-Bauer como método alternativo para verificar la resistencia de Enteroccocus faecium (E. faecium) a vancomicina.
Las cepas de control de calidad utilizadas fueron las siguientes: para E. coli, ATCC25922 y 35218; para Staphylococcus aureus, ATCC29213; para Enterococcus faecalis (E. faecalis), ATCC29212 y 51299; para Pseudomonas aeruginosa (P. aeruginosa), ATCC27853; y para Klebsiella pneumoniae (K. pneumoniae), ATCC700603.
Las cepas de K. pneumoniae, E. coli y Proteus mirabilis (P. mirabilis), con concentración mínima inhibitoria≥2μg/ml para ceftazidima y/o ceftriaxona y/o aztreonam, fueron catalogadas como bacterias con resistencia por β-lactamasas de espectro extendido (BLEE) (Clinical and Laboratory Standards Institute 2012)20,21.
3ResultadosSe estudiaron 457 pacientes, de los cuales 217 (47.48%) fueron niñas y 240 (52.52%) niños. La distribución por edad fue la siguiente: 91<6 meses (20%);137 tenían entre 7 y 12 meses de edad (30%);114 de uno a 5 años (25%);y 115 mayores de 5 años (25%).
El patógeno aislado con más frecuencia fue E. coli (312 pacientes, 68.3%); en segundo lugar se consideraron tanto E. faecalis como E. faecium (42, 9.7%). Estos patógenos, junto con K. pneumoniae (40, 8.7%), representaron el 86.2% de todos los aislamientos recolectados (fig. 1).
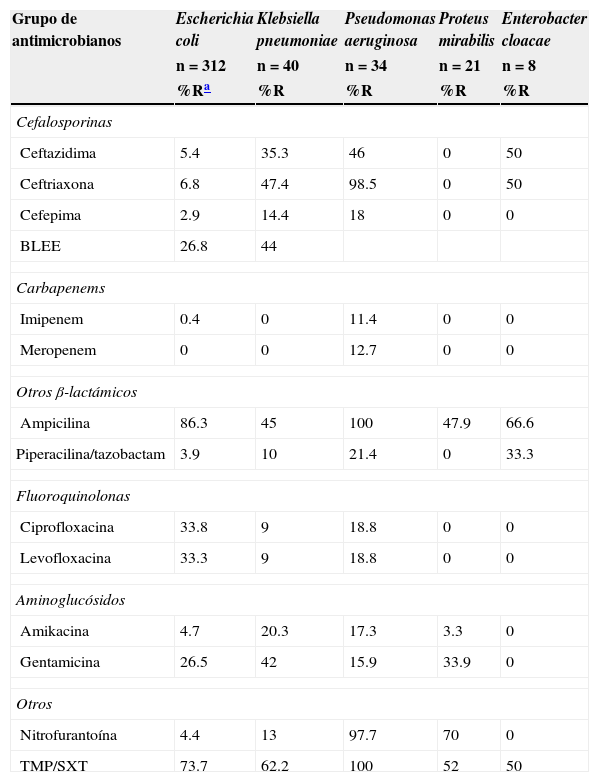
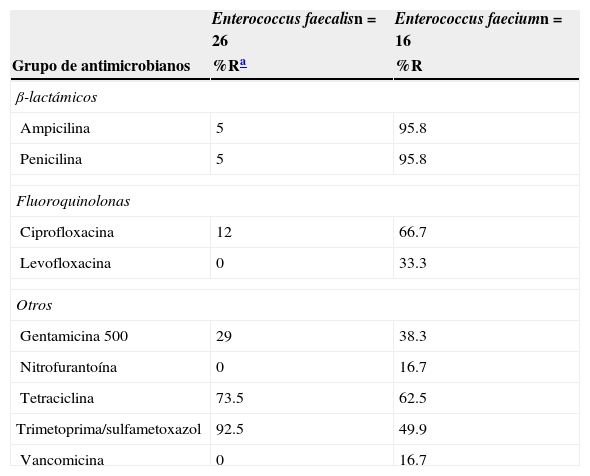
La resistencia de E. coli a los fármacos tradicionales fue de la siguiente manera: para trimetoprima-sulfametoxazol (TMP/SXT) fue superior al 73%; para ciprofloxacina, del 34%; nitrofurantoína, del 4.4%; amikacina, del 4.7%; y para gentamicina, del 26.5%. La susceptibilidad fue variable para cefalosporinas de tercera y cuarta generación. Aproximadamente una de cada cuatro cepas resistentes de E. coli mostraron el patrón de BLEE. En K. pneumoniae la mitad de las cepas (44%) presentaron este patrón de resistencia. En 26 de 312 cepas de E. coli (8.3%) se encontraron fenotipos de resistencia múltiple (ampicilina-ciprofloxacina y TMP/SXT). La resistencia de K. pneumoniae a los mismos fármacos utilizados para el tratamiento convencional fue de más del 62% para TMP/SXT, y una de cada 10 a ciprofloxacina. La resistencia a cefalosporinas fue del 14% (cefepima) al 47% (ceftriaxona). No se mostró resistencia a imipenem ni a meropenem. La resistencia de P. aeruginosa para ciprofloxacina fue>18%; a ceftazidima>40%; y se observó actividad variable para cefepima, imipenem y meropenem. P. mirabilis no presentó resistencia a cefalosporinas de tercera y cuarta generación, ni tampoco a carbapenem y quinolonas. En el caso de Enterobacter spp. se observó alta sensibilidad a cefepima, imipenem, meropenem, aminoglucósidos y nitrofurantoína (tabla 1). E. faecalis fue sensible a nitrofurantoína y no se documentó resistencia a vancomicina. En cambio, la resistencia de E. faecium fue marcada para ciprofloxacina y menor para nitrofurantoína. El 16.7% de las cepas fueron resistentes a vancomicina (tabla 2).
Actividad de diferentes grupos de antimicrobianos frente a uropatógenos Gram negativos in vitro
| Grupo de antimicrobianos | Escherichia coli | Klebsiella pneumoniae | Pseudomonas aeruginosa | Proteus mirabilis | Enterobacter cloacae |
|---|---|---|---|---|---|
| n=312 | n=40 | n=34 | n=21 | n=8 | |
| %Ra | %R | %R | %R | %R | |
| Cefalosporinas | |||||
| Ceftazidima | 5.4 | 35.3 | 46 | 0 | 50 |
| Ceftriaxona | 6.8 | 47.4 | 98.5 | 0 | 50 |
| Cefepima | 2.9 | 14.4 | 18 | 0 | 0 |
| BLEE | 26.8 | 44 | |||
| Carbapenems | |||||
| Imipenem | 0.4 | 0 | 11.4 | 0 | 0 |
| Meropenem | 0 | 0 | 12.7 | 0 | 0 |
| Otros β-lactámicos | |||||
| Ampicilina | 86.3 | 45 | 100 | 47.9 | 66.6 |
| Piperacilina/tazobactam | 3.9 | 10 | 21.4 | 0 | 33.3 |
| Fluoroquinolonas | |||||
| Ciprofloxacina | 33.8 | 9 | 18.8 | 0 | 0 |
| Levofloxacina | 33.3 | 9 | 18.8 | 0 | 0 |
| Aminoglucósidos | |||||
| Amikacina | 4.7 | 20.3 | 17.3 | 3.3 | 0 |
| Gentamicina | 26.5 | 42 | 15.9 | 33.9 | 0 |
| Otros | |||||
| Nitrofurantoína | 4.4 | 13 | 97.7 | 70 | 0 |
| TMP/SXT | 73.7 | 62.2 | 100 | 52 | 50 |
BLEE: β-lactámicos de espectro extendido; TMP/SXT: trimetoprima/sulfametoxazol.
Actividad de diferentes grupos de antimicrobianos frente a uropatógenos Gram positivos in vitro
| Enterococcus faecalisn=26 | Enterococcus faeciumn=16 | |
|---|---|---|
| Grupo de antimicrobianos | %Ra | %R |
| β-lactámicos | ||
| Ampicilina | 5 | 95.8 |
| Penicilina | 5 | 95.8 |
| Fluoroquinolonas | ||
| Ciprofloxacina | 12 | 66.7 |
| Levofloxacina | 0 | 33.3 |
| Otros | ||
| Gentamicina 500 | 29 | 38.3 |
| Nitrofurantoína | 0 | 16.7 |
| Tetraciclina | 73.5 | 62.5 |
| Trimetoprima/sulfametoxazol | 92.5 | 49.9 |
| Vancomicina | 0 | 16.7 |
La infección urinaria aguda febril no complicada muestra su máxima incidencia durante el primer año de vida en ambos sexos, mientras que la infección urinaria afebril se presenta en niños mayores de 3 años de edad22. Después de esa edad, la infección confinada a la mucosa vesical (cistitis) se acompaña, por lo general, de síntomas localizados, y puede ser fácilmente reconocida y tratada. El aumento de temperatura y las manifestaciones sistémicas incrementan la probabilidad de que el riñón esté comprometido.
En el tratamiento antimicrobiano hay dos situaciones que son críticas: la primera es que la respuesta al tratamiento sea rápida y efectiva, y que facilite la prevención de complicaciones y de recurrencias. La segunda, prevenir la urgencia de resistencia a los fármacos antimicrobianos prescritos a dosis, intervalo y duración.
En las dos últimas décadas se ha observado un aumento notable en la resistencia antimicrobiana de los uropatógenos, lo cual complica la selección específica de fármacos, aumenta tanto la morbilidad, los costos para reevaluar en forma individual cada caso, la decisión de retratamientos, así como el uso de fármacos de mayor espectro antimicrobiano23–28.
La selección del esquema de tratamiento se ha complicado a medida que la resistencia de los uropatógenos ha aumentado en todo el mundo. Antes de 1990, la resistencia de E. coli para TMP/SMX se encontraba entre 0 y 5%25; 5 años después se reportaron aumentos de entre el 7 y el 18%11,26–28, principalmente de E. coli en pacientes con cistitis. En un estudio a nivel nacional en Estados Unidos, la resistencia de E. coli a TMP/SMX fue del 15% en 1995, y del 16-17% para 1998-200111.
En Europa, un estudio similar demostró en España y Portugal cifras cercanas al 35%28. Los estudios más recientes que han sido publicados no demuestran que el panorama haya mejorado9–12.
Un aspecto que debe ser tomado en cuenta es la enorme variación geográfica de los perfiles de sensibilidad y resistencia a los antimicrobianos. Esta situación es una limitante de la información que, como en este trabajo, se publica en la literatura. De tal forma, es necesario que cada institución se nutra de la experiencia en su área de trabajo, y que los datos publicados, sean extranjeros o locales, se tomen como una orientación para iniciar los tratamientos.
Las guías de la Infectious Diseases Society of America29y de la Academia Americana de Pediatría10,30 han establecido los criterios de selección de fármacos considerados de primera línea para el tratamiento de la infección urinaria en sus diferentes modalidades tomando en consideración los perfiles de sensibilidad/resistencia específicamente de E. coli, patógeno al que debe enfocarse la selección empírica de tratamiento debido a su participación preponderante en la etiología.
La Academia Americana de Pediatría considera que el tratamiento debe administrarse preferentemente por vía oral10,30. Cuando el paciente se encuentra en estado nauseoso o presenta vómito, o cuando no se garantiza la adherencia, se justifica el tratamiento parenteral, sobre todo cuando el paciente parece estar severamente afectado, deshidratado o está impedida la vía oral.
Desde un punto de vista práctico, tanto la vía oral como la parenteral son igualmente efectivas y eficaces. La selección del fármaco depende de la resistencia que presenta en cada institución o región. Un consenso reciente en nuestro país presenta un enfoque multidisciplinario del tema2.
De los aspectos más relevantes de este estudio destaca que, entre los bacilos Gram negativos, cefepima, imipenem y meropenem fueron los β-lactámicos más efectivos (82-100%), con diferencia significativa al compararlos con ceftazidima frente a K. pneumoniae y P. aeruginosa (p<0.05). La resistencia a estos fármacos de amplio espectro, de acuerdo con los criterios del Clinical and Laboratory Standards Institute20, se relacionó, en parte, con la presencia de BLEE, en 26.8% de E. coli y 44% en K. pneumoniae31. Esta situación complica aún más la selección del esquema de tratamiento empírico y respalda la opción hacia la prescripción de otros β-lactámicos de más amplio espectro8,9,11,12,15,23–27,31. Sin embargo, antes de escalar hacia las cefalosporinas de tercera generación, de preferencia orales, o hacia los carbapenémicos, se debe considerar que en el caso de E. coli hay otras opciones. Por ejemplo la nitrofurantoína, que tiene una excelente acción frente a bacterias Gram negativas, como E. coli, K. pneumoniae y Enterobacter spp., así como frente a E. faecalis. La limitación particular se relaciona con la presencia de P. aeruginosa, para la cual su actividades nula2,28.
Cuando se compara con otros estudios publicados8,9,11,12,15,23–27,31, la resistencia de E. coli a los fármacos considerados de primera línea (TMP/SMX y ciprofloxacina) se encuentra en cifras consideradas como elevadas, del 73.7 y 33.8%, respectivamente.
Lo mismo sucede con P. aeruginosa, donde aproximadamente una de cada dos cepas es resistente a ceftazidima y una de cada 10 es resistente a imipenem, cefepima y meropenem. Nitrofurantoína mostró susceptibilidad por encima del 95% para E. coli, Enterococcus spp. y K. pneumoniae, que representan el mayor porcentaje de la etiología de la infección urinaria.
Ciertamente, las cefalosporinas de tercera generación cubren más del 90% de los patógenos; sin embargo, para iniciar un tratamiento, deben seleccionarse según las condiciones individuales de cada paciente. Por ejemplo, la Academia Americana de Pediatría10,30 considera que a los niños<2 años de edad con infección urinaria febril se les puede prescribir cefalosporinas de tercera generación vía oral, como ceftibuten.
Es necesario hacer hincapié en que las resistencias a los uropatógenos presentan variación geográfica importante, razón por la cual es conveniente conocer la información que se genera a nivel institucional o regional.
Enterococcus spp. ocupó, por frecuencia, el segundo lugar. E. faecalis presentó una sensibilidad a glucopéptidos (vancomicina) del 100%, cifra semejante a la observada para nitrofurantoína. La presencia de E. faecium, aunque no fue elevada (16/457, 3.5%),destacó por la resistencia presentada a vancomicina (16.7%). Esto implica que puede ser, potencialmente, una fuente de transmisión de diversos mecanismos de resistencia a otras especies bacterianas.
Los resultados aquí presentados confirman que la resistencia de los uropatógenos aislados de pacientes con infección urinaria adquirida en la comunidad es un problema serio, sobre todo para garantizar que el tratamiento que se inicia en forma empírica impida las recurrencias, el curso hacia la cronicidad y, lo más grave, el daño renal.
Para disminuir las fallas en el tratamiento, no solo de la infección urinaria aguda no complicada sino de la adquirida en hospital, es necesario disponer de un sistema de vigilancia de la resistencia antimicrobiana institucional que permita la selección de los fármacos específicos en dosis, intervalo y duración. La información vertida en este estudio permitirá seleccionar el antimicrobiano que pueda ofrecer eficacia y seguridad.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.