La neumonía adquirida en la comunidad (NAC) es una de las causas infecciosas más frecuentes de morbi-mortalidad a escala mundial en niños menores de 5 años. El objetivo del estudio fue precisar el diagnóstico bacteriano etiológico en lactantes con NAC.
MétodosSe condujo un estudio prospectivo, transversal y descriptivo en 17 pacientes de 6 meses a 2 años 11 meses de edad con NAC de mala evolución, que ingresaron al servicio de Neumología pediátrica. A los pacientes se les realizó broncoscopia con lavado broncoalveolar (LBA) con las medidas pertinentes durante el procedimiento para limitar el riesgo de contaminación.
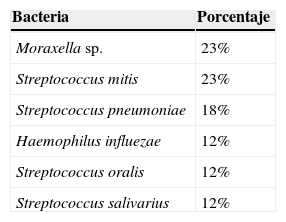
ResultadosLas bacterias aerobias aisladas fueron Moraxella sp. (23%), Streptococcus mitis (23%), Streptococcus pneumoniae (18%), Haemophilus influenzae (12%), Streptococcus oralis (12%), y Streptococcus salivarius (12%).
ConclusionesEn contraste con otros informes se observó que Moraxella sp. es un importante patógeno potencial bacteriano, posiblemente debido a la mejora en la detección con broncoscopia más LBA.
Community-acquired pneumonia (CAP) is one of the most common infectious causes of morbidity and mortality in children <5 years of age. The aim of the study was to clarify the bacterial etiologic diagnosis in infants with CAP.
MethodsA prospective, cross-sectional and descriptive study in patients 6 months to 2 years 11 months of age with CAP with poor outcome was conducted. Patients were admitted to the Pediatric Pneumology Service and underwent bronchoscopy with bronchoalveolar lavage (BAL), taking appropriate measures during the procedure to limit the risk of contamination.
ResultsAerobic bacteria isolated were Moraxella sp. 23%, Streptococcus mitis 23%, Streptococcus pneumoniae 18%, Haemophilus influenzae 12%, Streptococcus oralis 12%, and Streptococcus salivarius 12%.
ConclusionsIn contrast to other reports, we found Moraxella sp. to be a major bacterial pathogen, possibly because of improved detection with bronchoscopy plus BAL.
La neumonía constituye una de las principales causas de morbi-mortalidad en la infancia. Su atención consume importantes recursos sanitarios, tanto en el medio hospitalario como en el extrahospitalario. La máxima incidencia se produce en niños de 1 a 5 años, y es especialmente frecuente en la estación invernal1,2. La neumonía se define como la inflamación del tejido pulmonar debida a un agente infeccioso que estimula la respuesta inflamatoria y resulta en lesión pulmonar3. Esta respuesta provoca la migración de neutrófilos, la liberación de mediadores inflamatorios y de enzimas oxidativas, con extravasación de plasma y pérdida de surfactante, lo cual resulta en ausencia de aire y solidificación del órgano, que se conoce como consolidación. Los microorganismos causales pueden ser bacterias, virus, hongos o parásitos. Sin embargo, la alta mortalidad de la neumonía se atribuye, en mayor parte, a los agentes de etiología bacteriana, así como a la falta de un acceso rápido y apropiado al tratamiento.
La neumonía adquirida en la comunidad (NAC) es una infección aguda del parénquima pulmonar que afecta a un paciente inmunocompetente expuesto a un microorganismo fuera del hospital. Clásicamente se considera como una condición en la que el paciente no haya sido hospitalizado 7-14 días previos al comienzo de los síntomas, o que estos comiencen en las primeras 48h desde su hospitalización4,5.
El tratamiento antimicrobiano eficaz depende de la identificación del agente etiológico. Por ello, es necesario realizar un esfuerzo en obtener el material adecuado para realizar un diagnóstico bacteriológico, que incluya tinción de Gram y cultivos. En niños menores de 5 años es difícil obtener muestra de esputo, por lo que la utilización de la broncoscopia y del lavado broncoalveolar (LBA) disminuye la contaminación en la obtención de muestra. El lavado broncoalveolar es el método utilizado para obtener una muestra representativa de líquido y secreciones de las vías respiratorias bajas, que será útil para el diagnóstico citológico y microbiológico de las enfermedades pulmonares, sobre todo en pacientes pediátricos. La broncoscopia con LBA es una opción de muestreo no invasivo del tracto respiratorio inferior6–8. Así mismo deben utilizarse medios de cultivo enriquecidos que permitan el crecimiento de las bacterias exigentes en requerimientos nutritivos9–11.
La mayoría de las neumonías comunitarias del niño son de etiología viral. Sin embargo, la posible existencia de infecciones por bacterias a menudo condicionará la prescripción de tratamiento antibiótico. Es preciso señalar que los patrones radiológicos descritos en distintas formas etiológicas no tienen una validez absoluta. Aunque la existencia de un infiltrado alveolar es característica de las neumonías bacterianas, puede ser también observada en las originadas por virus12.
En México existen pocos estudios de la etiología bacteriana de NAC en niños13. Durante los primeros 3 años de vida destacan claramente los virus, aunque deben considerarse también Streptococcus pneumoniae y Haemophilus influenzae.
La mayor dificultad diagnóstica reside en la identificación del agente etiológico. Este hecho está relacionado con los problemas que presenta la obtención de muestras biológicas adecuadas para cultivo14. El paciente pediátrico no suele expectorar, y los hemocultivos son de escaso valor diagnóstico etiológico de las neumonías15,16. La fiebre, una característica de la neumonía, puede estar presente en el 88-96% de los casos confirmados con radiología17, pero debe valorarse en el contexto de toda la información. En niños de cualquier edad se debería considerar neumonía bacteriana ante fiebre persistente o recurrente > 38.5°C y aumento del trabajo y frecuencia respiratoria18.
Ya que el LBA permite un diagnóstico microbiológico en la mitad de los casos con una tasa mínima de complicaciones, se realizó el presente estudio con la finalidad de identificar de manera apropiada la etiología bacteriana en estos pacientes.
2Métodos2.1Diseño del estudioSe realizó un estudio prospectivo transversal descriptivo en lactantes (de 6 meses a 2 años 11 meses de edad) que ingresaron con diagnóstico de NAC de mala evolución, confirmado por radiografía de tórax según las guías de la Organización Mundial de la Salud (OMS)19, al servicio de hospitalización de Neumología pediátrica del Hospital Gaudencio González Garza del 1 de septiembre al 30 de noviembre del 2009.
Se incluyeron aquellos pacientes a quienes se les realizó LBA para cultivo y que cumplieron con los siguientes criterios de inclusión: taquipnea (más de 50 respiraciones por minuto (rpm) en menores de 1 año, y más de 40rpm en niños mayores), retracción supraesternal subcostal o intercostal, estertores crepitantes y sibilancias, radiopacidades opacas homogéneas con localización lobar o segmentaria con broncograma en su interior o bien radiopacidades difusas heterogéneas bilaterales de focos múltiples, cuenta de leucocitos por arriba de 15,000/mm3, proteína C reactiva y velocidad de sedimentación aumentadas, con o sin tratamiento antimicrobiano selectivo previo con ampicilina. A la mayoría de los pacientes se les tomaron las muestras al ingreso. Los pacientes no estaban intubados. Selectivamente se les realizó LBA.
El estudio cumplió con los procedimientos seguidos a las normas del Comité Institucional de Experimentación Humana Responsable, y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki. Previamente, el estudio fue aceptado por el Comité de Investigación y Ética de la Unidad Médica de Alta Especialidad Gaudencio González Garza, Centro Médico Nacional La Raza, Instituto Mexicano del Seguro Social. Así mismo, se firmó el consentimiento informado por los tutores.
Definición operacional de mala evolución:
- -
Dificultad respiratoria moderada
- -
Sat O2 < 92%
- -
Deshidratación
- -
Compromiso hemodinámico
- -
Persistencia de los síntomas y de las alteraciones radiográficas
- -
Falta de respuesta al tratamiento empírico
Se realizó la broncoscopia y el LBA usando un protocolo estándar. Se insertó un broncoscopio pediátrico por vía oral para evitar la contaminación nasal. Se instilaron y reaspiraron alícuotas de solución salina (0.9%) en el bronquio lobar o segmentario enfermo (volumen máximo, 3ml/kg de peso corporal). La primera fracción de LBA se descartó. Todos los pacientes fueron sedados con midazolam intravenoso, atropina sulfato y clorhidrato de tramadol. Se realizó un monitoreo transcutáneo para evaluar la saturación de oxígeno y la frecuencia cardiaca, y se administró oxígeno complementario según fuera necesario durante el procedimiento6.
2.3MicrobiologíaLas muestras de LBA se procesaron utilizando técnicas estándar. Brevemente, las muestras se enviaron de inmediato al laboratorio, se centrifugaron para realizar tinción de Gram del sedimento y se inyectaron en frascos BacT/ALERT® PF plus (bioMérieux) con carbón activado, el cual tiene la función de secuestrar el antibiótico empleado y permitir que crezca el microorganismo, puesto que los lactantes que ingresaron con diagnóstico de NAC ya habían sido manejados con esquemas de antibiótico. Cuando hubo desarrollo, se sembró en agar sangre de carnero al 5% y agar chocolate en una atmósfera aeróbica con CO2 al 5% a 37°C por 2 días, para el desarrollo de bacterias aerobias y facultativas. Una vez logrado el aislamiento puro, se procedió a la identificación por medio de la tinción de Gram, pruebas manuales (catalasa, oxidasa, sensibilidad a la optoquina, prueba de satelitismo según el microrganismo aislado), sistema VITEK® y API® 20 Strep (bioMérieux).
2.4Análisis estadísticoSe utilizó la prueba exacta de Fisher para la comparación de proporciones en virtud del número bajo de frecuencias observadas.
3Resultados3.1Población de estudioSe incluyeron 17 lactantes que cumplieron con los criterios de inclusión. La mayor prevalencia se observó en el grupo de 12 a 24 meses. El 24% fue alimentado con fórmula y el 76% al seno materno; en estos últimos, el tiempo de alimentación fue menor de 6 meses en el 69.2% y mayor de 6 meses en el 30.8%. El 29% de los pacientes con NAC cursó con cuadros diarreicos y el 59% presentó previamente otitis media. El diagnóstico de NAC se basó en criterios clínicos. En el momento del ingreso la tos fue un hallazgo en el 94% de los pacientes, de los cuales en el 82% fue tos húmeda y en el 12% tos seca. El tiempo de duración fue de 5 a 20 días. Se presentó fiebre en el 88.2%; faringe hiperémica en el 82%; adenomegalias en el 76%; secreción nasal en el 53% (verdosa o amarilla en el 33.4% y hialina en el 66.6%). Los cuadros previos de infección de vías respiratorias altas (IVRA) fueron de 2 a 5 en menos de 6 meses. Las hospitalizaciones por infección de vías respiratorias bajas (IVRB) fueron de 1 a 8 ocasiones (tabla 1). Cabe mencionar que no se presentaron complicaciones durante el LBA.
Características de los pacientes
| No. de pacientes | 17 |
|---|---|
| Edad en meses (media ± DE) | 17.4 ± 7 |
| Sexo | |
| Femenino | 42% |
| Masculino | 58% |
| Alimentación al seno materno | |
| Sí | 76% |
| No | 24% |
| Estado nutricional | |
| Bueno | 88.3% |
| Desnutrición | 11.7% |
| Esquema de vacunación | |
| Completo | 71% |
| Incompleto | 29% |
| Hallazgos clínicos | |
| Disnea | 100% |
| Sibilancias | 100% |
| Estridor | 100% |
| Cuadros previos de IVRA | |
| Sí | 53% |
| No | 47% |
| Hospitalización previa por IVRB | |
| Sí | 41.2% |
| No | 58.8% |
DE: desviación estándar; IVRA: infección de vías respiratorias altas; IVRB: infección de vías respiratorias bajas.
Las muestras estudiadas fueron adecuadas ya que, de acuerdo con los criterios descritos por Murray y Washington, tuvieron > 25 leucocitos polimorfonucleares y < 10 células epiteliales por campo a bajo aumento (100X) en un frotis teñido con Gram20.
Todos los aislados bacterianos fueron cultivos puros. Moraxella sp. y Streptococcus mitis fueron los agentes bacterianos predominantes, y se aislaron en el 23% ambos. Después siguió Streptococcus pneumoniae, contando para el 18% de los casos (tabla 2). Desafortunadamente, la identificación de M. catarrhalis por el sistema VITEK® no fue satisfactoria, ya que no se pudo identificar de manera precisa sino únicamente como Moraxella sp.
La presencia de otitis media aguda (OMA) se encontró asociada con Moraxella sp. en el 23.5% de los casos, a diferencia de los estreptococos del grupo viridans en el 11.7% (p = 0.03). El grupo de edad afectado por Moraxella sp. fue el de 12 a 28 meses en comparación con el resto de las bacterias aisladas que fue desde los 6 hasta los 35 meses (p = 0.03).
4DiscusiónLa neumonía es una de las principales causas de mortalidad en niños menores de 5 años. Este estudio abordó un grupo de 17 lactantes con NAC que requirieron de hospitalización y en quienes se determinó la etiología bacteriana de la infección.
Las bacterias aerobias aisladas principalmente fueron Moraxella sp. y Streptococcus mitis, en el 23% para ambos agentes, seguidos por Streptococcus pneumoniae en el 18%. Se tiene la certeza de que el riesgo de contaminación en las muestras de LBA se limitó considerablemente, ya que se tomaron diversas medidas técnicas para evitar la contaminación por secreciones del tracto respiratorio superior (TRS)3,6,21.
Al comparar los resultados con muestras de exudados faríngeos en una revisión de la estadística de la Sección de Microbiología del Hospital General Gaudencio González Garza del 1 de enero del 2009 al 26 de noviembre del 2009 de pacientes con diagnóstico de neumonía del servicio de Neumología pediátrica, se observó que el reporte de bacterias presentes en la flora del TRS fue del 74% para Streptococcus anginosus, S. mitis y S. sanguis, y del 26% en S. pyognes, sin la presencia de Moraxella sp. ni S. pneumoniae.
A pesar del bajo número de pacientes, los resultados de este trabajo coinciden con los estudios realizados por la OPS/OMS con respecto a que los niños son más propensos a contraer neumonía que las niñas22. De acuerdo con estudios anteriores, la mayoría de los niños con NAC estaban bien nutridos10,23. El problema de niños mal inmunizados sigue presente en un país donde la vacuna es obligatoria y gratuita, ya que se encontró que el 29% de la población no contaba con su esquema de vacunación completo. Precisamente, en tres de ellos se aisló S. pneumoniae y en dos de ellos, H. influenzae tipo b. Esta falla en el primer nivel de atención determina la necesidad de mantener una vigilancia activa de la aparición de enfermedades prevenibles, como las producidas por H. influenzae tipo b. La presencia de OMA se encontró asociada con Moraxella sp. y no con H. influenzae, divergiendo de un estudio previo24. La OMA es una infección muy frecuente en niños: antes de 1 año de edad, alrededor del 50% de los niños han experimentado al menos un periodo de OMA. Esta proporción aumenta al 70% a la edad de 3 años. Sin lugar a dudas, es la infección más grave y frecuente causada por M. catarrhalis en los niños, y como tal causa una alta morbilidad y requiere el uso generalizado de antibióticos.
En consideración a la identificación de Moraxella catarrhalis, el sistema automatizado VITEK® no fue satisfactorio ya que no se pudo identificar la especie. Otros autores han reportado la misma dificultad25. M. catarrhalis es un aeróbico, oxidasa-positivo, aceptado como patógeno, aunque hasta hace relativamente poco se consideraba como un comensal inocuo del tracto respiratorio superior. M. catarrhalis ha sido reconocido como un patógeno específico en la OMA durante casi 70 años26. Aunque las infecciones de las vías respiratorias inferiores en los niños son una causa frecuente de morbilidad e incluso de mortalidad en todo el mundo, la obtención de un diagnóstico microbiológico es difícil. La mayoría de los estudios utilizan combinaciones de métodos serológicos y microbiológicos convencionales (por ejemplo, cultivo o PCR). Muchos de estos métodos solo se han utilizado dentro del ámbito de la investigación y no siempre son fiables o fácilmente disponibles para los clínicos. En consecuencia, los datos sobre el papel de M. catarrhalis en las infecciones del tracto respiratorio inferior no son concluyentes26.
Las infecciones de las vías respiratorias bajas (IVRB) debidas a M. catarrhalis parecen ser poco frecuentes en la infancia. La mayoría de las infecciones se presentan en niños menores de 1 año27. M. catarrhalis se ha aislado en primer lugar, en cultivo puro de secreciones obtenidas por aspiración traqueal en neonatos, lactantes y niños con neumonía28,29. Considerando el porcentaje de prevalencia por Moraxella sp., mayor al de S. pneumoniae y H. influenzae, los resultados obtenidos aquí discrepan de lo reportado por otros autores30. Las infecciones respiratorias bajas por este agente deben sospecharse, quizá, cuando exista falla terapéutica al tratamiento con beta-lactámicos. Por esto, se debe investigar la participación de Moraxella sp. como agente causante de infecciones respiratorias agudas y crónicas de manera paralela con S. pneumoniae y H. influenzae. Moraxella sp. fue uno de los principales agentes encontrados, posiblemente debido a la mejora de la detección por broncoscopia con LBA. Esto sugiere que la NAC en pediatría podría reducirse al considerar a Moraxella sp. como un importante agente causal.
La neumonía causa más muertes en el mundo que cualquier otra enfermedad infecciosa. Aunque se puede curar con antibióticos, los pacientes pueden morir si no se inicia una terapia oportuna, apropiada y adecuada31. En el presente estudio se coincidió con otros autores24 quienes detectaron Moraxella sp y S. pneumoniae en el 28.9 y el 13.3% de los casos, respectivamente. Moraxella catarrhalis suele sobreinfectar a niños menores de 2 años con infección vírica5. Los resultados aquí obtenidos son compatibles con las directrices actuales que recomiendan el tratamiento con antibiótico para todos los casos de NAC, ya que una etiología viral o atípica establecida no excluye una infección bacteriana concomitante32,33. La identificación temprana de los microorganismos patógenos y el tratamiento antimicrobiano adecuado son esenciales para tratar a los pacientes con neumonía. Por lo tanto, los neumólogos han intentado durante mucho tiempo encontrar un método sensible, específico y seguro para obtener los patógenos causantes de infecciones de vías respiratorias bajas a partir de tales pacientes. El LBA permite un diagnóstico microbiológico en la mitad de los casos, con una tasa mínima de complicaciones. Por tanto, es importante tener presente esta técnica, que en manos experimentadas aporta mucha información clínica.
En cuanto a S. mitis y S. oralis, forman parte de los estreptococos del grupo mitis34. S. mitis suele ser un agente etiológico en infecciones odontogénicas y endocarditis, y solo en algunos casos ha sido reconocido como patógeno respiratorio y agente de neumonía en inmunocomprometidos. Es un microorganismo comensal que está estrechamente relacionado con el patógeno S. pneumoniae, el agente causante de OMA, neumonía, sepsis y meningitis. Se ha observado la recombinación homóloga entre estas especies. La transferencia de los determinantes genéticos de S. mitis a S. pneumoniae contribuye a la resistencia a la penicilina en el patógeno35. La microflora nasofaríngea ha sido el principal depósito de posibles patógenos respiratorios. S. mitis se ha encontrado en la cavidad oral, en todos los lactantes, en cada ocasión de muestreo36.
Es probable que debido a la vacunación en contra de S. pneumoniae y H. influenzae, se explique el menor porcentaje obtenido en sus aislamientos.
Las limitaciones del presente estudio incluyen el número de pacientes, que fue pequeño, y las cepas identificadas como Moraxella sp. es muy probable que sean de M. catarrhalis, las cuales no se pudieron identificar con el sistema VITEK®. Además, se debe mencionar el sesgo de selección, ya que somos un centro hospitalario de tercer nivel, como posible factor de nuestros resultados. No obstante, la aportación de este trabajo es conocer las cepas circulantes para mejorar el tratamiento empírico, y ayudar a precisar la epidemiología en trabajos futuros.
En conclusión, al igual que en estudios anteriores, se encontró que una variedad de microorganismos participaron en NAC en Pediatría. En contraste con otros informes, se encontró que Moraxella sp. es un importante patógeno potencial bacteriano, posiblemente debido a la mejora en la detección con broncoscopia más LBA. Se requiere de investigación adicional para aclarar los mecanismos patogénicos de este agente de NAC pediátrica. Sin embargo, los hallazgos sugieren que esta infección podría reducirse al considerando a Moraxella sp. como un importante agente causal en cuanto a tratamiento y estrategias de prevención. Aunque la literatura actual no proporciona una respuesta definitiva, los datos disponibles sugieren que M. catarrhalis puede estar involucrada en las IVRB en niños. Así pues, la pregunta queda abierta a nuevas investigaciones. Afortunadamente, la neumonía causada por M. catarrhalis tiende a ser una enfermedad relativamente leve.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
FinanciamientoRecursos propios de la Unidad Médica de Alta Especialidad.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.