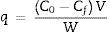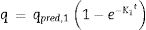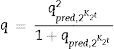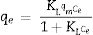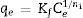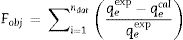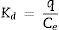En esta investigación se propone el reuso de los desechos de conchas de ostión en forma de nanoestructuras de CaCO3 biogénico y su aplicación como adsorbente de iones metálicos de cobre (II) y cadmio (II) en medios acuosos. Los experimentos de adsorción se realizaron por lotes a partir de soluciones de sales metálicas preparadas a diferentes concentraciones. Se utilizaron los modelos de isotermas de adsorción y su formulación matemática para describir los equilibrios de adsorción que ocurren en las nanoestructuras. Las capacidades máximas de adsorción obtenidas experimentalmente fueron de 18,6mgg−1 para los iones cadmio (II) y de 22,7mgg−1 para los iones cobre (II). Ambas isotermas corresponden a una isoterma tipo H, indicando una alta afinidad de adsorción y una fuerte interacción adsorbato-adsorbente. Basado en los coeficientes de adsorción (Kd) y los valores de porcentajes de metal removido, la secuencia de selectividad de los metales es cadmio (II) > cobre (II) para ser adsorbido en las nanoestructuras. Los resultados de caracterización mostraron que el CaCO3 obtenido a partir de fuentes biogénicas de conchas de ostión es altamente cristalino y polimorfo, compuesto por una mezcla de las fases de calcita y aragonita, predominando la forma romboédrica en tamaños nanométricos. Con estos resultados, se propone que con las nanoestructuras de CaCO3 obtenidas a partir de fuentes biogénicas tales como las conchas de ostión, es factible su uso para remover metales pesados de medios acuosos.
This research proposes the reuse of waste oysters shells in the form of nanostructures of CaCO3 biogenic and its application as adsorbent of copper (II) and cadmium (II) metal ions in aqueous media. The adsorption experiments were carried out in batches from metal salts solutions prepared at different concentrations. The adsorption isotherm models and their mathematical formulation were used to describe adsorption equilibria occurring in the nanostructures. The maximum adsorption capacities obtained experimentally were 18.6mgg−1 for cadmium ions (II) and 22.7mgg−1 for copper ions (II). Both isotherms correspond to an isotherm type H, indicating a high affinity of adsorption and a strong adsorbent-adsorbate interaction. Based on the coefficients of adsorption (Kd) and the values of percentage of metal removed, metals selectivity sequence is cadmium (II) > copper (II) to be adsorbed on nanostructures. The results of characterization showed that the CaCO3 obtained from oysters shells of biogenic sources is highly crystalline and polymorphous, composed of a mixture of phases of calcite and aragonite, predominating the rhombohedral form in nanometric sizes. With these results, it is proposed that with CaCO3 nanostructures obtained from biogenic sources such as oyster shells, is feasible use to remove heavy metals from aqueous media.
Los metales pesados representan una de las principales fuentes de contaminación del agua. Parte de la responsabilidad de esto es de las industrias que descargan en sus efluentes diferentes metales pesados que en cantidades elevadas son tóxicos, tales como el cromo (II), el cadmio (II), el cobre (II) o el plomo (II), entre otros; a estos contaminantes metálicos se les atribuyen diferentes enfermedades, tales como las que afectan el funcionamiento del hígado o el riñón, entre otras [1]. Por esta razón, en los años recientes se ha puesto mayor atención a las investigaciones acerca de las formas de remover los metales pesados de las aguas residuales. Actualmente existen muchos métodos físicos y químicos convencionales para el tratamiento de aguas residuales; estas tecnologías incluyen la coagulación, la filtración, la evaporación, la precipitación, la oxidación-reducción, los tratamientos electroquímicos, el intercambio iónico, la osmosis inversa y la adsorción, que son las más utilizadas para la eliminación de los metales pesados de los sistemas acuosos [2].
El proceso de adsorción es una tecnología efectiva y de bajo costo si se utiliza el adsorbente adecuado, además de ser la técnica más utilizada y eficaz para el tratamiento de aguas residuales contaminadas por compuestos tóxicos, ya sean orgánicos o inorgánicos [3]. En este contexto, se han reportado algunos trabajos acerca de la adsorción de metales pesados en soluciones monocompuestas, con las propuestas de adsorbedores de bajo costo como: residuos de limón [4], arcillas [5], sepiolita [6], cáscara de huevo [7], cenizas volantes [8], areniscas [9], cenizas de cáscara de arroz [10], zeolitas [11] y conchas de ostión [12], entre otros. Los residuos de conchas de ostión que contienen carbonato de calcio (CaCO3) son una alternativa para la eliminación de los iones metálicos debido a sus propiedades adsorbedoras. En algunos países, incluyendo México, se generan en gran medida grandes cantidades de desechos de conchas de ostión, lo que ofrece una fuente confiable para su utilización como un adsorbente de bajo costo.
Recientemente la adsorción de metales pesados por CaCO3 de origen biogénico ha recibido una considerable atención por su gran abundancia en el medio ambiente [13]. Las conchas de moluscos son comunes en las regiones costeras. Como una fuente biogénica de CaCO3, este material contiene un porcentaje mayor al 95% de CaCO3, una pequeña cantidad de SiO2, proteínas y polisacáridos [14]. Al igual que el CaCO3 geológico, el CaCO3 biogénico se presenta generalmente como aragonita, calcita y, a veces, como una mezcla de ellas. Por lo anterior, en este trabajo se propuso utilizar los desechos de conchas de ostión para obtener, mediante tratamientos de molienda, polvos de CaCO3 y determinar su capacidad de adsorción de iones metálicos de cadmio (II) y cobre (II) en suspensiones acuosas monocompuestas. La adsorción de metales fue analizada mediante los modelos cinéticos de pseudoprimer y pseudosegundo orden, y los modelos de isotermas de Langmuir y Freundlich para la discusión del fenómeno.
Desarrollo experimentalPreparación del adsorbenteLos residuos de conchas de ostión se recolectaron en la zona costera de los municipios de Comalcalco y Paraíso, Tabasco, México. Para eliminar impurezas y materia orgánica adherida a la valva se lavaron con agua y una esponja sin agentes químicos y se secaron al sol durante 2 días. Con ayuda de un martillo se redujeron de tamaño y se trituraron finalmente en morteros. Se utilizaron mallas del número 80 y 100 para tamizar y tener control sobre el tamaño de la partícula. Los polvos obtenidos se lavaron con agua desionizada hasta que el pH de los sobrenadantes se mantuviera constante. Finalmente, se secaron en un horno a 50°C durante 48h.
Caracterización del adsorbentePara determinar la presencia de los grupos funcionales de los componentes orgánicos e inorgánicos presentes en el adsorbente, las muestras fueron analizadas por espectroscopia de infrarrojo con transformada de Fourier, utilizando la técnica de ATR empleando un espectrofotómetro Nicolet™ iS10 de Thermo Scientific y un accesorio Smart iTR™. Los análisis IR se determinaron en un rango de número de onda de 4.000 a 500cm−1. La identificación de la estructura cristalina y los tamaños promedio de cristal se realizaron por difracción de rayos X, empleando un difractómetro Empyream de PANalytical para los polvos, con un ánodo de cobre, siendo la radiación correspondiente a la transición CuKα con una longitud de onda de 1,5418Å y barrido de 10 a 80° en la escala 2-theta, en un paso de 0,02° y con un tiempo de conteo de 127s. Los análisis de morfología de los polvos se obtuvieron por microscopia electrónica de barrido. Para el análisis, las muestras se montaron sobre cinta conductora de carbón de doble cara en un portamuestra de aluminio. Posteriormente, se observaron en un microscopio electrónico de barrido JEOL JSM-7600F a 5kV de voltaje de aceleración en condiciones de alto vacío ×5.000. Las imágenes se procesaron en el software InTouchScope™. Finalmente, para analizar las transformaciones de fases del material adsorbedor se empleó la técnica de microscopia electrónica de transmisión de alta resolución, para lo que se utilizó un equipo modelo JEM-2100 de ultraalta resolución a 200kV de potencia. La preparación de las muestras consistió en someter a ultrasonido durante 10min una suspensión compuesta de 0,1g de muestra de cada polvo en 15ml de alcohol isopropílico y el sobrenadante se colocó con una micropipeta de 100μL sobre la rejilla de cobre recubierta con carbono.
Evaluación del pH experimentalSe prepararon 3 soluciones de 500mgL−1 a partir de sales de nitrato de cadmio tetrahidratado (CdN2O6)·4H2O (Marca Aldrich) y nitrato de cobre pentahidratado (CuN2O6)·5H2O (Marca Aldrich) con agua desionizada. Para mantener los iones en solución se ajustaron las soluciones a valores de pH de 3, 4 y 5 con soluciones de NaOH y HNO3 0,1N; estos valores de pH menores de 6 fueron considerados con base en los diagramas de especie de cada metal. Para los experimentos se mezclaron 10ml de cada solución con 0,02g del adsorbente y se colocaron en un termobaño con agitación a 30°C y 120rpm por un periodo de 24h. Los polvos fueron separados de las suspensiones por centrifugación. Las concentraciones finales se midieron con un espectrofotómetro de absorción atómica Perkin Elmer AAnalist 100. Las capacidades de adsorción se calcularon a partir del siguiente balance de masa:
Donde C0 y Cf son las concentraciones iniciales y finales de los metales en mgL−1, V es el volumen en litros de la solución empleada en los experimentos de adsorción y W es la masa del adsorbente en gramos.
Experimentos cinéticosPara los experimentos cinéticos se prepararon soluciones iniciales de 100 y 300mgL−1 para cadmio (II) y de 60 y 160mgL−1 para cobre (II) y se ajustaron a un pH de 5 con NaOH y HNO3 0,1N; los experimentos se realizaron por lotes, mezclando 10ml de cada solución con 0,02g del adsorbente por tiempos de 5 a 1.080min. Se colocaron en un termobaño a 30°C y 120rpm. Posteriormente se separaron las suspensiones del adsorbente por centrifugación y se midieron los cambios en los valores de pH. Las concentraciones finales de los metales se determinaron por la técnica de espectroscopia de absorción atómica.
Experimentos de adsorciónSe prepararon soluciones a partir de (CdN2O6) ·4H2O y (CuN2O6)·5H2O con agua desionizada. Las concentraciones iniciales de las soluciones tenían valores entre 10 y 500mgL−1 de cada uno de los metales por separado. Las soluciones se ajustaron a un pH de 5 con soluciones de NaOH y HNO3 0,1N. Los experimentos por lotes consistieron en mezclar 10ml de cada solución con 0,02g del adsorbente y se colocaron en termobaños a 30°C y 120rpm durante 14h. Se separaron los polvos de las suspensiones por centrifugación y se midieron los valores finales de pH. Las concentraciones finales de los metales se determinaron por la técnica de espectroscopia de absorción atómica.
Modelos de datos de adsorciónEn la literatura se mencionan varios modelos de adsorción empleados para correlacionar los datos de adsorción en sistemas por lotes. Para esta investigación se seleccionaron los modelos de pseudoprimer y pseudosegundo orden. Estas expresiones cinéticas están definidas como:
Donde K1 (min−1) es la velocidad de pseudoprimer orden, q (mgg−1) es la cantidad de soluto adsorbido en el equilibrio y qpred (mgg−1) es la cantidad de soluto adsorbido en un tiempo t, y K2 (gmg−1min−1) es la velocidad de pseudosegundo orden. La cinética de pseudoprimer orden asume que solo una especie del adsorbato se relaciona con solo un sitio activo del adsorbente, mientras que el modelo de pseudosegundo orden considera que 2 sitios activos pueden ser ocupados por el mismo ion.
Por otra parte, para correlacionar los datos de las isotermas de cobre (II) y cadmio (II) fueron considerados los modelos de Langmuir y Freundlich. En primera instancia, el modelo de Langmuir asume que la adsorción ocurre en monocapa donde los sitios activos son idénticos y energéticamente equivalentes [15], esta expresión está dada por:
Donde qe y Ce son la capacidad de adsorción en mgg−1 y la concentración en equilibrio en mgL−1, respectivamente; qm es la capacidad de adsorción máxima teórica en mgg−1 y KL en Lmg−1 representa la constante de equilibrio de Langmuir. Tanto qm como KL se obtienen a partir de la correlación de los datos de adsorción.
Alternativamente, el modelo de Freundlich es un modelo empírico, cuya expresión es utilizada para describir un sistema heterogéneo [15], que se define como:
Donde Kf (mg1-1/nL1/ng−1) y n1 son parámetros característicos del sistema adsorbato-adsorbente; estos valores se obtienen a partir de la correlación de los datos de adsorción.
En todos los modelos es necesario determinar los parámetros ajustables que proporcionen el mejor ajuste a los datos medidos, usando un procedimiento de correlación de datos adecuado. En esta investigación, la correlación de datos de los resultados experimentales se obtuvieron utilizando una aproximación de regresión no lineal [2] basada en la minimización del error de los datos experimentales y los calculados con la función objetivo:
Donde qeexp es la capacidad de adsorción experimental, qecal es la capacidad de adsorción calculada y ndat es el número de datos experimentales analizados.
Para evaluar la afinidad de adsorción, el porcentaje de adsorción del metal y el coeficiente de distribución se calcularon usando las ecuaciones 7 y 8, respectivamente [12]:
Donde Cj es la concentración inicial del metal añadido (mgL−1), Ce es la concentración en el equilibrio, Kd es el coeficiente de distribución y q es la concentración de equilibrio en la fase sólida en mg kg−1.
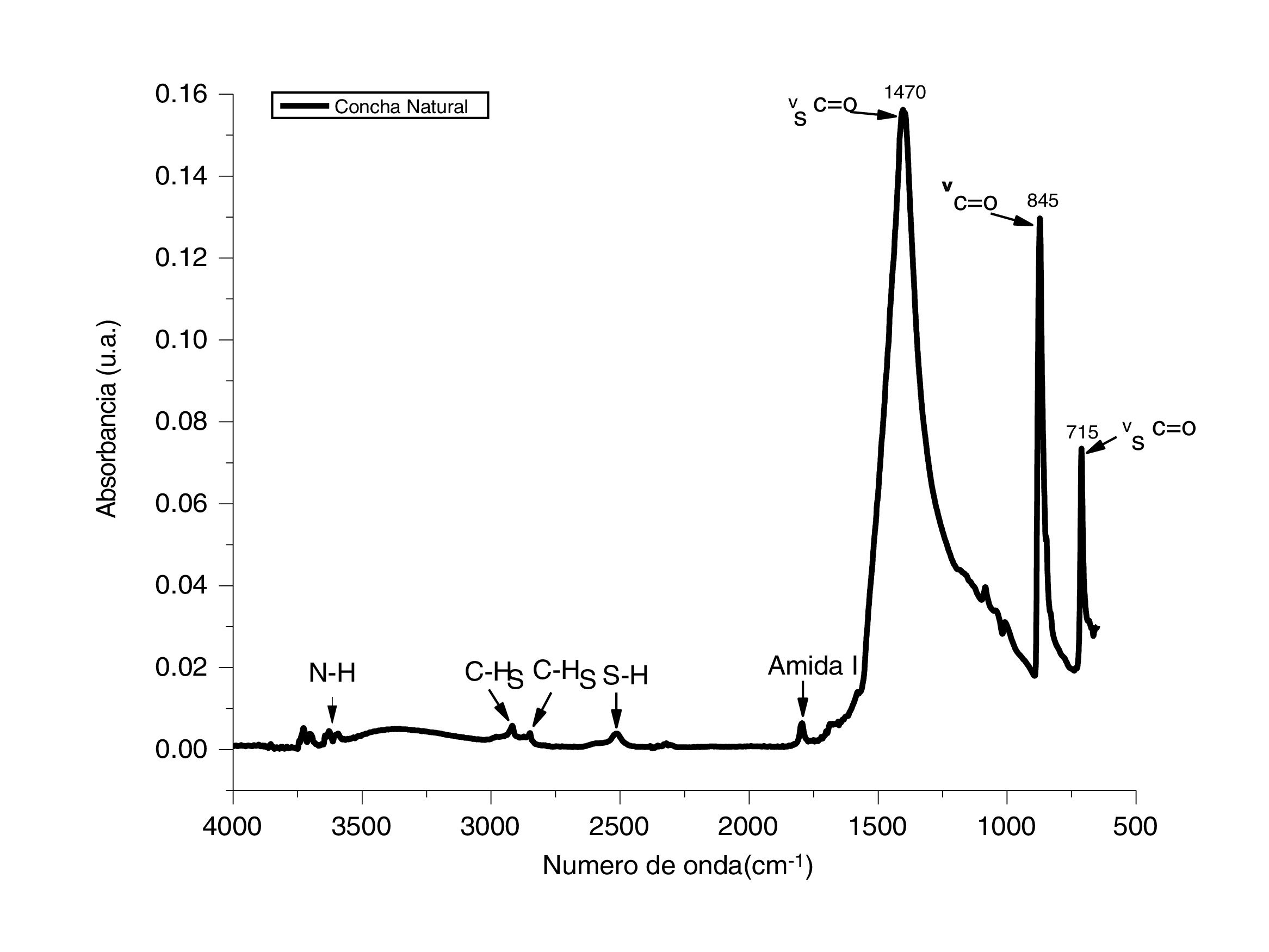
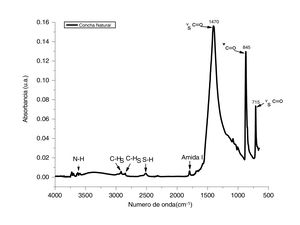
ResultadosCaracterización del adsorbente por espectroscopia infrarroja con transformada de FourierPara determinar la composición de los polvos de conchas de ostión en estado natural se utilizó la técnica de espectroscopia infrarroja con transformada de Fourier. Esta técnica permite identificar los modos vibracionales de los enlaces entre el metal y el oxígeno, en este caso el calcio. En la figura 1 se presenta el espectro de IR determinado en un rango de 4.000 a 500cm−1 en modo absorbancia; este espectro corresponde a los polvos de conchas de ostión en estado natural. Las bandas principales que se observan asociadas al grupo funcional C=O se encuentran en 1.470, 845 y 715cm−1; estas bandas están asociadas a un estiramiento simétrico de νC=O [16]. Adicionalmente se analizaron las bandas correspondientes a los grupo N-H cercanas a los 3.500cm1−, C-H entre 2.800 y 3.000cm−1, S-H en 2.500cm−1 y una amida primaria en 1.780cm−1. Estas vibraciones son atribuidas a que los compuestos, al ser de origen biogénico, presentan componentes biológicos en su composición [17]. Con este análisis se confirma que el CaCO3 es el principal componente de los desechos de conchas de ostión.
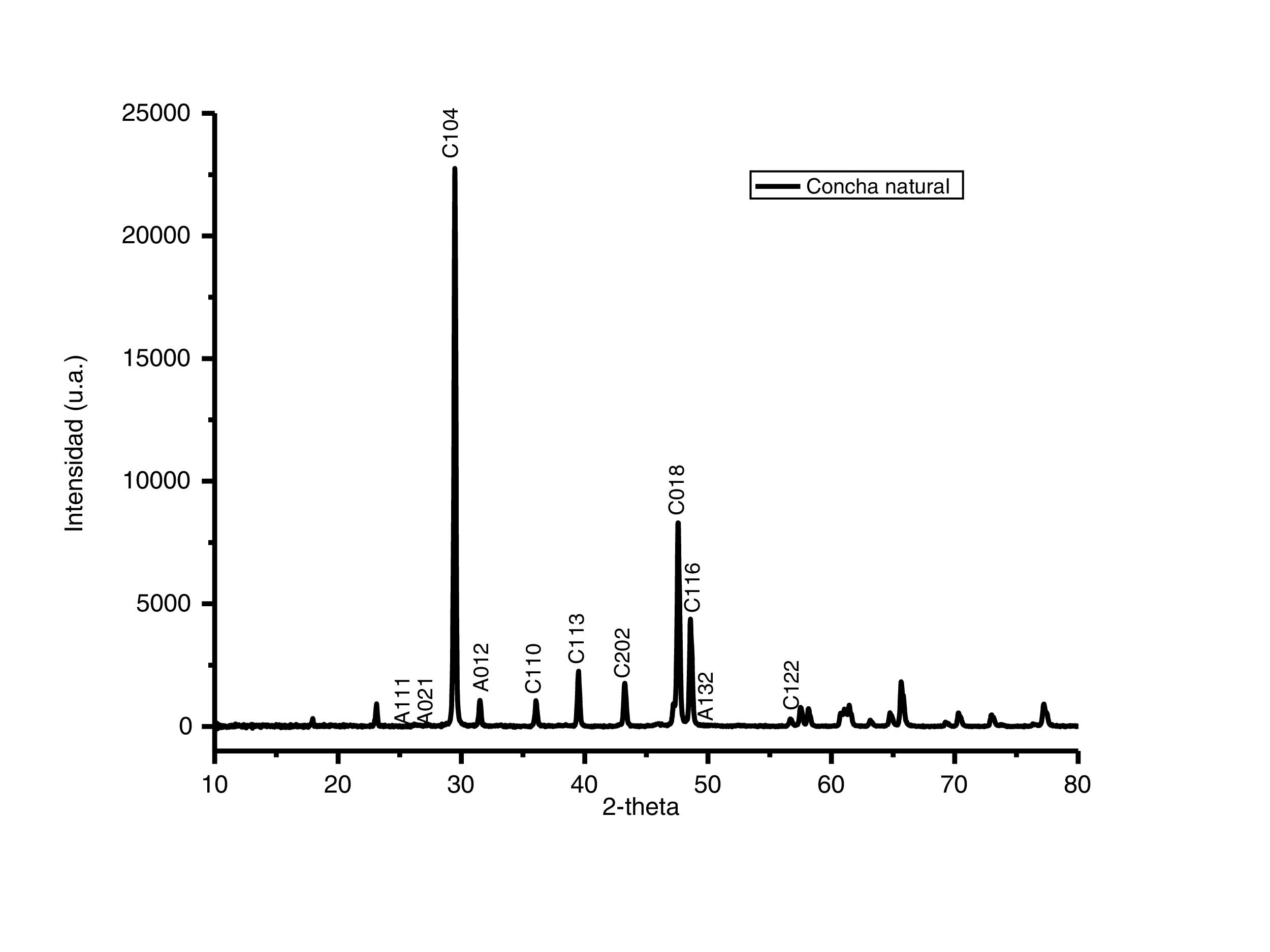
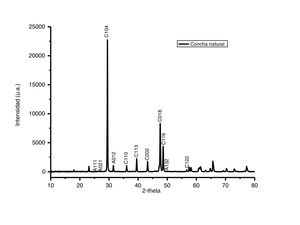
Caracterización por difracción de rayos X del adsorbentePara identificar las fases cristalinas de los polvos de conchas de ostión se empleó la técnica de difracción de rayos X. En la figura 2 se presenta el difractograma de los polvos de conchas de ostión en estado natural, medido en un rango de 10 a 80 2-theta. Analizando el patrón de difracción se observa que la muestra es altamente cristalina, y posee una gran proporción a los patrones de difracción de la calcita (CaCO3), con indización de los planos (1 0 4), (1 1 3), (2 0 2) y (0 1 8) tipo romboédrico, con señales características en 2-theta=29,34°, 39,41°, 43,16° y 47,11° (según PDF, N.o 471743, base de datos JCPDS). En adición al carbonato de calcio en forma de calcita, también está presente la aragonita, otro tipo de carbonato de calcio pero con diferente estructura cristalina. Es posible identificar los picos correspondientes de la aragonita marcados con la letra A y los picos de la calcita marcados con la letra C. El carbonato de calcio está presente en 2 estructuras cristalinas diferentes, la romboédrica de calcita [18] y la ortorrómbica de la aragonita [19].
Caracterización por microscopia electrónica de barrido y microscopia electrónica de transmisión de alta resolución del adsorbenteLos análisis de morfología se realizaron empleando las técnicas de microscopia electrónica de barrido y microscopia electrónica de transmisión de alta resolución; los primeros análisis se hicieron a escala de 1μm ×20.000. En estas micrografías es posible observar una estructura morfológica en forma de tabletas con estructura laminada. Este tipo de morfología coincide con la reportada por Rousseau et al. [20] para bivalvos de agua de mar. De acuerdo con la figura 3, se puede estimar que el espesor medio de las láminas es menor a los 100nm. Con base en el análisis de microscopia electrónica de transmisión de alta resolución se observaron tamaños de partículas individuales de hasta 200nm, las más pequeñas (fig. 4a); con una mayor magnificación se aprecia que estas partículas están formadas por dominios cristalinos (cristalitos) de tamaños menores de 10nm (fig. 4b), y con alta resolución, se identifican los patrones de franjas paralelas (fig. 4c) de la estructura cristalina de calcita en la forma romboédrica (fig. 4d).
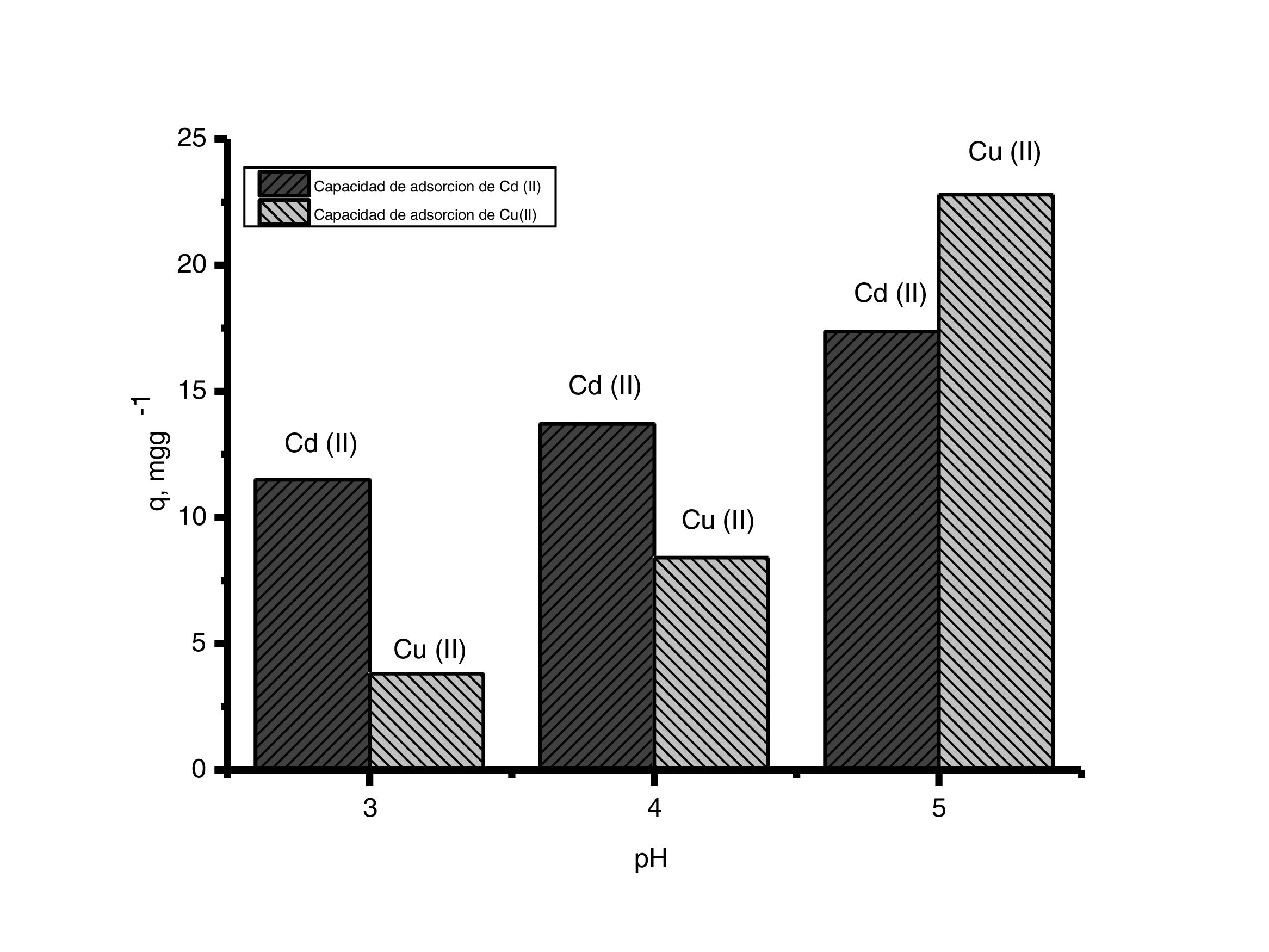
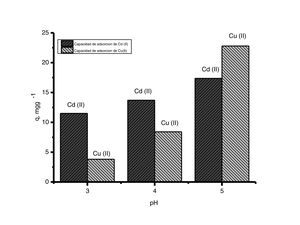
En los resultados de la evaluación del pH experimental de la figura 5 se aprecia que cuando hay una disminución en el valor de pH la capacidad de adsorción del adsorbente decrece. Esto es debido a que la concentración de protones aumenta cuando disminuye el valor de pH de la solución, compitiendo por los sitios activos del adsorbente, afectando la capacidad de adsorción de los iones de cobre (II) y cadmio (II). Cuando el adsorbente se pone en contacto con soluciones de pH menores a su valor estable (pH=7) estos se cargan positivamente; atribuido a lo anterior, las partículas de CaCO3 contenidas en los polvos de conchas de ostión tienden a atraer aniones y a repeler cationes. Estos resultados evidencian que las interacciones coulómbicas entres los iones metálicos y la superficie cargada de los polvos de conchas de ostión contribuyen a que el proceso de adsorción se lleve a cabo [2].
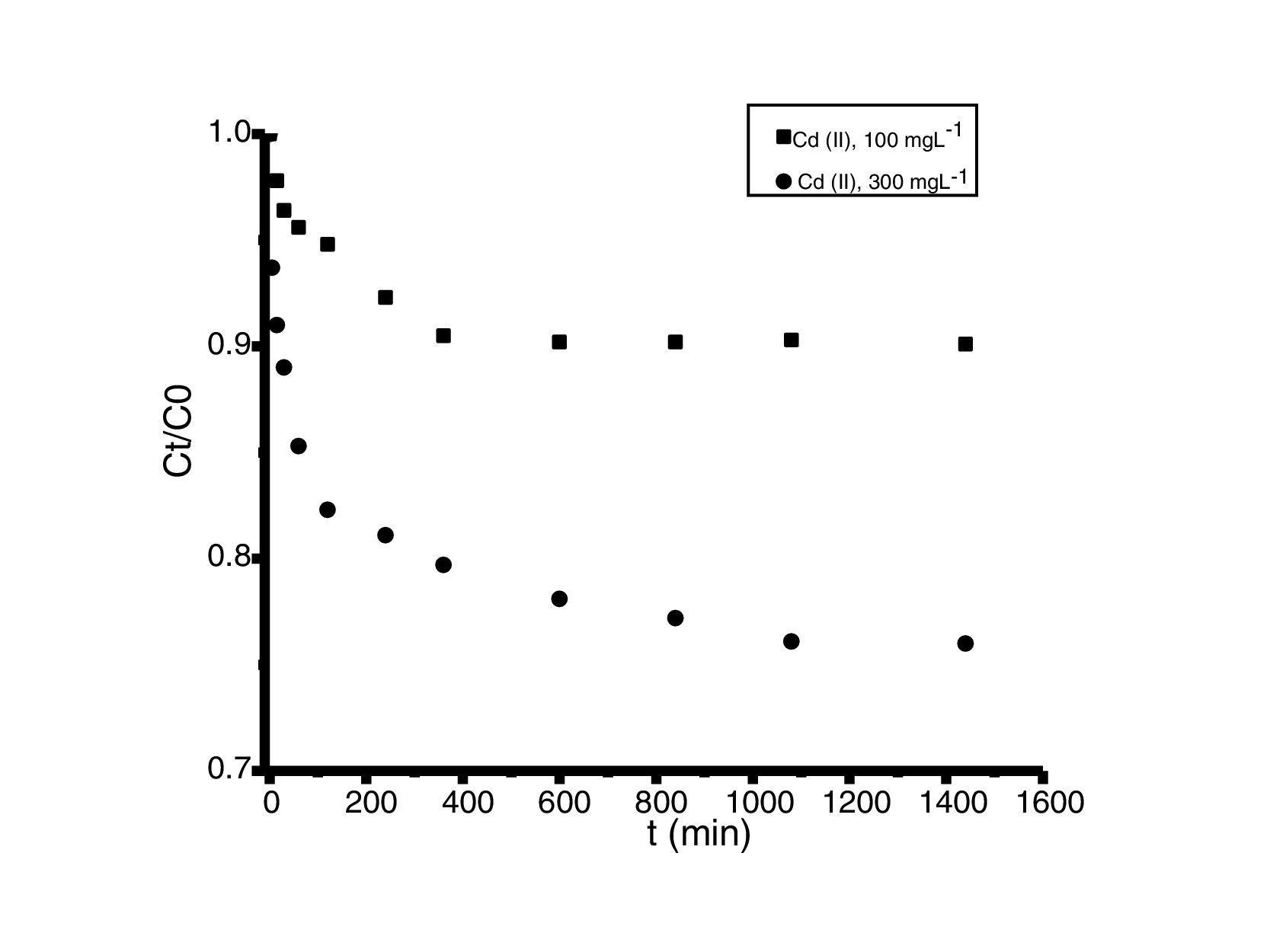
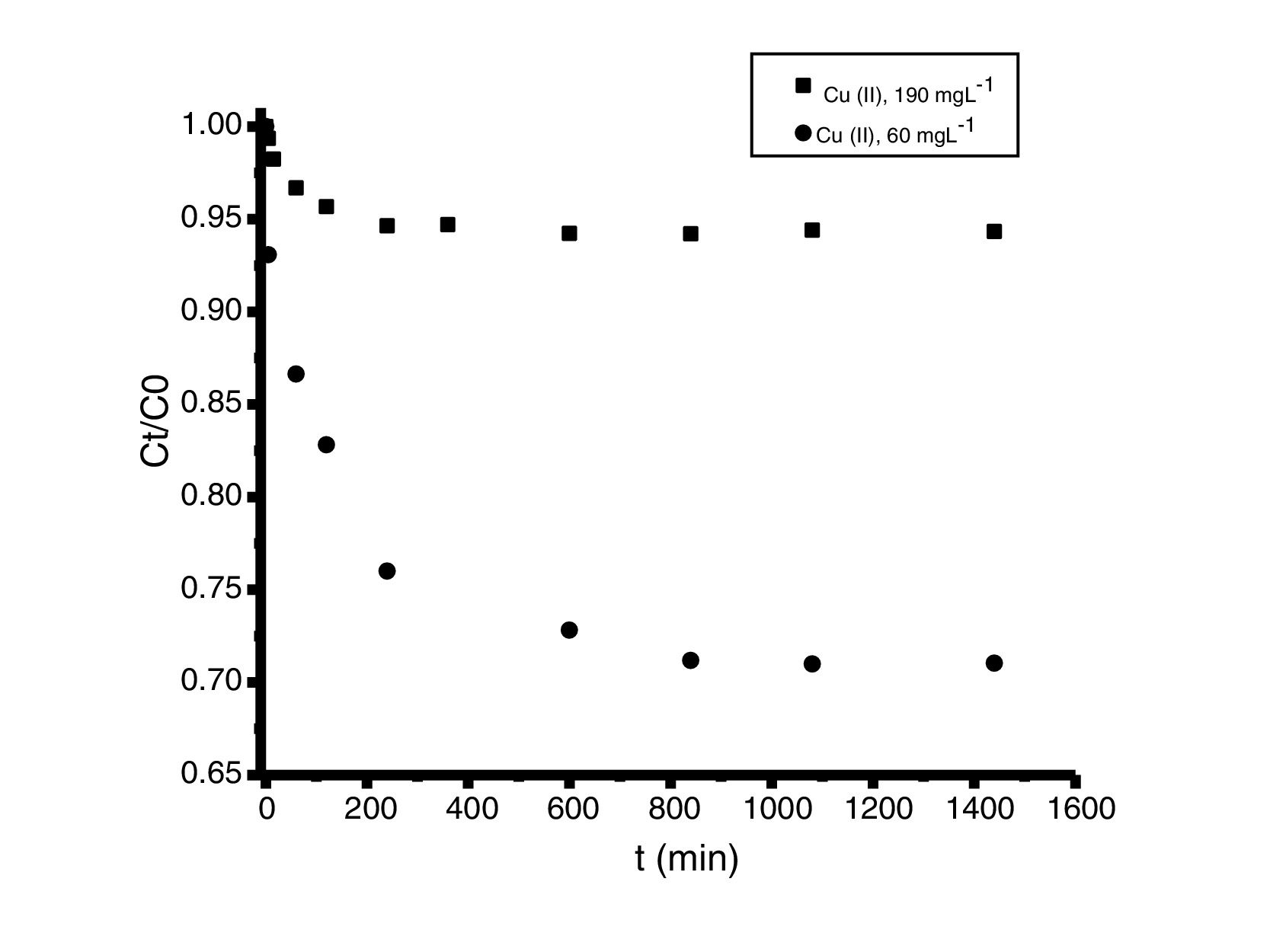
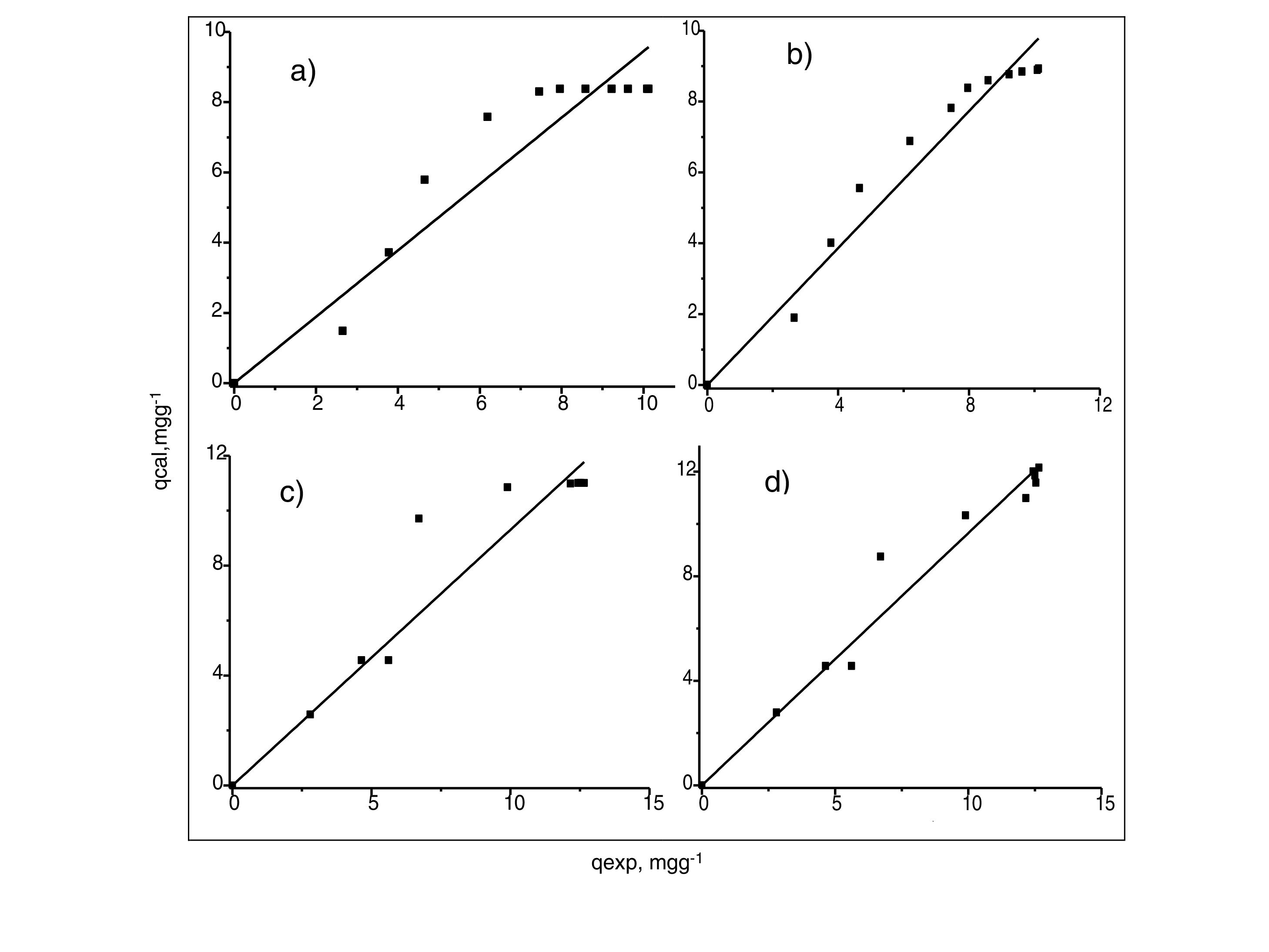
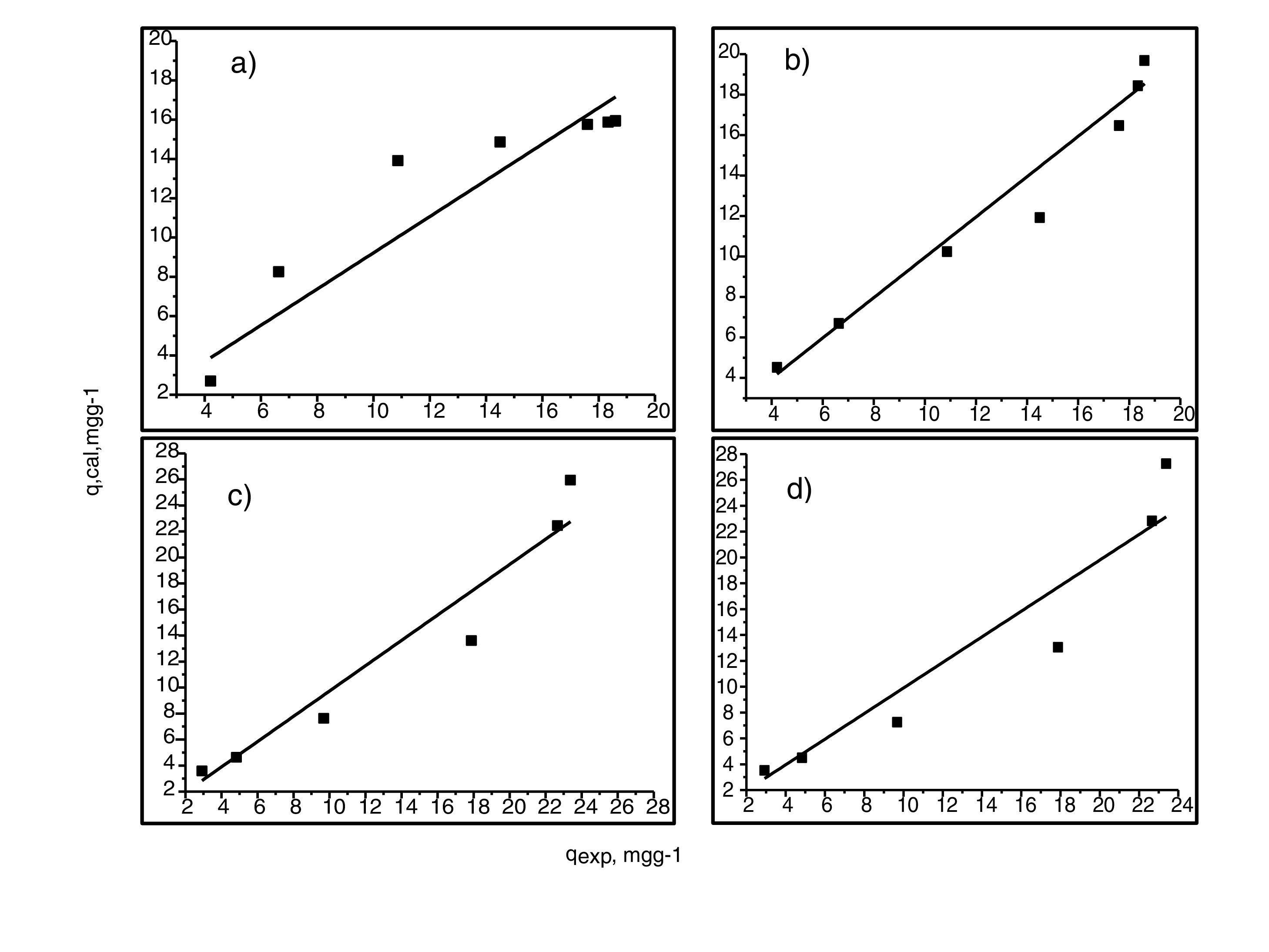
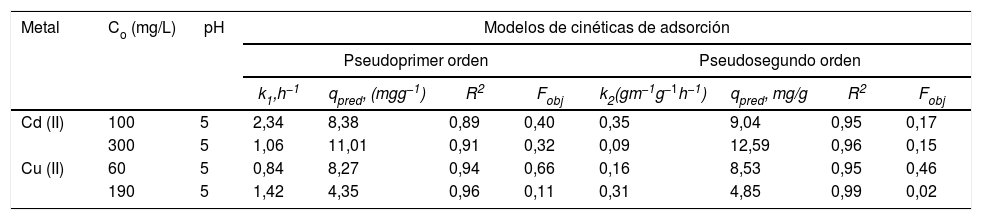
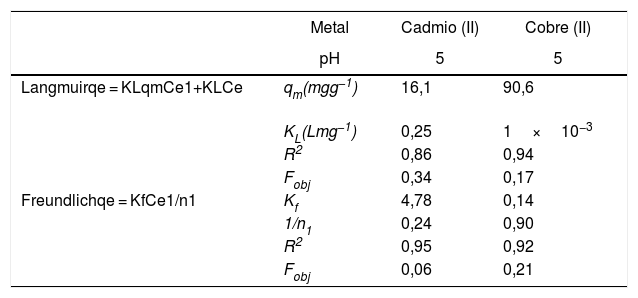
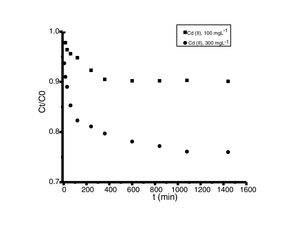
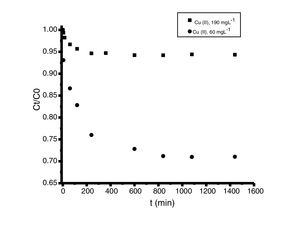
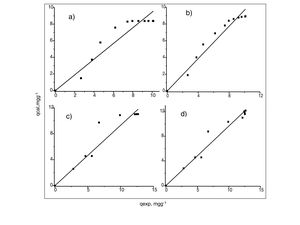
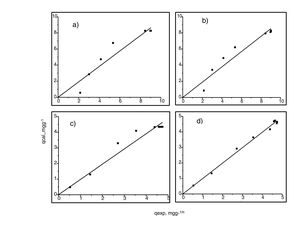
Análisis de las cinéticas de adsorción e isotermasEn general, la velocidad de reacción depende del pH de la solución y de la concentración inicial de las soluciones de los iones metálicos, por lo que al establecer las condiciones de reacción de pH 5 y las concentraciones de 100 y 300mgL−1 para cadmio (II) y de 60 y 190mgL−1 para cobre (II), en todos los casos, se observa que la velocidad de reacción (Ct/C0) ocurre en promedio entre tiempos de 600 a 840min (figs. 6 y 7); este tiempo resulta suficiente para que el adsorbente se sature y el proceso de adsorción termine. Los resultados de los datos correlacionados con estos modelos se presentan en la tabla 1, y para fines ilustrativos, en las figuras 8 y 9 se presenta el análisis de regresión lineal para los datos cinéticos obtenidos a pH 5, en donde los resultados del ajuste cinético indican que el modelo de pseudosegundo orden ofrece los mejores coeficientes de correlación para los metales probados. Específicamente, los valores de coeficientes de correlación son de 0,95 y 0,96 para cadmio (II) y de 0,95 y 0,99 para cobre (II). Las capacidades de adsorción calculadas por estos modelos son muy cercanas a las medidas en los experimentos de adsorción.
Resultados de datos correlacionados de cinéticas de adsorción de iones de cadmio (II) y cobre (II) en polvos de conchas de ostión en estado natural
| Metal | Co (mg/L) | pH | Modelos de cinéticas de adsorción | |||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Pseudoprimer orden | Pseudosegundo orden | |||||||||
| k1,h−1 | qpred, (mgg−1) | R2 | Fobj | k2(gm−1g−1h−1) | qpred, mg/g | R2 | Fobj | |||
| Cd (II) | 100 | 5 | 2,34 | 8,38 | 0,89 | 0,40 | 0,35 | 9,04 | 0,95 | 0,17 |
| 300 | 5 | 1,06 | 11,01 | 0,91 | 0,32 | 0,09 | 12,59 | 0,96 | 0,15 | |
| Cu (II) | 60 | 5 | 0,84 | 8,27 | 0,94 | 0,66 | 0,16 | 8,53 | 0,95 | 0,46 |
| 190 | 5 | 1,42 | 4,35 | 0,96 | 0,11 | 0,31 | 4,85 | 0,99 | 0,02 | |
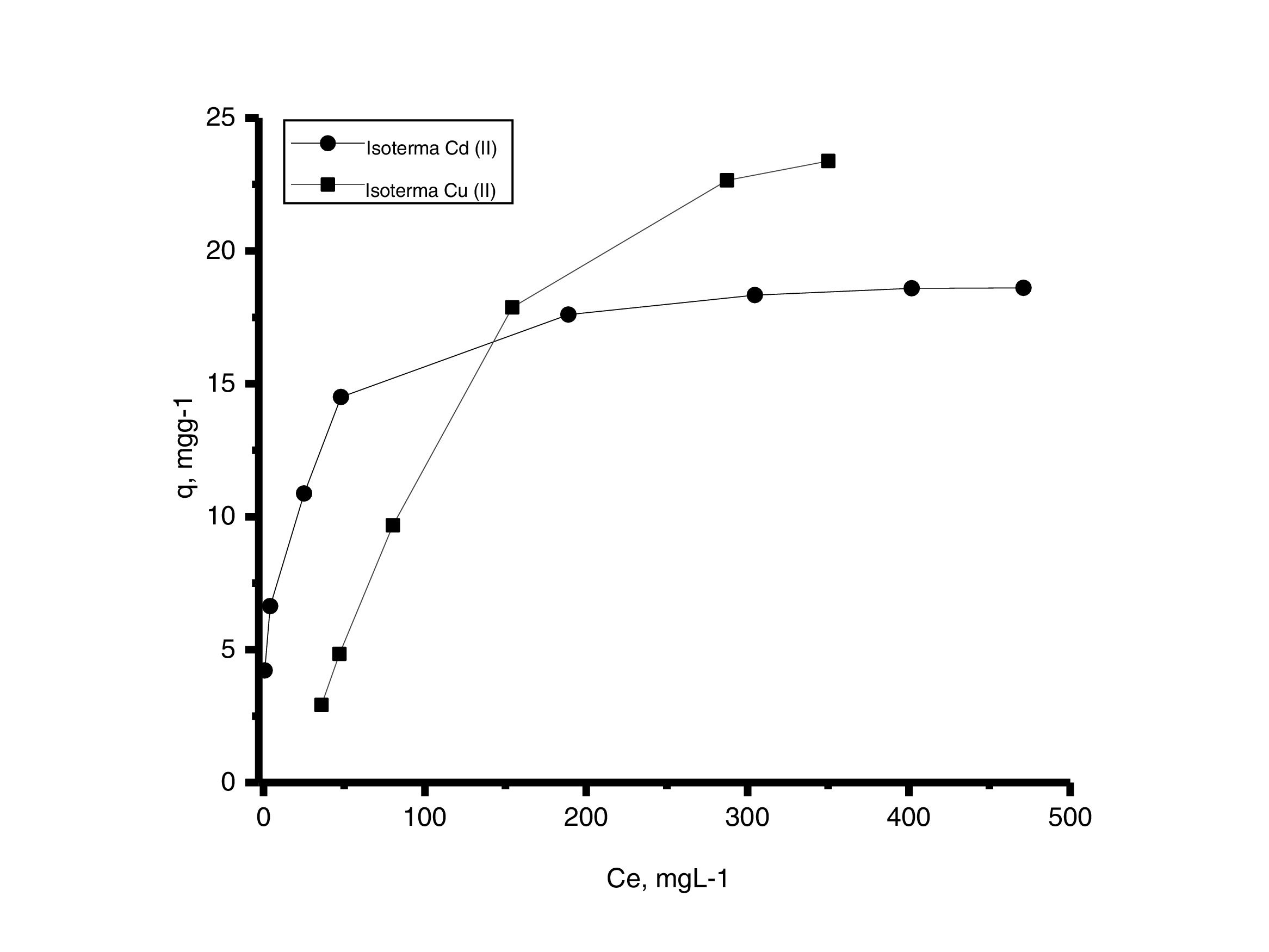
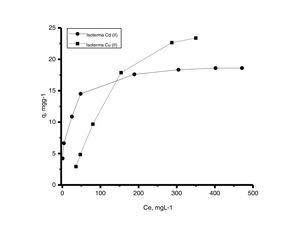
Las curvas isotérmicas de equilibrio presentadas en la figura 10 se graficaron con los datos de concentración en el equilibrio obtenidos por mediciones de absorción atómica en mgL−1 frente a los datos de la capacidad de adsorción calculada en mgg−1. Los resultados indican que las 2 curvas muestran un comportamiento no lineal y están en concordancia con Msaky y Calvet, quienes en 1990 señalaron que la forma de las isotermas de adsorción depende de factores como el pH y la concentración inicial de las soluciones, y que no siempre es lineal [21].
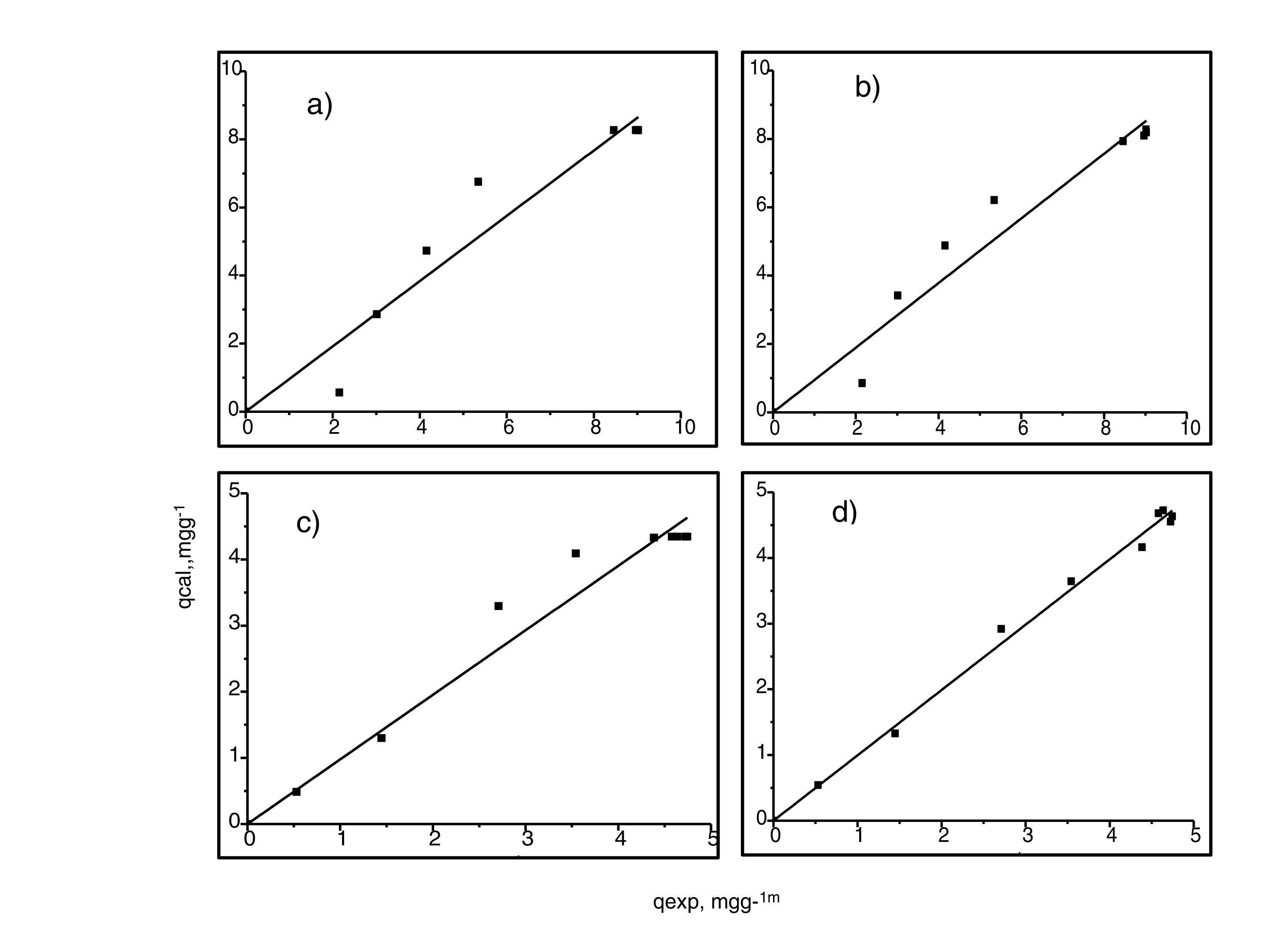
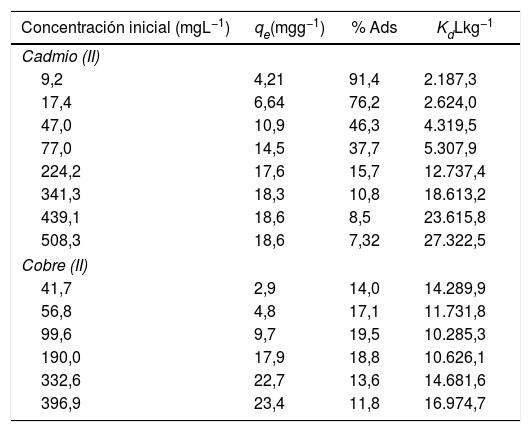
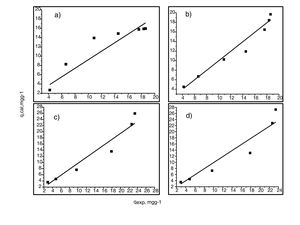
Generalmente, se pueden describir 4 tipos de isotermas de adsorción: S, H, L y C. La isoterma tipo S es un indicador de baja afinidad de adsorción a concentraciones bajas y que aumenta al incrementarse la concentración, mientras que una isoterma tipo L indica una alta afinidad de adsorción a bajas concentraciones, que luego disminuye cuando la concentración aumenta. La isoterma tipo H muestra una alta adsorción como resultado de la fuerte interacción adsorbato-adsorbente. La isoterma tipo C explica un mecanismo de partición cuando no hay unión entre al adsorbato y el adsorbente. En el presente estudio las isotermas de adsorción para ambos metales se pueden describir como isotermas de tipo H (alta afinidad de adsorción) [22]. Las capacidades de adsorción de los iones de cadmio (II) y cobre (II) fueron analizadas con los modelos de isotermas de Langmuir y Freundlich. Estos modelos de isotermas fueron utilizados porque son los más comunes para la interpretación de los datos de equilibrio [23]. Los parámetros obtenidos de los modelos se presentan en la tabla 2, y para fines ilustrativos, en la figura 11 se muestra el análisis de regresión lineal para los datos de isotermas obtenidos a un pH de 5. Estos resultados del ajuste de los modelos indican que el modelo de isoterma de Freundlich ofrece el mejor coeficiente de correlación para cadmio (II) (fig. 11b), específicamente 0,95, y el modelo de Langmuir se ajusta mejor para los datos de isotermas de Cu (II) (fig. 11c), con un valor de 0,94. Los resultados de la tabla 2 muestran los valores para la función objetivo; para el caso del cadmio (II), el valor para el ajuste del modelo de Langmuir es de 0,34 y para el caso de Freundlich, de 0,06, por lo que se cree que el modelo que más se ajusta a los datos experimentales es el de Freundlich; contrario a esto, para el caso del cobre (II) los valores de la función objetivo muestran que para el modelo de Langmuir este valor es de 0,17 y para el caso del modelo de Freundlich el valor es de 0,21, por lo que el modelo de isoterma de Langmuir sería el que mejor se correlaciona con los datos experimentales.
Resultados de los modelos de isotermas de adsorción de la remoción de iones de cadmio (II) y cobre (II) en polvos de conchas de ostión sin tratamientos
| Metal | Cadmio (II) | Cobre (II) | |
|---|---|---|---|
| pH | 5 | 5 | |
| Langmuirqe = KLqmCe1+KLCe | qm(mgg−1) | 16,1 | 90,6 |
| KL(Lmg−1) | 0,25 | 1×10−3 | |
| R2 | 0,86 | 0,94 | |
| Fobj | 0,34 | 0,17 | |
| Freundlichqe = KfCe1/n1 | Kf | 4,78 | 0,14 |
| 1/n1 | 0,24 | 0,90 | |
| R2 | 0,95 | 0,92 | |
| Fobj | 0,06 | 0,21 |
La eficiencia de la adsorción de los metales pesados en sólidos depende de varios mecanismos, entre los que se incluyen el intercambio iónico, la quimisorción, la complejación y la superficie de interacción [12]. Los resultados de los porcentajes de remoción de los metales pesados por los polvos de conchas de ostión se muestran en la tabla 3. Revelaron que para el caso del cadmio (II) casi todo el metal se removió cuando la concentración era baja. Sin embargo, esta eficiencia fue disminuyendo conforme aumentó la concentración inicial del cadmio (II) de 91,4 a 7,32%, y para el caso del cobre (II), se obtuvieron valores de porcentaje de remoción de 19,5% como máximo y de 11,8% como mínimo. Debido a que durante la reacción de intercambio iónico se producen cambios en los valores de pH, hay un aumento en la carga superficial del material, originando un incremento en las interacciones intermoleculares y dando paso a que ocurra la adsorción [24]. Con base en los resultados obtenidos, el porcentaje de adsorción de los metales estuvo influido por la carga superficial, que se define como la cantidad de metal añadido por unidad de masa de adsorbente. Independientemente del tipo de metal pesado de que se trate, el porcentaje del metal adsorbido disminuye con el aumento de la carga superficial y estos resultados demuestran que la eliminación de cadmio (II) y cobre (II) de las suspensiones es altamente dependiente de la concentración. Los resultados de esta investigación coinciden con los reportados por Saha et al. [25] y Ahmad et al. [12], quienes explicaron que la adsorción de los metales solo tiene lugar en los sitios específicos del adsorbente, y que con el aumento de la concentración inicial los sitios de fijación del adsorbente resultan insuficientes, por lo que existe una reducción en la capacidad de adsorción del metal. Papadopoulos y Rowell [26] explicaron que la adsorción de estos iones metálicos se debe a un intercambio entre el calcio y el metal. De igual manera, Yavuz et al. [27] propusieron las siguientes reacciones:CaCO3 + Cd II→CdCO3 + Ca IICaCO3 + Cu II→CuCO3 + Ca II
Datos del porcentaje de adsorción y el coeficiente de distribución para cada concentración de metal añadido sobre los polvos de conchas de ostión en estado natural
| Concentración inicial (mgL−1) | qe(mgg−1) | % Ads | KdLkg−1 |
|---|---|---|---|
| Cadmio (II) | |||
| 9,2 | 4,21 | 91,4 | 2.187,3 |
| 17,4 | 6,64 | 76,2 | 2.624,0 |
| 47,0 | 10,9 | 46,3 | 4.319,5 |
| 77,0 | 14,5 | 37,7 | 5.307,9 |
| 224,2 | 17,6 | 15,7 | 12.737,4 |
| 341,3 | 18,3 | 10,8 | 18.613,2 |
| 439,1 | 18,6 | 8,5 | 23.615,8 |
| 508,3 | 18,6 | 7,32 | 27.322,5 |
| Cobre (II) | |||
| 41,7 | 2,9 | 14,0 | 14.289,9 |
| 56,8 | 4,8 | 17,1 | 11.731,8 |
| 99,6 | 9,7 | 19,5 | 10.285,3 |
| 190,0 | 17,9 | 18,8 | 10.626,1 |
| 332,6 | 22,7 | 13,6 | 14.681,6 |
| 396,9 | 23,4 | 11,8 | 16.974,7 |
Se calcularon los valores del coeficiente de distribución, el cual representa un índice útil para comparar la capacidad de adsorción de diferentes materiales para un ion en particular bajo las mismas condiciones experimentales [28]. Se define como la relación de la concentración del metal en la fase sólida y la concentración de la solución en el equilibrio después de un tiempo de reacción especificado [29]. Un valor alto de Kd indica una alta retención del metal en la fase sólida a través de la adsorción y la reacción química. Por el contrario, un valor bajo de Kd indica que una gran cantidad del metal se quedó en la solución [12].
Basándose en los valores del coeficiente de distribución Kd y el porcentaje de adsorción del metal, la secuencia de selectividad del metal adsorbido sobre los polvos de conchas de ostión es cadmio (II) > cobre (II). Esta mayor afinidad del cadmio (II) puede ser explicada por su gran radio iónico (0,09) en comparación con el cobre (II) (0,07). Muchos estudios sobre la adsorción de metales pesados coinciden con esta selectividad por las siguientes razones: a) mayor radio iónico y, como consecuencia, menor hidratación; b) mayor masa atómica, y c) mayor hidrólisis [28].
ConclusionesEn esta investigación se emplearon residuos de conchas de ostión para la obtención de CaCO3 y evaluar su aplicación como un adsorbente de origen biogénico de bajo costo en la eliminación de iones metálicos de cadmio (II) y cobre (II) en suspensiones acuosas. Mediante el análisis de los resultados de caracterización se demostró que el carbonato de calcio en forma de calcita y aragonita es el principal componente de los residuos de conchas en estado natural. Los ajustes de los modelos de isotermas de adsorción de Langmuir y Freundlich evidencian que la adsorción se da por el intercambio iónico del calcio y los iones de cadmio (II) y cobre (II). Los resultados experimentales obtenidos en este estudio revelan que es posible la reutilización de los desechos de conchas de ostión en estado natural sometidos únicamente a procesos de molienda para tratamientos de adsorción de iones metálicos, haciéndolo un material biogénico con una aplicación ecológicamente útil para la gestión y el cuidado del medio ambiente.