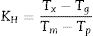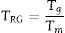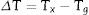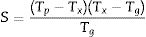En este trabajo se estudió la influencia de la composición química y del tratamiento térmico en la cristalización de biovidrios del sistema 31SiO2-11P2O5-(58-X) CaO –X MgO (X=0, 2, 7, 16 y 32). El tratamiento térmico se realizó a 900, 1.000, 1.100 y 1.200°C por un periodo de una hora. Posterior a este proceso las muestras se caracterizaron mediante análisis de difracción de rayos X, espectroscopia infrarroja por transformada de Fourier y análisis térmico diferencial, encontrando que al incrementar el contenido de MgO se inhibe la formación de la fase cristalina hidroxiapatita y se promueve la formación de la fase cristalina whitlockita.
In this work, the influence of chemical composition and thermal treatment on the crystallization of bioglasses of the 31SiO2-11P2O5- (58-X) CaO -X MgO system was studied. (X=0, 2, 7, 16 and 32). The heat treatment was carried out at 900, 1000, 1100 and 1200°C for a period of one hour. After this process, the samples were characterized by X-ray diffraction analysis, Fourier transform infrared spectroscopy,and differential thermal analysis finding that increasing the MgO content inhibits the formation of the Hydroxyapatite crystalline phase and promotes the formation of the Whitlockite crystalline phase.
El vidrio bioactivo 45S5 fue desarrollado por Hench en 1971 al fundir una mezcla de óxidos en las siguientes proporciones: 45% SiO2, 24,5% Na2O, 24,5% CaO y 6% P2O5 (porcentaje en peso). Su nombre es debido al contenido de SiO2 (45% en peso) y a la relación molar Ca/P (5% en peso). Este material es el más usado en aplicaciones clínicas [1–4]. Es bien conocido que algunas partes del cuerpo humano, tales como el esmalte y la dentina, contienen 0,44% y 1,23% en peso de magnesio (Mg), respectivamente. La presencia de Mg está asociada con la mineralización e influye indirectamente en el metabolismo mineral, siendo uno de los principales sustitutos del calcio en la apatita biológica. Vale la pena resaltar que el hueso contiene 0,72% en peso de Mg, por lo tanto se espera que la hidroxiapatita con Mg tenga una excelente biocompatibilidad y propiedades biológicas mejoradas con respecto a la que no contiene este elemento químico. Saboori et al. [5] sugirieron que el Mg estimula directamente la proliferación de osteoblastos, con un efecto comparable al de la insulina (un conocido factor de crecimiento para los osteoblastos). Además, Kansal et al. [6] plantearon que el Mg activa la fagocitosis y regula el transporte de calcio activo. Ma et al [7] y Goel et al. [8] han mostrado que los materiales con hidroxiapatita sustituida con magnesio tienen una excelente biocompatibilidad y muestran una gran osteoconductividad en el tiempo y una mayor reabsorción del material. Además, los vidrios bioactivos libres de álcali con alta bioactividad tienen una menor disolución y un buen comportamiento en la sinterización en comparación con el vidrio bioactivo 45S5.
Kokubo [9] desarrolló una vitrocerámica (GC) de acuerdo con los principios de cristalización superficial controlada de vidrios en polvo, la cual presentó la presencia de fases apatita-wollastonita con la siguiente composición química: 34% SiO2-4,6% MgO-44,7% CaO-16% P2O5 (porcentaje en peso). Para su obtención el vidrio en polvo fue totalmente densificado a una temperatura de 830°C y las fases oxifluorapatita y wollastonita precipitaron durante un tratamiento térmico entre 870 y 900°C. La vitrocerámica obtenida estaba libre de poros, pero presentaba agrietamiento. Los cristales fueron distribuidos homogéneamente en la matriz vítrea y tenían un tamaño aproximado entre 50-100nm. De acuerdo con los resultados de difracción de rayos X, este material alcanzó una cristalización de aproximadamente un 38% de apatita y un 24% de wollastonita. La matriz vítrea residual fue de aproximadamente un 38% (porcentaje en peso). Las vitrocerámicas con este tipo de estructura presentan una resistencia a la flexión de 215MPa, una resistencia a la compresión de 1.080MPa y una tenacidad a la fractura de 2MPa (m)0,5. Claramente las vitrocerámicas tienen mejores propiedades mecánicas que el vidrio puro siendo, por lo tanto, más adecuadas para implantes sometidos a carga. Numerosos ensayos clínicos han mostrado intercrecimiento entre la vitrocerámica y el hueso humano. Estas vitrocerámicas (GC) han sido usadas como prótesis vertebrales y para restauración de la cresta iliaca [9]. Los vidrios A.GC son ricos en apatita (A) y los vidrios A-W-CP.GC son ricos en apatita (A), wollastonita (W) y fosfato de tricalcio. En contacto con fluido fisiológico simulado estos materiales desarrollaron una capa de hidroxicarbonato de apatita con características y composiciones químicas similares a los desarrollados por la superficie de los vidrios bioactivos. También el vidrio A-W.G forma capas ricas en sílice y fosfato de calcio en la interfaz con el tejido óseo 2 días después de su implantación [10]. Las fases apatita y wollastonita en estos sistemas pueden ser producidas por la sinterización y posterior cristalización de los polvos [11]. Los cambios en la microestructura, propiedades químicas y mecánicas de los vidrios favorecidos por los cambios en la composición, el método de preparación y los diferentes tratamientos térmicos aplicados posibilitan su uso en diferentes aplicaciones biomédicas. La apatita y la wollastonita tienen diferentes mecanismos de cristalización; la apatita se precipita en escala en volumen debido al mecanismo de cristalización tridimensional, mientras que la wollastonita precipita preferencialmente a partir de la superficie libre, a través de un mecanismo de cristalización bidimensional. Una característica de este crecimiento de los cristales es su orientación vertical hacia la superficie. Esta naturaleza lleva a un efecto de cristalización único sobre las vitrocerámicas A/W, sin la utilización de aditivos o tratamientos superficiales. Los procesos de cristalización en la superficie afectan de manera diferente las propiedades del material en el interior y en la superficie [12]. En este trabajo se estudió la influencia del tratamiento térmico, el tamaño de partícula y la concentración del MgO en el comportamiento térmico y en la cristalización de los vidrios bioactivos del sistema SiO2-P2O5-CaO-MgO.
Materiales y métodosEn este trabajo se utilizaron vidrios del sistema 31SiO2-11P2O5-(58-X) CaO–XMgO (X=0, 2, 7, 16 y 32 molar), los cuales se prepararon por el método convencional de fusión utilizando reactivos grado analítico marca Alfa Aesar. El óxido de silicio (SiO2), óxido de calcio (CaO), óxido de magnesio (MgO) y óxido de fósforo (P2O5) se mezclaron en cantidades apropiadas y se fundieron en un crisol de platino en un horno eléctrico a 1.600°C durante 3horas a una velocidad de calentamiento de 9°C/min. El material fundido se vació directamente en un recipiente con agua a temperatura ambiente con el fin de vitrificar el líquido fundido.
En cuanto a las distribuciones granulométricas se trabajaron 2 distribuciones, una de ellas codificada como D1, con tamaño de partícula inferior a 1.213μm, obtenidas después del proceso de enfriamiento, y otra codificada como D2, la cual fue sometida a un proceso de molienda en un molino centrífugo de ZrO2 marca Restch S100, con el fin de obtener un tamaño de partícula inferior a 100μm. Posteriormente se realizaron tratamientos térmicos a la muestra D1 a 900°C, 1.000°C, 1.100°C y 1.200°C y a la muestra D2 a 1.100°C, con el fin de comparar el efecto del tamaño de las partículas sobre las fases presentes a esa temperatura. El tiempo de sostenimiento a la temperatura de calentamiento fue de 1hora, la velocidad de calentamiento fue de 4°C/min y con enfriamiento en el horno para obtener las fases apatita y wollastonita.
La composición química de todas las muestras fue determinada mediante fluorescencia de rayos X utilizando un espectrómetro ARL OPTIM’X de ThermoScientific. La distribución granulométrica de los polvos se midió mediante tamizado para los polvos codificados como D1 y difracción láser en un equipo Máster Sizer 2000 para los polvos codificados como D2. Los espectros Raman de los diferentes biovidrios en estado amorfo, y con un tamaño de partícula entre 3 y 8μm, fueron registrados mediante un espectrómetro Raman confocal marca Horiba Jobin Yvon, modelo Labram HR de alta resolución, usando un láser de diodo de 785nm, operando a 80mW para la excitación. Los espectros de infrarrojos de las muestras de vidrio bioactivo, tanto de los polvos como de los recubrimientos, se obtuvieron en el rango de 3.000-400cm-1 en un equipo Perkin-Elmer Spectrum One (FT-IR). Las fases contenidas en los polvos fueron analizadas mediante difracción de rayos X utilizando un difractómetro marca Rigaku Miniflex, con una fuente de radiación de cobre (CuKα, λ=1,5418Å), operado a 40kV y 30mA. Los picos detectados en el ángulo 2θ, comprendido entre 5° y 70°, fueron analizados utilizando el software X’PertHighScore.
Las temperaturas asociadas con las transiciones particulares que ocurren durante el calentamiento de los vidrios fueron determinadas mediante un análisis térmico diferencial (DTA), a una velocidad de calentamiento de 4°C/min, hasta alcanzar una temperatura de 1.500°C. Este ensayo fue realizado en un equipo Linseys STA PT 1600. Durante el análisis se varía linealmente la temperatura como función del tiempo y se mide la diferencia de temperatura entre la muestra de vidrio y una de referencia inerte. La temperatura de transición vítrea, Tg, representa la temperatura a la cual se inicia el movimiento entre las cadenas y átomos que conforman el material, y da una idea del grado de reticulación que tienen los vidrios estudiados, y por lo tanto, del grado de rigidez de los mismos [13]; además, se puede asociar con la solubilidad y degradación del vidrio, cristalización y propiedades mecánicas [14]. Cuando la estructura del vidrio se vuelve más rígida se manifiesta con el incremento de Tg [15].
Cálculo del parámetro de Hruby. Hruby [16] propuso un parámetro, KH, obtenido de los datos arrojados por el DTA; este mide la estabilidad contra la cristalización en el calentamiento de los vidrios. El parámetro de Hubry es definido por la (ecuación 1).
Donde Tg es la temperatura de transición vítrea, Tx es la temperatura de inicio de la cristalización, Tp es la temperatura de los picos exotérmicos y Tm es la temperatura de fusión. Según Hruby el valor más grande de KH en una serie de vidrios indica una mayor estabilidad contra la cristalización en el calentamiento [16–18]. Otro parámetro utilizado para reflejar la habilidad relativa para formar cristales de los vidrios es la temperatura de transición vítrea reducida TRG[18] (ecuación 2).
Parámetro de estabilidad térmica. Un parámetro usualmente empleado para estimar la estabilidad de los vidrios es la estabilidad térmica (ΔT), la cual está definida por la (ecuación 3).
Una gran diferencia entre Tx y Tg indica una mayor estabilidad térmica de los vidrios. Saad y Poulain [19] obtuvieron otro criterio, el parámetro de estabilidad térmica (S) (ecuación 4). Este parámetro refleja la resistencia a la desvitrificación después de la formación del vidrio. En la ecuación 4 (Tp-Tx) está relacionado con la velocidad de desvitrificación de las fases cristalinas. Por otro lado, altos valores de (Tx-Tg) retrasan el proceso de nucleación.
Resultados y discusiónCaracterización química y distribución granulométrica de los polvos de biovidrioEn la tabla 1 se muestra la composición química de los polvos de biovidrio expresada en porcentaje en peso, los cuales presentaron una distribución granulométrica correspondiente a la fracción D1 con una distribución de tamaño entre D10=780μm y D90=1213μm, mientras que en las codificadas como D2 la distribución esta entre D10=44μm y D90=96μm.
Composición de los vidrios
| Referencia | Formulación Porcentaje molar | *SiO2 | *CaO | *MgO | *P2O5 | Relación molar MgO/CaO | Relación molar MgO/SiO2 | Relación molar CaO/SiO2 |
|---|---|---|---|---|---|---|---|---|
| M1 | 31SiO2-11P2O5-58CaO | 25,,13 | 52,,04 | 0 | 20,,080 | 0 | 0 | 1,,870 |
| M2 | 31SiO2-11P2O5-56CaO-2MgO | 28,,79 | 44,,76 | 1,,35 | 24,,47 | 0,,036 | 0,,064 | 1,,806 |
| M3 | 31SiO2-11P2O5-51CaO-7MgO | 30,,99 | 42,,82 | 3,,08 | 23,,11 | 0,,137 | 0,,225 | 1,,645 |
| M4 | 31SiO2-11P2O5-42CaO-16MgO | 29,,98 | 34,,80 | 10,,29 | 24,,47 | 0,,381 | 0,,516 | 1,,355 |
| M5 | 31SiO2-11P2O5-26CaO-32MgO | 28,,92 | 21,,00 | 20,,39 | 29,,29 | 1,,231 | 1,,097 | 0,,839 |
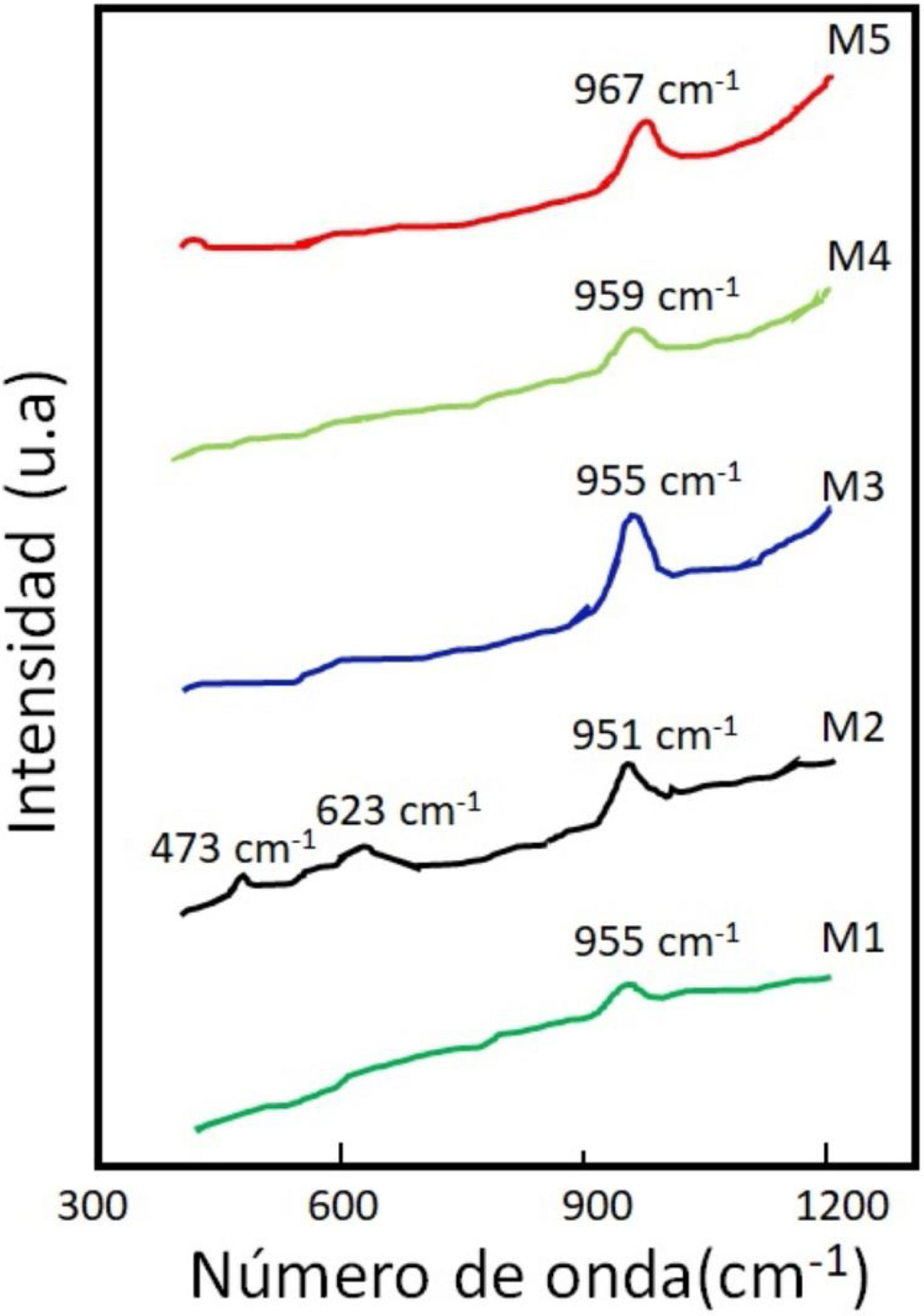
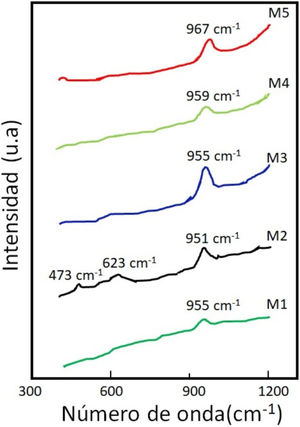
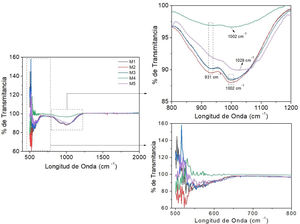
En la figura 1 se encuentran los espectros Raman correspondientes a cada uno de los vidrios en estudio. Se puede observar que los vidrios M1, M2, M3 y M4 tienen la presencia de una banda entre los 950 y los 960cm-1 correspondiente al estiramiento simétrico de los enlaces P-O de los ortofosfato (PO4-1), pertenecientes al fosfato de calcio amorfo o grupos Q0[13,20]. En estos vidrios el fósforo siempre está presente en una estructura de ortofosfato y en consecuencia se cristalizará como tal [21]. La muestra M2 tiene una banda en 473cm-1, esta banda es asignada al movimiento de doblamiento (bending motions) y vibraciones en silicatos de Ca, Mg-O (400-600cm-1) [21]. La banda en 623cm-1 pertenece al modo de oscilación del enlace Si-O-Si [22]. La muestra M5 presenta una banda entre 960 y 970cm-1, la cual puede ser atribuida al enlace Si-O- de la unidad estructural SiO2[3–21]. Dependiendo de la composición molar del óxido metálico, xM2O(1-x)P2O5 presente en la composición del vidrio, podemos obtener principalmente 3 tipos de vidrios, los de ultrafosfato, los de metafosfato y los de pirofosfato. En este caso, los biovidrios son de pirofosfato, también conocidos como vidrios inversos, que corresponden a aquellos vidrios con un contenido en P2O5 inferior al 30% molar y, por lo tanto, con un alto porcentaje de óxidos modificadores de red. Estos vidrios tienden a cristalizar espontáneamente en sistemas simples, por lo que este tipo de vidrios generalmente es elaborado dentro de sistemas bastante complejos, con la adición de óxidos metálicos como el MgO. La estructura de este tipo de vidrios consiste únicamente en grupos Q1 y Q0, es decir, están compuestos por unidades P2O7 y PO4.
Los vidrios de pirofosfato se caracterizan por poseer una elevada estabilidad química, además, este tipo de estructura permite elaborar vidrios con una relación Ca/P muy cercana a la de la fase mineral del hueso, lo cual es muy interesante en el caso de las aplicaciones biomédicas, ya que implica la obtención de vidrios bioactivos. Esta última propiedad abre nuevas perspectivas, tanto en el campo de la cirugía ortopédica como en el de la ingeniería de tejidos[13].
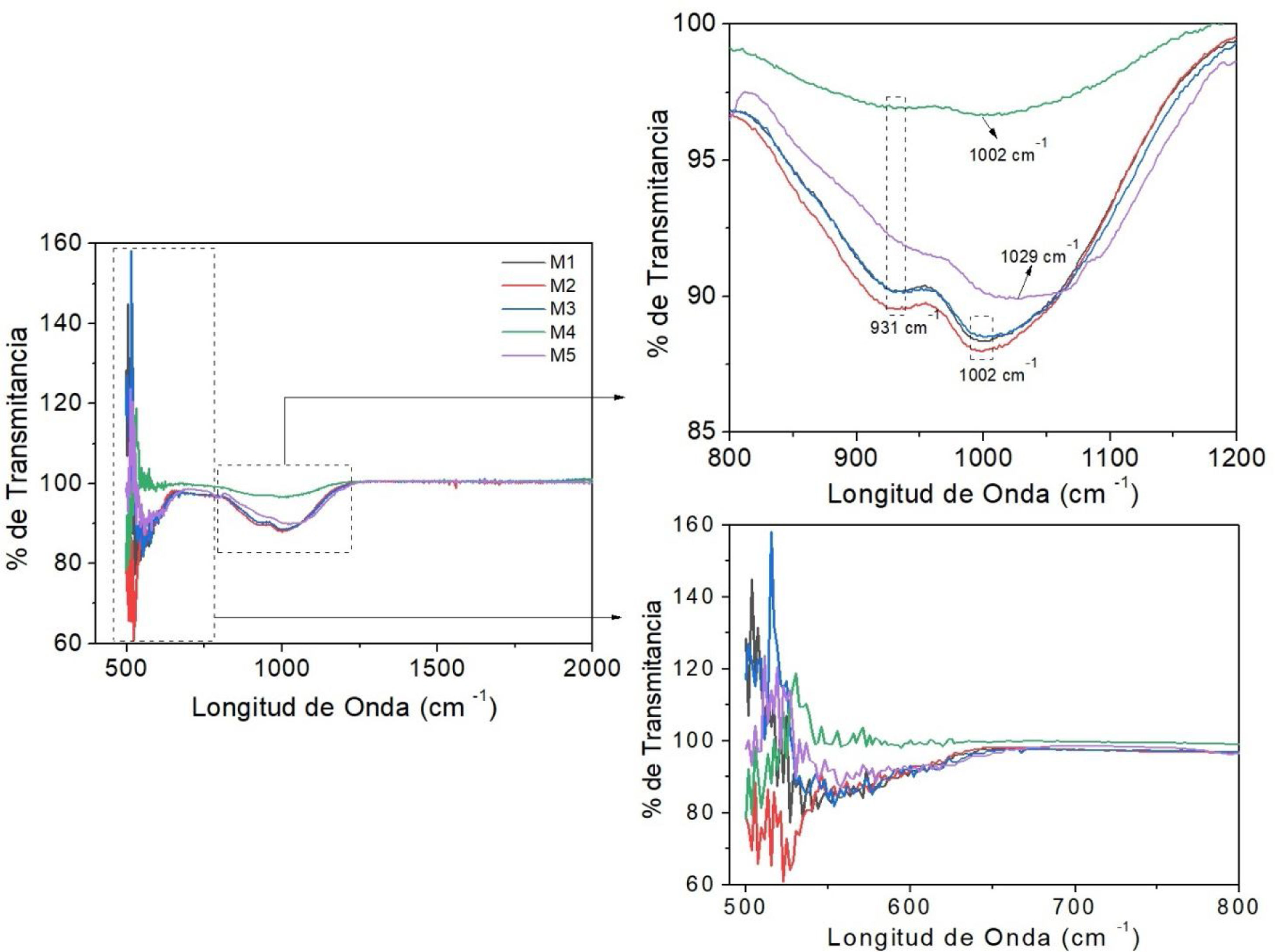
Espectroscopia infrarroja por transformada de FourierEn la figura 2 se encuentran los espectros de espectroscopia infrarroja por transformada de Fourier (FTIR) correspondientes a cada uno de los vidrios en estudio. Los espectros muestran para todos los vidrios picos correspondientes a los grupos ortofosfatos Q0 (tensión simétrica de PO43− entre 960-1060cm-1), pequeños picos correspondientes a las tensiones simétricas del enlace P-O-P (725-960cm-1) y al enlace P-O (550-593cm-1). La región del ortofosfato fue asignada a la tensión simétrica del grupo PO43−, por lo cual los átomos de oxígeno no enlazados están unidos al átomo de fósforo en el tetraedro de fosfato Q0[23]. Cuando la sustitución de CaO por MgO es inferior al 4% molar, la ausencia de cambios en el espectro FTIR podría indicar que el MgO ingresa en la estructura del vidrio como formador de red tal y como predijo Watts et al. [24].
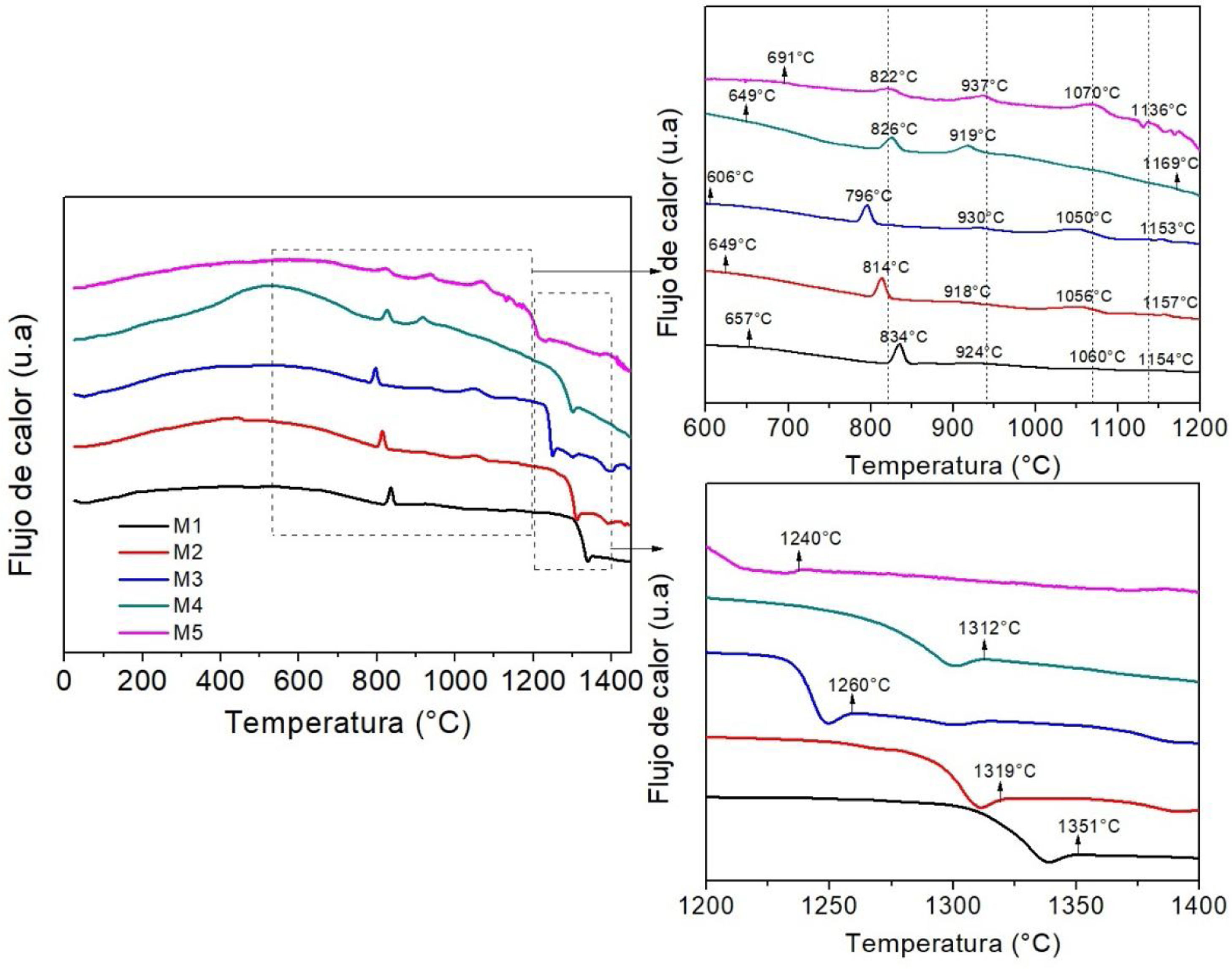
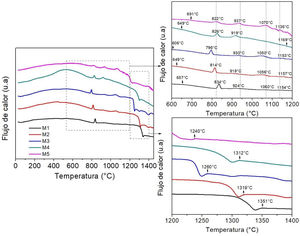
Análisis térmico diferencialEn la figura 3 se muestran los análisis DTA que se les realizaron a los polvos de todas las composiciones que no han sido tratados térmicamente con un tamaño de partícula entre 44 y 96micrómetros (distribución D2), con el fin de determinar el efecto de la adición de MgO a expensas del CaO en el comportamiento de la cristalización; en la tabla 2 se reportan las temperaturas asociadas con las transiciones particulares que ocurren durante el calentamiento de las muestras. La temperatura de transición vítrea, Tg, representa la temperatura a la cual se inicia el movimiento entre las cadenas y átomos que conforman el material y da una idea del grado de reticulación que tienen los vidrios estudiados, y por lo tanto del grado de rigidez de los mismos [13], además, se puede asociar con la solubilidad y degradación del vidrio, cristalización y propiedades mecánicas [14]. Cuando la estructura del vidrio se vuelve más rígida se manifiesta con el incremento de Tg [15].
Temperaturas asociadas con las transiciones de los vidrios para la distribución D2, en °C
| Muestras | Tg | Tx1 | Tp1 | Tx2 | Tp2 | Tx3 | Tp3 | Tx4 | Tp4 | Tm |
|---|---|---|---|---|---|---|---|---|---|---|
| M1 | 657 | 818 | 834 | 895 | 924 | 1050 | 1060 | 1123 | 1154 | 1351 |
| M2 | 623 | 796 | 814 | 884 | 918 | 994 | 1056 | 1147 | 1157 | 1319 |
| M3 | 606 | 778 | 796 | 910 | 930 | 1010 | 1050 | 1143 | 1153 | 1260 |
| M4 | 649 | 800 | 826 | 875 | 919 | 1137 | 1169 | 1178 | 1190 | 1312 |
| M5 | 691 | 790 | 822 | 890 | 937 | 1030 | 1070 | 1131 | 1136 | 1240 |
Tg: temperatura de transición vítrea; Tm: temperatura de liquidus; Tp: temperatura de los picos exotérmicos; Tx: temperatura de inicio de la cristalización.
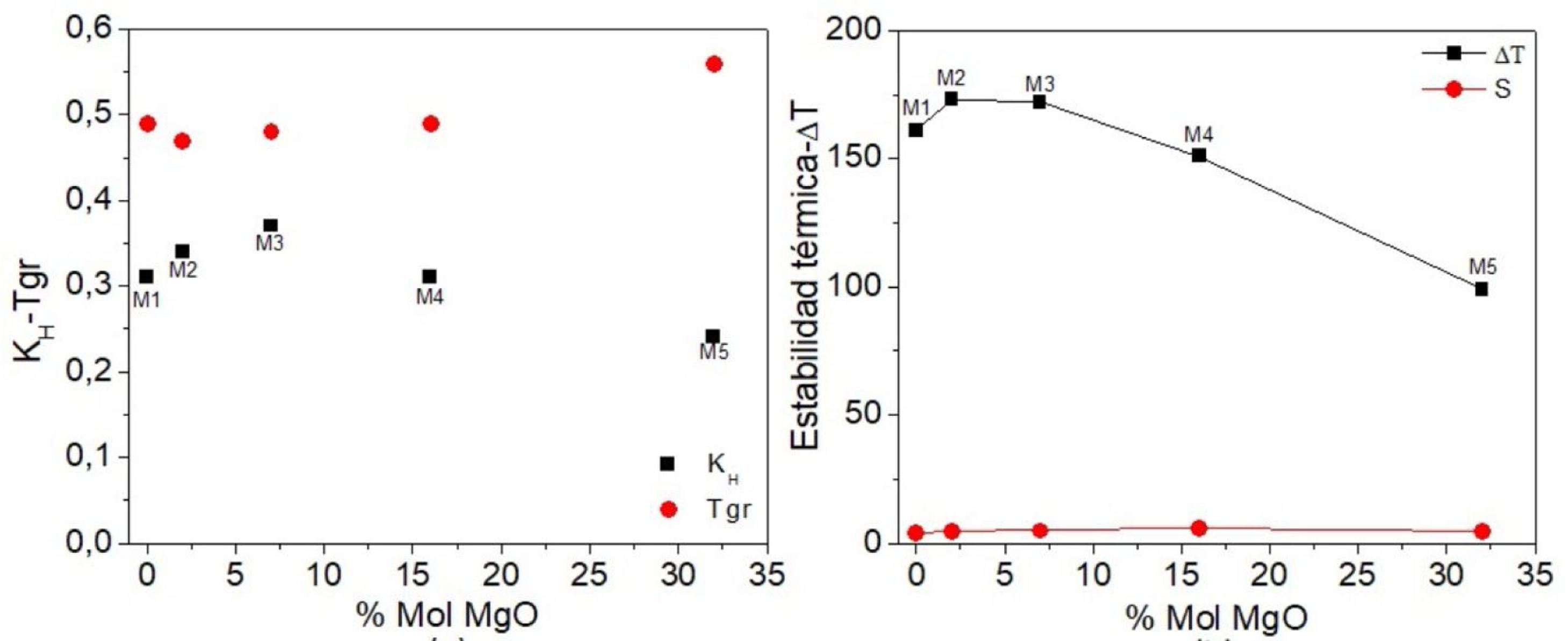
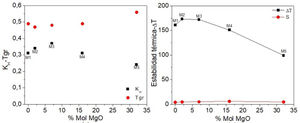
La figura 4 muestra el efecto del porcentaje molar de MgO el parámetro de Hruby, temperatura de transición vítrea reducida (TRG) y la estabilidad térmica del material en estudio. En investigaciones previas sobre nucleación en vidrios de silicato se observó qué vidrios estequiométricos que tienen una temperatura de transición vítrea reducida mayor a 0,58-0,60 muestran solo cristalización superficial (en su mayor parte heterogénea), mientras que los vidrios que tienen una TRG menor a 0,58-0,60 muestran una nucleación homogénea interna. Cuando la TRG>0,58-0,60 el trabajo para la formación de clústeres críticos a T∼TRG es aún demasiado grande para producir una nucleación medible. Sin embargo, cerca o en la interfaz, el trabajo para la formación de clústeres críticos y la viscosidad son más bajos que los valores en volumen que causan cristalización en la superficie. La transición de vidrios que muestran solo cristalización en la superficie a vidrios que muestran nucleación en volumen es explicada por un incremento en la velocidad de nucleación en volumen, con un decrecimiento en la TRG[25].
En la figura 4a se observa que las muestras M1y M2 presentan valores bajos de KH; esto se debe a que tienen las relaciones CaO/SiO2 más altas, el CaO en grandes cantidades facilita la desvitrificación. El vidrio M3 muestra la máxima estabilidad contra la cristalización en el calentamiento y posee la menor habilidad para formar cristales. El MgO en proporciones del 3 al 4% en peso eleva la viscosidad del vidrio. Además, se observa que la muestra M5 es la que presenta la menor estabilidad contra la cristalización en el calentamiento; este vidrio tiene la relación MgO/CaO y MgO/SiO2 más altas (tabla 1). Por lo tanto, se puede concluir que todos los vidrios tienen una nucleación homogénea interna, ya que los valores de la TRG son menores a 0,58-0,60. Tal y como se mencionó anteriormente los parámetros TRG y KH dependen principalmente de las propiedades térmicas y de la composición química de los vidrios, y en consecuencia el valor de TRG desempeña un papel crucial en la determinación de la habilidad para formar vidrios por cuanto más alto es este parámetro para una composición dada, mayor es la capacidad para formar cristales [18]. En la figura 4b se puede observar claramente que la muestra con mayor estabilidad térmica es la muestra M3, debido a la alta viscosidad generada por su composición química. El MgO en cantidades superiores al 5% en peso tiene un efecto reductor sobre la viscosidad de estos vidrios. Como resultado de la disminución en la viscosidad, la movilidad y velocidades de difusión de los diferentes iones y complejos iónicos formadores de vidrio serán marcadamente incrementados durante el proceso de cristalización, llevando a más altas cristalizaciones [26], provocando un aumento en la temperatura de transición vítrea Tg. Las variaciones en los parámetros TRG y KH son debidas a las propiedades térmicas de los vidrios. Estos parámetros también dependen de la composición. Aun si TRG no da la amplitud del intervalo de la temperatura, este también determina que tan cerca a la temperatura de liquidus comienza la disminución en la movilidad en el líquido para reducir la velocidad de nucleación, por lo tanto TRG desempeña un papel crucial en la determinación de la habilidad para formar vidrios en una mezcla de óxidos, pues cuanto más alta es la relación mayor es la capacidad para formar cristales [18].
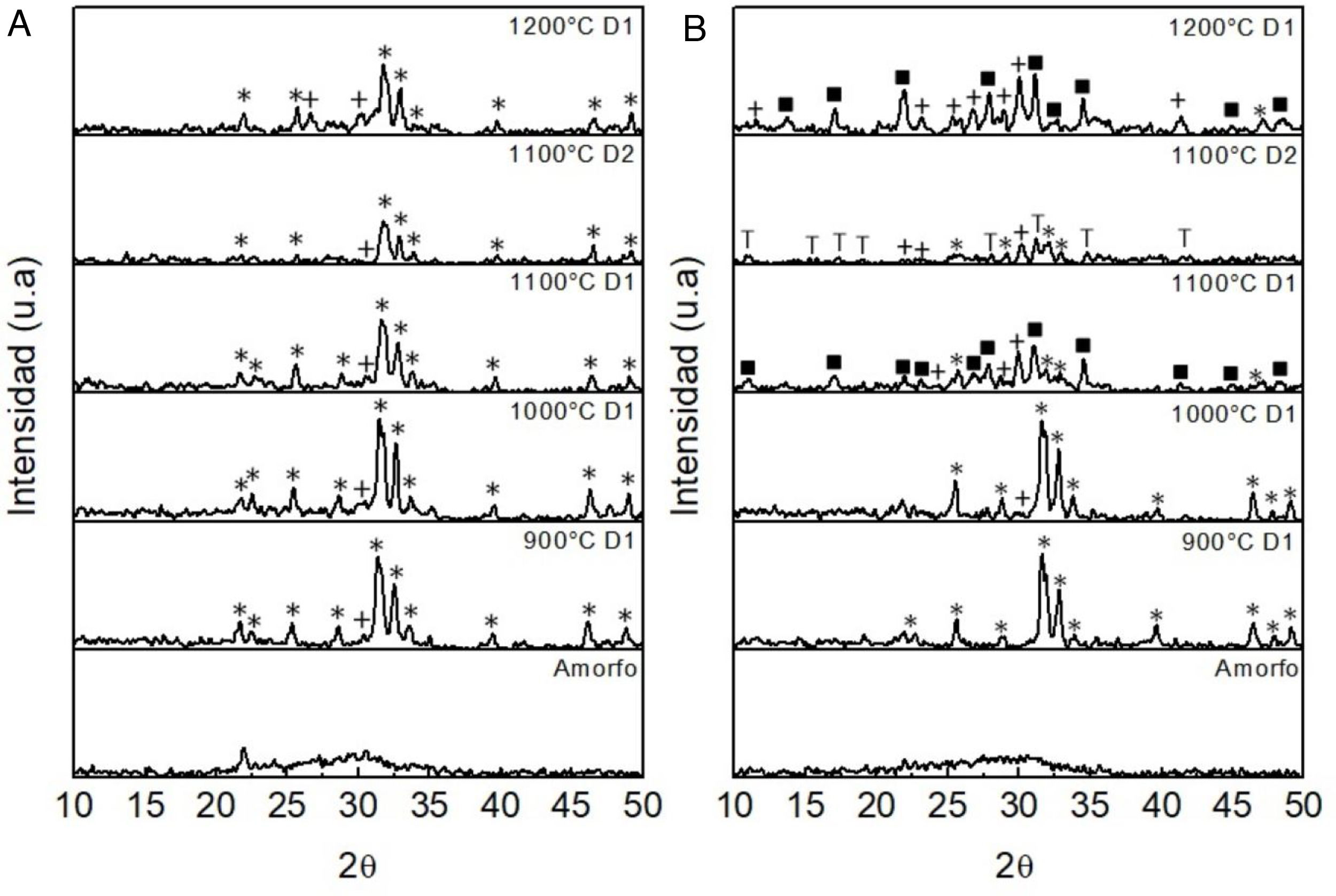
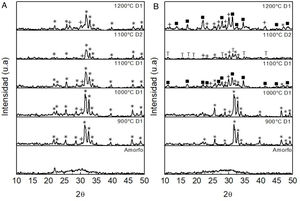
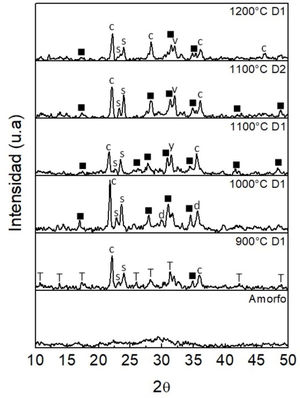
Difracción de rayos XLos difractogramas de rayos X de las muestras D1 y D2, después de realizados los respectivos tratamientos térmicos, se muestran en las figuras 5-7. En la figura 5a se observa que en los polvos de tamaño grueso codificados como D1 la única fase presente en la muestra M1 después del tratamiento térmico a 900°C es la hidroxiapatita, mientras que después de tratarla a 1.000, 1.100°C y 1.200°C aparece la fase wollastonita, la cual es más evidente a medida que aumenta la temperatura del tratamiento térmico. No obstante, en todos los casos, la fase predominante es la hidroxiapatita. Al comparar los difractogramas de las probetas D1 y D2 (con diferente tamaño de partícula), tratadas térmicamente a 1.100°C, no se aprecian cambios significativos. Sin embargo, es bien conocido que, para velocidades de calentamiento bajas, aumenta la nucleación durante el calentamiento, lo cual produce una disminución de las temperaturas de inicio de la cristalización. Por otra parte, los procesos de cristalización están favorecidos por el tamaño pequeño de las partículas de partida, cuya superficie específica es alta. En estas la nucleación y la cristalización de tipo superficial resultan fenómenos termodinámicamente favorables [27]. La presencia de hidroxiapatita es normal en este tipo de materiales, puesto que estudios previos han establecido que el fosfato de calcio puede encontrarse en forma de hidroxiapatita o whitlockita, y que en algunos casos ambos tipos de estructuras pueden estar presentes en la misma muestra [28]. La hidroxiapatita, cuya fórmula es Ca5(PO4)3 OH, es un fosfato básico de calcio, forma parte de los dientes y es el componente inorgánico natural de los huesos. La hidroxiapatita sintética presenta unas propiedades muy interesantes porque tiene excelente biocompatibilidad y cierto grado de bioactividad, pero su uso es limitado por sus propiedades mecánicas, que difieren de las del hueso natural [29,30]. La hidroxiapatita es la fase de mayor presencia en el tejido óseo. También existe una fase de whitlockita con un orden de corto alcance, en una forma amorfa en el hueso humano y en la dentina, con una cantidad aproximada del 20% en peso y entre el 26% y 58% en peso, respectivamente, dependiendo de la cantidad de Mg disponible. Existe una mayor proporción de whitlockita en el cuerpo a una menor edad y en la etapa temprana de la biomineralización, sugiriendo que la whitlockita ejerce un papel importante en el desarrollo del tejido duro [30]. En la muestra M1 correspondiente al vidrio sin tratamiento térmico se observa un pico perteneciente a la fase cristobalita (en el ángulo 2θ=21,9°). Esta fase se forma a pesar de que el material fundido es enfriado rápidamente en agua, debido al bajo valor del parámetro KH dado por el alto contenido de CaO presente en su composición química.
En la figura 5b, correspondiente a los difractogramas de rayos X de la muestra M2, se observa que en el polvo de tamaño grueso (D1) tratado a 900°C la única fase presente es la hidroxiapatita, mientras que a 1.000°C aparece un pequeño pico de la fase wollastonita (CaSiO3), a 1.100°C además se forma la fase whitlockita Ca3(PO4)2 y la intensidad de los picos de hidroxiapatita disminuye considerablemente. A 1.200°C la hidroxiapatita desaparece totalmente y la intensidad de los picos correspondientes a la wollastonita aumenta notoriamente. En el polvo D2, tratado térmicamente a 1.100°C, se detectó hidroxiapatita, wollastonita CaSiO3 y la fase whitlockita del tipo Ca18Mg2H2(PO4)14, la cual puede ser atribuida al menor tamaño de partícula. La whitlockita del tipo Ca18Mg2H2(PO4)14 es un fosfato de calcio básico, similar al fosfato tricálcico, en el cual el Mg 2+, el H2O y el HP042− desempeñan un papel estructural. Los iones de magnesio tienen un efecto importante sobre la nucleación y el crecimiento de los ortofosfatos de calcio presentes en las fases hidroxapatita Ca5(PO4)3OH y whitlockita Ca3(PO4), ya que retardan la conversión de la fase amorfa en la fase apatítica y reduce considerablemente la velocidad de crecimiento de la apatita. Por otra parte, una cierta proporción de iones Mg2+ inhibe completamente el crecimiento de la apatita y aparece la fase Ca18Mg2H2(PO4)14[31]. La formación de whitlockita y whitlockita que contiene Mg está de acuerdo con lo reportado por otros investigadores [30].
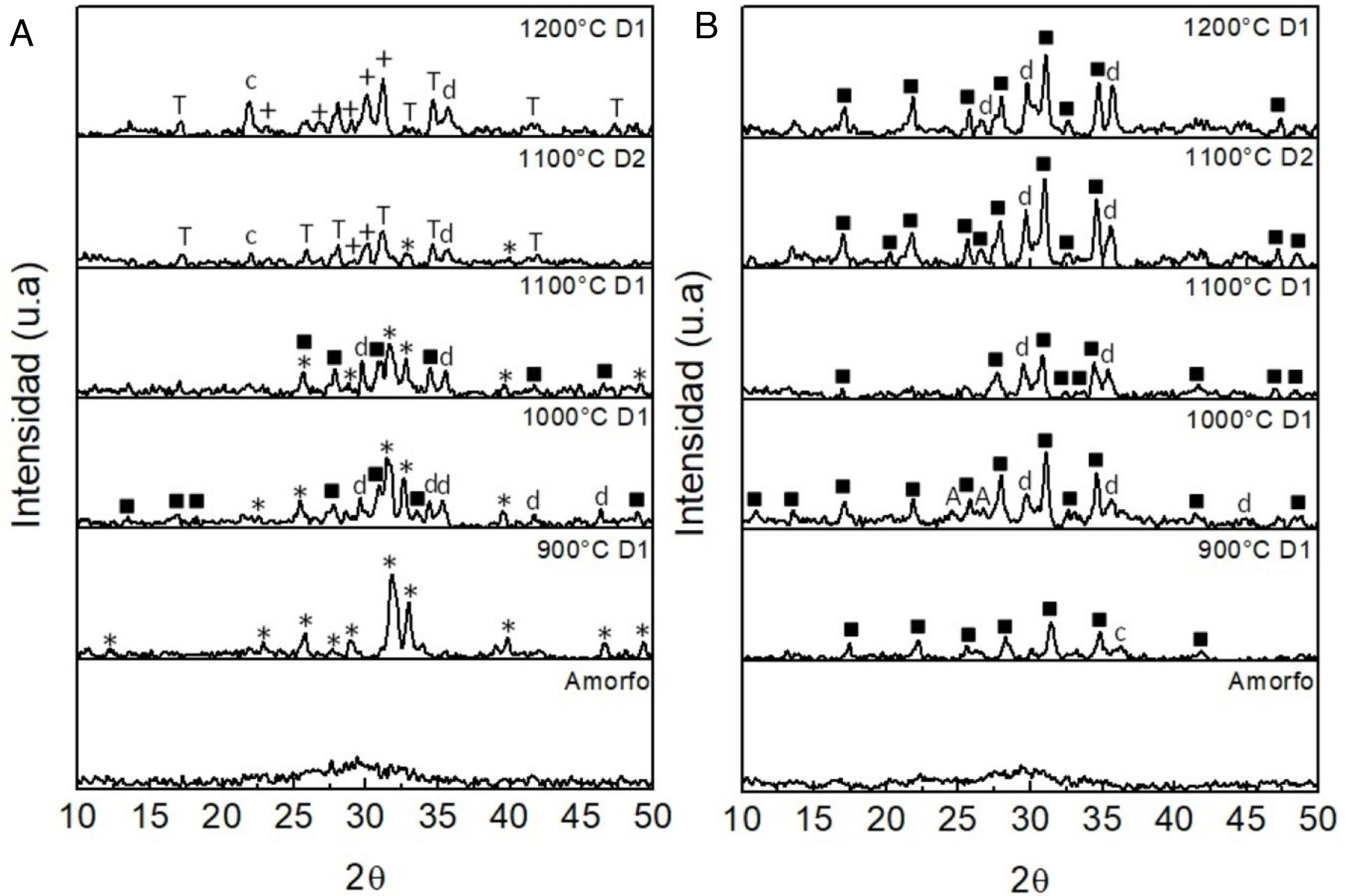
Por su parte, en la muestra M3 (fig. 6a) de tamaño grueso (D1) tratada a 900°C la única fase detectada fue la hidroxiapatita, mientras que a 1.000 y 1.100°C aparecen las fases whitlockita del tipo (Ca3(PO4)2) y diópsido (CaMgSi2O6). A 1.200°C la whitlockita cambia del tipo (Ca3(PO4)2) al tipo Ca18Mg2H2(PO4)14 y desaparece por completo la hidroxiapatita. En cuanto al polvo más fino de esta muestra (D2), tratado a 1.100°C, su difractograma es similar al del polvo D1 tratado a 1.200°C, la única diferencia es que en D2 aún son evidentes algunos rastros de hidroxiapatita, lo cual se debe a la menor temperatura de tratamiento térmico.
Difractograma de rayos X (a) muestra M3 y (b) muestra M4.
*Hidroxiapatita Ca5(PO4)3OH (ICSD 01-073-17319).
▪Whitlockita Ca3(PO4)2 (ICSD 00-009-0169).
T Whitlockita Ca18Mg2H2(PO4)14 (ICSD 00-042-0578).
+Wollastonita CaSiO3 (ICSD 00-029-0372).
cCristobalita SiO2 (ICSD 00-003-0270).
dDiópsido CaMgSi2O6 (ICSD 01-071-1495).
AAlthausita Mg2PO4(OH) (ICSD 00-029-0869).
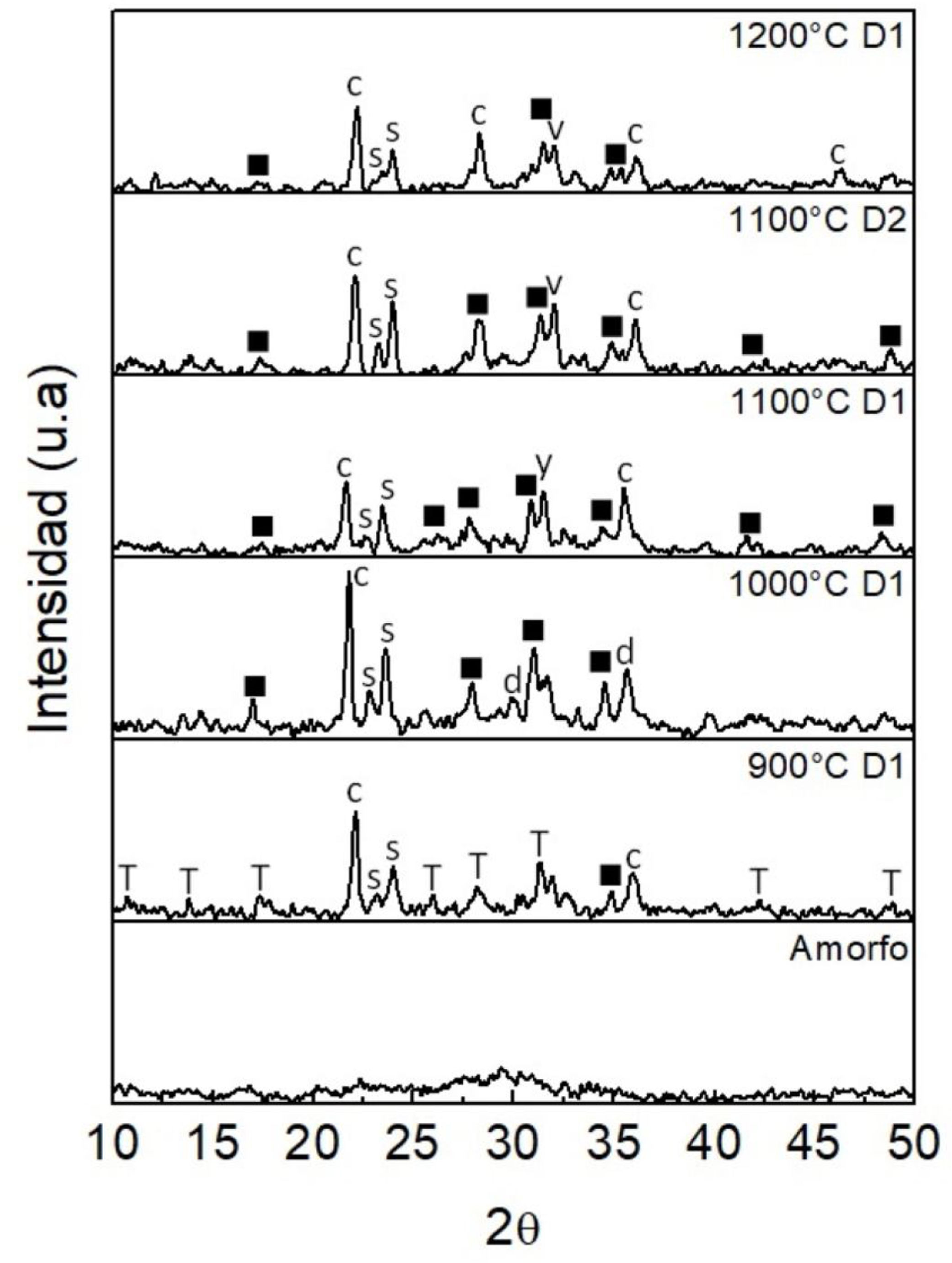
En el difractograma mostrado en la figura 6b, en lo que tiene que ver con el polvo de tamaño grueso (D1) de la muestra M4, tratada a 900°C, aparece la fase whitlockita Ca3(PO4)2 y una pequeña cantidad de cristobalita, siendo evidente la ausencia total de hidroxiapatita, la cual fue detectada en las muestras M1, M2 y M3 tratadas a esta misma temperatura. Como ya fue mencionado, el magnesio retarda la velocidad de crecimiento de la apatita y, por lo tanto, el alto contenido de MgO (10,29% en peso) en esta muestra puede ser el responsable de la inexistencia de esta fase. El tratamiento térmico realizado a 1.000°C al polvo D1 de la muestra M4 produjo una transformación total de la cristobalita, y las únicas fases detectadas fueron la whitlockita Ca3(PO4)2, diópsido (CaMgSi2O6) y la althausita (Mg2PO4(OH)); esta última, al parecer, es poco estable a temperaturas superiores, ya que en las muestras tratadas a 1.100 y 1.200°C no fue detectada, siendo la whitlockita Ca3(PO4)2 y el diópsido (CaMgSi2O6) las únicas fases encontradas en estas muestras. El diópsido es un miembro importante de la clase de los piroxenos, los vidrios y vidrios cerámicos basados en diópsido tienen buenas propiedades mecánicas y bioactivas, lo cual los hace muy atractivos para aplicaciones en la ingeniería de tejidos. Por otra parte, el fosfato tricálcico es una fase reabsorbible del fosfato de calcio, la cual es ampliamente utilizada en reparación de huesos. Las cerámicas de fosfato tricálcico tienen excelentes propiedades para la diferenciación osteogénica en el cultivo de células estromales de la médula ósea y para soportar el crecimiento del hueso. Sin embargo, las composiciones ricas en fosfato tricálcico exhiben pobre sinterabilidad y resultan en vidrios cerámicos de baja resistencia mecánica. La alta solubilidad de las cerámicas de fosfato tricálcico podría conducir a una velocidad de reabsorción incontrolada de injertos óseos, haciéndolos inadecuados para las aplicaciones de carga, o como rellenos y recubrimientos de implantes. Por lo tanto, la combinación de diópsido y fosfato tricálcico se espera que resulte en vidrios cerámicos con propiedades mejoradas para diferentes aplicaciones biomédicas. Las cerámicas basadas en diópsido y fosfato tricálcico son conocidas por exhibir buenas propiedades mecánicas y bioactivas [30]. Con respecto a la muestra de tamaño de partícula fina (D2) tratada a 1.100°C no se evidenciaron cambios respecto a la D1 tratada a la misma temperatura (fig. 6b). Al igual que en la muestra M4, en el polvo grueso de la muestra M5 (cuyo contenido de MgO es 20,39% en peso) de la figura 7, tratada a 900°C, no fue detectada la hidroxiapatita, siendo la whitlockita (Ca3(PO4)2), la cristobalita (SiO2) y el fosfato de silicio (SiP2O7) las fases presentes en esta muestra.
Difractograma de rayos X de la muestra M5.
SFosfato de silicio SiP2O7 (ICSD 00-017-0577).
▪Whitlockita Ca3(PO4)2 (ICSD 00-009-0169).
TWhitlockita Ca18Mg2H2(PO4)14 (ICSD 00-003-0713).
cCristobalita SiO2 (ICSD 00-003-0270)
yWhitlockita (Ca, Mg)3(PO4)2 (ICSD 00-013-0404).
d Diópsido CaMgSi2O6 (ICSD 01-071-1495).
v Silicato de calcio Ca2SiO4 (ICSD 00-003-0753).
El aumento de la temperatura a 1.000°C junto con la fase anterior produjo la cristalización de diópsido (CaMgSi2O6), la cual aparentemente tiene poca estabilidad a temperaturas superiores, ya que en las muestras tratadas a 1.100 y 1.200°C ya no fue detectada. En los polvos tratados a estas temperaturas junto con la Whitlockita (Ca3(PO4)2), la cristobalita (SiO2) y el fosfato de silicio (SiP2O7), se produjo el silicato de calcio (Ca2SiO4). Trabajos previos han atribuido la presencia del fosfato de silicio al tratamiento térmico y posterior enfriamiento de muestras con alto porcentaje de MgO, además se ha establecido que este óxido puede actuar como un agente de nucleación para disminuir la barrera de energía de cristalización [32]. En lo que respecta al polvo fino (D2) tratado térmicamente a 1.100°C, no se evidenciaron diferencias con su similar de tamaño grueso (D1). La muestra que no fue tratada térmicamente presenta en el ángulo 2θ=22,2° un pico perteneciente a la fase cristobalita. Para los ángulos 2θ=16,6°, 26,6° y 30,8° se observan picos correspondientes a la fase whitlockita tipo Ca3(PO4)2. Esta muestra es la que posee el más bajo parámetro Hruby ocasionado por el alto contenido de Mg presente en la composición química (fig. 7).
ConclusionesSe determinó que el Mg tiene un efecto importante sobre la nucleación y crecimiento de los ortofosfatos de calcio, ya que retarda la conversión de fase amorfa en una fase apatítica y reduce considerablemente la velocidad de crecimiento de la apatita. Cantidades superiores al 16% molar (10,29% en peso) inhiben completamente el crecimiento de la fase apatita y aparece la fase whitlockita tipo Ca3(PO4)2 y Ca18Mg2H2(PO4)14. En los vidrios que tienen un porcentaje molar inferior al 16% la estabilidad de la fase apatita disminuye hasta tal punto que a 1.200°C esta fase desaparece. En aquellos vidrios cuya cantidad de MgO es superior al 16% molar la ausencia de hidroxiapatita fue evidente incluso en los polvos tratados térmicamente a 900°C. La alta temperatura del tratamiento térmico al que fueron sometidos los polvos provee las condiciones energéticas suficientes para producir la movilidad de los iones Mg, dando lugar a la aparición de la fase whitlockita, incluso en las muestras de bajo contenido de MgO, y esta temperatura es inferior en las de alto contenido de MgO.
Con los análisis térmicos de DTA se pudieron encontrar varias temperaturas características que permitieron determinar la estabilidad térmica de los vidrios:
- -
Todos los biovidrios obtenidos tienen una nucleación homogénea interna, ya que los valores de la TRG son menores a 0,58.
- -
Cuando la composición química es superior al 7% molar (3,08% en peso) de MgO, el aumento de este óxido disminuye la estabilidad contra la cristalización en el calentamiento de los vidrios y la estabilidad térmica.
- -
El sistema de trabajo es un sistema complejo en donde se detectaron durante el calentamiento: hidroxiapatita, whitlockita, diópsido, wollastonita, cristobalita, pirofosfato de silicio.
- -
La muestra que presenta mayor estabilidad térmica es la del 7% en peso de MgO y la de menor estabilidad es la del 32% en peso MgO.
- -
El tamaño de partícula podría afectar solo la velocidad con la que se lleva a cabo el proceso de nucleación, ya que al final se obtuvieron las mismas fases en todas las muestras de igual composición química, pero diferente tamaño.
Los autores agradecen a la Fundación para la Promoción de la Investigación y la Tecnología BANCO DE LA REPÚBLICA por la financiación del proyecto «Obtención y caracterización de polvos de biovidrios pertenecientes al sistema 31SiO2-11P2O5-(58-X) CaO –X MgO para ser aplicados mediante proyección térmica» (Proyecto 2.563).