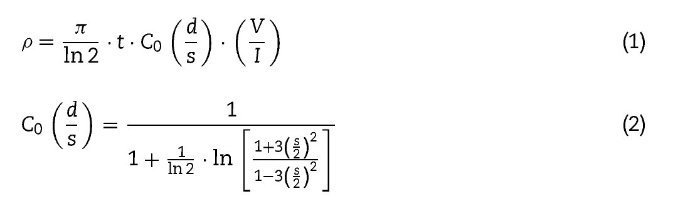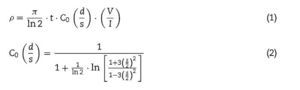Se han sintetizado a través del método sol-gel, y caracterizado por varias técnicas, nuevos compósitos tipo perovskita de La0,8Sr0,2Cr0,5Mn0,5O3-δ (LSCM), utilizando cobre (XCu; X = 25, 35 y 45%) como aditivo formador del cermet LSCM + Cu para utilizarse como ánodos alternativos en celdas de combustible de óxido sólido de temperatura intermedia (IT-SOFC). Se confirma por difracción de rayos X (XRD) la formación de fase de los cermets LSCM-Cu. La conductividad eléctrica obtenida desde temperatura ambiente hasta 800 ¿C indica la presencia de 2 tipos de comportamiento tanto semiconductor como metálico. Cuando la concentración de Cu fue del 25 y del 35%, el comportamiento que dominó fue del tipo semiconductor. La determinación de los coeficientes de expansión térmica (TEC) mostró una dependencia lineal inversamente proporcional a la concentración de Cu. Nuestros resultados de conductividad eléctrica, análisis morfológico y TEC sugieren que los ánodos con 25 y 35% de Cu tienen la mayor posibilidad para aplicarse en las celdas tipo SOFC-IT.
New types of La0,8Sr0,2Cr0,5Mn0,5O3-δ (LSCM) perovskite composites with the addition of copper(Cu), XCu (X = 25, 35 and 45%) as forming additive, were synthesized via the sol-gel method as alternative anodes for intermediate-temperature solid oxide fuel cells (IT-SOFCs) and characterized by several techniques. Phase formation of the LSCM-Cu cermets was confirmed by X-ray diffraction (XRD). Electrical conductivity was obtained from room temperature to 800 ¿C, indicating the presence of two types of behaviors: both semiconductor and metal. When the concentration of Cu was 25 and 35%, the dominant behavior was the semiconductor type. The thermal expansion coefficient (TEC) determined was linearly inversely proportional to the concentration of Cu. The results of electrical conductivity, TEC, and morphological analysis suggested that the anodes with 25 and 35% Cu are most suitable for use in the IT-SOFCs.
Introducción
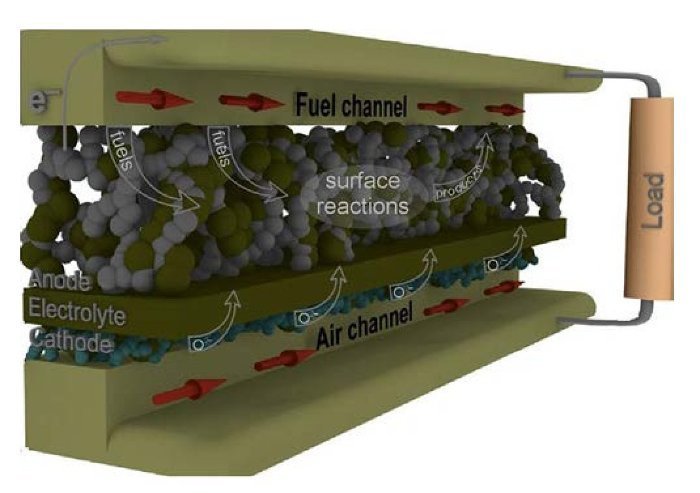
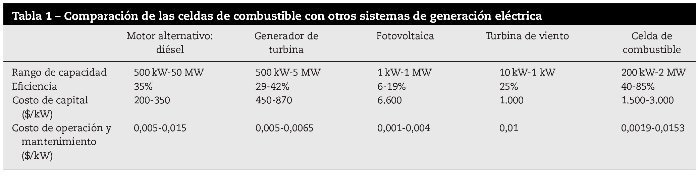
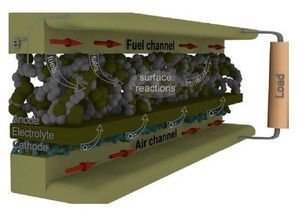
El hidrógeno representa el mayor potencial como vector energético de las energías renovables. En este caso, la mayor eficiencia se puede conseguir a través de la tecnología de las celdas de combustible [1]. Las celdas de combustible (tabla 1) son dispositivos que combinan el oxígeno y el hidrógeno para producir energía eléctrica, calor y agua. Las celdas de combustible de óxido sólido (SOFC) (fig. 1), que operan a temperaturas altas (alrededor de los 1.000 ¿C), pueden alcanzar eficiencias superiores al 60% [2] si se emplea el calor residual en cogeneración. El funcionamiento a alta temperatura elimina la necesidad de catalizadores de metales nobles como platino. También permite reformar el combustible internamente, lo que permite el uso de mayor variedad de combustibles y reducir el costo asociado a la adición de un reformador en el sistema. La celda SOFC es un sistema de óxido sólido que generalmente utiliza un material cerámico de óxido de zirconio sólido y una pequeña cantidad de itria. Sin embargo, la alta temperatura de operación (≈ 1.000 ¿C) y la naturaleza frágil de los componentes cerámicos de la celda (ánodoelectrólito-cátodo) han mermado su aplicación [3] y, debido a esto, las investigaciones actuales están enfocadas a reducir tal temperatura en el rango de 400-800 ¿C. [4–6] En el caso del electrodo anódico, la estructura perovskita (ABO3), en particular el compuesto cerámico La0,75Sr0,25Cr0,5Mn0,5O3-δ, normalmente llamado LSCM, se considera uno de los ánodos más prometedores para celdas SOFC funcionando por debajo de 1.000 ¿C[7,8]. En general, esta perovskita ofrece baja resistencia de polarización y buena estabilidad en combustibles a base de hidrocarburos [9]. Respecto a la oxidación del combustible, varios autores han señalado al compuesto LSCM como un material ideal para maximizar la eficiencia de oxidación del combustible [10,11].
Figura 1 – Diseño planar de una celda de combustible de óxido sólido, SOFC.
Es importante mencionar que el compuesto LSCM es un conductor tipo-p con un valor de conductividad igual a 38 S cm−1 a una presión parcial de oxígeno de 10−10 atm y a una temperatura de 900 ¿C [13]. Sin embargo, la conductividad eléctrica de esta perovskita es mucho menor en atmósferas reductoras (1,5 S cm−1 con 5% de H2) [12,13]. En este caso, la sustitución de estroncio (Sr) en el sitio A de la perovskita LSCM promueve una compensación de carga debido a la transición de Cr3+/Mn3+ a Cr4+/Mn4+; esta compensación es posible debido a formación de vacancias de oxígeno a una presión parcial de oxígeno relativamente baja. Por lo tanto, en un ambiente reductor, la conductividad iónica del material LSCM puede aumentar mientras la conductividad eléctrica disminuye significativamente. En este sentido, la adición de una fase eléctricamente conductora, por ejemplo de cobre (Cu) o níquel (Ni, más caro), puede mejorar en gran medida la conductividad eléctrica del electrodo. Debido a su baja temperatura de fusión, el óxido CuO puede reducirse a Cu con el gas del combustible durante el funcionamiento de la celda y así mejorar su funcionamiento [12,14]. Cabe resaltar que el reciente desarrollo de materiales para celdas SOFC libres de Ni, tales como NdBaCo2/3Fe2/3Cu2/3O5+δ [15] Cu-Co/CeO2 [16], Cu-Fe/CeO2 [17], Cu-YSZ [18] y óxidos tipo perovskita [19]. LaCrO3, La(Ti,Mn)O3, Sr(Nb,Mn)O3 como ánodos alternativos para celdas SOFC han despertado una gran atención. Lo anterior se debe en gran parte al demostrar que la deposición de carbono en la superficie del material se reduce notablemente al utilizar Cu en lugar de Ni. A diferencia del níquel, el cobre no cataliza la formación de enlaces carbono-carbono (C-C), lo que promueve la formación de coque, afectando el rendimiento de la celda [14,20].
Por otro lado, es bien conocido que las propiedades de los cerámicos se ven afectadas por las características de sus polvos, como tamaño de partícula, morfología, pureza y composición química; estas características cambian según el método de síntesis empleado, el cual es muy sensible a los parámetros experimentales como temperatura, pH, composición química, concentración de reactantes y naturaleza del solvente. El método sol-gel ha mostrado ser eficiente en el control de la morfología, y la composición química de los polvos preparados, comparado con otros métodos no químicos, como el de reacción en estado sólido [21], el cual presenta ciertos inconvenientes como ausencia de homogeneidad, morfología irregular, tamaños de partículas grandes, altas temperaturas (1.300-1.600 ¿C) y periodos largos de calcinación [22]. El proceso sol-gel es una atractiva ruta que se inicia a partir de los precursores moleculares formando una red de óxidos inorgánicos a través de reacciones de polarización. Este proceso presenta varias ventajas, como alta pureza en la fase obtenida, aceptable homogeneidad composicional, alta actividad superficial de los polvos resultantes y es muy versátil; es un proceso relativamente simple que puede transferirse a escala industrial y no es muy costoso [23]. Cabe resaltar que, con este método, la estabilidad química de los materiales inorgánicos y orgánicos puede modificarse eficientemente debido a que los cationes están más cercanos unos a otros en su movimiento aleatorio, por lo tanto la cinética de reacción se tiene a temperaturas más bajas comparado con las reacciones en estado sólido. En este sentido, los materiales anódicos (LSCM + Cu) propuestos en este estudio se han realizado por el método sol-gel.
La motivación de este trabajo se basa en los excelentes resultados que hemos logrado en investigaciones anteriores, donde se han utilizado cermets base LSCM con adiciones de cobre y níquel [24,25]. En este artículo se estudia, a través de diversas técnicas de caracterización, el efecto que tiene la impregnación de la perovskita La0,8Sr0,2Cr0,5Mn0,5O3-δ con cobre.
Experimentación
Síntesis de los ánodos La0,8Sr0,2Cr0,5Mn0,5O3-ı + XCu
La preparación del material anódico La0,8Sr0,2Cr0,5Mn0,5O3-δ + XCu (LSCM + XCu) fue realizada a partir del método sol-gel. Se prepararon en total 3 muestras, donde el contenido de cobre (X) utilizado como aditivo fue del 25, 35 y 45% en peso. Para la fase perovskita (LSCM) los precursores empleados fueron diversos nitratos tipo La(NO3)3·6H2O (99,9% de pureza, Alfa Aesar), Sr(NO3)3 (99,7% de pureza, Fisher Scientific), Cr(NO3)3 (98,5% de pureza, Alfa Aesar) y Mn(NO3)3(99,9% de pureza, MP Biomedicals, LLC). Cada uno de ellos fue disuelto por separado en agua desionizada y etilenglicol; la cantidad que se empleó de cada precursor se colocó en un vaso de precipitado de 50 ml; el vaso de precipitado se colocó sobre una plancha con regulador de temperatura y agitación moderada por una hora, y la temperatura se mantuvo aproximadamente a 60 ¿C en condición de reflujo, para lo cual se cubrió cada vaso con papel aluminio. Una vez disuelto cada precursor, se mezclaron en un vaso de precipitado de 1.000 ml y se añadió agua desionizada hasta alcanzar un volumen de aproximadamente 800 ml, manteniéndose en agitación y reflujo. Para favorecer la gelación, a las 24 h de permanecer en tales condiciones se añadió nuevamente etilenglicol como agente de esterificación, manteniéndose así hasta la evaporación total de la solución. De este proceso se obtuvo un residuo que fue secado a 250 ¿C por una hora. El material resultante fue triturado en un mortero de ágata durante 1 h. Posteriormente, estos polvos de LSCM se calcinaron en atmósfera de aire en una mufla a temperaturas de 100, 200, 300, 400, 500, 600, 700 y 800 ¿C durante 1 h a cada temperatura, a una velocidad de 5 ¿C/min; luego se aumentó la temperatura hasta 1.050 ¿C, manteniéndose durante 6 h más a la misma velocidad de calentamiento y posterior enfriamiento. Para la obtención de los cermets LSCM + Cu, se disolvió el precursor de cobre CuN2O6·2,5 H2O (98,8% de pureza, Fisher Scientific) en las mismas condiciones que la perovskita LSCM. Posteriormente, y manteniendo la agitación de la solución de cobre, los polvos de perovskita la impregnaron para formar cada una de las composiciones de LSCM-XCu. Los geles resultantes fueron secados en las mismas condiciones que el compuesto LSCM y entonces calcinados en un crisol de alúmina a 450 ¿C durante 1 h en atmósfera de aire. Los polvos de LSCM-XCu se mezclaron con 6% de grafito (formador de poro) y alcohol polivinílico (PVA) como aglutinante, luego se molieron en un mortero de ágata durante 1 h para después prensarlos unidireccionalmente a una tonelada de presión durante 15 segundos. Finalmente, los pellets resultantes con 25, 35 y 45% de Cu en la perovskita La0,8Sr0,2Cr0,5Mn0,5O3-δ se sinterizaron en un crisol de platino a 1.200 ¿C durante 75 minutos con una velocidad de calentamiento y enfriamiento de 3 y 5 ¿C, respectivamente.
Caracterización de los compuestos LSCM + XCu
Difracción de rayos X La difracción de rayos X (XRD) se utilizó para realizar un análisis estructural preliminar de las muestras. Esta técnica nos sirve para comprobar el grado de cristalinidad de las muestras preparadas y evaluar la pureza de las fases. Las mediciones para identificar las fases cristalinas del compuesto La0,8Sr0,2Cr0,5Mn0,5O3-δ + Cu (LSCM + XCu) se llevaron a cabo en un difractómetro (philips X´pert pro) con radiación CuKα (λ = 1,5456Å) y una geometría θ-2θ en un rango de 20-80¿. Se utilizó el modo de barrido con un paso de 0,01¿ y con un tiempo de conteo por paso de 10 segundos.
Microscopia electrónica (SEM)
El ánodo debe cumplir con ciertos requisitos morfológicos muy precisos. Por un lado debe presentar una adecuada porosidad interconectada que permita la adecuada distribución del combustible gaseoso y, por otro, una elevada área activa para llevar a cabo el proceso de oxidación de combustible. Para observar los cambios morfológicos y la distribución de la porosidad, los pellets fueron analizados en un microscopio electrónico de barrido JEOL-JSM 6400 al cual está unido a un equipo EDAX y tiene un filamento con emisión de campo de 30 kV. Para el análisis morfológico los polvos de cada muestra se situaron en un portamuestras con cinta de grafito. Todas las muestras caracterizadas en este trabajo son conductoras, por lo que no se necesitó ningún tratamiento previo de metalización.
Coeficiente de expansión térmica
La mayor parte de los materiales se dilatan cuando se realiza una transformación isobara al aumentar la temperatura, siempre que no haya ningún proceso de cambio de fase en dicha transformación. Generalmente, en el caso de sustancias sólidas, el calor que se introduce en el sistema para aumentar su temperatura hace aumentar la amplitud de vibración de los átomos que lo constituyen, y con ello la separación media entre ellos. Este efecto corresponde a una dilatación macroscópica. La medida del coeficiente de expansión térmica (TEC) se llevó a cabo en muestras densificadas para evitar el efecto de contracción que se observaría en una muestra no densificada al aumentar la temperatura que apantallaría la dilatación-contracción intrínseca del material. Las muestras reducidas de LSCM + XCu fueron examinadas en un analizador termomecánico marca TMA Instruments modelo 2900, y de los datos obtenidos (pendiente de las curvas) se pudo calcular el TEC. El experimento se llevó a cabo hasta una temperatura de 800 ¿C con una velocidad de calentamiento igual a 5 ¿C/min bajo una atmósfera de 10% H2+90% N2, con un flujo continuo de 80 cm3/min.
Conductividad eléctrica
Las medidas de conductividad eléctrica se realizaron mediante el método de 4 puntas en corriente continua sobre pellets de 10 mm de diámetro y 1 mm de espesor aproximadamente, sinterizados desde temperatura ambiente hasta 800 ¿C. Todas las muestras medidas en este estudio fueron pulidas para lograr un espesor lo más homogéneo posible. Las mediciones experimentales se efectuaron en un horno equipado con un multímetro digital Hewlett Packard 34401A además de un ordenador para la adquisición de datos, obteniendo un valor de resistividad eléctrica para cada temperatura. Para la adquisición de los datos de conductividad eléctrica se consideró la temperatura programada (la que indica el contador del horno), y con el objetivo de describir las condiciones reales de manera más apropiada se estimó una incertidumbre experimental de la temperatura real de la muestra de ± 3,5 ¿C. Según nuestros resultados obtenidos en investigaciones anteriores y con el fin de evitar la rotura de simetría en la perovskita, donde se observó un cambio estructural (ABO3 → A2BO4) [24], primeramente se llevó a cabo la reducción de las muestras de LSCM + XCu en un horno tubular-horizontal marca Thermolyne. Las 3 muestras (25-45%Cu) fueron colocadas dentro de un tubo de cuarzo, el cual se introdujo dentro del horno y se hizo fluir una mezcla de 10% H2+90% N2 (Praxair, 99,9%), manteniendo un flujo continuo de 200 cm3/min, y se calentaron mediante una velocidad de calentamiento de 5 ¿C/min hasta una temperatura de 800 ¿C durante 8 h. Se ha utilizado un electrodo de contacto de oro. Esta particular versión del método de Van der Pauw [26] ha sido muy utilizada para medir pellets planos de distintos materiales en los que la conductividad del seno del sólido se puede estimar a partir de la medida superficial mediante las 4 puntas, siempre y cuando los contactos se encuentren en el interior de la muestra circular, la superficie de contacto entre el electrodo y la muestra sea suficientemente pequeña, la muestra presente un espesor uniforme y que no presente grietas ni poros en la superficie [27–29]. Para calcular la resistencia eléctrica se consideraron las siguientes ecuaciones [30]:
donde I es la intensidad de corriente que atraviesa la muestra, V es la diferencia de potencial, d es el espesor de la muestra, s es la distancia entre los contactos del potencial, C0 es igual a 2[H9266]s y t es un factor de corrección adicional.
Resultados y discusión
Difracción de rayos X
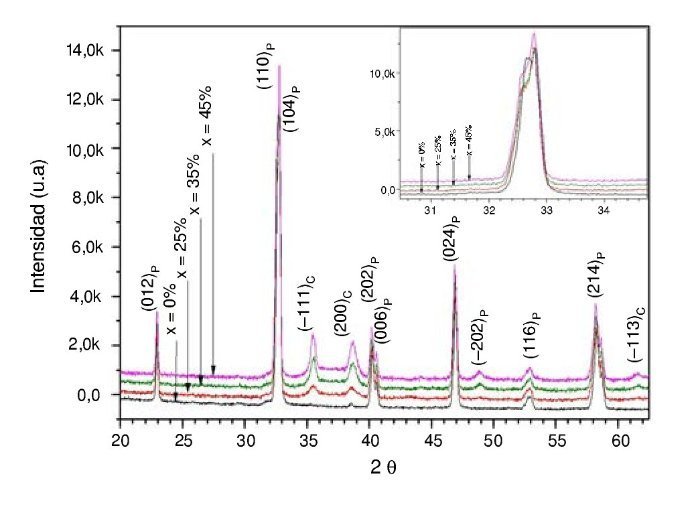
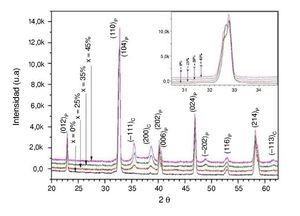
En la figura 2 se muestran los patrones de difracción de rayos X realizados a todas las muestras del compuesto La0,8Sr0,2Cr0,5Mn0,5O3-δ+ Cu, en el que el contenido de Cu varía del 25 hasta el 45% sinterizados a una temperatura de 1.200 ¿C y después de la reducción con hidrógeno a una temperatura de 600 ¿C. Los patrones de XRD fueron indexados a partir de una estructura tipo perovskita-romboédrica (hexagonal) [31]. Estas muestras poseen la misma estructura cristalina que la perovskita La0,75Sr0,25Cr0,5Mn0,5O3 obtenida por otros autores [32–34].
Figura 2 – Patrones de difracción de rayos X después del proceso de reducción de los ánodos La0,8Sr0,2Cr0,5Mn0,5O3-δ+XCu.
En el difractograma se distingue que el cambio de intensidad en los planos cristalográficos tiene una relación directa con la variación de la cantidad de Cu en los compósitos, debido a que cuando la cantidad de LSCM disminuye, el plano (−111)C de Cu aumenta pero el plano de la perovskita (104)P disminuye, lo cual es proporcional al nivel de impregnación con Cu. Los patrones confirman claramente la reducción de CuO → Cu, así como la formación de la estructura perovskita (LSCM) y la ausencia de cristales de CuO de estructura monoclínica [35]. En la parte inferior de la figura se observa que se ha formado con éxito una sola fase estable tipo La0,8Sr0,2Cr0,5Mn0,5O2,85 sin impregnación de Cu, y posteriormente se muestran las demás fases de la perovskita con la impregnación del 25-45% en peso de Cu. Claramente se puede apreciar que no hay evidencia de formación de fases secundarias. Se ha comprobado que el dopaje de la estructura perovskita en los sitios A y B ha mejorado sustancialmente la actividad catalítica para la oxidación del metano [39]; además, termodinámicamente la sustitución de Sr y Mn puede mantener la estabilidad de la perovskita incluso en severas condiciones de reducción, mientras que otros elementos pudieran desestabilizar el sistema (A´ = Ca, B´ = Mg, Fe, Co, Ni) [36]; esta estabilidad en parte se debe al comportamiento que tienen estos elementos (Sr y Mn) a ciertas presiones parciales de oxígeno preservando la fase perovskita [40]. Estos elementos incrementan el número de portadores de carga por formación de defectos, y si la presión parcial de oxígeno es constante, es el contenido de estroncio el que puede determinar la concentración total de portadores, lo cual también permite la estabilización del sistema [37]. Además, el Sr en el sitio A y el Mn en el sitio B de la perovskita mejoran la actividad catalítica [38–40]. Por otro lado, es importante mencionar que conforme el contenido de Cu aumenta (25 al 45% de Cu), el pico característico de la perovskita ubicado aproximadamente a 33¿ se va desplazando hacia la izquierda (ver recuadro superior de figura 2). Estos cambios de volumen de la perovskita pueden ser debidos a pequeñas diferencias en los contenidos de Cu dentro de la propia perovskita, mostrando una relación inversa con el ángulo 2θ. Este desplazamiento del pico hacia la izquierda está relacionado al aumento del parámetro de red por la cantidad de dopante adicionado; en términos generales, a mayor concentración de dopante se observa un mayor desplazamiento [41], lo cual depende del tamaño del catión dopante en comparación con el catión que se reemplaza. Este desplazamiento hacia ángulos menores de 2θ indica la expansión de la celda unitaria [42]. Lo anterior se debe en parte a los posibles efectos de sustituir Mn o Cr con Cu2+ como distorsión de la celda y cambios de volumen respecto a los radios iónicos. Es bien conocido que la estructura de la fase y la red cristalina están estrechamente relacionadas con el radio iónico de los cationes en los sitios A y B de la perovskita. Es importante señalar que, dependiendo de la temperatura del medio y la presión parcial de oxígeno, el manganeso puede tomar múltiples estados de oxidación, variando desde +2 a +4 en un óxido tipo perovskita. La reducción de la presión parcial de oxígeno puede conducir a la reducción térmica del manganeso a un estado de oxidación inferior, acompañado de un aumento en el radio iónico y subsecuentemente la expansión de la red [42].
Análisis morfológico
La figura 3 muestra las imágenes en SEM de la superficie de los cermets La0,8Sr0,2Cr0,5Mn0,5O2,85-XCu reducidos en una atmósfera de 10%H2-90%N2, donde se puede observar el tamaño de la porosidad y la microestructura después del sinterizado a 1.200 ¿C durante 75 min. La figura 3a-c muestra la morfología y la distribución de las partículas de acuerdo al porcentaje en peso de Cu (25, 35 y 45%). La técnica de sol-gel y la cantidad de grafito/PVA permitió la formación de partículas de tamaño submicrométrico de estructura tipo perovskita impregnadas con estructuras cristalinas de Cu (de tamaño submicrométrico a micrométrico), las cuales tienen distribución aleatoria y una porosidad diseminada en forma de esponja. Cabe mencionar que la estructura del ánodo requiere una elevada porosidad en su morfología para asegurar una buena difusión del gas [43]. Los ánodos mostraron una porosidad abierta y una estructura porosa altamente interconectada durante el sinterizado, así como en el proceso de reducción. La cantidad de Cu influyó en el tamaño de la porosidad, y tuvo una influencia notable la cantidad de porosidad. Además, el análisis de SEM claramente revela la presencia de finas partículas de perovskita sobre la superficie y en la microestructura del ánodo en bulk, con un tamaño aproximado de 0,25 μm. Cuando la concentración de Cu se incrementa, se observa la acumulación de aglomerados formados por cristales de Cu de forma casi esférica. La distribución de las partículas de Cu es homogénea, manteniéndose el tamaño de los granos de Cu entre 0,5 y 1 μm cuando la concentración de Cu alcanza el 35%. Pero cuando la concentración aumenta al 45%, el tamaño de grano aumenta aproximadamente de 3 a 6 μm. Esto se atribuye a la alta coalescencia y difusión catiónica del Cu en alta temperatura. Como es de esperar, cuando los aglomerados crecen disminuye la cantidad de poros. Cualitativamente se puede afirmar que el tamaño del poro aumenta cuando la concentración de Cu aumenta. En general los ánodos presentan buena porosidad, debido en gran parte al tamaño de partícula del PVA y el grafito. La morfología observada es de un material poroso, lo cual concuerda con los requerimientos para la fabricación de ánodos en celdas SOFC de temperatura intermedia.
Figura 3 – SEM, imágenes de la sección transversal de la superficie de los ánodos La0,8Sr0,2Cr0,5Mn0,5O3-δ+XCu reducidos en una atmósfera de 10%H2-90%N2, donde: a) x = 25%, b) x = 35% y c) x = 45%.
Coeficiente de expansión térmica
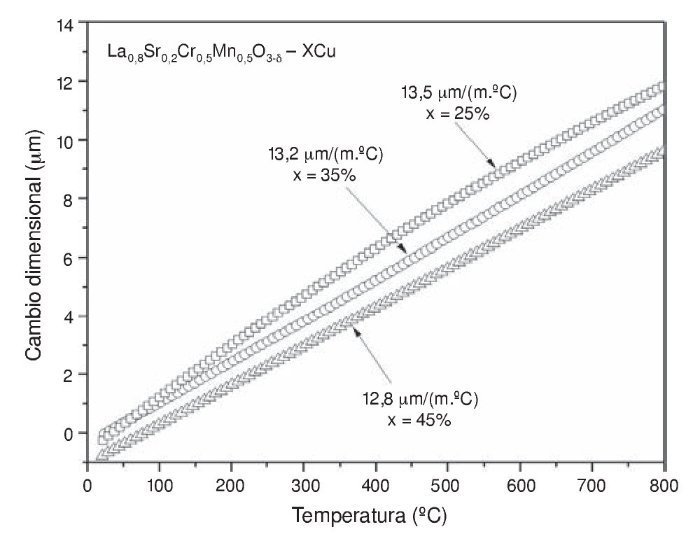
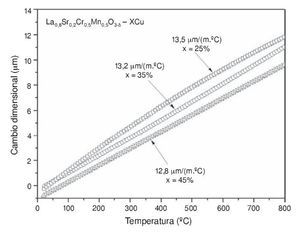
La información del TEC es de suma importancia debido a que durante el acoplamiento de una celda SOFC y la posterior sinterización de los compuestos, puede haber fracturas si existe diferencia en los valores del TEC entre los componentes de la celda como ánodo, electrólito, cátodo, sellos e interconectores. El TEC de los cermets anódicos La0,8Sr0,2Cr0,5Mn0,5O2,85-XCu se muestra en la tabla 2 y en la gráfica de la figura 4. Los ánodos mostraron un coeficiente de expansión térmico isotrópico y positivo hasta 800 ¿C. La tabla 2 también indica ciertas diferencias entre los coeficientes de expansión térmica, siendo ligeramente menor a medida que la concentración de Cu aumenta. Se puede observar que las concentraciones de 25 a 35% de Cu mostraron la tendencia a formar un valor promedio máximo de expansión térmica de 13,5 μm m−1 ¿C−1 y 13,2 μm m−1 ¿C−1, respectivamente, contrariamente a lo que sucede cuando la cantidad de Cu alcanza el 45%, obteniéndose un TEC de 12,8 μm m−1 ¿C−1. Es interesante observar en las micrografías obtenidas por SEM (fig. 3) que la cantidad de porosidad se redujo y a la vez el valor del TEC fue también disminuyendo al incrementar la cantidad de Cu (25-45%). Considerando los resultados de otros autores, es bien conocido que el promedio en el coeficiente de expansión térmica para el compuesto LSCM puede variar de 9,3 μm m−1 ¿C−1 a 11,8 μm m-1 ¿C−1 en el rango de temperatura de 25 a 900 ¿C [44,45]. Pero según nuestros resultados, los coeficientes pueden aumentar cuando en el compuesto LSCM se aumenta la sustitución parcial de los iones de Cu2+ en la estructura cristalina, lo cual conduce a incrementar el volumen de la celda [25]. La tendencia de los datos del coeficiente de expansión térmica sugiere que las muestras con 25 y 35% de Cu representan los ánodos más apropiados para aplicaciones en las celdas SOFC; además, estos resultados pueden permitir el uso de diversos materiales para los demás componentes de la celda, por ejemplo en electrólitos tipo Gd0,2Ce0,8O2-δ (TEC ≈ 12,9 μm m−1 ¿C−1) [46–48] y Sm0,2Ce0,8O2-δ (TEC ≈ 13,3 μm m−1 ¿C−1) [49,50]; cátodos como el material La0,6Sr0,4MnO3 (TEC ≈ 13 μm m−1 ¿C) [51]; e interconectores como el material LaCr0,9Co0,1O3 (TEC ≈ 13,1 μm m−1 ¿C) [52], así como algunos otros compuestos base Cr o Ni [53]. De esta manera se pueden evitar problemas como fracturas en la interface del ánodo. El uso de estos cermets puede considerarse una de las opciones más sencillas y rentables; además, un beneficio adicional es el efecto catalítico en estos sistemas [54,55], lo cual se ha reportado ampliamente por varios autores en diversas reacciones que involucran hidrocarburos; un ejemplo de ello es la oxidación de CO [56,57], reformado con vapor de metanol [58–60], síntesis de metanol [61,62], descomposición de metanol [63], oxidación de metano [64], oxidación de propano y tolueno [65] y oxidación de carbono [66].
Figura 4 – Comportamiento del coeficiente de expansión térmica (TEC) de los ánodos La0,8Sr0,2Cr0,5Mn0,5O3-δ+XCu.
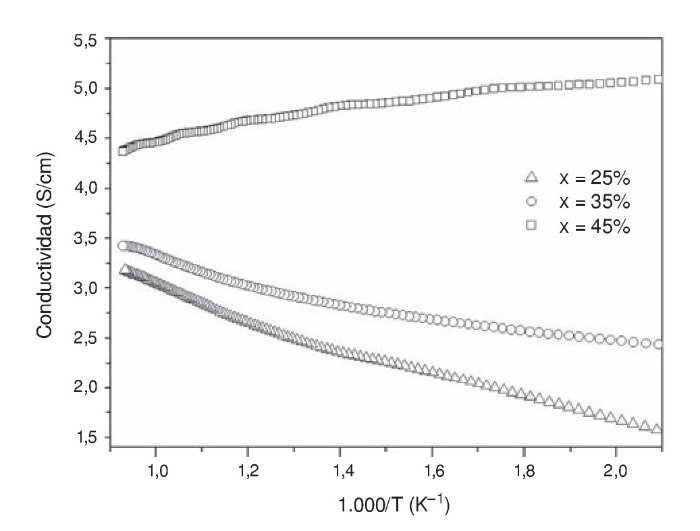
Conductividad electrónica
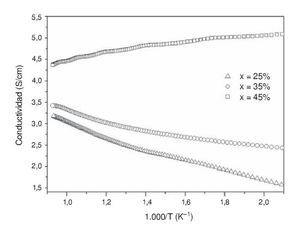
En la figura 5 se muestran las conductividades eléctricas de los cermets tipo perovskita La0,8Sr0,2Cr0,5Mn0,5O2,85 desde temperatura ambiente hasta 800 ¿C en función de la concentración de Cu (25-45%) y bajo una atmósfera de 10%H2-90%N2. Se observa que la resistividad eléctrica disminuye notablemente en alta temperatura cuando las concentraciones de Cu son del 25 y 35% en el compuesto LSCM. Según el gráfico, para las composiciones entre 25 y 35% de cobre se tiene una pendiente negativa y un comportamiento tipo semiconductor. Por el contrario, la concentración de LSCM-Cu del 45% muestra un comportamiento tipo metálico con pendiente positiva en todo el rango de temperatura. Un ánodo ideal posee suficiente conductividad electrónica (generalmente > 100 S/cm) para asegurar de manera eficiente la generación de corriente. Sin embargo, al tratar de optimizar la porosidad de la estructura, la conductividad puede reducirse hasta un valor de 1 S/cm [67]. Generalmente, los óxidos tipo perovskita poseen una baja conductividad electrónica comparada con los materiales base Ni. En este contexto se puede mencionar el material La0,75Sr0,25Cr0,5Mn0,5O3, que es un conductor tipo-p y tiene una conductividad de 38 S/cm a una temperatura aproximada de 900 ¿C. Sin embargo, su conductividad eléctrica de 1.5 S/cm es mucho menor en una atmósfera reductora (H2) [68]. Por lo tanto, es necesaria una fase conductora que sirva de apoyo en un ambiente reductor. Según lo anterior, se esperaría que la perovskita La0,8Sr0,2Cr0,5Mn0,5O2,85 en este estudio muestre una conductividad relativamente baja. Sin embargo, al observar la figura 5, las conductividades obtenidas para las 3 muestras con 25, 35 y 45% de Cu alcanzan un valor máximo de 3,25, 3,4 y 5,2 S/cm, respectivamente, bajo una atmósfera reductora de 10%H2+90%N2. Estos resultados de conductividad son varias veces más altos que los obtenidos en el compuesto La0,75Sr0,25Cr0,5Mn0,5O3 en condiciones similares (≈ 1,02 S/cm en hidrógeno) [68]. Esto sugiere que el material La0,8Sr0,2Cr0,5Mn0,5O2,85 puede tener un mejor rendimiento en comparación al compuesto La0,75Sr0,25Cr0,5Mn0,5O3 respecto a la eficiencia de corriente generada y transferencia electrónica. Para el caso de las muestras con 25 y 35% de Cu, es posible que la reducción de Mn+4 a Mn+3 resultara tanto en la reducción de la densidad en la nube electrónica de los orbitales externos, como en la disminución de formación de vacancias de oxígeno; ambos procesos bloquearon el salto de los electrones, lo cual puede explicar la menor conductividad eléctrica en una atmósfera reductora con hidrógeno comparada con la muestra con 45% de Cu. La reducción en conductividad eléctrica sugiere que la conductividad tipo-p en los portadores de carga es el mecanismo dominante en ambas muestras de 25 y 35% de Cu.
Figura 5 – comportamiento de la conductividad eléctrica de los ánodos La0,8Sr0,2Cr0,5Mn0,5O3-δ+XCu reducidos en una atmósfera de 10%H2-90%N2.
Cabe resaltar que la sustitución de Sr en el sitio A de la perovskita promueve una compensación de carga en relación a la transición de Cr3+/Mn3+ a Cr4+/Mn4. Tal compensación se consigue mediante la formación de vacancias de oxígeno a partir de la introducción de Sr en la posición del lantano. Esta creación de vacantes proviene del propio equilibrio del oxígeno de la muestra con el oxígeno del ambiente a bajas presiones parciales de oxígeno. La conductividad depende del tipo de defecto electrónico involucrado; por lo tanto, la conductividad iónica de la perovskita se puede incrementar mientras que la conductividad electrónica disminuye de manera significante en un medio reductor debido no solo a las vacancias generadas, sino que ello puede también estar relacionado con la incorporación de dopantes donadores y aceptores dentro de la red de la perovskita, permitiendo un exceso de portadores de carga que pueden influir de forma positiva o negativa en el material. En este sentido, la conductividad electrónica (electrón/hueco) en materiales semiconductores ocurre generalmente bien a través de estados deslocalizados en la banda de conducción/valencia, o por saltos («hopping») entre estados localizados debido a mecanismos térmicos. En este sentido, considerando la valencia mixta del manganeso y bajo una atmósfera reductora, el total del número de portadores de carga disminuyen debido a la reducción del Mn+4, lo cual puede conducir a la caída de la conductividad; además, la posibilidad de dislocaciones y bordes de grano en el material reduce la conductividad del cermet y cada imperfección contribuye a un incremento en la resistividad, pero más importante aún es la movilidad del portador eléctrico que tiene una relación directa entre la movilidad de la vacancia y la resistividad total que obedece la regla de Matthiessen de acuerdo a la ecuación = T + d, donde Pd es igual a la contribución proveniente de todos los defectos y además proporcional a la concentración X de Cu en cada compuesto [69]. Es importante mencionar que, a pesar de que las diferentes relaciones de Cr/Mn utilizadas en la perovskita han demostrado resultados comparables a los cermets Ni-YSZ en celdas alimentadas con hidrógeno, existe la posibilidad de formación de depósitos de carbón que también pueden afectar el rendimiento de la conductividad7. En este caso, la adición de una fase eléctrica conductora de Cu puede reducir la generación de estos depósitos y mejorar la conductividad del electrodo anódico La0,8Sr0,2Cr0,5Mn0,5O2,85. Un punto importante a mencionar es que, debido al carácter semiconductor y a la cantidad de porosidad de los ánodos observada en SEM, se pueden incrementar los sitios de reacción en la triple frontera de fase (TPB) [70]; de lo contrario, la TPB estaría limitada a la interface cercana al colector de corriente si la conductividad electrónica disminuye. Por lo tanto, los resultados en conductividad eléctrica sugieren que los ánodos con composiciones de 25 y 35% en peso de Cu serían los más adecuados para su uso en celdas SOFC [71].
Los procesos electroquímicos asociados a la oxidación del combustible dependen de muchos factores, entre los que destacan la conducción mixta iónica-electrónica del electrodo. Este material (LSCM) ha demostrado ser estable en un ambiente redox, con un rendimiento electroquímico comparable al cermet Ni/YSZ y buena estabilidad catalítica para la electrooxidación del combustible a altas temperaturas [72]. La oxidación del combustible sobre esta perovskita impregnada de Cu es un proceso complejo, y es evidente que se requiere una mayor profundidad en las investigaciones relacionadas para poder entender fundamentalmente los mecanismos de reacción y cinética en estos materiales. Por último, cabe mencionar que el volumen de la celda de LSCM puede aumentar después del proceso de reducción, y posiblemente no cambiaría cuando la cantidad de Cu aumente. Por lo tanto, el comportamiento semiconductor es influenciado en gran medida por la movilidad de carga (e−) en los huecos de la estructura perovskita, los cuales se localizan principalmente en el sitio B [73].
Por otra parte, los materiales que estudiamos en este artículo son conductores iónico-electrónicos y los procesos de conducción ocurren a alta temperatura, pues a temperatura ambiente la movilidad de sus portadores es muy pequeña. Estos procesos necesitan ser activados con la temperatura, lo que implica que se producirá un aumento de la conductividad a medida que la temperatura va aumentando. El proceso de conducción, térmicamente activado, como función de la temperatura de trabajo, generalmente se puede expresar a través de la relación empírica de Arrhenius. En este estudio, y considerando el comportamiento de las gráficas de conductividad electrónica (fig. 5), se ha determinado la energía de activación, Ea, a partir de la ecuación (3):
donde σ es la conductividad, A es un factor exponencial, T es la temperatura absoluta, es la constante de Boltzmann y Ea es la energía de activación.
Como se observa en la tabla 3, la energía de activación fue mayor para las muestras con 25 y 35% de cobre obteniendo valores máximos de 19,26 y 8,58 kJ/mol, donde el contenido de la perovskita LSCM fue más alto. Sin embargo, para la concentración de 45%Cu se obtuvo un valor mínimo de 0,74 kJ/mol, lo cual es de esperar considerando el carácter iónico-electrónico que tiene la perovskita, donde la energía de movilidad de carga es fundamental. En consecuencia, los ánodos con mayor cantidad de perovskita aumentaron su energía de activación, que es un factor determinante para su posible aplicación como ánodo en celdas SOFC [74].
Conclusiones
Se sintetizaron por la ruta sol-gel cermets tipo perovskita La0,8Sr0,2Cr0,5Mn0,5O2,85-XCu, seguido por el sinterizado y reducción de 3 compósitos variando la cantidad de cobre XCu (X = 25, 35, 45%). En las condiciones de reducción, la perovskita La0,8Sr0,2Cr0,5Mn0,5O2,85 es altamente estable. En la difracción de rayos X no se observó cambio de estructura u origen de fases secundarias. Los resultados de conductividad eléctrica muestran un cambio de comportamiento semiconductor a metálico cuando la concentración de Cu se encuentra a 45%, no así en las muestras del 25 y 35%, donde el comportamiento es de tipo semiconductor, observando que la resistencia disminuye con la temperatura, aumentando la conductividad. El cambio de semiconductor a metálico puede atribuirse principalmente al contenido más alto de Cu; sin embargo, también pueden influir la porosidad y las vacancias electrónicas existentes que obedecen a la regla de Mattheissen.
Los coeficientes de expansión térmica (TEC) muestran una dependencia lineal pero inversamente proporcional a la concentración Cu en relación a que cuando la cantidad de Cu aumenta, el TEC disminuye. Se observa que hay una relación directa entre el valor del TEC con la energía de activación de cada cermet. Además, de acuerdo a las micrografías observadas de SEM, el TEC disminuye cuando la cantidad de porosidad también lo hace a medida que la cantidad de Cu aumenta. Los resultados obtenidos respecto su carácter semiconductor, TEC, energía de activación y porosidad de las muestras con el 25 y 35% de Cu pueden sugerir el uso de electrólitos tipo Gd0,2Ce0,8O2-δ y Sm0,2Ce0,8O2-δ; cátodos como el material La0,6Sr0,4MnO3; e interconectores como el material LaCr0,9Co0,1O3, así como algunos otros compuestos base Cr o Ni, con lo cual además puede reducirse el deterioro de la interface del ánodo. Según estos resultados, los ánodos con 25 y 35% de Cu son los más apropiados para su aplicación en celdas de combustible de óxido sólido de temperatura intermedia (SOFC-IT) a 800 ¿C bajo una atmósfera de 10%H2+90%N2.
Agradecimientos
Los autores agradecen al Posgrado de Ingeniería Ambiental de la Facultad de Ingeniería Química perteneciente a la Universidad Michoacana de San Nicolás de Hidalgo, por el apoyo brindado en la realización de esta investigación. Se agradece notablemente al Consejo Nacional de Ciencia y Tecnología (CONACyT) (Beca de Posdoctorado otorgada al Dr. José Juan Alvarado Flores).
Historia del artículo:
Recibido el 11 de mayo de 2015
Aceptado el 20 de julio de 2015
On-line el 14 de agosto de 2015
http://dx.doi.org/10.1016/j.bsecv.2015.08.001
∗ Autor para correspondencia.
Correo electrónico: cedhryck@hotmail.com (J.J. Alvarado Flores).