En esta comunicación se presentan unos primeros resultados de interés relevante sobre la obtención de carbonato de calcio precipitado como nanopartículas de los polimorfos vaterita y calcita. Se parte de precursores inorgánicos, nitrato de calcio tetrahidratado y bicarbonato de sodio, en presencia de sacarosa empleada como aditivo orgánico en disolución acuosa. Las fases cristalinas formadas se estudian mediante difracción de rayos X con un método cuantitativo y la morfología de las partículas obtenidas, mediante microscopia electrónica de barrido. Cuando no se emplea el aditivo orgánico se consigue la precipitación de calcita, polimorfo más estable termodinámicamente, como fase nanocristalina predominante (83%) mezclada con vaterita. Con una alta concentración del aditivo (67%) se obtiene vaterita como fase mayoritaria (>98%). La utilización del aditivo en distinta proporción produce la formación de los 2 polimorfos de carbonato de calcio, siendo vaterita la fase predominante. La morfología de las partículas obtenidas muestra la formación de partículas nanoesféricas uniformes con contornos irregulares que se asocian a vaterita, así como partículas romboédricas de calcita cuando está presente, con potencial interés por su biocompatibilidad para su aplicación como biomateriales en implantes óseos.
In this communication, it is reported the first relevant results on a broad study on the preparation of calcium carbonate as precipitated nanoparticles of the polymorphs vaterite and calcite. The inorganic precursors are calcium nitrate tetrahydrate and sodium hydrogencarbonate, and the organic additive is sucrose in aqueous solution. The crystalline phases are studied by X-Ray powder diffraction, using a quantitative method, and the particle morphologies using scanning electron microscopy. When the organic additive is not used, calcite as the most thermodynamically stable polymorph is precipitated as nanocrystalline predominant phase (83%) mixed with vaterite. Using a high concentration of the organic additive (67%), vaterite is precipitated as the nanocrystalline predominant phase (>98%). Using the additive in variable proportion produces the precipitation of the 2 polymorphs, being vaterite always the predominant phase. The morphology of the precipitated calcium carbonate shows nanospherical uniform particles with irregular contourns of vaterite and characteristic rhomboedral particles of calcite when this phase is present. According to the biocompatibility, this material shows interest in applications as biomaterial in bone implants.
Entre los polimorfos anhidros de carbonato de calcio (denominados calcita, aragonito y vaterita), la vaterita es termodinámicamente el menos estable y posee una alta superficie específica, más alta solubilidad en agua que los otros polimorfos y una baja densidad [1,2]. En condiciones normales de temperatura y presión, esta fase se transforma en aragonito y calcita, lo que produce que la vaterita se encuentre muy raramente en la naturaleza, al ser una fase metaestable [1–4]. Es importante conseguir su síntesis como una fase lo más pura posible y estabilizar su forma cristalina, dada su importancia como un material de interés por sus aplicaciones, en particular, en abrasivos, limpiadores y absorbentes; en el desarrollo de biomarcadores y biosensores; en especialidades biomédicas como sistema de transporte; al no ser tóxico y por su biocompatibilidad, en la obtención de biomateriales para implantes de huesos; en la encapsulación de moléculas con aplicaciones terapéuticas para su liberación controlada, donde el tamaño de las partículas es, con frecuencia, un parámetro crucial. De hecho, en los últimos años se han realizado diversas investigaciones con todos estos propósitos [4–10].
Micropartículas de vaterita se pueden obtener por una serie de vías de síntesis, aunque la mayoría de ellas son laboriosas o bien requieren condiciones extremas y equipos especiales. Los procedimientos de obtención se basan en métodos de burbujeo de CO2 y métodos biomiméticos con 2 aproximaciones: métodos de precipitación y por emulsión reversible [2–13]. En ellos se ha pretendido controlar los factores de influencia para la precipitación, nucleación y crecimiento, además de la estabilidad de los cristales de carbonato de calcio y, en particular, de vaterita, como son: naturaleza de los precursores, disolventes empleados, presencia de aditivos orgánicos o inorgánicos, temperatura, pH del medio, concentración iónica, agitación del medio y otros, afectándose el tamaño y la forma de los polimorfos obtenidos [8,9]. Por ejemplo, en la precipitación de vaterita utilizando etilenglicol como aditivo orgánico y acetato de calcio, en presencia de bicarbonato de sodio, se han obtenido microesferas huecas de diámetro 800±100nm [11], pero también nanoesferas de tamaño variable entre 20 y 430nm [12]. En este caso, la función del aditivo orgánico fue una disminución de la solubilidad y de la velocidad de crecimiento cristalino del carbonato de calcio. Asimismo, se ha encontrado que diferentes concentraciones de suero de bovino y sacarosa al 20% en peso influyen en la cristalización de CaCO3 de tal modo que un periodo de 7 días de incubación produce la formación de vaterita con respecto a calcita [13]. A pesar de todos estos avances, tanto la obtención de vaterita con pureza elevada como el efecto de la incorporación de diversos aditivos sobre el mecanismo o mecanismos de cristalización todavía no se conocen con certeza.
El objetivo del presente estudio es investigar si es factible la obtención de vaterita como una fase estable de carbonato de calcio en forma de nanopartículas, dado su potencial interés en aplicaciones como biomaterial. En este trabajo se emplean precursores inorgánicos en presencia de sacarosa a distintas concentraciones en medio acuoso, siendo todas estas materias primas de un bajo coste relativo.
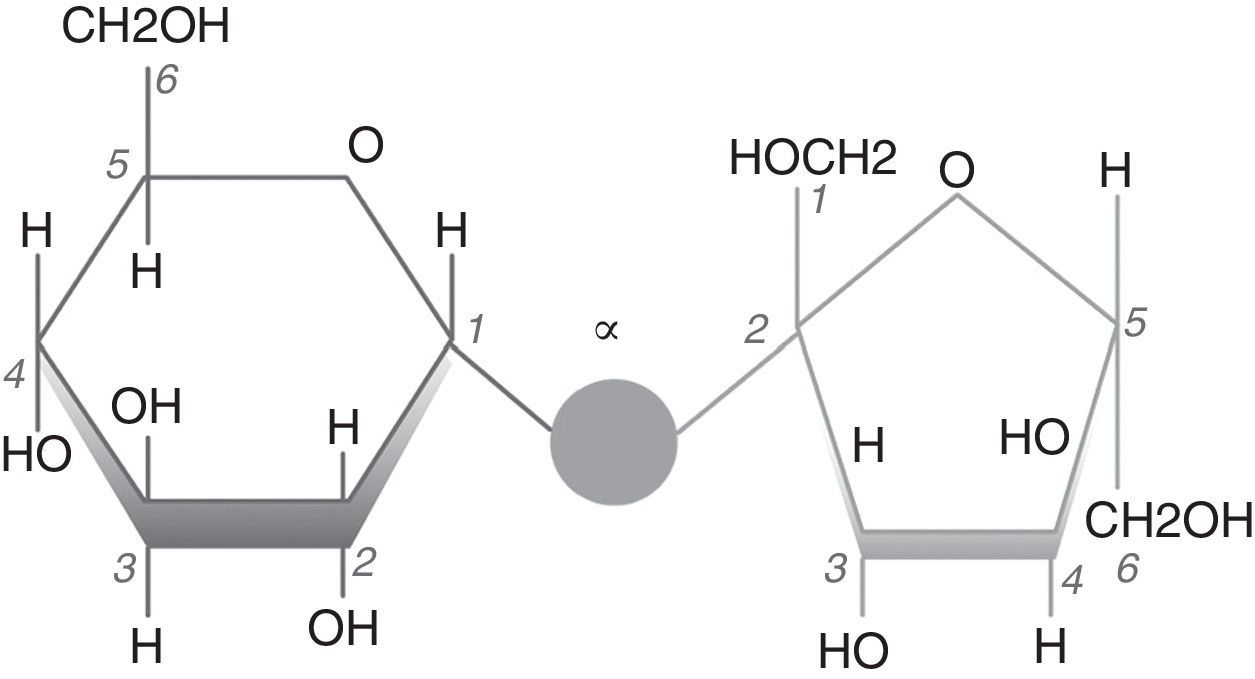
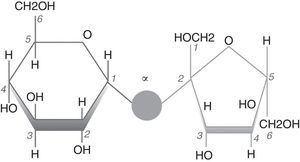
Procedimiento experimentalObtención del carbonato de calcio mediante precipitaciónComo precursores inorgánicos se utilizan nitrato de calcio tetrahidratado Ca(NO3)2.4H2O y bicarbonato de sodio NaHCO3 (Panreac). El azúcar empleado es el disacárido sacarosa (C12H22O11), formado por una molécula de glucosa y otra de fructosa. Químicamente es α-D-glucopiranosil-(1-2)-β-fructofuranósido (fig. 1), muy soluble en agua [14]. Se ha utilizado para ello un producto industrial puro, resultado de la fabricación de este azúcar (CEVITAL, Algeria). La concentración de sacarosa en disolución acuosa, como etapa previa a la obtención del azúcar cristalizado, es del 67% en peso y posee una densidad de 1,32-1,34.
En las experiencias realizadas se parte de 2 disoluciones acuosas 1M de nitrato de calcio tetrahidratado y bicarbonato de sodio en 2 recipientes de vidrio y se añaden volúmenes distintos conocidos de la disolución al 67% en peso de sacarosa (0-50mL) a las 2 disoluciones. Se ajusta el volumen final de cada una con agua destilada hasta 50mL. Las 2 disoluciones se mezclan en otro recipiente de vidrio que se utiliza como reactor, a temperatura de 30°C, colocado en un baño termostático, y se agita a 800rpm durante 15min. El producto que precipita se filtra, se lava con agua destilada y se seca en estufa a 103°C.
Técnicas de caracterizaciónLa técnica de difracción de rayos X (DRX) de polvo cristalino se utiliza para realizar una caracterización cualitativa de los distintos polimorfos de carbonato de calcio. Se emplea un equipo Philips X’Pert PRO de PANalytical con radiación CuKα. El porcentaje relativo de cada polimorfo, calcita o vaterita se determina por DRX siguiendo un procedimiento cuantitativo propuesto en la bibliografía y debidamente contrastado [15]. Dicho procedimiento supone que la muestra es uniforme y homogénea, formada por una mezcla de 2 componentes (vaterita y calcita), construyendo una recta de calibrado de mezclas binarias de composición conocida. El error se estima inferior al 2%. Se consideran para esta determinación las reflexiones 104 de calcita y 110 de vaterita. Asimismo, la microscopia electrónica de barrido (MEB) se utiliza para el examen de la morfología y las características texturales de los materiales obtenidos por medio de un equipo Philips ESEM XL30-TMP-W.
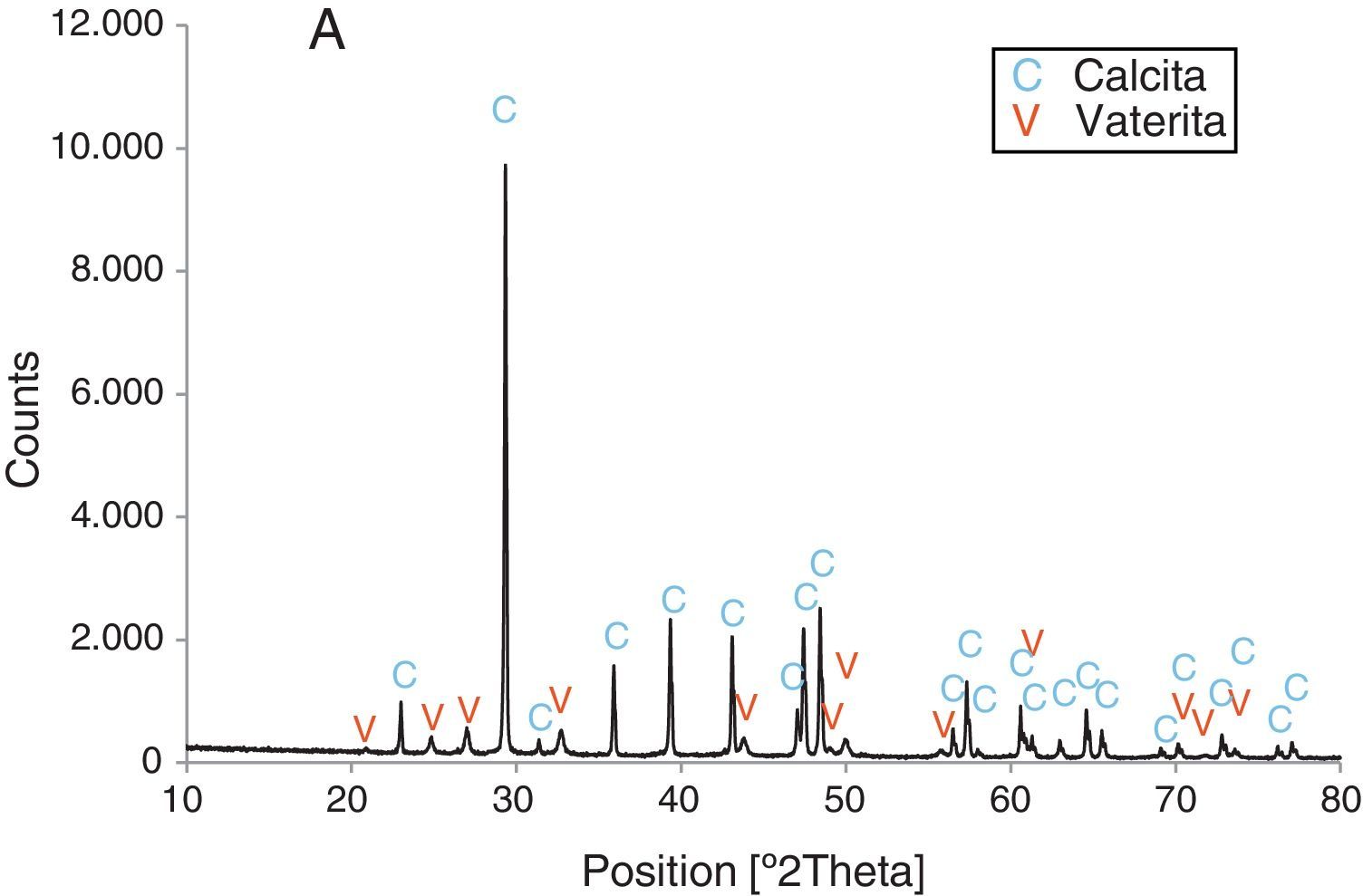
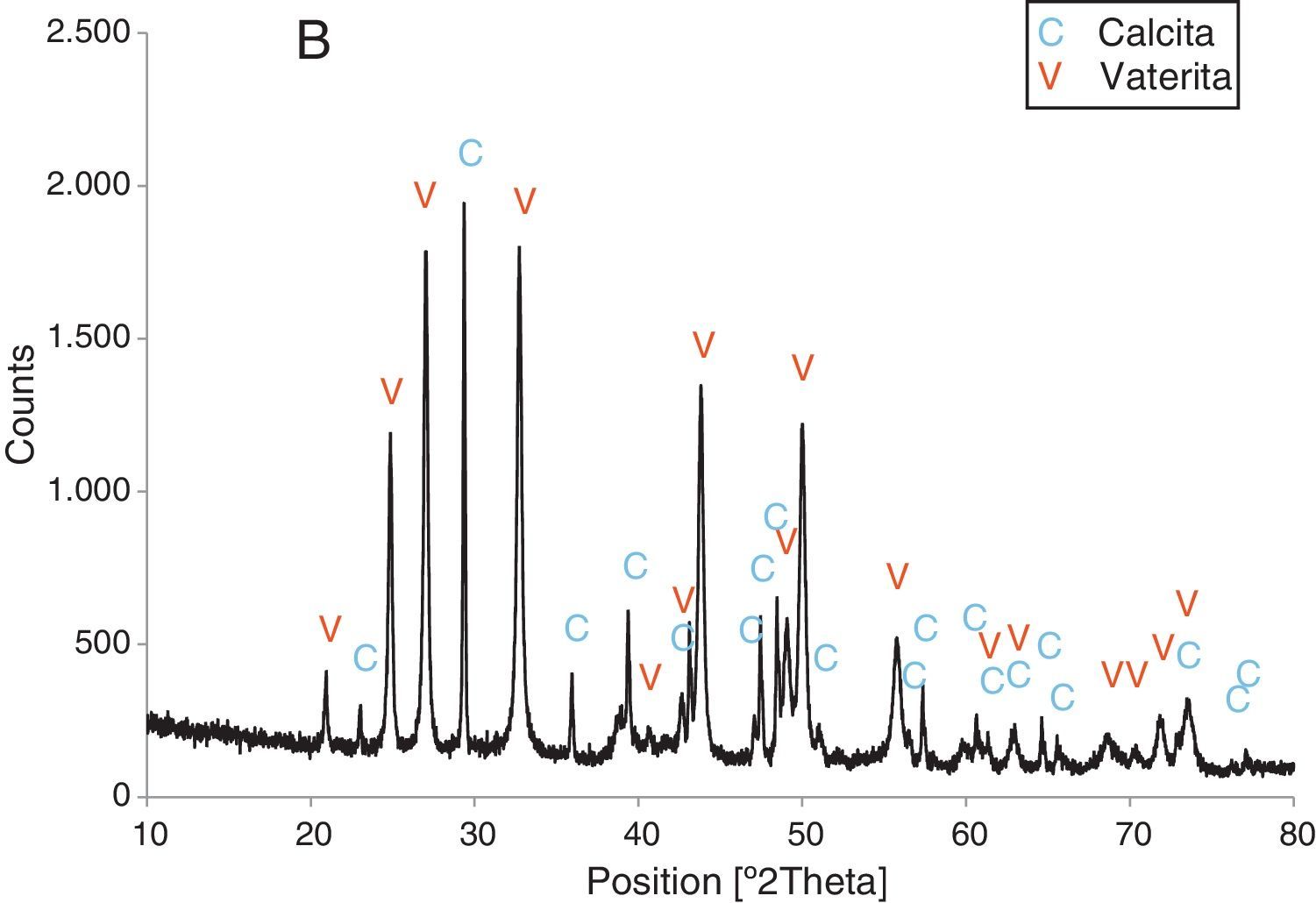
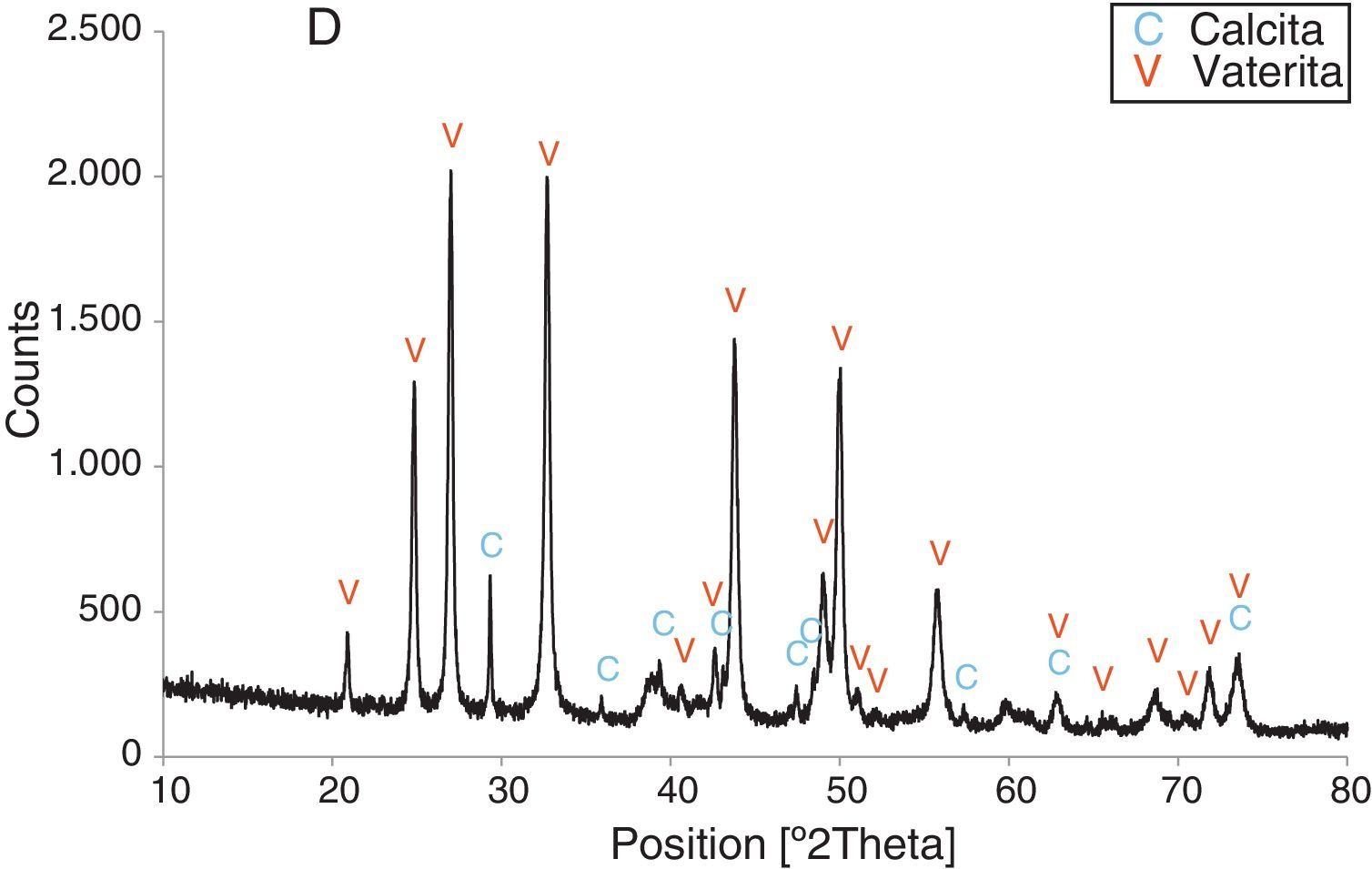
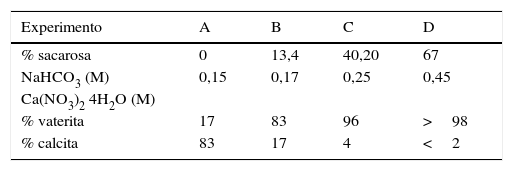
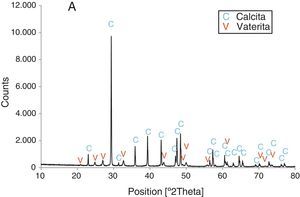
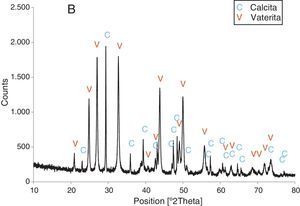
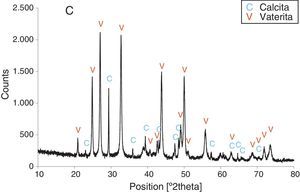
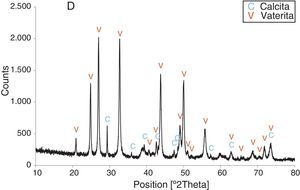
Resultados obtenidosComo resultados más destacados de la serie de experiencias realizadas con los precursores inorgánicos, las figuras 2–5 muestran una serie de difractogramas de DRX correspondientes a los distintos precipitados obtenidos, en presencia o ausencia de la disolución de sacarosa como aditivo en distintos porcentajes (0-67% en peso). Con arreglo a estos resultados, que no permiten asegurar con certeza si existe formación de carbonato de calcio en estado amorfo [4], se comprueba la presencia de los 2 polimorfos de carbonato de calcio, vaterita y calcita. En ningún caso se detecta la presencia del otro polimorfo (aragonito). La calcita es predominante, pero aparece mezclada con vaterita cuando el aditivo está ausente del medio acuoso. Por el contrario, la vaterita es el polimorfo que se identifica por DRX como única fase cristalina presente cuando se emplea la máxima cantidad de aditivo orgánico. La tabla 1 presenta las distintas condiciones experimentales utilizadas en el estudio realizado, así como el resultado del análisis cuantitativo por DRX. Con estos datos, se deduce que la fase calcita obtenida en ausencia del aditivo (0% de sacarosa) es de un 83% en peso frente a un 17% de vaterita, pero esta relación se invierte por adición de disolución del azúcar (20mL en los experimentos realizados), de tal modo que un 13,4% de sacarosa da lugar a un precipitado de carbonato de calcio compuesto de un 83% de vaterita y un 17% de calcita (fig. 3).
Resumen de las condiciones experimentales y los resultados de la precipitación de carbonato de calcio, polimorfos vaterita y calcita, realizada a 30°C
| Experimento | A | B | C | D |
|---|---|---|---|---|
| % sacarosa | 0 | 13,4 | 40,20 | 67 |
| NaHCO3 (M) | 0,15 | 0,17 | 0,25 | 0,45 |
| Ca(NO3)2 4H2O (M) | ||||
| % vaterita | 17 | 83 | 96 | >98 |
| % calcita | 83 | 17 | 4 | <2 |
Los porcentajes de vaterita y calcita se han determinado por DRX según el procedimiento descrito en Kontoyannis y Vagenas [15].
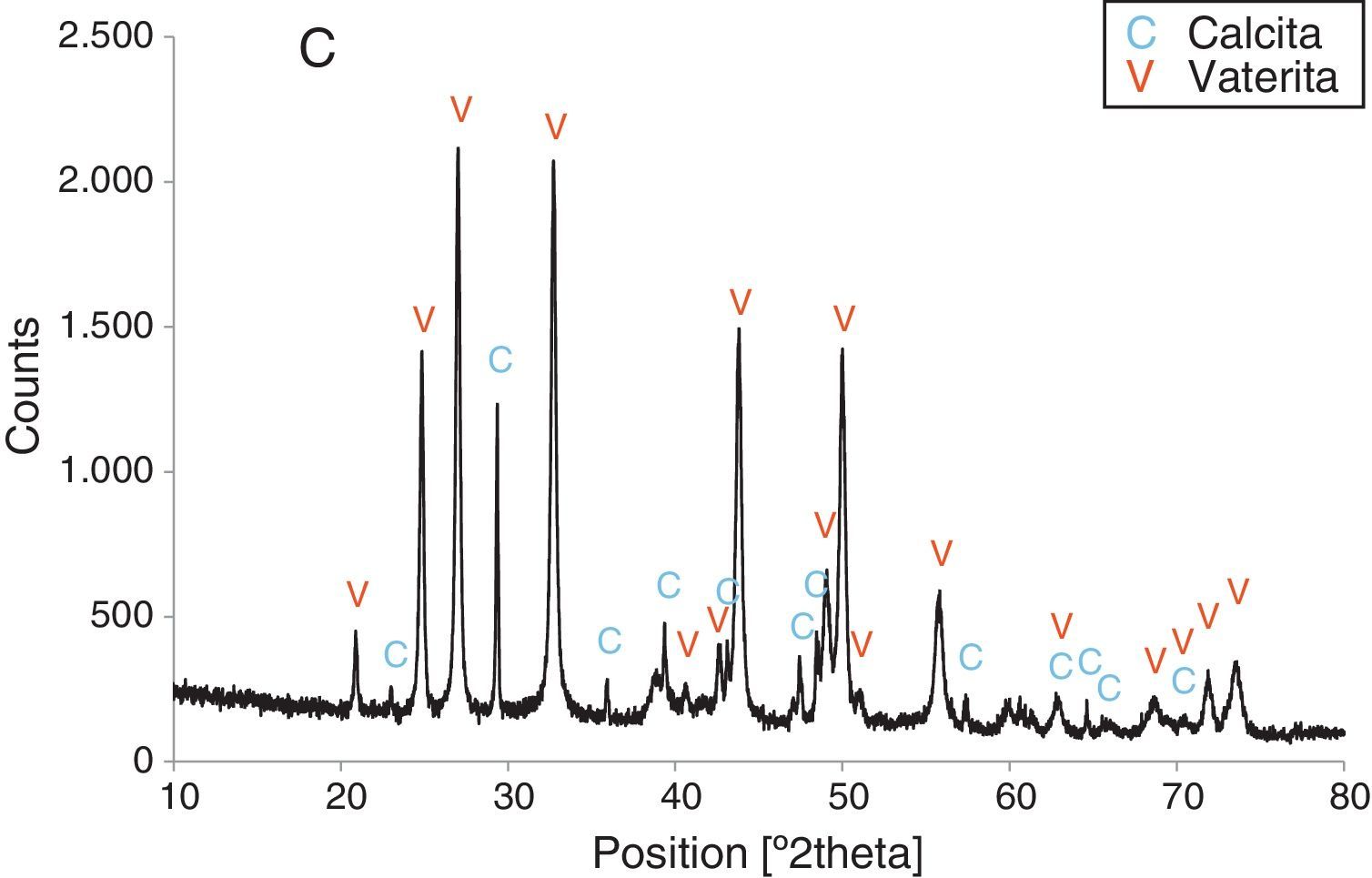
Por otra parte, con adiciones crecientes de la disolución de sacarosa, que corresponden a 26,8, 40,2 y 53,6% en peso, y de las sales (0,2, 0,25 y 0,32M), según el estudio realizado por DRX (figs. 2–5) y los resultados de la tabla 1, se consigue que los precipitados obtenidos de carbonato de calcio cristalino muestren siempre una mayor proporción de vaterita (91,6, 95,6 y 97,6%, respectivamente) e inferior de calcita (8,4, 4,4 y 2,4%, respectivamente). Por último, bajo las condiciones experimentales descritas y empleando la disolución con el mayor porcentaje disuelto de sacarosa (67%), se produce vaterita (fig. 5) como única fase cristalina (>98%), siendo el polimorfo menos estable termodinámicamente.
Los cambios en morfología y tamaño de los cristales precipitados en función de la concentración del aditivo se estudian por MEB, seleccionándose una serie de microfotografías representativas (fig. 6). En ausencia de sacarosa, la fase cristalina predominante de carbonato de calcio es la calcita (fig. 2) y los cristales obtenidos aparecen bajo forma cúbica, formando romboedros, con tamaños variables de 4-6μm. Se detectan también formas esféricas con superficies uniformes y suaves con un diámetro medio similar y que pueden considerarse como microesferas, asociándose a la presencia del otro polimorfo, vaterita, que se ha identificado previamente por DRX (fig. 2). En presencia de sacarosa a varias concentraciones (13,4, 26,80, 40,20, 53,60% en peso), estas microesferas que se obtienen de vaterita se van reduciendo de tamaño y, paralelamente, cada vez es más difícil identificar formas romboédricas de calcita (fig. 6). A la mayor concentración posible del aditivo empleado en la precipitación, las microesferas de vaterita (>98% según DRX; fig. 5 y tabla 1) van siendo de formas más irregulares y alcanzan su mínimo tamaño, del orden de 0,5-1μm o incluso inferior; es decir, partículas submicrónicas y otras que pueden considerarse nanopartículas.
Microfotografía de MEB de los productos precipitados que corresponden a los DRX de la figuras 2–5 (A-D).
Los resultados expuestos, además de ser prometedores al aplicar como aditivo sacarosa, ponen de manifiesto también el bajo costo relativo que lleva asociada la obtención de vaterita prácticamente pura que venía siendo un reto en la bibliografía.
Una posible explicación de lo que ocurre en este sistema se basa en la alta solubilidad relativa de la fase vaterita en agua con respecto a calcita. Esta propiedad podría acelerar el proceso de su transformación, una vez nucleada, en la fase más estable termodinámicamente y menos soluble en agua que es la calcita [1–4]. De acuerdo con esta explicación, prevalecería entonces la calcita en el precipitado formado en medio acuoso cuando no se emplea el aditivo orgánico, o bien a una baja concentración de este, como así se observa experimentalmente (tabla 1, A). Se comprueba que existe un «umbral» de proporción en la obtención de ambos polimorfos sin el aditivo que se estima en un 80% de calcita y el resto de vaterita, según los resultados (tabla 1). El aditivo orgánico, un disacárido que puede formar compuestos con iones inorgánicos [14,16], permite entonces un cierto control en la precipitación de carbonato de calcio en este sistema al reaccionar los iones Ca2+ con los iones carbonato y bicarbonato en disolución que proceden de la hidrólisis del precursor inorgánico NaHCO3. Podría llegar a cambiar la carga de las partículas por enlace de estos iones con Ca2+ que, en parte, también pueden formar tanto sacarato monocálcico como bicálcico y tricálcico con la sacarosa disuelta en el medio, si se encuentra presente, y dependiendo de su concentración. De este modo, dichos compuestos pueden adsorberse sobre planos específicos de los cristales que se van nucleando en el medio, con influencia para modificar su crecimiento por nanoagregación y su morfología.
No hay que despreciar tampoco el posible efecto de la formación de enlaces de hidrógeno entre los grupos OH del disacárido y las moléculas de agua del medio [14], que serían mayores a medida que se aumenta la concentración del aditivo orgánico. Estas interacciones hacen disminuir la presencia de moléculas de agua libres, y los nanocristales de carbonato de calcio que se formarían inicialmente, incluso en los espacios intermoleculares del disacárido, no se disolverían. Al ser la vaterita un polimorfo más soluble en agua que la calcita, esto aceleraría el fenómeno de su transformación en el más estable termodinámicamente y menos soluble en agua que es la calcita. Los nanocristales de vaterita formarían agregados de partículas que darían lugar a las microesferas, aunque algunas más irregulares, observadas por MEB (fig. 6) y que son perfectamente cristalinas (figs. 2–5). La nucleación y crecimiento de los cristales de calcita se inhibiría así gradualmente, favoreciendo el de vaterita, y llegaría entonces a desaparecer la calcita. Se puede afirmar que esto sucede casi completamente en las experiencias realizadas al emplear la disolución de sacarosa como aditivo orgánico a su máxima concentración (67% en peso). En el presente estudio se han obtenido microesferas de vaterita, según las observaciones al MEB (fig. 6), pero Ahmed y Ganguli [17], bajo otras condiciones experimentales y sin sacarosa, encuentran que la temperatura y la concentración de Ca2+ es esencial para obtener vaterita como fase pura. Sin embargo, estos autores observan morfologías por MEB que van desde cristales planos hexagonales, también característicos de vaterita, hasta partículas nanocristalinas alargadas («nanorods») y partículas esféricas. Han et al. [5], con un método de obtención de carbonato de calcio mediante burbujeo de CO2 y distintas variables de proceso, observan por MEB partículas esféricas formadas a 25°C compuestas de vaterita y calcita; a 60°C observan partículas alargadas de aragonito. Zhao et al. [18] también obtienen microesferas de vaterita. Un examen más detallado de la superficie de las partículas muestra que son esferoides más que esferas, estando formadas por subunidades de tamaño más pequeño y que se consideran partículas monocristalinas de vaterita, o nanogramos de acuerdo con Trushina et al. [9]. Es importante mencionar que la vaterita precipitada puede presentarse con morfologías más complejas, dependiendo de las condiciones experimentales de su obtención, pues las partículas pueden constituir estructuras de tipo lenticular (lentejas o esferoides más planos), framboidales, en roseta con simetría hexagonal, formas similares a huevos fritos, similares a coliflores o en forma de pétalos o piramidales, como han mostrado diversos autores [8,9].
Asimismo, los equilibrios iónicos en disolución acuosa en el sistema considerado pueden ser bastante complejos de analizar y el pH del medio es un factor de influencia. Al reaccionar el nitrato de calcio con bicarbonato de sodio en disolución acuosa, en una primera etapa se forma primero bicarbonato de calcio, soluble en medio acuoso, y después, en una segunda etapa, los cristales de carbonato de calcio pueden nuclearse y crecer por nanoagregación, formándose ambos polimorfos, vaterita y calcita, pero con predominancia del segundo (tabla 1, A) al ser menos soluble y disponer de mayor cantidad de moléculas de agua «libre», aunque con puentes de hidrógeno, en el medio. Aumentando entonces la concentración de sacarosa en el medio se reduce el número de moléculas de agua libres y, en consecuencia, disminuye su efecto sobre la transición de vaterita a calcita. De este modo, se promueve la estabilidad relativa de la primera sobre la segunda, a pesar de ser la fase calcita más estable termodinámicamente. Gómez-Morales et al. [3] estudian la nucleación de carbonato de calcio sin la presencia de compuestos orgánicos. Estos autores consideran la disolución de vaterita según el equilibrio CaCO3=Ca2++CO32− de su producto de solubilidad y un modelo de distintos equilibrios iónicos considerando las especies Ca2+, CO32−, HCO3− y HCO3Ca+. Identifican por DRX vaterita y calcita y morfologías por MEB de esferulitos aglomerados y discos (vaterita), así como romboedros polidispersos (calcita). En el presente sistema se incluiría, además, la influencia de los equilibrios correspondientes a la formación de sacaratos de calcio, ya expuesta anteriormente. Según otros autores [2,8,19], las partículas de vaterita que son metaestables se transforman en calcita por un mecanismo de disolución-precipitación. Este hecho podría explicar la presencia de calcita cuando no se añade aditivo orgánico (tabla 1). En este sentido, Kitamura [20] ha señalado que la transición vaterita/calcita puede estar influida por la presencia de macromoléculas orgánicas o inorgánicas en disolución, que pueden adsorberse en la interfase sólido-líquido y modificar así la energía superficial del cristal. La presencia de sacarosa en altas concentraciones (tabla 1) forma un líquido siruposo, altamente viscoso, que limitaría el espacio intermolecular donde se produce la formación de vaterita debido a un efecto estérico. En consecuencia, las partículas que se forman cuando se emplea sacarosa en concentraciones relativamente elevadas no son uniformes, son más pequeñas y poseen contornos irregulares (fig. 6), lo que se atribuye a este efecto.
La siguiente etapa de esta investigación será la obtención de biomateriales de interés a partir de vaterita precipitada según el método descrito. Estos biomateriales presentan una potencial aplicación en implantes de huesos a base de hidroxiapatita [8,9,21,22].
ConclusionesPartiendo de precursores inorgánicos, nitrato de calcio tetrahidratado y bicarbonato de sodio, las experiencias realizadas conducen a la obtención de carbonato de calcio mediante una reacción de precipitación en medio acuoso. Se consigue que la precipitación sea del polimorfo más estable termodinámicamente, calcita, en forma de partículas romboédricas en una proporción superior al 80% junto con vaterita sin emplear un aditivo orgánico.
La utilización de sacarosa en disolución acuosa como aditivo orgánico en distinta proporción, como se ha expuesto en este trabajo por primera vez, da lugar a la formación de los 2 polimorfos de carbonato de calcio, pero vaterita es la fase mayoritaria. Se pone de manifiesto el papel importante que juega el aditivo orgánico en este sistema en relación con la precipitación de los 2 polimorfos. Con una alta concentración del aditivo (67%), la fase obtenida es vaterita (>98%) con presencia de partículas submicrónicas y nanopartículas, presentando algunas morfología nanoesférica, siendo estas uniformes con contornos irregulares. Ese material particulado presenta un potencial interés para su aplicación como biomaterial en implantes óseos.
Se agradece la ayuda económica recibida por la Junta de Andalucía al grupo de investigación TEP 204, que ha permitido la realización de este trabajo.