La ablación de electrogramas fraccionados y complejos tiene una eficacia controvertida tras el aislamiento circunferencial de venas pulmonares. Si este es amplio podría eliminar una proporción elevada de dichos electrogramas, pudiendo no ser de utilidad la ablación de los restantes. Nuestros objetivos son conocer la distribución de los electrogramas fraccionados y complejos en la aurícula izquierda en la fibrilación auricular persistente y cuantificar después los eliminados tras una ablación circunferencial amplia de venas pulmonares.
Método y resultadosHemos realizado un mapa electroanatómico de electrogramas fraccionados y complejos de la aurícula izquierda, con un software especial para su identificación, a 20 pacientes con fibrilación auricular persistente. Sobre el mismo mapa, pero ciego a la información de la actividad eléctrica, se realizó una ablación circunferencial amplia de venas pulmonares (caída del voltaje a 0,05mV o 90% del valor basal) con el endpoint del aislamiento de todas las venas pulmonares comprobado mediante un catéter circular. Posteriormente se cuantificaron los electrogramas fraccionados y complejos eliminados con las coronas de ablación. La distribución fue homogénea, aunque con tendencia a una mayor densidad en cara anterior, lateral izquierda, septo y techo (75, 63, 59 y 56% del total de puntos de cada cara, respectivamente). Tras la ablación circunferencial, el 35,7% de los electrogramas fraccionados y complejos fueron eliminados.
ConclusiónLa distribución dispersa y homogénea de los electrogramas fraccionados y complejos hace que el aislamiento circunferencial de venas pulmonares sea insuficiente para su ablación, al eliminar una proporción baja de ellos.
Complex and fractionated electrograms ablation after circumferential pulmonary veins isolation has a controversial usefulness. If this is wide, it could eliminate a high proportion of them, so ablation of the rest might not be necessary. Our objectives are to determine the distribution of complex fractionated atrial electrograms in left atrium in persistent atrial fibrillation and to quantify how many of them are eliminated after a wide circumferential ablation of the left atrium.
Method and resultsWe performed an electroanatomical map, with software for detecting complex fractionated electrograms, in 20 consecutive patients with persistent atrial fibrillation. Supported by the same map, but blind to electrical data, we performed a wide circumferential ablation (voltage drop to less than 0.05mV or 90% of baseline value) to isolate all the pulmonary veins guided by a circular catheter. We quantified complex and atrial electrograms eliminated with encircling lines. The distribution was homogeneous, but slightly more dense in the anterior, left lateral wall, in the septum and the roof (75%, 63%, 59% and 56% of all electrograms of each wall, respectively). The 35,7% of them were eliminated after the circumferential ablation.
ConclusionComplex fractionated electrograms are homogeneously dispersed in the left atrium, so a wide circumferential ablation is not enough to ablate them as it only eliminates a low proportion of them.
Tras conocerse la importancia de las venas pulmonares (VVPP) en la génesis de la fibrilación auricular (FA)1, el aislamiento de estas se ha convertido en el objetivo principal en los procedimientos de ablación2. El progresivo mayor conocimiento de la fisiopatología de la FA, el avance de las tecnologías de ablación y los efectos secundarios de las técnicas iniciales han hecho que el tipo de abordaje haya sido modificado sucesivamente, aunque con el mismo objetivo inicial. Actualmente, el aislamiento de VVPP mediante una ablación circunferencial amplia (ACA) guiada por mapas electroanatómicos es el tipo de procedimiento más aceptado, logrando tasas de éxito, en cuanto a mantenimiento del ritmo sinusal al año de seguimiento, de hasta el 85% en la FA paroxística y en torno al 68% en la FA persistente3.
Nademanee et al.4 describieron una nueva modalidad de ablación en la que se aborda el sustrato mediante la eliminación de los electrogramas fraccionados y complejos (CFAE) presentes en ambas aurículas, sin aislamiento de VVPP, logrando excelentes resultados. Sin embargo, estos han sido dispares cuando esta técnica se combina con una ACA5–7. Esto puede explicarse en parte porque la ACA logra eliminar gran parte de los CFAE de la aurícula izquierda (AI) y no es de utilidad la ablación de los restantes8. En el presente trabajo pretendemos conocer la distribución de los CFAE en la AI y determinar la cantidad de CFAE que son eliminados tras una ACA de VVPP.
MétodoEl estudio se realizó en pacientes con FA persistente sometidos consecutivamente a una ACA de VVPP. Consideramos FA persistente aquella con una duración superior a 7 días o que precise una cardioversión para su cese en caso de duración inferior2. Se excluyeron los pacientes con un procedimiento de ACA previo. Todos los pacientes fueron seguidos mediante visitas a consulta al mes de la ablación y posteriormente cada trimestre hasta completar un año de seguimiento.
Estudio electrofisiológicoEl procedimiento fue llevado a cabo con el paciente en ayunas y bajo sedación consciente con remifentanilo. Previamente se realizó un angioTAC de AI y VVPP y un ecocardiograma transesofágico. Todos los pacientes firmaron el consentimiento informado.
Se introdujeron un catéter decapolar (Woven; Bard Inc, Lowell MA, USA) en el seno coronario, un catéter circular de 20 polos (Lasso™; Biosense Webster, Diamond Bar CA, USA) para mapeo de las cuatro VVPP y un catéter con punta de 3,5mm con irrigación abierta (Navistar thermocool™; Biosense Webster, Diamond Bar CA, USA.) para mapeo y ablación. El acceso a la AI se realizó mediante doble punción transeptal guiada por escopia. Entonces se inició anticoagulación sistémica con heparina sódica para mantener un activated clotting time (ACT) entre 250 y 350 segundos. Se utilizó el sistema CARTO® XP (Biosense Webster, Diamond Bar CA, USA.) con software de CFAE para la reconstrucción electroanatómica de las VVPP y la AI. Esta se realizó mediante la adquisición homogénea de puntos en toda la AI, manteniendo el catéter de mapeo estable en cada uno durante 2 segundos. El mapa obtenido fue integrado con la imagen de reconstrucción tridimensional del angioTAC de las VVPP y la AI.
AblaciónLa ablación se realizó sobre el mapa de la AI en modo anatómico, ciega a la información de densidad y localización de CFAE. Se practicaron dos coronas de ablación que englobaban ambas VVPP ipsilaterales. Las líneas se realizaron a 15mm de los ostia en su aspecto posterior y a unos 5mm en el anterior.
Se utilizó información relativa a valores de impedancias, siendo el 5% sobre el valor medio medido en la pared posterior de AI el nivel de corte para su localización9, con apoyo adicional en la escopia y señales eléctricas. Las aplicaciones se realizaron punto a punto con una potencia de 35W, una temperatura pico de 45°C y una irrigación de 30ml/min, con el fin de reducir el voltaje dentro de la corona un 90% del basal o por debajo de 0,05mV. El objetivo del procedimiento fue el aislamiento de las 4 VVPP, determinado por la desaparición de potenciales de vena registrados por el catéter circular situado en cada ostium. En los pacientes que no pasaron a ritmo sinusal al final del estudio se realizó una cardioversión eléctrica.
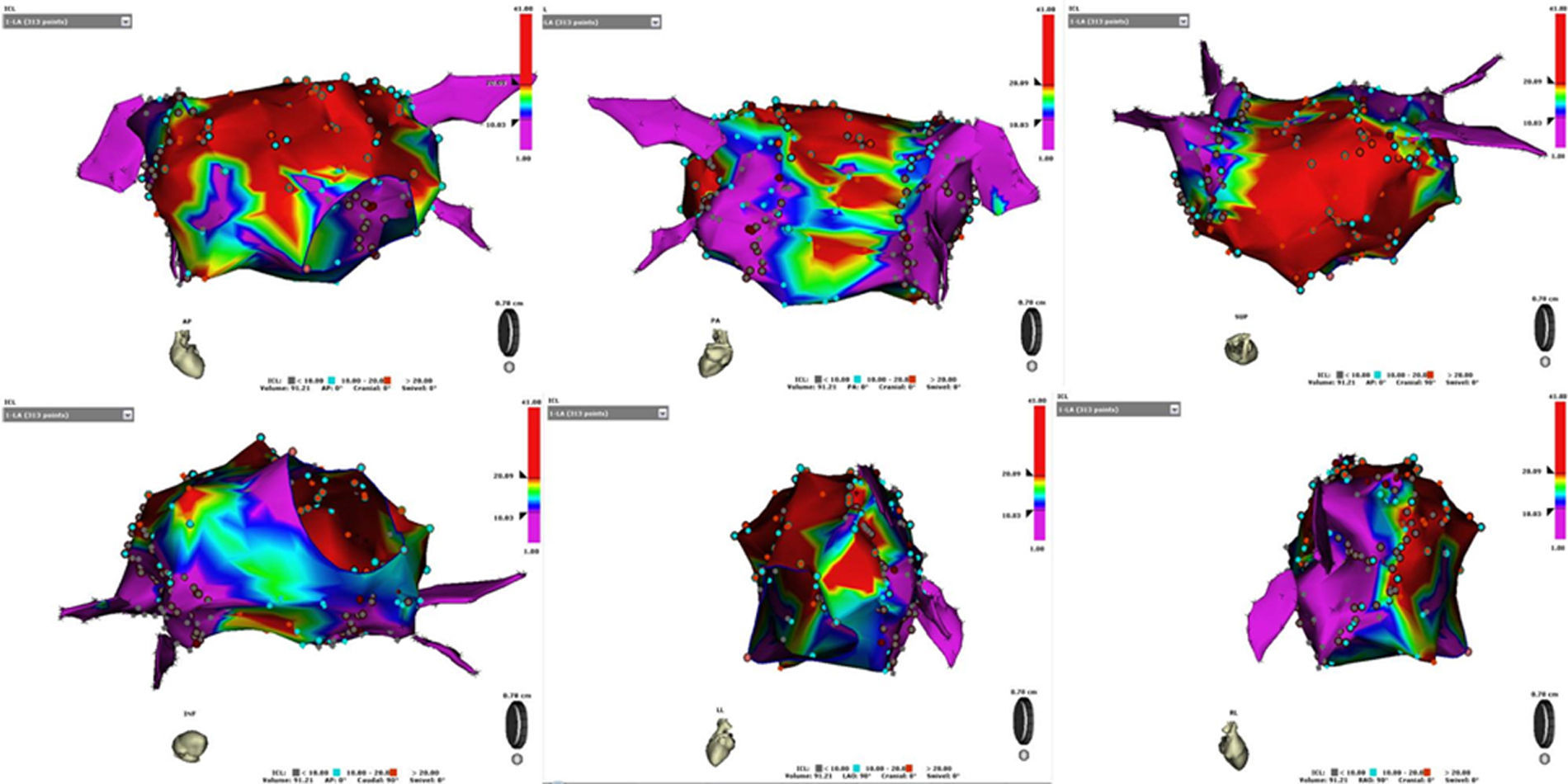
CFAETras el procedimiento se ajustaron los parámetros del software de CFAE para localizarlos con mayor sensibilidad y especificidad: electrogramas con duración entre 30 y 50ms, límite inferior de voltaje de 0,05mV y superior de 1mV. Fueron considerados para el análisis los puntos clasificados de fragmentación media y alta (nivel del intervalo de confianza >10)10. Para determinar la posición relativa de los CFAE en la AI, esta fue dividida en 6 caras, correspondientes a su visualización en 6 posiciones puras con el sistema CARTO: cara anterior (vista anteroposterior), posterior (vista posteroanterior), superior, inferior, septo (vista lateral derecha) y lateral izquierda (fig. 1). Se cuantificó el número total de CFAE, el porcentaje respecto al número total de puntos adquiridos para configurar el mapa de AI, el número de CFAE en cada cara y su porcentaje respecto al total de puntos en cada una (densidad de CFAE), y el número y porcentaje eliminado con las coronas de ablación.
Mapas electroanatómicos de la aurícula izquierda con codificación para la identificación de CFAE. Se muestran las 6 proyecciones utilizadas para su contabilización. De izquierda a derecha y de arriba a abajo: anteroposterior, posteroanterior, superior, inferior, lateral izquierda y lateral derecha. El color violeta codifica zonas con CFAE con intervalo de confianza inferior a 10; el rojo con valor superior a 20; los valores intermedios quedan codificados por el resto de colores.
Las variables cuantitativas se expresaron con la media±desviación estándar (DE), y las cualitativas, en porcentajes. Las comparaciones entre cualitativas, con la Ji cuadrado o el test exacto de Fisher, y entre cuantitativas y cualitativas, con la t de Student o el análisis de la varianza (ANOVA) y el procedimiento de Bonferroni. Se consideraron significativos los resultados con un valor de p<0,05.
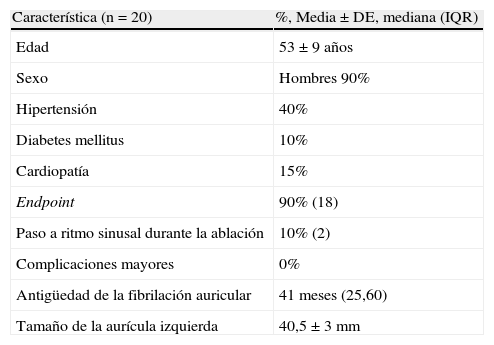
ResultadosSe incluyeron en el estudio 20 pacientes. Sus características se recogen en la tabla 1. El end point del procedimiento se logró en 18 de los 20 pacientes. Dos pacientes pasaron a ritmo sinusal durante el procedimiento. No se registró ninguna complicación mayor. El 75% estaba libre de arritmias al final del año de seguimiento tras un único procedimiento y sin apoyo de fármacos, excluyendo las recidivas en los 3 primeros meses.
Características de la población
| Característica (n=20) | %, Media±DE, mediana (IQR) |
| Edad | 53±9 años |
| Sexo | Hombres 90% |
| Hipertensión | 40% |
| Diabetes mellitus | 10% |
| Cardiopatía | 15% |
| Endpoint | 90% (18) |
| Paso a ritmo sinusal durante la ablación | 10% (2) |
| Complicaciones mayores | 0% |
| Antigüedad de la fibrilación auricular | 41 meses (25,60) |
| Tamaño de la aurícula izquierda | 40,5±3mm |
Se registraron 2.699 puntos CARTO (media 135±27 puntos/paciente) para la reconstrucción de la AI. De estos, 1.480 (54,8%) fueron clasificados como CFAE con fragmentación media o alta. Estos presentaron una mayor densidad en la cara anterior (75%), seguida de la cara lateral izquierda (63%), el septo (59%), el techo (56%), la cara posterior (43%) y la inferior (41%). Sólo se objetivaron diferencias significativas entre la cara anterior y la inferior y posterior (p=0,002 y 0,001, respectivamente). El 35,7% de todos los CFAE quedaron excluidos por las coronas de la ACA.
DiscusiónSegún nuestros resultados, los CFAE tienen una distribución homogénea en las diferentes regiones de la AI, siendo menor en la cara inferior y posterior. La ACA elimina un porcentaje bajo del total de los mismos, lo que podría justificar la ablación adicional de CFAE fuera de las coronas para mejorar los resultados.
Ablación de CFAETras el descubrimiento de Haïssaguerre et al.1 del papel de las VVPP como iniciadoras de FA, su aislamiento es actualmente la piedra angular en los procedimientos de ablación de FA. El aislamiento de las VVPP mediante una ACA guiada por mapas electroanatómicos es actualmente la técnica más aceptada2. Sin embargo, sus resultados son inferiores en pacientes con FA persistente3. Por ello, se han investigado diferentes técnicas que, como alternativa o añadidas a la anterior, permitan mejorar los resultados.
Konings et al.11 demostraron la teoría de las múltiples reentradas aleatorias como mecanismo de mantenimiento de la FA y se identificaron los CFAE como representación de los circuitos de reentrada funcional en la AI. Basándose en dichos trabajos, Nademanee et al. realizan una ablación puntual de todas las zonas donde se localizan los anclajes de dichos circuitos en ambas aurículas. Estos fueron identificados bien como electrogramas fraccionados con 2 o más deflexiones o una oscilación continua de la línea de base, o bien como electrogramas con una longitud de ciclo igual o inferior a 120ms, en ambos casos registrados en 10 segundos. Al año de seguimiento el 76 y el 91% de pacientes permanecían libres de arritmias auriculares tras uno y dos procedimientos, respectivamente4. Sin embargo, no todos los autores han refrendado sus excelentes resultados. Oral et al.12 obtuvieron un 57% de mantenimiento del ritmo sinusal al año a pesar de someter a más de un procedimiento al 44% de los pacientes.
Estrategia combinadaEstudios posteriores han estudiado la incorporación de la ablación de CFAE al ACA de VVPP. Haïssaguerre et al.7 demostraron una mayor eficacia de la ablación de FA cuando se combinaban el aislamiento de las VVPP, el de otras venas torácicas, la ablación de CFAE y la ablación lineal de la AI con el objetivo de restaurar el ritmo sinusal, logrando un 95% de pacientes libre de arritmias auriculares a los 11 meses de seguimiento. Verma et al.6 comparan la ablación aislada de CFAE, la ACA de VVPP y la combinación de ambas, obteniendo los mejores resultados con la última estrategia (38, 68 y 88% libres de FA al año tras dos procedimientos). Sin embrago, Deisenhofer et al.13 en la FA paroxística y Oral et al.5 en la FA crónica no han observado tales beneficios. Una de las posibles explicaciones dadas a estos resultados dispares en la estrategia combinada es que el uso de una ACA de VVPP elimine gran cantidad de CFAE8. En nuestro estudio, sin embargo, observamos que con una ACA solo logramos eliminar el 35,7% de los CFAE registrados en la AI. Es por esto que pensamos que esta explicación no es suficiente para justificar las discrepancias comentadas. Con la estrategia única de la ACA, característicamente más amplia en la región posterior de los antros y menos en la anterior, la mayoría de los CFAE no serían eliminados, por lo que es más esperable un beneficio adicional de la estrategia combinada, como han demostrado varios estudios.
Localización de los CFAEEn nuestro estudio, el 54,8% de los puntos recogidos para recrear el mapa de la AI fueron codificados como puntos de CFAE. Esta cifra es bastante superior al 30,5% observado por Caló et al.10. Sin embargo, su estudio recoge pacientes con una serie de características que sugieren la presencia de una FA con sustrato más avanzado, en el que la presencia de escaras y el bajo voltaje en la AI sea más frecuente, siendo por ello la presencia de CFAE menor y de más difícil cuantificación. Hemos observado una distribución espacial homogénea, de modo que todos los pacientes presentaban una densidad de CFAE similar en cada una de las caras. Solo la cara anterior presentaba una mayor densidad respecto a la posterior e inferior. También en el aspecto anterior de los antros (septo y cara lateral izquierda) y en el techo se objetivó una tendencia a presentar una mayor densidad, hallazgos superponibles a los de Nademanee4. Estas localizaciones se han demostrado estables en el tiempo, por lo que no consideramos necesario realizar varios mapas para confirmar la presencia de un CFAE en una zona en el momento de su contabilización, es decir, tras el ACA. Scherr et al.14 demostraron dicha estabilidad repitiendo diferentes mapas en un mismo paciente con diferencias de 30min uno del otro, observando que el 90,6% de los puntos de CFAE iniciales se correspondían en el segundo mapa.
LimitacionesSe trata de un estudio sobre 20 pacientes. El volumen de muestra puede condicionar las escasas diferencias detectadas entre la densidad de CFAE observadas en las diferentes zonas. La AI no ha sido dividida siguiendo unos límites anatómicos definidos, sino de forma virtual con el fin de simplificar el análisis de la distribución de CFAE. Aunque la estabilidad de los CFAE ha sido comprobada en otros estudios14, sería preciso realizar un nuevo mapa tras la ACA de VVPP para confirmar que esta no ocasiona una variación en la distribución y número de CFAE restantes.
ConclusionesLos CFAE presentan una distribución homogénea en la AI, con predominio en la pared anterior, lateral izquierda, septo y techo. El ACA sólo permite eliminar un porcentaje discreto de ellos. Por esto pensamos que las estrategias híbridas pueden justificar un beneficio adicional de su ablación tras un ACA de VVPP.
FinanciaciónPara la realización del presente trabajo los autores han disfrutado de una beca concedida por la Sociedad Andaluza de Cardiología.
Conflicto de interesesLos autores declaran que no existen conflictos de intereses en relación al presente trabajo.