La extrasistolia ventricular (EV) es una realidad frecuente en la práctica clínica. En los últimos años es más conocida su asociación como causa de cardiopatía y no solamente como un mero marcador de la misma, lo que ha conllevado a cambiar el antiguo paradigma diagnóstico-terapéutico. Este artículo revisa la evaluación y el manejo del paciente con EV centrándose, principalmente, en los aspectos clínicos y arritmológicos.
Epidemiología y pronósticoLa EV es una causa común de palpitaciones y un hallazgo asintomático frecuentemente detectado de forma casual en la electrocardiografía (ECG) y monitorización ECG ambulatoria. Aunque son pocos los estudios epidemiológicos amplios, puede estimarse una prevalencia de entre el 1–4% en población sana, aumentando hasta un 8% en pacientes con cardiopatía previa1.
Desde hace más de 20 años se ha aceptado que en los pacientes asintomáticos, con EV frecuente o no, y sin cardiopatía previa (definida tradicionalmente como EV idiopática), el pronóstico es benigno y solo deben tratarse aquellos cuya sintomatología sea debida a la EV. Sin embargo, estudios recientes demuestran que en los pacientes con una alta carga de EV, tanto con cardiopatía previa como sin ella, el pronóstico a largo plazo empeora debido al desarrollo de disfunción ventricular izquierda (DVI), insuficiencia cardiaca (IC) y aumento de la mortalidad, cuestionándose así la benignidad de esta entidad2. En presencia de cardiopatía isquémica previa el pronóstico es más ominoso, asociándose la presencia de EV con un aumento de hasta tres veces el riesgo de muerte súbita3.
La definición de EV frecuente es variable y depende del contexto del paciente (presencia o ausencia de cardiopatía) y el modo de su cuantificación (número de EV/hora, número de EV/día). En la mayoría de la población sana la carga es menor de 100 EV/día llegando en un 1–4% de la población a cargas de 60 o más EV/hora4. Las densidades altas se han asociado con aumento de la mortalidad en pacientes sin coronariopatía5 (>30 EV/hora), y con el desarrollo de DVI (>24%/día), si bien es importante resaltar que cargas menores del 4% pueden llegar a producir DVI6,7. Por otro lado, hasta un 20% de los casos con una densidad de EV >24% no desarrollaron DVI, lo que sugiere que debe haber otros factores etiopatogénicos (localización anatómica del foco, duración de la EV, intervalo de acoplamiento y anchura del QRS de la EV, etc.) que participen en su génesis.
Patogenia y fisiopatologíaLa EV ocurre en una variedad de ámbitos tanto en pacientes con cardiopatía estructural como sin ella. En cada contexto el mecanismo inductor puede variar dependiendo de las circunstancias clínicas. La EV de origen en los tractos de salida no suele asociarse, por lo general, a cardiopatía estructural. Su mecanismo más frecuente es la actividad desencadenada (despolarizaciones tardías) secundaria al incremento de los niveles intracelulares de calcio tras la activación del sistema AMP cíclico8.
Las EV en la fase crónica del infarto tienden a ocurrir en las regiones de escara del miocardio, pudiendo deberse a automatismo aumentado, actividad desencadenada o una posible reentrada/microreentrada.
El mecanismo responsable del desarrollo de cardiopatía por la EV actualmente está en investigación. La disincronía electromecánica crónica y el disbalance de la homeostasis del Ca2++ son mecanismos potenciales de su génesis. Todo ello conduce a una contracción miocárdica ineficiente con aumento progresivo de la rigidez del ventrículo izquierdo (VI), depresión de la FEVI, aumento de las presiones telediastólicas del VI y finalmente a la producción de dilatación ventricular como mecanismo de remodelado adverso9.
DiagnósticoPresentación clínicaEl espectro clínico es muy amplio, incluso cuando los EV son frecuentes, oscilando entre la ausencia total de síntomas y la presencia de síntomas debilitantes tales como: palpitaciones, dolor torácico, cansancio, presíncope o síncope. La inmensa mayoría de estos pacientes no presentan cardiopatía, especialmente cuando los EV son monomórficos, no precisando tratamiento, salvo en los pocos casos que asocian síntomas limitantes. Es esencial realizar una historia clínica detallada para descartar miocardiopatías familiares asociadas, ya que la aparición de EV puede preceder en años a la expresión fenotípica evidente. Por el contrario, otras veces, la EV aparece tardíamente en el curso de la cardiopatía.
En los casos con cardiopatía hay tres escenarios clínicos importantes de reconocer, dado el distinto abordaje terapéutico que requieren:
- •
EV frecuente asociada a IC congestiva y/o DVI: la EV puede ser la causa de la IC o bien empeorar una situación previa de IC secundaria a una cardiopatía.
- •
EV desencadenante de fibrilación ventricular: puede ocurrir tanto en casos de fibrilación ventricular idiopática o canalopatía subyacente, como tras un infarto de miocardio.
- •
EV frecuente asociada a estimulación biventricular reducida: la alta carga de EV puede disminuir el porcentaje de estimulación biventricular y reducir el beneficio clínico de la resincronización.
El ECG de superficie y la monitorización con Holter permiten valorar la presencia y la frecuencia de la EV, correlacionarla con la sintomatología y ayudar a la localización aproximada del foco.
La EV puede originarse en focos a nivel tanto endocárdico, mesocárdico como epicárdico, de uno u otro ventrículo. La EV idiopática suele originarse más frecuentemente en el tracto de salida del ventrículo derecho (TSVD). Otras localizaciones son el tracto de salida del ventrículo izquierdo (TSVI), los fascículos de la rama izquierda del haz de His, los músculos papilares, las cúspides aórticas, la continuidad mitroaórtica, los anillos de las válvulas aurículoventriculares o el epicardio. Además, la presencia de manguitos de tejido miocárdico extendiéndose más allá de las válvulas semilunares hacía la porción proximal de las grandes arterias son sitios bien establecidos de origen de EV10.
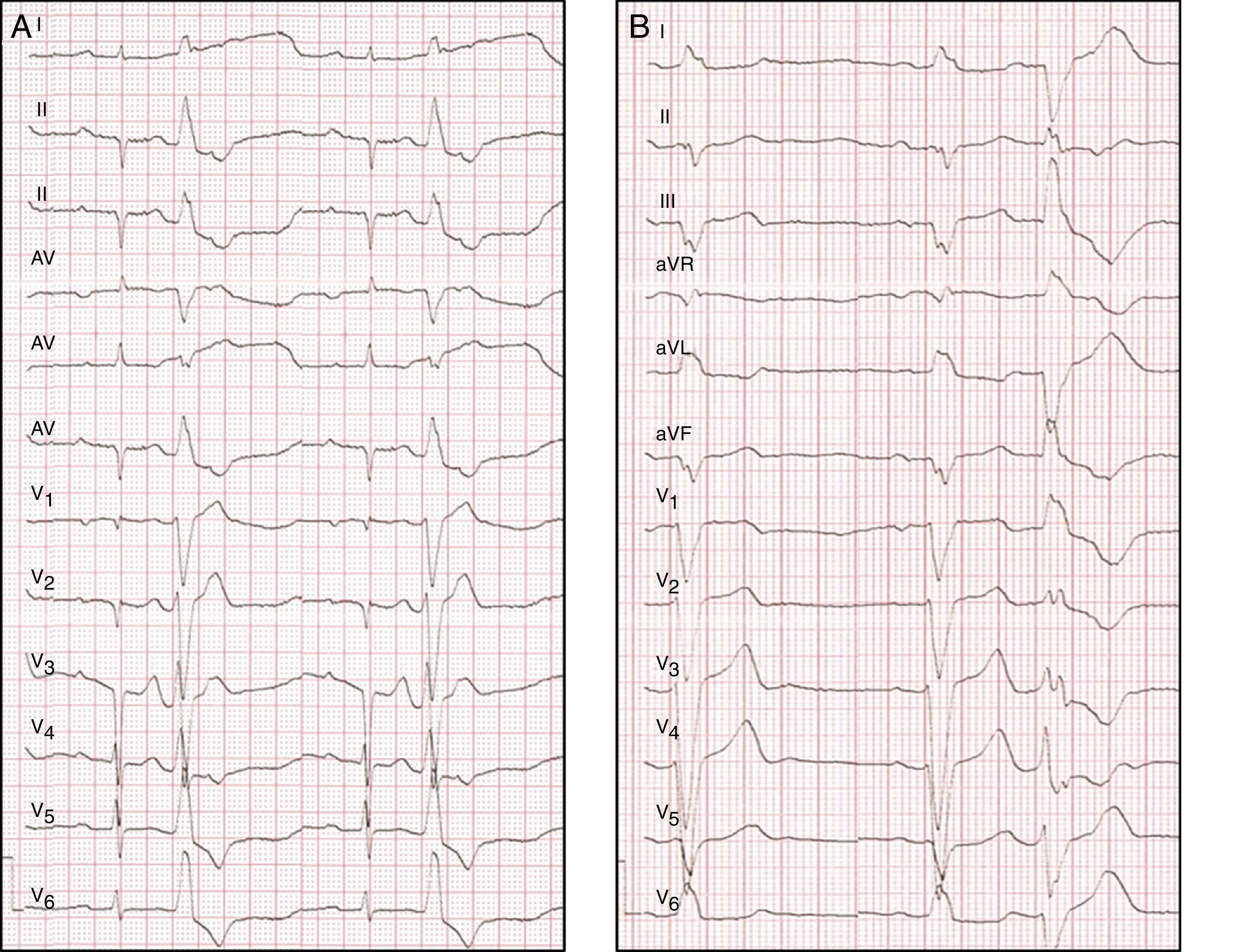
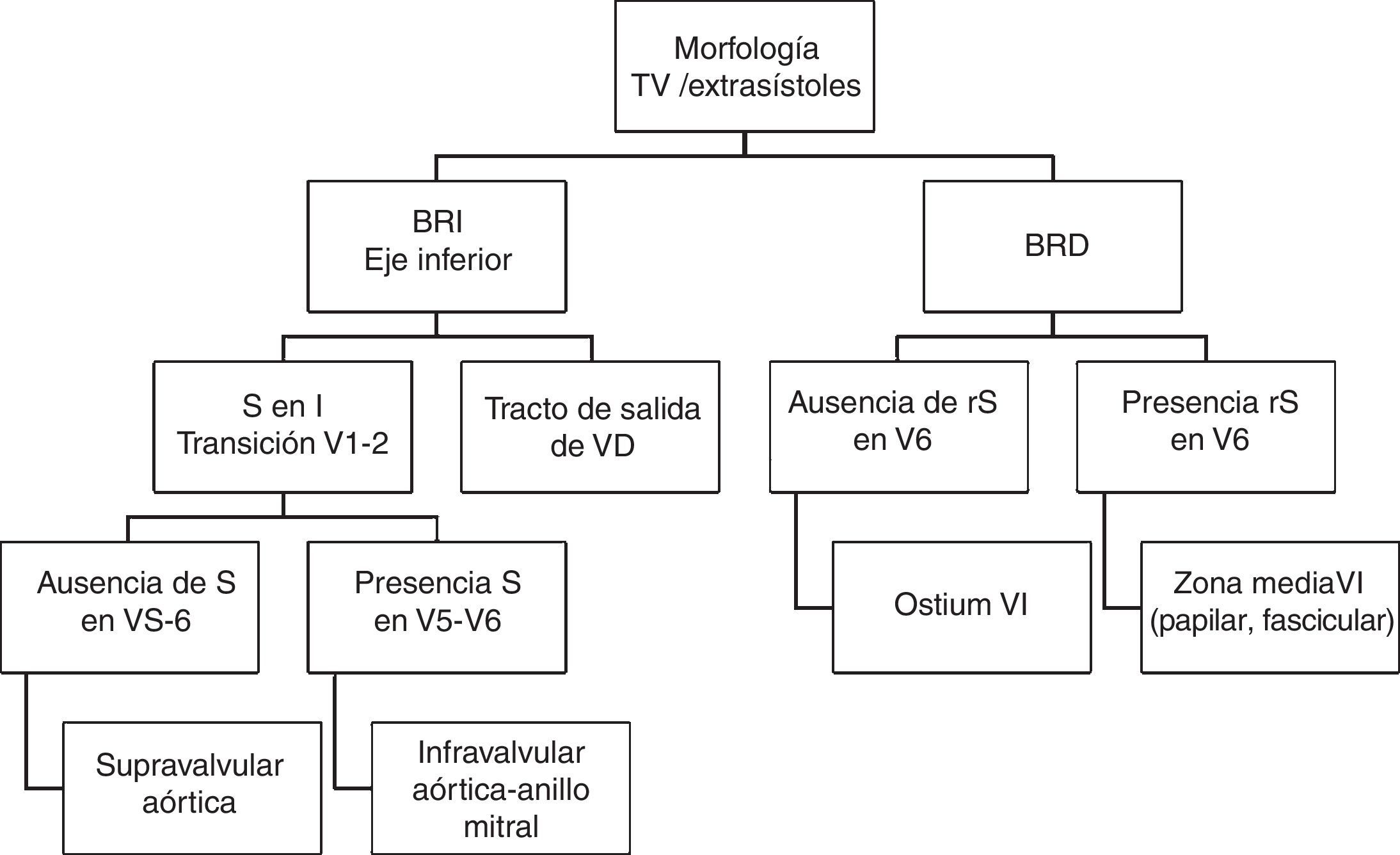
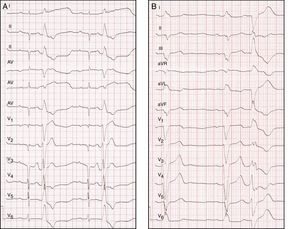
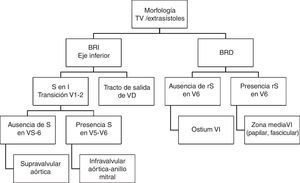
El análisis de la morfología del EV en el ECG de 12 derivaciones ofrece pistas que ayudan a identificar el origen del foco. La figura 1 muestra dos ECG de diferentes orígenes del foco de EV. La EV que se origina en el TSVD típicamente muestra configuración de bloqueo de rama izquierda con eje inferior y una transición precordial tardía (>V3). Si la transición es precoz (≤V3), el origen puede ser en las cúspides aórticas, el TSVI o la zona basal del epicardio del VI («left ventricular summit»). Cuando la transición es justamente en V3, el origen puede ser en TSVD o TSVI, pudiendo compararse para su distinción, la transición R/S en derivaciones precordiales de la EV frente a la del latido en RS (transición más precoz en las precordiales del EV frente al latido en RS, sugiere origen en TSVI y, viceversa, sugiere origen en TSVD). Por otro lado, la configuración de bloqueo de rama derecha indica un origen en el VI. La concordancia precordial positiva es indicativa de un origen en la zona basal del ventrículo, apareciendo una transición precordial a R/S más precoz cuando el origen se aproxima a zonas medias ventriculares. En estos casos el patrón qR en aVR sugiriere origen en el músculo papilar posteromedial. Cuando el foco de origen es a nivel intramural, es más difícil de localizar y un patrón específico no ha sido bien descrito. Un inicio lento del complejo «deltoide» sugiere origen epicárdico. La figura 2 expone un algoritmo para la aproximación diagnóstica de la localización de la EV guiada por el ECG.
El manejo inicial se debe centrar en identificar desencadenantes o causas potencialmente reversibles tales como alteraciones electrolíticas, isquemia, patología valvular significativa, hipoxia y alteraciones metabólicas. Un factor desencadenante muy frecuente son los factores hormonales en las mujeres y clásicamente se asocia al periodo perimenstrual y perimenopáusico. Hay que indagar sobre los desencadenantes de los síntomas, como son la ingesta de cafeína u otros estimulantes (tabaco, alcohol, dieta), aun cuando son pocas las evidencias acerca del beneficio clínico real que conlleva evitar dichos desencadenantes11. Sin embargo, se recomienda modificar dichos factores de riesgo dado el beneficio global a nivel cardiovascular. El siguiente paso consiste en identificar qué pacientes pueden beneficiarse del tratamiento farmacológico y/o intervencionista. En general, el tratamiento estará indicado cuando exista expectativa de mejoría de los síntomas o de la función ventricular. Muy dudoso, por no existir suficiente evidencia clínica, es el tratamiento cuando hay una carga de EV muy alta, con la finalidad de prevenir la posible aparición futura de DVI o minimizar el riesgo arrítmico.
Tratamiento farmacológicoEn ausencia de contraindicaciones, los fármacos de elección son los betabloqueantes o los antagonistas del calcio no dihidropiridínicos. Los betabloqueantes actúan sobre el receptor beta-1 adrenérgico reduciendo el AMPc intracelular y por tanto reduciendo el automatismo de los miocardiocitos. En casos de cardiopatía estructural son los fármacos de elección debiendo evitarse los calcioantagonistas. Los antagonistas del calcio no dihidropirídinicos son efectivos en casos de ausencia de cardiopatía estructural, particularmente en la EV de origen fascicular. Si el tratamiento con estos fármacos no produce un adecuado beneficio clínico, se debe considerar el tratamiento con fármacos antiarrítmicos (flecainida en ausencia de cardiopatía o DVI, sotalol/amiodarona en su presencia) o plantear la ablación. La EV, fundamentalmente de causa idiopática, puede tener un componente dependiente del sistema nervioso autónomo, y por tanto verse incrementada con frecuencias ventriculares más altas (tono simpático) como con bajas (tono vagal). No es infrecuente encontrar casos con mejoría de la densidad de EV tras la retirada de los betabloqueantes, sugiriendo una probable modulación intrínseca del sistema nervioso autónomo. La tabla 1 resume las indicaciones de las actuales Guías de Práctica Clínica sobre el manejo de arritmias ventriculares de la Sociedad Europea de Cardiología. En ellas, se recomienda como primera opción terapéutica los fármacos antiarrítmicos de la clase I en el caso de EV cuyo origen es del VI, cúspides aórticas o epicardio, quedando la ablación como segunda opción terapéutica en caso de fracaso de los mismos o el paciente no desea tomar medicación antiarrítmica. Sin embargo, si el origen es en el TSVD, la ablación puede ser considerada de primera elección en pacientes sintomáticos o con aparición de disfunción ventricular.
Indicaciones terapéuticas actuales de la extrasistolia ventricular dependiente de la localización del origen del foco
| Indicaciones terapéuticas de la extrasistolia ventricular | |||
|---|---|---|---|
| TV/EV de tracto de salida | VD | Ablación con catéter en pacientes sintomáticos y/o tras fallo de los antiarrítmicos (BB) o cuando aparece disfunción ventricular | I-B |
| VI/Cúspides aórticas/epicárdicas | Tratamiento con fármacos clase I en pacientes sintomáticos | I-C | |
| Ablación con catéter realizada por operadores experimentados cuando fallan los fármacos clase I, o es deseo del paciente con síntomas | Iia-B | ||
| TV/EV fasciculares izquierdas | Ablación con catéter como tratamiento de primera línea | I-B | |
| BB, verapamil o clase I cuando la ablación no está disponible o no la prefiere el paciente | I-C | ||
| TV/EV papilar o anillos AV | BB, verapamil o clase I | I-C | |
| Ablación con catéter cuando fallan los fármacos o es deseo del paciente | Iia-C | ||
AV: aurículoventricular; BB: betabloqueantes; EV: extrasistolia ventricular; TV: taquicardia ventricular; VD: ventrículo derecho.
La ablación con catéter del foco de EV representa una opción terapéutica efectiva en muchos pacientes refractarios o intolerantes al tratamiento farmacológico, o incluso, como primera opción terapéutica. El papel de la ablación es tratar la sintomatología, mejorar o detener el deterioro del VI y prevenir la aparición de arritmias ventriculares sostenidas.
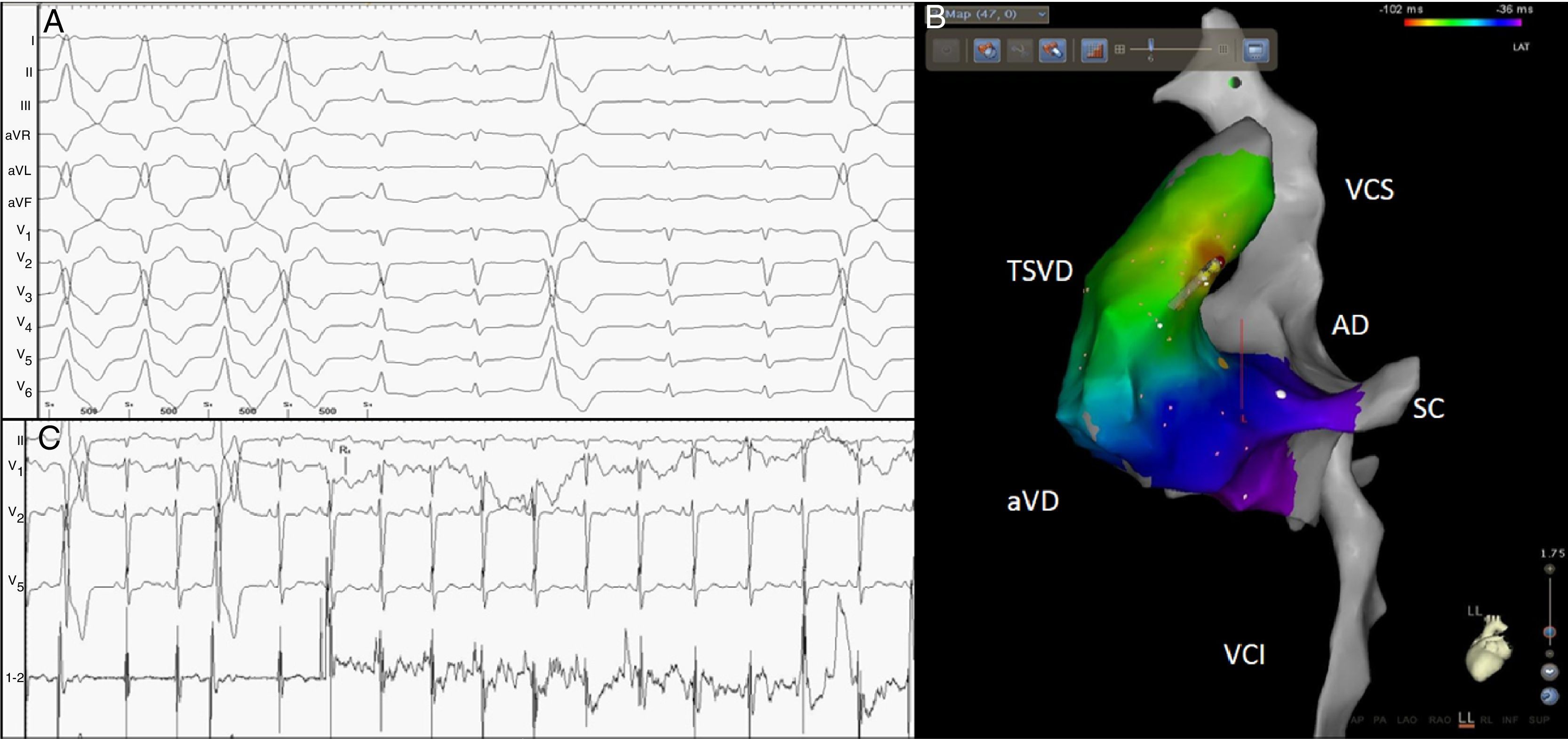
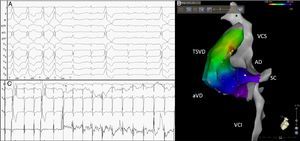
Numerosos avances e innovaciones tecnológicas han hecho de la ablación con catéter un procedimiento eficaz y seguro. Diferentes series objetivan una tasa de éxito entre el 70 y el 90% con una muy baja incidencia de complicaciones. Dependiendo de la localización anatómica del foco, la tasa de éxito varía. En efecto, el origen en el TSVD tiene la mayor tasa de éxito mientras que la localización a nivel de los músculos papilares o el epicardio muestran éxitos más bajos12. La figura 3 muestra un ejemplo de ablación de EV frecuente sintomática asociada a DVI. Un inconveniente frecuente a la hora de realizar la ablación, y probablemente dependiente del tono autonómico del paciente, es la baja tasa de extrasístoles el día del procedimiento, lo cual dificulta su realización aun a pesar de evitar sedación e infundir catecolaminas el día de la intervención. Para ello, los sistemas de cartografía sin contacto son útiles en este sentido y permiten realizar casos que no habrían sido posibles por cartografía convencional.
Paciente con EV frecuente asociada a DVI (panel A). Se realizó cartografía electroanatómica comprobándose foco de origen en el TSVD posteroseptal (panel B). La ablación en dicha zona suprimió la EV a los pocos segundos (panel C). TSVD: tracto de salida del ventrículo derecho; aVD: ápex de ventrículo derecho; VCI: vena cava inferior; SC: seno coronario; AD: aurícula derecha; VCS: vena cava superior.
Numerosos estudios han demostrado la mejoría de la FEVI tras la ablación exitosa del foco de EV. La tasa de normalización de la FEVI tras la supresión del foco ronda el 80%, y puede darse también en casos con cardiopatía previa subyacente13–16. Por otro lado, hay información preliminar que apunta a que esta mejoría de la FEVI tras la ablación del foco de EV puede permitir la retirada de la indicación de DAI en prevención primaria, de una forma segura, tanto en pacientes con cardiopatía como sin cardiopatía previa. Estos resultados han sido corroborados por nuestro grupo, en un estudio multicéntrico, encontrándose una mejoría de la FEVI basal, tras la ablación exitosa del foco de EV, del 28 ±4% a un 42 ±12% a los 12 meses de seguimiento. Junto a la FEVI, la clase funcional y los niveles séricos de BNP también mejoraron durante el seguimiento. En nuestro estudio la indicación de DAI en prevención primaria pudo ser retirada en un 64% de los pacientes, la mayoría de ellos, de una forma segura en los 6 primeros meses postablación. Además, un punto de corte de carga de EV ≥13%, tuvo una sensibilidad del 100% y una especificidad del 93% (área bajo la curva del 99%) para predecir la retirada del implante del DAI en los pacientes tratados con ablación17. Por tanto, dado el favorable perfil de riesgo/beneficio de la intervención, creemos que la ablación con catéter es una terapia de primera elección en pacientes con DVI, inducida o empeorada por la carga de EV, independientemente de la sintomatología.
ConclusionesLa EV es un problema frecuente que tradicionalmente se ha asociado a un buen pronóstico. Sin embargo, no siempre es una entidad benigna, ya que una alta carga puede inducir un remodelado ventricular funcional y estructural adverso, produciendo DVI en pacientes sin cardiopatía conocida, o contribuyendo al deterioro de la función ventricular en aquellos con cardiopatía. Este remodelado es potencialmente reversible con las diferentes opciones terapéuticas disponibles con lo que es de suma importancia realizar un seguimiento clínico a los pacientes con alta carga. En este sentido, la ablación exitosa del foco de EV ha demostrado la mejoría, tanto clínica como de la función ventricular, por lo que debe considerarse siempre en todo paciente con EV frecuente y disfunción ventricular.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.