La espondiloartritis axial es una enfermedad reumatológica que afecta a individuos jóvenes y tiene una gran repercusión sociolaboral. El retraso en el diagnóstico y el tratamiento se asocia con un mayor deterioro funcional y un impacto negativo en la calidad de vida, por lo que requiere un abordaje multidisciplinario.
ObjetivoDesarrollar y formular un conjunto de recomendaciones específicas basadas en la mejor evidencia disponible para la detección temprana, el diagnóstico, el tratamiento y el seguimiento de los pacientes adultos con espondiloartritis axial.
MétodosSe configuró un grupo desarrollador, se formularon preguntas clínicas contestables, se graduaron los desenlaces y se realizó la búsqueda sistemática de la evidencia. El panel de la guía fue multidisciplinario (incluyendo representantes de los pacientes) y balanceado, minimizando el sesgo por conflictos de intereses. Se utilizó la aproximación Grading of Recommendations Assessment, Development and Evaluation (GRADE) para evaluar la calidad de la evidencia, al igual que la dirección y la fortaleza de las recomendaciones. Se presentan 11 recomendaciones relacionadas con diagnóstico (n=2), tratamiento farmacológico (n=6), tratamiento no farmacológico (n=2) y seguimiento (n=1).
ResultadosSe recomienda la radiografía de articulaciones sacroilíacas como primer método diagnóstico, y el uso de escalas de actividad para el seguimiento de los pacientes (ASDAS o BASDAI). Los antiinflamatorios no esteroideos son la primera opción de tratamiento; en caso de intolerancia o dolor residual se recomienda acetaminofén u opioides. En pacientes con compromiso axial se recomienda abstenerse de utilizar medicamentos antirreumáticos modificadores de la enfermedad convencionales ni glucocorticoides sistémicos o locales. En pacientes con falla a los antiinflamatorios no esteroideos, se recomienda un anti-TNFα o un anti-IL17A. En pacientes con falla a anti-TNFα, se recomienda iniciar un anti-IL17A. El ejercicio y la terapia física y ocupacional se recomiendan como parte del tratamiento. Se recomienda no utilizar las terapias no convencionales como única opción de tratamiento.
ConclusionesEste conjunto de recomendaciones proporciona una guía actualizada sobre el diagnóstico y el tratamiento de la espondiloartritis axial.
Axial spondyloarthritis is a rheumatic condition affecting young patients with social and occupational consequences. Diagnosis delay is associated with functional impairment and impact on quality of life, requiring a multidisciplinary approach.
ObjectiveTo develop a set of recommendations based on the best available evidence for the early detection, diagnosis, treatment, and monitoring of adult patients with axial spondyloarthritis.
MethodsA working group was established, questions were developed, outcomes were graded, and a systematic search for evidence was conducted. A multidisciplinary panel of members was established (including patient representatives), minimizing bias in relation to conflicts of interest. The GRADE approach “Grading of Recommendations Assessment, Development and Evaluation” was used to assess the quality of the evidence as well as the direction and strength of recommendations. In total, 11 recommendations on diagnosis (n=2), pharmacological treatment (n=6), non-pharmacological treatment (n=2) and monitoring (n=1) are presented.
ResultsSacroiliac joint radiography as the first diagnostic method, and the use of disease activity scales for patient monitoring (ASDAS or BASDAI), are recommended. Nonsteroidal anti-inflammatory drugs are the first treatment option; in case of intolerance or residual pain, acetaminophen or opioids are recommended. In patients with axial involvement, it is recommended not to use conventional disease-modifying antirheumatic drugs or systemic or local glucocorticoids. In patients with failure to non-steroidal anti-inflammatory drugs, anti-TNF or anti-IL17A is recommended. In those patients presenting with anti-TNF failure, starting an anti-IL17A is recommended. Exercise, physical and occupational therapy are recommended as part of treatment. It is recommended not to use unconventional therapies as the only treatment option.
ConclusionsThis set of recommendations provides an updated guideline for the diagnosis, treatment, and monitoring of patients with axial spondyloarthritis.
Espondiloartritis (EspA) es un término genérico que integra un grupo de condiciones inflamatorias interrelacionales, las cuales comparten características clínicas, genéticas, epidemiológicas, fisiopatológicas, radiográficas y opciones terapéuticas. Según el patrón clínico de presentación, pueden ser predominantemente axiales o periféricas. La edad de inicio de los síntomas se presenta usualmente antes de los 45 años. La espondiloartritis axial (EspAax), como un subtipo de EspA, es una enfermedad inflamatoria crónica que afecta principalmente el esqueleto axial (columna vertebral y articulaciones sacroilíacas), pero también puede afectar las articulaciones periféricas (oligoartritis de predominio en miembros inferiores) y las entesis (regiones donde un tendón, ligamento o la cápsula articular se insertan en el hueso) tanto axiales como periféricas. El término EspAax incluye: 1) pacientes con daño estructural en las articulaciones sacroilíacas o la columna vertebral visible en radiografías (EspAax radiográfica, también llamada espondilitis anquilosante [EA], y 2) pacientes sin daño estructural visible en la radiografía simple (EspAax no radiográfica [EspAax-nr])1. La prevalencia de EspA se ha estimado para Latinoamérica en 0,52 (IC 95%: 0,10-1,25) y la de EA en 0,14 (IC 95%: 0,05-0,34)2. En Colombia, un estudio reciente que utilizó la metodología Copcord, estimó una prevalencia del 0,11% para EA y del 0,28% para EspA indiferenciadas3.
Los pacientes se presentan con dolor de espalda crónico (mayor de 3 meses de evolución) asociado a rigidez matinal, predominantemente localizado en la región lumbar; sin embargo, cualquier parte de la columna vertebral puede verse afectada. El dolor lumbar es un síntoma frecuente en la práctica clínica diaria y constituye una de las principales causas de consulta médica, por lo que es importante definir su enfoque, especialmente en el primer nivel de atención. Adicionalmente a las manifestaciones extraarticulares (uveítis, psoriasis y enfermedad inflamatoria intestinal), las comorbilidades asociadas en estos pacientes incrementan la carga total de la enfermedad, sobre todo aquellas relacionadas con enfermedades cardiovasculares e infecciosas4. El diagnóstico de EspAax, así como su enfoque terapéutico, presentan retos y desafíos importantes para el clínico, dada la variabilidad y la heterogeneidad de sus manifestaciones clínicas. Una de las manifestaciones más importantes es la presencia de dolor lumbar inflamatorio. Se han desarrollado diferentes criterios para la clasificación del dolor lumbar inflamatorio, los cuales se superponen en gran medida5,6. Los criterios ASAS que definen las características inflamatorias del dolor lumbar, tienen una sensibilidad del 79,6% y una especificidad del 72,4%7. Estos incluyen el inicio del dolor antes de los 40 años, el cual es de presentación insidiosa y nocturna, mejora con el ejercicio y, además, se caracteriza por la ausencia de mejoría con el reposo. Varios estudios en el país han reportado los diferentes patrones de presentación clínica en EspA y sus manifestaciones más frecuentes8,9, y han evaluado el rendimiento de los diferentes criterios de clasificación utilizando el diagnóstico clínico del reumatólogo como estándar externo10. De igual forma, estudios adicionales en el país han explorado las variables clínicas que orientan al reumatólogo para solicitar estudios adicionales en el diagnóstico de EspA11, y han reportado la frecuencia del alelo HLA-B27 en individuos con signos clínicos sugestivos de EspA12 y en individuos sanos13.
Esta es la primera guía de práctica clínica (GPC) dirigida a pacientes con EspAax que se desarrolla, publica e implementa en Colombia, y pretende impactar de forma favorable en el diagnóstico temprano, el tratamiento y el seguimiento de estos pacientes. La GPC en EspAax se suma y complementa a las guías internacionales de más uso en el país para el diagnóstico y el tratamiento de esta enfermedad, como son la guía de la European League Against Rheumatism (EULAR)14 y la guía del American College of Rheumatology (ACR)15.
Esta GPC se dirige a los profesionales de la salud involucrados en la atención de pacientes con EspAax, tomadores de decisiones, pagadores del gasto en salud y entidades gubernamentales que generan políticas en salud. La versión completa de esta GPC (incluida la metodología desarrollada, la búsqueda sistemática de la información científica y la presentación detallada de la evidencia) se encuentra en el material suplementario, y estará disponible para la consulta en la página de la Asociación Colombiana de Reumatología (Asoreuma) y en la página de Sociedades Científicas del Ministerio de Salud y Protección Social de Colombia, posteriormente a la publicación de este documento.
Materiales y métodosLa guía tiene como objetivo desarrollar y formular un conjunto de recomendaciones específicas basadas en la mejor evidencia disponible en relación con el diagnóstico y el tratamiento temprano de pacientes adultos con EspAax, establecer los parámetros clínicos para el enfoque diagnóstico del paciente con dolor lumbar inflamatorio, sensibilizar al cuerpo médico acerca de la identificación y sospecha clínica de la enfermedad, disminuir la variabilidad en el tratamiento y, potencialmente, racionalizar el gasto, optimizar la derivación oportuna de pacientes al reumatólogo y mejorar la calidad de vida y el desempeño laboral y social de los pacientes.
El Grupo Desarrollador de la Guía (GDG) evaluó la certeza de la evidencia, desarrolló y graduó las recomendaciones siguiendo la aproximación The Grading of Recommendations Assessment, Development and Evaluation (GRADE)16–19. En el desarrollo de la GPC, el GDG ha seguido una serie de pasos que se describen a continuación.
Organización, planeación y coordinación de la guía de práctica clínicaEl GDG estuvo conformado por 9 médicos reumatólogos expertos y una bacterióloga inmunóloga, miembros del Grupo de Estudio en Espondiloartritis de Asoreuma, 2 representantes de pacientes y un antropólogo como representante de la sociedad civil. Todas las sesiones del panel contaron con el acompañamiento de representantes del Ministerio de Salud y Protección Social y del Instituto de Evaluación de Tecnologías en Salud (IETS). El líder de la GPC es un reumatólogo representante del Grupo de Estudio de Asoreuma y miembro del grupo Assessment of Spondyloarthritis International Society (ASAS). El desarrollo de la GPC tuvo el acompañamiento metodológico de una empresa de consultoría externa e independiente. La GPC se realizó siguiendo los lineamientos de la «Guía metodológica para la elaboración de guías de práctica clínica con evaluación económica en el Sistema General de Seguridad Social en Salud colombiano»20. El trabajo del GDG se realizó mediante herramientas informáticas, reuniones presenciales y reuniones virtuales. Además de sintetizar la evidencia de manera sistemática, la empresa Evidentias SAS apoyó el proceso de desarrollo de la GPC, incluyendo la determinación de los métodos, la preparación de agendas y reuniones, los materiales y la facilitación de paneles de discusión.
Formulación de preguntas clínicas y definición de los desenlacesLas preguntas de la guía se formularon por consulta abierta a todos los miembros del GDG, y posteriormente fueron priorizadas por el mismo GDG, siguiendo la metodología Delphi, hasta alcanzar el consenso (mayor del 80%). Se llevaron a cabo en total 2 rondas de consulta virtual por correo electrónico. Se siguió la metodología propuesta por el GRADE Working Group (GRADEwg) para la gradación de los desenlaces de interés para cada pregunta16. El proceso se realizó de forma virtual. Los desenlaces que se presentan en la tabla 1 se evaluaron como críticos e importantes para el total de preguntas por responder por la GPC, dichos desenlaces se utilizaron para la definición de los criterios de selección de la evidencia que soporta cada recomendación (material suplementario: protocolos por pregunta disponibles en https://www.asoreuma.org).
Gradación de los desenlaces para preguntas de terapia y diagnóstico
| Desenlaces en preguntas que evalúan intervenciones terapéuticas | Importancia |
|---|---|
| Desenlaces en preguntas que evalúan intervenciones terapéuticas | |
| Control de la enfermedad - remisión/baja actividad de síntomas | Crítico |
| Control de la enfermedad - mejoría de escalas de funcionalidad | Crítico |
| Mejor calidad de vida | Crítico |
| Eventos adversos serios (definidos para cada tratamiento específico) | Crítico |
| Control de la enfermedad - progresión radiográfica | Importante |
| Cambios estructurales crónicos y cambios inflamatorios agudos en radiografía | Importante |
| Desenlaces en preguntas que evalúan pruebas diagnósticas y escalas | |
| Precisión diagnóstica (sensibilidad, especificidad, valor predictivo positivo valor predictivo negativo, razón de probabilidad) | Crítico |
| Fiabilidad, sensibilidad al cambio, capacidad discriminativa | Crítico |
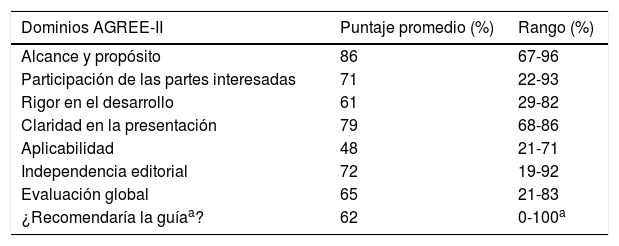
Una vez definidas las preguntas que respondería la guía, se hizo una búsqueda encaminada a identificar las GPC en EspAax, con el fin de evaluar la pertinencia de adaptar o adoptar algunas de sus recomendaciones siguiendo la estrategia Adolopment21. Se identificaron en total 12 GPC publicadas en los últimos 5 años14,15,22–31, como criterio de selección preestablecido. Estas GPC fueron revisadas en su totalidad por tres miembros del GDG y un metodólogo de Evidentias SAS, de acuerdo con el instrumento The Appraisal of Guidelines for Research & Evaluation Instrument (AGREE-II)32,33. Los resultados de esta evaluación se presentan en la tabla 2.
Evaluación de las GPC en EspAax según el instrumento AGREE-II
| Dominios AGREE-II | Puntaje promedio (%) | Rango (%) |
|---|---|---|
| Alcance y propósito | 86 | 67-96 |
| Participación de las partes interesadas | 71 | 22-93 |
| Rigor en el desarrollo | 61 | 29-82 |
| Claridad en la presentación | 79 | 68-86 |
| Aplicabilidad | 48 | 21-71 |
| Independencia editorial | 72 | 19-92 |
| Evaluación global | 65 | 21-83 |
| ¿Recomendaría la guíaa? | 62 | 0-100a |
EspAax: espondiloartritis axial; GPC: guía de práctica clínica.
Ninguna de las 12 GPC abordó la totalidad de las preguntas definidas por el GDG. Aquellas que cumplían con la rigurosidad deseada (según evaluación de este dominio por AGREE-II) fueron tenidas en cuenta para adaptar sus recomendaciones sobre aquellas preguntas para las cuales no se encontró evidencia que permitiera dar una respuesta. En la mayoría de los casos se procedió a desarrollar las preguntas de novo.
Revisión de la evidencia y desarrollo de las recomendacionesEl equipo de Evidentias SAS llevó a cabo revisiones sistemáticas de la literatura para resolver cada pregunta de la guía e informar sobre los efectos (beneficios y daños) de las intervenciones, la utilización de recursos (rentabilidad), valores y preferencias (importancia relativa de resultados), el impacto posible sobre la equidad, la aceptabilidad y la viabilidad de la potencial recomendación.
Búsqueda de evidenciaInicialmente, se generó una estrategia de búsqueda altamente sensible para identificar las publicaciones relacionadas con la condición «espondiloartritis». A partir de esta estrategia de definición de la condición, se desarrollaron estrategias de búsqueda específicas para cada pregunta en formato «Paciente, Intervención, Comparador y Outcome o desenlace» (PICO).
Para cada pregunta se diseñaron al menos 3 estrategias de búsqueda complementarias: una búsqueda enfocada en la identificación de evidencia para evaluar el efecto de la intervención o prueba diagnóstica y su seguridad, otra búsqueda para identificar estudios de costos y evaluaciones económicas que permitieran informar al panel sobre el potencial impacto económico de la intervención, y, por último, una búsqueda diseñada para identificar estudios sobre valores y preferencias de los pacientes. Para cada una de estas búsquedas, las estrategias definidas inicialmente para cada pregunta PICO se complementaron con filtros de alta sensibilidad para la identificación del estudio de interés (revisiones sistemáticas de ensayos clínicos, estudios de pruebas diagnósticas, estudios de costos y análisis económicos, estudios de calidad de vida y valoración de preferencias). Las búsquedas fueron realizadas por un experto en bioinformática.
Las búsquedas se hicieron mediante el metabuscador OVID, incluyendo las bases de datos PubMed/MEdline, Embase, Epistemonikos y LILACs - Scientific Electronic Library Online (SciELO). Cuando la búsqueda no arrojó evidencia relevante para responder la pregunta, se llevó a cabo una búsqueda manual por revisión de referencias, consulta a páginas de sociedades científicas y consulta a expertos del GDG.
Tanto la búsqueda como los procesos de selección, evaluación y síntesis de evidencia se llevaron a cabo de acuerdo con los estándares propuestos por la colaboración Cochrane34. Los estudios identificados para cada pregunta PICO fueron evaluados en su calidad metodológica por epidemiólogos. Las revisiones sistemáticas (RSL) se evaluaron de conformidad con la herramienta Assessing the Methodological Quality of Systematic Reviews (Amstar 2)35, los experimentos clínicos aleatorios se evaluaron con el instrumento de riesgo de sesgo de la colaboración Cochrane Risk of Bias (RoB)36, los estudios de diagnóstico y las revisiones sistemáticas de pruebas diagnósticas con la herramienta Quality Assessment of Diagnostic Accuracy Studies (QUADAS 2)37, y los estudios de costos, con la lista de chequeo de Drummond, recomendada para la evaluación de estudios de análisis económico38. La evaluación de la calidad de los estudios de valores y preferencias se realizó siguiendo las recomendaciones del GRADEwg para este tipo de evidencia39. La evaluación de la calidad global de la evidencia se llevó a cabo de acuerdo con la aproximación GRADE40.
A partir de la evaluación de la evidencia, siguiendo los lineamientos de la aproximación GRADE, se elaboraron perfiles de evidencia y tablas de resumen de hallazgos que incluyeron los principales desenlaces definidos como de interés para cada pregunta17 (material suplementario disponible en: https://www.asoreuma.org).
Para cada pregunta se preparó un protocolo que incluyó: la pregunta PICO, la calificación de los desenlaces, la estrategia de búsqueda, la descripción de los resultados de la búsqueda, una breve reseña de los estudios identificados para cada aspecto de interés y su calidad metodológica, y la tabla de resumen de hallazgos GRADE. Adicionalmente, cada protocolo incluyó el formato de Evidence to Decision (EtD) sugerido por el GRADEwg para soportar al panel en la formulación de recomendaciones18.
Cada protocolo, una vez completado, fue revisado por un experto reumatólogo del GDG. Los comentarios y las adiciones sugeridas por el experto se tuvieron en cuenta para realizar una nueva versión del protocolo, el cual fue enviado finalmente a todos los miembros del GDG para su revisión. Los artículos enviados por los expertos como información complementaria se evaluaron en su calidad metodológica por el grupo de Evidentias SAS y, de acuerdo con esta evaluación, la información obtenida fue asignada a las columnas de «evidencia» o «información adicional» del EtD.
Los miembros del GDG, los representantes de los pacientes y los expertos en equidad fueron contactados por los coordinadores de la GPC durante el proceso de preparación del EtD con antelación suficiente para obtener de ellos la información pertinente a estos 2 aspectos para cada pregunta.
Todos los miembros del GDG recibieron el total de protocolos desarrollados para cada pregunta de la GPC, en un mensaje de correo electrónico que motivaba a leer la información y preparar con antelación tanto la información adicional que consideraran pertinente como la votación (juicio) que darían a cada aspecto contemplado en el formato EtD. Este envío se realizó con 8 días de antelación a la reunión de recomendaciones.
De acuerdo con la metodología de consenso formal de la Guía Metodológica para la elaboración de guías de atención integral en el Sistema General de Seguridad Social de Salud colombiano20, se escogió la modalidad de panel de expertos, facilitando así la discusión de la evidencia para la construcción de las recomendaciones. El panel de expertos estuvo conformado por 10 miembros del Grupo de Estudio en Espondiloartritis de Asoreuma. Se seleccionaron un líder y un coordinador para la GPC de EspAax.
Para generar las recomendaciones se hicieron dos reuniones virtuales mediante la plataforma Google Meet. A las reuniones asistieron, además del panel de expertos, los representantes de los pacientes, un antropólogo, los representantes del Ministerio de Salud y Protección Social, los representantes del Instituto de Evaluación Tecnológica en Salud (IETS) y los metodólogos. Las votaciones se realizaron por medio del sistema de votación electrónico Mentimeter®. La recomendación era aceptada con una votación del 50%+1 de los votos del total de personas habilitadas para votar (votaciones en el material suplementario disponible en: https://www.asoreuma.org). Posteriormente a la votación se generó el EtD definitivo, incorporando los ajustes acordados y las recomendaciones votadas. Los protocolos finales fueron revisados nuevamente por el GDG. Las reuniones se grabaron en audio y video para su posterior referencia.
Revisión del documentoEl GDG realizó las actividades que permitieron la inclusión de opiniones de los diferentes actores y tomadores de decisiones: 1) socialización del alcance, los objetivos y las preguntas clínicas contenidas en la guía, mediante la publicación en la página de Asoreuma; 2) participación y votación en las reuniones virtuales; 3) socialización durante un mes de las recomendaciones finales de la GPC con los profesionales de la salud e interesados, mediante su publicación en la página de Asoreuma y anuncios en redes sociales; y 4) envío del documento final de la GPC a revisión por pares externos. Se propone actualizar esta GPC cada dos años a partir de su publicación, si hay evidencia nueva que cambie en una u otra dirección alguna de las recomendaciones inicialmente propuestas. De no haber evidencia nueva, se revisará de nuevo en 3 años.
ResultadosA continuación, se presentan las recomendaciones de acuerdo con cada pregunta realizada, junto con el resumen de la evidencia:
- •
Pregunta 1. ¿En la detección de pacientes adultos con EspAax y dolor lumbar crónico en individuos menores de 45 años, cuál de las escalas de tamizaje (1. Algoritmo de Berlín; 2. Criterios de ASAS de dolor lumbar inflamatorio; 3. Criterios de Calin), se debe usar por sus características operativas y rendimiento diagnóstico?
Recomendación: en pacientes con dolor lumbar mayor de 3 meses de evolución, el panel sugiere la aplicación cualquiera de los 3 criterios de clasificación para tamizaje de dolor lumbar inflamatorio. Recomendación condicional a favor. Calidad de la evidencia ⊕⊕○○ baja.
Punto de buena práctica: el médico en atención primaria puede encontrar más útil el uso de los criterios ASAS de dolor lumbar inflamatorio para este fin.
Resumen de la evidencia: no se identificaron RSL que compararan las características operativas de las escalas de tamizaje Calin, Berlín y ASAS. Se identificaron 3 estudios independientes que evalúan comparativamente algunas de estas pruebas de tamizaje: el estudio Divers41, el estudio de Arnbak 201642 y el estudio Solmaz43.
Conclusión: los cuestionarios de tamizaje de dolor inflamatorio lumbar tienen como ventajas su amplia disponibilidad y fácil realización. Los valores de sensibilidad y especificidad variaron de forma amplia, teniendo en cuenta el patrón de referencia que se empleara. En general, el rendimiento diagnóstico es aceptable. Estas herramientas deberán ser complementarias al juicio clínico.
- •
Pregunta 2. ¿Para el diagnóstico de EspAax en pacientes adultos, se debe realizar resonancia magnética (RM) de articulaciones sacroilíacas en vez de radiografía de sacroilíacas, por sus características operativas y rendimiento diagnóstico?
Recomendación: se sugiere realizar radiografía convencional de las articulaciones sacroilíacas, como el primer método de imagen para diagnosticar la sacroileítis como parte de la EspAax. Si el diagnóstico de EspAax no puede establecerse en función de las características clínicas y la radiografía convencional, y todavía se sospecha EspAax, se sugiere utilizar la RM de las articulaciones sacroilíacas. Recomendación condicional a favor de la radiografía convencional. Calidad de la evidencia ⊕⊕○○ baja.
Punto de buena práctica: el panel considera que no es pertinente solicitar gammagrafía ósea para el estudio de pacientes con dolor lumbar y sospecha de EspAax.
Resumen de la evidencia: no se identificaron estudios que evaluaran comparativamente la RM vs. la radiografía lumbosacra. Este resumen se basa en 4 estudios: una RSL que evalúa la RM en el diagnóstico de la EspAax44, un estudio que evalúa realizar RM de sacroilíacas y lumbar45 y 2 estudios de cohorte46,47.
Conclusión: se sugiere realizar radiografía convencional de las articulaciones sacroilíacas como primer método de imagen para diagnosticar la sacroileítis. Se considera pertinente, con base en la capacidad de la RM de detectar tempranamente la enfermedad, realizarla en población joven con síntomas de pocos años de duración.
- •
Pregunta 3. ¿En pacientes adultos con EspAax, se deben usar antiinflamatorios no esteroideos (AINE) como la primera opción de tratamiento farmacológico por su efectividad (control enfermedad, remisión/baja actividad de síntomas, mejoría de escalas de funcionalidad) y seguridad (eventos adversos)?
Recomendación: en pacientes con EspAax se recomienda el uso de AINE como primera opción de tratamiento. Recomendación fuerte a favor. Calidad de la evidencia ⊕⊕⊕⊕ alta.
Punto de buena práctica: al momento de prescribir medicamentos tipo AINE se deben valorar las posibles contraindicaciones. El panel considera que, en caso de enfermedad activa, se deben usar 2 AINE secuenciales en dosis óptimas por al menos 4 semanas.
Resumen de la evidencia: se seleccionó la revisión sistemática de la literatura (RSL) de Kroon 2015 que incluyó 39 estudios. La calidad metodológica según Amstar fue buena.
Conclusión: el balance entre los efectos deseables y no deseables favorece el uso de la intervención, con impacto en varios desenlaces de forma favorable y un perfil de seguridad adecuado.
- •
Pregunta 4. ¿En el tratamiento de pacientes adultos con EspAax y manifestaciones axiales, se deben usar medicamentos antirreumáticos modificadores de la enfermedad convencionales (DMARD), por su efectividad (control de la enfermedad, remisión/baja actividad de síntomas, mejoría de escalas de funcionalidad) y seguridad (eventos adversos)?
Recomendación: en pacientes con EspAax y manifestaciones axiales, se recomienda no usar DMARD convencionales como opción terapéutica. Recomendación condicional en contra. Calidad de la evidencia ⊕⊕○○ baja.
Resumen de la evidencia: no se identificaron estudios que evaluaran comparativamente DMARD convencionales agrupados vs. otras terapias en la EspAax. Este resumen se basa en 2 RSL de la literatura48,49. La calidad global de la evidencia fue «baja».
Conclusión: no se recomienda el uso de DMARD convencionales como estrategia terapéutica en pacientes con EspAax dado que la certeza en la evidencia es baja. Adicionalmente, no hay diferencias en las comparaciones (metotrexate, sulfasalazina y leflunomida vs. placebo). Se presentó más riesgo de eventos adversos con DMARD convencionales en estudios que evaluaron estos medicamentos en otras enfermedades autoinmunes.
- •
Pregunta 5. ¿En el tratamiento de pacientes adultos con EspAax se deben usar los analgésicos convencionales (acetaminofén, opioides), por su efectividad (mejoría de escalas de dolor y calidad de vida) y seguridad (eventos adversos)?
Recomendación: en pacientes con EspAax que presentan intolerancia y/o contraindicación a la terapia con AINE, o quienes presenten dolor residual a pesar de un tratamiento adecuadamente instaurado, se sugiere el uso de acetaminofén u opioides para el control del dolor. Recomendación condicional a favor. Calidad de la evidencia ⊕⊕○○ baja.
Punto de buena práctica: el panel sugiere evitar el uso continuo y prolongado de medicamentos opioides y racionalizar su uso, como también iniciar analgésicos tipo acetaminofén antes de iniciar medicamentos opioides.
Resumen de la evidencia: no se identificó ningún estudio que evaluara este tratamiento únicamente en pacientes con EspAax, solo se encontró un estudio realizado por Chang et al.50 en espondilitis anquilosante.
Conclusión: los pacientes con EspAax con contraindicación y/o intolerancia a AINE, o quienes presenten enfermedad avanzada o comorbilidades asociadas, pueden beneficiarse del uso de acetaminofén y/o opioides.
- •
Pregunta 6. ¿En el tratamiento de pacientes adultos con EspAax se deben usar los glucocorticoides (locales o sistémicos) por su efectividad (control de la enfermedad, remisión/baja actividad de síntomas, mejoría de escalas de funcionalidad y calidad de vida, progresión radiográfica) y seguridad (eventos adversos)?
Recomendación: en pacientes con EspAax, se recomienda no usar glucocorticoides sistémicos ni locales. Recomendación fuerte en contra. Calidad de la evidencia ⊕○○○ muy baja.
Resumen de la evidencia: se seleccionó la RSL de Ward et al.51. La calidad de la evidencia fue catalogada como muy baja. Esta RSL generó una recomendación fuerte en contra.
Conclusión: la baja calidad de los estudios, la pequeña cantidad de pacientes y el alto riesgo de sesgos impidieron concluir en favor de la intervención. La evidencia indirecta con respecto al perfil de seguridad del uso de corticoides sistémicos hace pensar que son mayores los riesgos que los beneficios.
- •
Pregunta 7. ¿En pacientes adultos con EspAax activa que han fallado a AINE, se debe usar: 1) anti-TNFα; 2) anti-IL-17; 3) anti-12-23 o 4) inhibidores JAK, como segunda opción de tratamiento por su mayor efectividad y seguridad?
Recomendación: en pacientes con EspAax que presentan falla terapéutica o intolerancia farmacológica a AINE, se recomienda el inicio de terapia con anti-TNFα o con anti-L17A. Recomendación fuerte a favor. Calidad de la evidencia ⊕⊕⊕⊕ alta.
Punto de buena práctica: en caso de considerar terapia con anti-IL17A, el panel recomienda preferiblemente la elección de secukinumab, sobre el cual hay mayor evidencia que soporta su uso.
Resumen de la evidencia: no se identificaron estudios primarios que comparen en paralelo el efecto de iTNFa, anti-IL17A, anti-IL12-23 e iJAK. Se identificó un estudio que comparó ixekizumab (anti-IL17A) en 2 dosis diferentes con adalimumab (iTNFa) y placebo52. Se identificaron varios estudios que evaluaron individualmente medicamentos de las clases de interés vs. placebo52–56. El secukinumab ha sido evaluado en varios ECA conocidos como los estudios Measure (1, 2 y 3) para el tratamiento de EspAax, y en el estudio PREVENT54 para el tratamiento de la EspAax-nr.
Conclusión: el balance de los efectos deseables e indeseables a partir de la evidencia evaluada favorece el uso de la intervención. La evidencia sobre el beneficio y la seguridad de iTNFa es de alta calidad. La evidencia sobre secukinumab con respecto a beneficios es alta, sin embargo, debido a la imprecisión en la medición de eventos adversos (frecuencias menores aL 1%), la calidad de la evidencia se considera moderada.
- •
Pregunta 8. ¿En pacientes adultos con EspAax que han fallado a primera línea de tratamiento biológico con un anti-TNFα, se debe usar otro medicamento/biológico (cuál) como siguiente opción de tratamiento por su efectividad y seguridad?
Recomendación: en pacientes con EspAx, que presentan falla terapéutica o intolerancia farmacológica a los anti-TNFα, se sugiere el inicio de un anti IL17A. Recomendación condicional a favor. Calidad de la evidencia ⊕⊕○○ baja.
Resumen de la evidencia: no se identificó ningún estudio que haya evaluado los inhibidores IL17A en pacientes con EspAax que fallan a la terapia inicial con anti-TNF. Los estudios Measure 1 a 4 de fase III se condujeron con el fin de evaluar el efecto de secukinumab a diferentes dosis en pacientes con espondilitis anquilosante. En el Measure 257,58 se condujo un análisis de subgrupos que incluyó 219 pacientes, de los cuales 85 (38,8%) habían recibido tratamiento anti-TNF sin respuesta o intolerancia58.
En el estudio Measure 359 se incluyeron 226 pacientes, de los cuales 53 habían presentado falla terapéutica o intolerancia farmacológica al manejo con un anti-TNF.
Conclusión: el balance entre los efectos deseables e indeseables favorece el uso de un anti-IL17A.
- •
Pregunta 9. ¿En pacientes adultos con EspAax se deben usar terapias no farmacológicas, como terapia física y ejercicio, para el control de la enfermedad, la remisión de síntomas, la baja actividad de la enfermedad y la mejoría de las escalas de funcionalidad y la calidad de vida?
Recomendación 9A: en pacientes con EspAax, se recomienda la prescripción del ejercicio y de terapia física como parte del tratamiento usual. Recomendación fuerte a favor. Calidad de la evidencia ⊕⊕⊕○ moderada.
Recomendación 9B: en pacientes con EspAax, se sugiere la prescripción de terapia ocupacional. Recomendación condicional a favor. Calidad de la evidencia ⊕⊕○○ baja.
Punto de buena práctica: el panel considera priorizar el ejercicio en tierra sobre el ejercicio en agua por factibilidad de realizarlo por largo tiempo. Considera que la prescripción de la terapia física sea realizada idealmente por profesionales capacitados para este fin (especialista en medicina física y rehabilitación, especialista en medicina del deporte).
Resumen de la evidencia: no se identificaron estudios que evaluaran comparativamente todas las terapias físicas disponibles, sin embargo, sí se identificaron estudios que evaluaran algunas de ellas en comparación con otras, o con la opción de no hacer terapia física. Se identificó un ensayo clínico controlado abierto60, cuyo objetivo fue evaluar el efecto de la terapia ocupacional sobre el estado funcional de los pacientes con EA tratados con medicamentos anti-TNF. Se identificó una RSL61 que evalúa el papel del ejercicio en tierra o en el agua para el manejo de pacientes con EA. Esta revisión fue calificada con Amstar62 y se consideró de calidad aceptable. Para el ejercicio se identificó la RSL de Pécourneau et al. 201863 de calidad aceptable de acuerdo con Amstar.
Conclusión: la evidencia de ensayos clínicos y metaanálisis ha mostrado el impacto positivo de la terapia física, el ejercicio tanto en tierra como en agua y la terapia ocupacional en el estado de salud, el estado funcional y la calidad de vida de los pacientes con EspAax.
- •
Pregunta 10. ¿En pacientes adultos con EspAax se debe usar el manejo no farmacológico con terapias no convencionales (1. Acupuntura; 2. Pilates; 3. Terapia neural; 4. Yoga; 5. Reiki) para el control de la enfermedad, la remisión de síntomas, la baja actividad de la enfermedad, la mejoría de escalas de funcionalidad y de la calidad de vida?
Recomendación: en pacientes con EspAax se recomienda no usar terapias no convencionales como «única» opción de tratamiento. Recomendación condicional en contra. Calidad de la evidencia ⊕⊕○○ baja.
Resumen de la evidencia: se identificaron 75 resultados, de los cuales 8 corresponden a revisiones sistemáticas y metaanálisis: acupuntura, 3 RSL64–66; Pilates, 2 RSL66,67; un metaanálisis68, un estudio cuasiexperimental69 y 2 estudios clínicos70,71. Terapia neural: se identificó solo un estudio72. Yoga: se identificó solo un estudio73. Reiki: la búsqueda de la literatura no arrojo ningún artículo relevante.
Conclusión: las terapias complementarias, en general con pocas contraindicaciones y efectos secundarios, podrían ser parte del arsenal terapéutico multidisciplinario pertinente en estas enfermedades. Sin embargo, no se deben utilizar como única opción de tratamiento.
- •
Pregunta 11. ¿Para evaluar la actividad de la enfermedad en pacientes adultos con EspAax, cuál de las escalas de clinimetría (ASDAS, BASDAI) se debe usar, de acuerdo con las características de la prueba (fiabilidad, sensibilidad al cambio, capacidad discriminativa, consistencia interna)?
Recomendación: en pacientes con EspAax se sugiere el uso de las escalas ASDAS o BASDAI para la evaluación de la actividad de la enfermedad. Recomendación condicional a favor. Calidad de la evidencia ⊕⊕⊕⊕ alta.
Punto de buena práctica: el panel sugiere usar preferiblemente el ASDAS porque permite una mejor estratificación de la actividad de la enfermedad.
Resumen de la evidencia: se identificaron cuatro estudios que abordan esta pregunta74–77.
Conclusiones: se recomienda de forma condicional a favor de la evaluación de la actividad con BASDAI y ASDAS, que mostraron una buena habilidad de discriminación y sensibilidad al cambio.
LimitacionesEs importante tener en cuenta que, en algunas de las preguntas de esta GPC, la evidencia encontrada no respondía de forma directa, dado que no se encontraron estudios comparativos entre las estrategias. Esto obligó a utilizar información indirecta para las recomendaciones. Se hace necesario en el futuro el diseño de ECA que involucren directamente las comparaciones de interés. La cambiante clasificación de la enfermedad dificultó la selección de los estudios.
DiscusiónEsta GPC presenta las recomendaciones relacionadas con el diagnóstico y el tratamiento temprano de pacientes adultos con EspAax, dirigida a los profesionales de la salud involucrados en la atención de pacientes, tomadores de decisiones, pagadores del gasto en salud y entidades gubernamentales que generan políticas en salud. Estas recomendaciones se dirigen a describir el enfoque del tratamiento del paciente típico y no pueden anticipar todos los escenarios clínicos posibles, por lo tanto, su aplicación debe ser individualizada. Con esta iniciativa académica se pretende disminuir la variabilidad en la práctica clínica y apoyar la toma de decisiones en el manejo de pacientes con EspAx.
FinanciaciónEl desarrollo de esta GPC fue posible gracias al apoyo irrestricto de las siguientes entidades que en su conjunto financiaron su realización: Abbvie, Amgen, Janssen, Novartis, Pfizer. El trabajo técnico del proceso para el desarrollo de esta GPC se llevó a cabo de manera independiente por parte del GDG.
Conflicto de interesesLa declaración de conflictos de interés de cada uno de los miembros del GDG se realizó desde el inicio del proceso de elaboración de la GPC, y antes de iniciar las reuniones de generación de recomendaciones por todos los demás participantes. No se manifestó ningún conflicto de interés que impidiera la participación o votación de alguno de los miembros.
El grupo desarrollador de la guía agradece por su participación desinteresada y permanente durante todo el desarrollo de esta GPC a los representantes de los pacientes María T. Castellanos y Julieth S. Buitrago (representante de la Fundación de Espondilitis Anquilosante en Colombia), al antropólogo representante de la sociedad civil Yuri Romero, a los representantes del Ministerio de Salud y Protección Social Gloria Villota, Rodrigo Restrepo, Nubia Bautista e Indira Caicedo, y a los representantes del IETS Adriana Robayo, Kelly P. Estrada, Ani Cortez, Lorena del Pilar Mesa, Jeyson Javier Salamanca Rincón. De igual forma, el GDG agradece la participación, el apoyo metodológico, la asesoría y el acompañamiento de José R. Pieschacón MD, MSc., magíster en Epidemiología Clínica, y María X. Rojas, enfermera, magíster en Epidemiología Clínica, DEA en Salud Pública, Ph. D. en Investigación Biomédica con énfasis en Evaluaciones Económicas, como representantes de Evidentias SAS.
Un agradecimiento especial a los evaluadores externos de la GPC, Dr. Mario H. Cardiel, MD, MSc., especialista en Medicina Interna y Reumatología del Centro de Investigación Clínica de Morelia SC, Morelia, Michoacán, México, Unidad de Investigación «Dr. Mario Alvizouri Muñoz» del Hospital General «Dr. Miguel Silva» de la Secretaría de Salud del Estado de Michoacán, Universidad Michoacana de San Nicolás de Hidalgo, Universidad Nacional Autónoma de México, y Dr. Enrique R. Soriano MD, MSc., especialista en Medicina Interna y Reumatología, jefe de la Sección de Reumatología del Hospital Italiano de Buenos Aires, Argentina, profesor titular en el Instituto Universitario del Hospital Italiano de Buenos Aires; director de la Maestría en Investigación Clínica de dicho instituto, expresidente de la Liga Panamericana de Asociaciones de Reumatología (PANLAR), expresidente de la Sociedad Argentina de Reumatología, y miembro del Comité Directivo del Grupo Group for Research and Assessment of Psoriasis and Psoriatic Arthritis (GRAPPA).
Este documento se publica simultáneamente en las revistas [Revista Colombiana de Reumatología -https://doi.org/10.1016/j.rcreu.2021.08.003] y [Reumatología Clínica – https://doi.org/10.1016/j.reuma.2021.09.003], con el consentimiento de los autores y editores.