El ictus isquémico es una de las principales causas de morbimortalidad en nuestro entorno. Por otra parte, la fibrilación auricular (FA) es una causa conocida de ictus isquémico, aunque el riesgo de accidentes cerebrovasculares asociados a FA se reduce significativamente con el uso de anticoagulantes. El inicio de terapia anticoagulante tras un ictus isquémico requiere la documentación de FA. En cambio, en ausencia de documentación de FA tras un ictus isquémico, en la mayoría de los casos se recomienda la administración de terapia antiagregante. Dado que la FA puede tener frecuentemente un comportamiento paroxístico y asintomático, puede no ser detectada mediante las técnicas convencionales de monitorización electrocardiográfica usadas en el contexto del ictus isquémico de origen desconocido (criptogénico). Las estrategias empleadas en la práctica clínica habitual para la detección de FA tras un ictus isquémico incluyen la monitorización hospitalaria, los ECG seriados, el holter de 24h, holter de registro continuo de hasta 7 días y los registradores de eventos externos e internos, existiendo resultados muy heterogéneos respecto a la efectividad de los distintos métodos. Esto es debido, en parte, a la disparidad entre los estudios respecto a los criterios de inclusión de pacientes, los endpoints y a la duración exigida al episodio para establecer el diagnóstico de FA. Por este motivo, actualmente no existe consenso acerca de la estrategia óptima para la detección de FA tras un ictus criptogénico. En este artículo revisamos los métodos que han sido analizados en los últimos años para detectar la FA tras un ictus criptogénico y resumimos las recomendaciones actualmente vigentes en relación con el manejo del ictus criptogénico.
Ictus criptogénico. ¿Cómo se define y cuál es su importancia?El ictus criptogénico se define como aquel ictus isquémico de etiología desconocida tras excluir todas las potenciales causas mediante un estudio completo (ECG, holter, ecocardiograma transesofágico, eco-doppler de troncos supraaórticos y transcraneal, angioTC/RM de cabeza y cuello). Entre un 17% a 30% de los ictus isquémicos son de origen cardioembólico, si bien se estima que hasta un 40% de los ictus isquémicos son de causa desconocida. Estudios recientes han puesto de manifiesto que en un porcentaje importante de estos pacientes se detecta FA en el estudio etiológico, lo cual tiene unas implicaciones directas en el manejo terapéutico, ya que establece la indicación de tratamiento anticoagulante. Por otro lado, cuando se detecta FA de novo tras un ictus criptogénico, existe un riesgo incrementado de un nuevo ictus. Por lo tanto, las estrategias de detección de FA en el ictus criptogénico son de especial relevancia, ya que incidirán de forma directa en la decisión del tratamiento apropiado.
Ictus criptogénico y fibrilación auricular silente. ¿Relación causa-efecto?El término FA silente ha surgido recientemente para describir aquellos episodios de FA o taquiarritmias supraventriculares que son detectados por sistemas de monitorización electrocardiográfica prolongados, pero que no serían documentados en el contexto clínico habitual por su carácter paroxístico y frecuentemente asintomático. El papel que desempeña la FA silente en el ictus criptogénico no es del todo conocido.
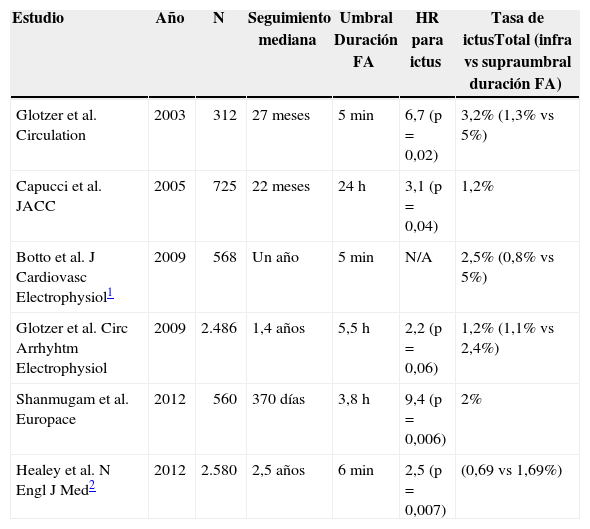
La prevalencia de episodios de FA silente entre los pacientes portadores de holter insertable o marcapasos oscila entre el 30% y el 60%1. Los principales estudios que han analizado el riesgo tromboembólico de los episodios de FA silente en pacientes portadores de marcapasos o desfibrilador sin antecedente de ictus se resumen en la tabla 1. Todos estos estudios muestran aumento de las tasas de ictus asociado a la detección de episodios de FA. El punto de corte establecido para la duración del episodio de FA que se asocia a incremento de riesgo de ictus es de 6min2. Pese a esta asociación, no parece que exista relación temporal entre el episodio de FA y el ictus entre los pacientes portadores de dispositivos (marcapasos o desfibriladores). En este sentido, en la mayoría de pacientes (73-94%) no se detecta FA en el dispositivo en los 30 días previos al evento tromboembólico. Estos datos indican que en los pacientes portadores de dispositivos el mecanismo del ictus no parece estar relacionado con el episodio de FA; si bien esto no contradice que la aparición de episodios de FA silente en estos pacientes consistentemente aumenta el riesgo de eventos tromboembólicos.
Resumen de estudios sobre detección de FA silente en dispositivos bicamerales y riesgo tromboembólico
| Estudio | Año | N | Seguimiento mediana | Umbral Duración FA | HR para ictus | Tasa de ictusTotal (infra vs supraumbral duración FA) |
|---|---|---|---|---|---|---|
| Glotzer et al. Circulation | 2003 | 312 | 27 meses | 5min | 6,7 (p=0,02) | 3,2% (1,3% vs 5%) |
| Capucci et al. JACC | 2005 | 725 | 22 meses | 24h | 3,1 (p=0,04) | 1,2% |
| Botto et al. J Cardiovasc Electrophysiol1 | 2009 | 568 | Un año | 5min | N/A | 2,5% (0,8% vs 5%) |
| Glotzer et al. Circ Arrhyhtm Electrophysiol | 2009 | 2.486 | 1,4 años | 5,5h | 2,2 (p=0,06) | 1,2% (1,1% vs 2,4%) |
| Shanmugam et al. Europace | 2012 | 560 | 370 días | 3,8h | 9,4 (p=0,006) | 2% |
| Healey et al. N Engl J Med2 | 2012 | 2.580 | 2,5 años | 6min | 2,5 (p=0,007) | (0,69 vs 1,69%) |
N: tamaño muestral; HR: hazard ratio.
Por otro lado, aún no está del todo claro cuáles son las características electrocardiográficas clave de los episodios de FA que se asocian a la formación de trombo y al ictus; y que por tanto establecerían la indicación de iniciar anticoagulación. Una de esas características de las que se desconoce su influencia es la duración del episodio de FA. Se ha sugerido que los episodios de «FA no sostenidos» (<30seg) podrían no tener el mismo impacto en la incidencia y características del ictus isquémico respecto a los episodios de FA paroxística o persistente, si bien esto no se ha comprobado en estudios prospectivos.
¿Qué estrategias existen y qué rentabilidad tienen para la detección de fibrilación auricular silente tras un ictus criptogénico?Monitorización intrahospitalaria y electrocardiogramas seriadosEn el pasado constituían las únicas técnicas para documentar FA tras el ictus. Se estima que la realización de ECG seriados durante la hospitalización tras un ictus criptogénico permite detectar episodios de FA en un 2-5% de los pacientes. Resultados similares (2-6%) se obtienen con la realización de holter de 24h durante el ingreso. Sin embargo, estas estrategias han mostrado tener una baja sensibilidad y limitado valor predictivo negativo al ser comparadas con sistemas de monitorización más prolongada.
Monitorización extrahospitalaria mediante sistemas no implantablesEstas estrategias incluyen el holter de registro continuo de 72h, el holter de 48h realizado en repetidas veces, los sistemas de telemonitorización y los registradores de eventos de asa cerrada. En resumen, cuando la monitorización ECG supera las 72h la rentabilidad en la detección de FA silente aumenta un 2-4% con cada 24h adicionales de monitorización. En este sentido, entre los sistemas no implantables los registradores de eventos de asa cerrada son los que han mostrado una mayor tasa de detección de FA silente en pacientes con ictus criptogénico. En el registro SMART el uso de un registrador de eventos externo durante 30 días detectó FA en el 12,1% de una cohorte de pacientes con ictus criptogénico, detectándose el 24% de los episodios en los últimos 10 días de monitorización3. Por otro lado, en un estudio aleatorizado reciente la tasa de detección de FA silente en pacientes con ictus criptogénico, obtenida mediante un registrador de eventos durante 30 días, fue significativamente superior a la observada con la estrategia convencional de holter de 24-48h (16,1% vs 3,2%)4, permitiendo iniciar el tratamiento oportuno en una mayor tasa de pacientes.
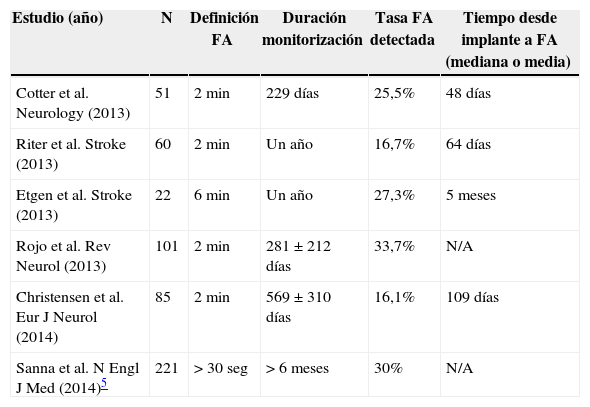
Registradores de eventos implantables (holter insertable)El hallazgo de taquiarritmias auriculares asintomáticas en pacientes portadores de dispositivos de estimulación o desfibriladores, puso de manifiesto la necesidad de los sistemas de monitorización electrocardiográfica implantables para la detección de arritmias como la FA silente. Estos monitores generalmente detectan los episodios de FA mediante algoritmos que analizan la irregularidad de intervalos RR sucesivos. Por lo tanto, estos sistemas exigen una duración mínima (habitualmente 2min) del episodio para que cumpla criterios de detección. Varios estudios han analizado la rentabilidad del holter insertable en la detección de FA en pacientes con ictus criptogénico (tabla 2). La incidencia de FA detectada mediante holter insertable en esta población oscila entre un 16% y un 33,7%, dependiendo de la duración requerida para considerar el episodio como FA, de la duración de la monitorización y del cribado realizado antes del implante. Varios estudios han mostrado que a mayor duración de la monitorización, más elevada es la incidencia de FA detectada.
FA detectada mediante holter insertable en pacientes con ictus criptogénico
| Estudio (año) | N | Definición FA | Duración monitorización | Tasa FA detectada | Tiempo desde implante a FA (mediana o media) |
|---|---|---|---|---|---|
| Cotter et al. Neurology (2013) | 51 | 2min | 229 días | 25,5% | 48 días |
| Riter et al. Stroke (2013) | 60 | 2min | Un año | 16,7% | 64 días |
| Etgen et al. Stroke (2013) | 22 | 6min | Un año | 27,3% | 5 meses |
| Rojo et al. Rev Neurol (2013) | 101 | 2min | 281±212 días | 33,7% | N/A |
| Christensen et al. Eur J Neurol (2014) | 85 | 2min | 569±310 días | 16,1% | 109 días |
| Sanna et al. N Engl J Med (2014)5 | 221 | >30seg | >6 meses | 30% | N/A |
En un reciente estudio prospectivo aleatorizado multicéntrico se comparó la incidencia de FA (a los 6, 12 y 36 meses) en pacientes con edad>40 años que habían sufrido un ictus criptogénico, y que fueron asignados aleatoriamente a monitorización convencional frente a implante de holter insertable (Reveal XT, Medtronic). Entre los pacientes sometidos a monitorización convencional las tasas de detección de FA a los 6, 12 y 36 meses fueron 1,4%, 2% y 3% respectivamente, mientras que en el grupo al que se implantó el holter insertable fueron 8,9%, 12,4% y 30%. Significativamente, al año del implante del holter insertable más del 90% de los pacientes en los que se detectaron episodios de FA presentaron al menos un día con más de 6min de FA5, punto de corte asociado a mayor riesgo tromboembólico según los resultados del estudio ASSERT2.
Conclusiones y recomendaciones para la práctica clínicaLa FA es la primera causa prevenible de ictus recurrente, por lo que su detección y tratamiento precoz son críticos para el correcto manejo de pacientes que han sufrido un ictus isquémico. En este sentido, el rendimiento de las técnicas convencionales para la detección de FA silente en pacientes con ictus criptogénico no parece ser suficiente. Como se ha mostrado en esta revisión, las tasas de detección de FA en pacientes con ictus criptogénico están en función de la duración de la monitorización y de las características de los pacientes (mayores tasas en pacientes de edad>40-50 años). Por otro lado, la FA silente ha mostrado ser un predictor independiente tanto de eventos tromboembólicos de novo como de recurrencias, aunque los episodios de FA no siempre ocurren en proximidad al evento cerebrovascular. Adicionalmente, estudios aleatorizados recientes han mostrado la superioridad de los sistemas de monitorización prolongada en la detección de FA respecto a las estrategias convencionales. Queda por tanto saber si es la FA silente la culpable del ictus criptogénico. La respuesta, a la luz de los datos sobre la incidencia de FA en pacientes con monitorización prolongada es que podría explicar el origen del ictus criptogénico en hasta un 30% de los casos. En este sentido, ¿deberían ser anticoagulados los pacientes con ictus criptogénico en los que se detecta FA silente? La respuesta, de nuevo, es sí; sobre todo teniendo en cuenta que solo el antecedente de ictus previo aporta 2 puntos en la evaluación del CHADS2VASC, estableciendo la indicación de anticoagulación. Por último, queda por responder ¿cuándo y en qué pacientes se debe recurrir a estos sistemas de monitorización electrocardiográfica prolongada? Actualmente no hay una respuesta definitiva para esta pregunta. Según las recomendaciones de la Academia Americana de Neurología se debe realizar una monitorización ECG prolongada (de una o más semanas) en pacientes con ictus criptogénico para incrementar la rentabilidad diagnóstica en la detección de FA (nivel de evidencia C). No obstante, no queda claramente establecido en qué pacientes, por ejemplo, se debe optar por una monitorización con dispositivos implantables vs no implantables. En este sentido, parecería lógico que las estrategias de monitorización prolongada deberían reservarse para los pacientes con ictus criptogénico que se pudieran beneficiar de tratamiento anticoagulante, es decir aquellos con una sospecha clínica de FA probable (en función de la edad y factores de riesgo cardiovascular) y que no tengan contraindicación para la terapia anticoagulante. No obstante, son necesarios nuevos estudios que definan la estrategia óptima de monitorización y la población diana de la misma. Por otro lado, se debe avanzar en el conocimiento exacto del papel que desempeña la FA silente en el mecanismo del ictus criptogénico, así como definir mejor las características (duración y frecuencia) de los episodios de FA silente que se asocian a mayor riesgo tromboembólico.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.