La revascularización miocárdica quirúrgica fue iniciada en el año 1967 con los estudios de Favaloro y Green. Con el paso de los años, los resultados globales de la cirugía coronaria han permanecido estables, a pesar de que en la actualidad el perfil de los pacientes ha empeorado de forma llamativa. El aumento de la edad media y de las comorbilidades se ve reflejado en la supervivencia de la cirugía coronaria a los 5, 10, 15 y 20 años, situándose en torno al 92, 80, 65 y 40%, respectivamente1, con el 60% de los pacientes sin angina transcurridos 10 años desde la intervención.
En el último registro de intervenciones publicado por la Sociedad Española de Cirugía Torácica y Cardiovascular (2006-2008)2 se realizaron más de 5.000 procedimientos de cirugía coronaria aislada con una mortalidad del 4% con circulación extracorpórea (CEC) y del 3,9% sin CEC. Sin embargo, si bien el año 2000 la cirugía coronaria era el procedimiento quirúrgico más frecuente (49%), en la actualidad sólo supone el 28,5%, siendo la cirugía valvular el 40,6% de las intervenciones. La cirugía de las complicaciones del infarto agudo de miocardio (IAM) ha supuesto el 0,9% de las intervenciones totales, con una mortalidad del 3,4% desde 2008.
En nuestro centro, la mortalidad global de la cirugía coronaria aislada es del 1,8%, realizándose alrededor de 100 intervenciones anuales.
Este tipo de cirugía fue inicialmente concebida para el tratamiento de la angina estable, y posteriormente ensayada en el contexto del infarto de miocardio en fase aguda. El tratamiento quirúrgico de las complicaciones mecánicas del IAM sí sigue estando vigente en la actualidad, si bien afortunadamente la incidencia de éstas ha disminuido considerablemente tras el advenimiento de los tratamientos fibrinolíticos y de la angioplastia primaria.
¿Existe un lugar para la revascularización miocárdica quirúrgica precoz en el seno del IAM?Conceptualmente, la revascularización quirúrgica en las primeras horas tras un síndrome coronario agudo con elevación del ST (SCACEST) podría revertir la isquemia de forma eficaz, delimitando la extensión de la necrosis. No obstante, supondría añadir una agresión quirúrgica en el seno de una situación crítica.
Los estudios experimentales consideran que la ventana de viabilidad es corta, instaurándose la necrosis tras solamente 3h. Tras el desarrollo de la trombólisis y la angioplastia primaria, se ha realizado un cambio gradual hacia el empleo de técnicas menos agresivas para reabrir las coronarias en el seno de un IAM, sustituyendo éstas a la cirugía en la mayoría de los casos, a pesar de no contar con estudios aleatorizados en el momento presente.
En la actualidad, el tratamiento de elección es la angioplastia primaria, siendo así especialmente en centros de alto volumen de actividad programada y por intervencionistas experimentados3.
La fibrinólisis conlleva contraindicaciones, eficacia limitada en reperfusión y elevado riesgo hemorrágico y de retrombosis. Sin embargo, es una alternativa importante a la angioplastia primaria y permite instaurar un tratamiento en pacientes lejos de los hospitales de referencia. La «ACTP facilitada» (asociando fibrinolíticos, anti IIb-IIIa y tratamiento percutáneo) ha mostrado resultados contradictorios y será analizada en otros capítulos de esta monografía.
En el momento actual, los pacientes a los que se practica cirugía coronaria urgente constituyen un subgrupo muy seleccionado con fracaso de la trombólisis o de la angioplastia. La reoclusión precoz tras trombólisis aislada puede llegar al 25%, dependiendo de la severidad de las lesiones subyacentes. No obstante, en aquellos en los que se llega a plantear la cirugía, debe tenerse en cuenta a priori el riesgo hemorrágico que conlleva tras un tratamiento fibrinolítico. Por ello, incluso en este contexto, el rescate con angioplastia-stent es la primera elección, quedando también la cirugía en un segundo plano.
Los pacientes con lesiones severas multivaso, con lesión de tronco coronario o con baja fracción de eyección constituyen un grupo en los que sí es aceptable un tratamiento quirúrgico precoz (no urgente) realizado 24-36h tras una trombólisis adecuada. En estos casos la mortalidad se sitúa en torno al 5%, con una tasa de reintervenciones por sangrado del 5%4.
La otra perspectiva con la que puede plantearse una cirugía coronaria en fase aguda o subaguda es en la prevención del reinfarto precoz cuando existen otras lesiones coronarias en la coronariografía, así como para el control de los síntomas en caso de angina inestable postinfarto. En pacientes diabéticos, con baja fracción de eyección o pacientes multivaso, la cirugía revascularizadora puede ser una opción aún válida hoy en día.
Técnicamente, se recomienda la utilización de cardioplejía retrógrada y anterógrada en estos pacientes. Para ello, si estamos realizando el procedimiento dentro de las primeras 6h, se recomienda iniciar la revascularización con el vaso culpable, reperfundiéndolo con solución cardiopléjica tan pronto como sea posible. Si han pasado más de 6h, el orden es contrario, iniciando la revascularización (y reperfusión) por el vaso de mayor calibre y las zonas en riesgo, dejando la ya infartada (y posiblemente no recuperable) para el final. El conducto elegido puede ser la vena safena o la mamaria interna, si bien la safena puede dar un mayor flujo inicial y permite emplearla como conducto para administrar cardioplejía anterógrada.
La cirugía realizada en fases posteriores del infarto (por angina postinfarto o anatomía coronaria de riesgo), fuera de situaciones emergentes, especialmente la que se lleva a cabo después de 72h, ofrece resultados superponibles a la cirugía coronaria en el paciente con angina estable.
En conclusión, la cirugía de revascularización emergente en el SCACEST solamente se indicaría en casos de anatomía desfavorable para angioplastia primaria, o fallo de la misma, cuando existe un área miocárdica en riesgo muy extensa y siempre que pueda realizarse en las 3-4h iniciales5. Una vez quede estabilizada la situación, tras la fibrinólisis y/o la angioplastia primaria de la lesión culpable, los pacientes considerados para cirugía deberían intervenirse en los 3-7 primeros días.
¿Cuáles son las complicaciones mecánicas del IAM?Existen 5 entidades nosológicas bien diferenciadas:
- •
Comunicación interventricular (CIV) postinfarto.
- •
Rotura cardíaca.
- •
Insuficiencia mitral isquémica aguda.
- •
Shock cardiogénico.
- •
Aneurisma ventricular izquierdo (complicación diferida).
La incidencia de estas complicaciones ha disminuido en los últimos 30 años debido a la estandarización de la revascularización precoz, aunque no de forma tan significativa como cabría esperar. El shock cardiogénico, una vez disminuida la mortalidad arritmogénica, se ha situado como la primera causa de muerte tras un IAM.
¿Cuál es la clave para el diagnóstico precoz?La clave del diagnóstico precoz es la sospecha clínica y la ecocardiografía sistemática en todos los pacientes que presenten signos de bajo gasto en el seno de un IAM.
¿Cuál es el tratamiento más adecuado en la insuficiencia mitral postinfarto?Entre el 30 y el 60% de los pacientes pueden presentar algún grado de insuficiencia mitral tras un infarto con elevación de ST. El grado de insuficiencia predice la mortalidad al año del IAM6.
El mecanismo puede ser la isquemia del músculo papilar, la rotura de éste o incluso la dilatación generalizada del ventrículo izquierdo, provocando un jet central. La mortalidad de la insuficiencia mitral severa post IAM alcanza el 90% sin tratamiento.
Si la sospecha es de disfunción isquémica del músculo papilar, puede intentarse una ACTP primaria sobre la arteria culpable si se actúa en las primeras horas. Posteriormente, y sobre todo si la disfunción es severa, debe intervenirse de urgencia y proceder a la sustitución de la válvula mitral con preservación de tejido subvalvular si es posible. Por lo general, si bien la válvula puede ser aparentemente sana, no está justificado emplear más tiempo en la reparación, así como asumir un mayor riesgo de reintervención precoz, especialmente si la situación es emergente.
Si se dispone de coronariografía previa, debe procederse también a la revascularización completa.
¿Ha mejorado la mortalidad de la CIV postinfarto?La incidencia de la CIV postinfarto ha permanecido relativamente estable en los últimos años, y se estima en el 0,2% de los casos de SCACEST.
La mortalidad quirúrgica continúa siendo del 20 al 50% según las series. La ocurrencia de una CIV anterior, la instauración de shock cardiogénico preoperatorio, así como el tiempo transcurrido hasta el diagnóstico, siguen siendo factores de mal pronóstico.
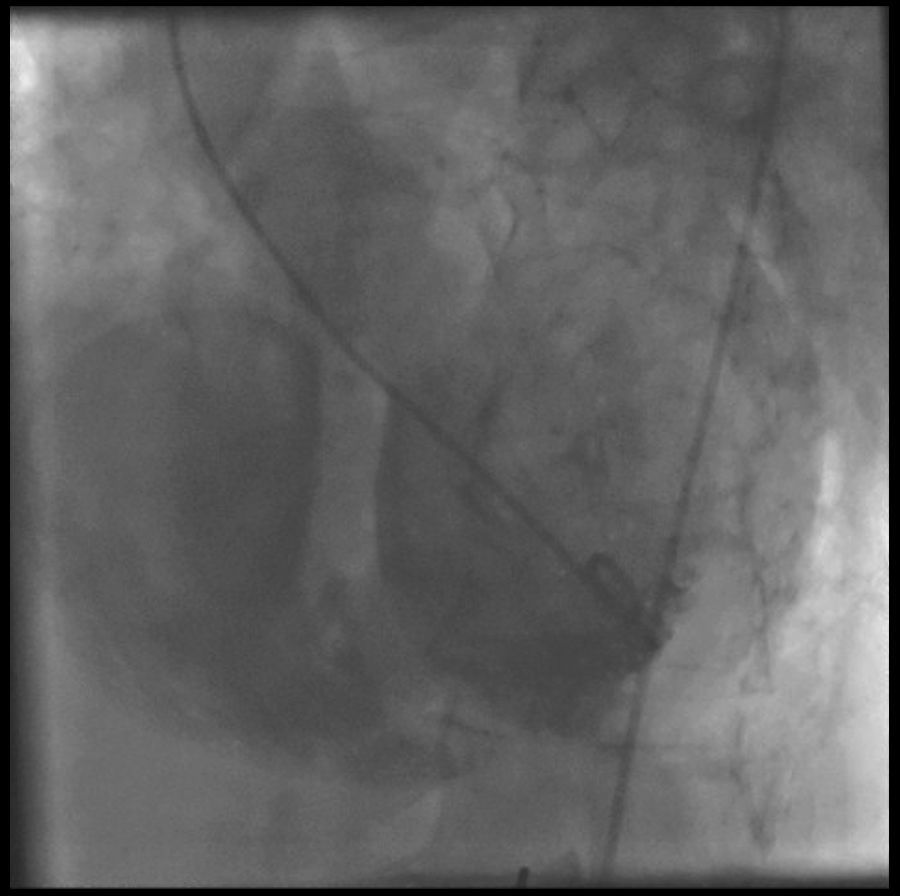
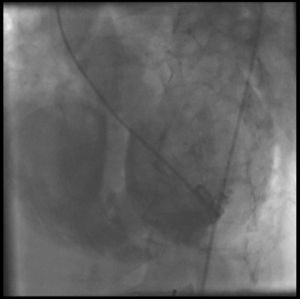
A pesar de que existen algunos intentos de tratamiento percutáneo, hoy por hoy continúa siendo una indicación de cirugía abierta emergente (fig. 1).
Ventriculografía. Comunicación interventricular (CIV) posterior en el seno de un infarto de miocardio inferoposterior en fase aguda. En este caso se procedió a tratamiento quirúrgico emergente: la ventriculotomía se realizó paralela a la arteria descendente posterior, cerrándose la CIV con parche de Dacron intraventricular.
Recientemente se han publicado experiencias que rondan el 40% de mortalidad empleando la técnica del doble parche, uso de pegamentos biológicos, revascularización completa y balón de contrapulsación intraaórtico (BCIA) preoperatorio. No obstante, en los análisis de grandes grupos americanos la mortalidad no ha variado en los últimos 20 años y su incidencia continúa estable7.
¿Cuál es el manejo de la rotura ventricular postinfarto?La rotura ventricular postinfarto puede ocurrir en forma de exudado (oozing) o rotura ventricular franca (evidencia de comunicación franca entre ventrículo y cavidad pericárdica). La mortalidad del segundo caso es significativamente superior, pero las claves del éxito radican en el diagnóstico precoz y en la instauración inmediata del tratamiento quirúrgico. La mayoría de los casos pueden ser tratados con la técnica del parche epicárdico suturado o bien adherido con la ayuda de pegamentos biológicos, a corazón latiendo.
La medida inicial tras el diagnóstico puede ser el drenaje pericárdico percutáneo, siempre que ello no implique un retraso de la cirugía. En determinados centros, la mortalidad puede ser inferior al 15%.
¿Existen nuevas opciones para el tratamiento del shock cardiogénico postinfarto?El shock cardiogénico es la causa más frecuente de muerte tras un IAM con elevación del ST. A pesar de que su incidencia ha disminuido con el desarrollo de las unidades coronarias y las estrategias de angioplastia primaria y tratamientos trombolíticos, una vez instaurado su mortalidad puede alcanzar el 90-100%. Las bases del tratamiento continúan siendo:
- •
Revascularización precoz y completa.
- •
Manejo hemodinámico.
- •
Corrección de las complicaciones mecánicas presentes.
- •
Mantener un adecuado gasto cardíaco: el BCIA sigue siendo ampliamente utilizado. Sin embargo, éste tiene posibles contraindicaciones (arteriopatía periférica grave, insuficiencia aórtica o disección aórtica) y presenta un techo de incremento de gasto situado en 1,8 l/min, lo que puede resultar insuficiente en situaciones hemodinámicas críticas.
El oxigenador de membrana extracorpóreo (ECMO) puede ser una alternativa temporal en pacientes con insuficiencia cardíaca aguda con visos de recuperación tras la revascularización.
Existen dispositivos de asistencia ventricular izquierda que pueden implantarse por vía transfemoral y de forma mínimamente invasiva. Los estudios aleatorizados en el seno del shock post-IAM han demostrado un mayor soporte hemodinámico inicial, pero la mortalidad a largo plazo continúa siendo muy elevada, sin grandes diferencias respecto al BCIA8.
Existen dos alternativas: el Tandem Heart (con canulación femoral) y el Impella (flujo axial transaórtico). Los dispositivos de asistencia ventricular permiten optar por varias estrategias: puente a la recuperación, puente al trasplante o puente al puente (paso de dispositivos de corta duración a dispositivos de larga duración)9. Los dispositivos implantables con cánula de entrada en el ápex del ventrículo izquierdo proporcionan un soporte hemodinámico superior y permiten asistencias de semanas, meses e incluso años. A pesar de que el concepto de canular un ápex ventricular con frecuencia infartado puede resultar contradictorio, los resultados de los grandes grupos son francamente espectaculares, con tasas de trasplante del 80-90%.
No obstante, antes de plantear un tratamiento más allá del ECMO o el BCIA, debe valorarse el coste-efectividad de la medida y realizar una valoración neurológica y de órganos diana que ofrezca alguna garantía de éxito en caso de recuperación hemodinámica.