Dentro del compromiso de la Sociedad Andaluza de Cardiología con la formación continuada, hemos querido realizar un documento que recoja las recomendaciones que existen en el tratamiento antiplaquetario, por ser la piedra angular en la cardiopatía isquémica, cuyo objetivo es proporcionar y orientar a sus miembros en los temas clínicos de especial relevancia y cuya práctica clínica diaria pueden contener algunas lagunas en la toma de decisiones clínicas. No obstante, en el uso cotidiano las guías clínicas siguen siendo la herramienta principal para ofrecer las recomendaciones basadas en la evidencia. En este documento se trata de ofrecer a modo de resumen las recomendaciones terapéuticas del tratamiento antiplaquetario en diferentes escenarios clínicos, en algunos de ellos como el implante valvular aórtico transcatéter (TAVI, por sus siglas en inglés) la evidencia está más limitada, y en otros, en continua evolución; por lo que pueden resultar útiles las directrices analizadas en este documento, con un enfoque nuevo, centrándose en los puntos clave y con recomendaciones concisas, no obstante, apoyadas fundamentalmente en las recientes guías europeas de práctica clínica, por ser nuestro entorno de trabajo. Los temas que son abordados fueron seleccionados basándose en la actualidad clínica por un comité de expertos, constituido por cardiólogos clínicos e intervencionistas, que han tratado de resumir las pautas de tratamiento sobre la base de la evidencia más recientemente disponible, con el objetivo de comentar y mantener informado de las principales estrategias de tratamiento e intentar orientar al clínico en aquellas situaciones en que pueda existir una brecha. Para facilitar la lectura de este documento, se ha estructurado en unas consideraciones generales, y/o resumen de la evidencia disponible y de las posibles controversias que suscitan mayor debate, para continuar de forma concisa en las recomendaciones, apoyándose en las citas bibliográficas referenciadas, y a veces, ilustrado con algunos algoritmos.
Valoración del riesgo del sangradoLa evidencia actual indica que la doble terapia disminuye el riesgo de trombosis intra-stent. No obstante, está asociada con un mayor riesgo de sangrado, siendo necesario sopesar este riesgo versus el beneficio potencial. Para esta finalidad se han desarrollado scores para estimar el riesgo de sangrado y el riesgo isquémico en los pacientes con tratamiento antiplaquetario. Estas herramientas deben ser utilizadas de forma individualizada. La mayoría de los scores de riesgos para evaluar los eventos isquémicos y hemorragias graves fueron desarrollados y validados originalmente para la predicción de eventos en la fase hospitalaria1,2.
Predicción de las hemorragias en la fase aguda del síndrome coronario agudoLas complicaciones hemorrágicas se asocian a peor pronóstico en el síndrome coronario agudo (SCA). El estado de conocimiento actual y las estrategias terapéuticas disponibles permiten reducir la tasa de complicaciones hemorrágicas. La estratificación del riesgo isquémico-hemorrágico (balance) es esencial para optimizar del beneficio terapéutico. Existen factores de riesgo de sangrado fijos como la edad, el sexo femenino, la diabetes, la arteriopatía periférica o la historia previa de sangrado, sobre los que no podemos actuar para limitar el riesgo de sangrado, y hay otros factores de riesgo de sangrado modificables como el acceso vascular o la terapia antitrombótica, sobre los que sí podemos actuar para reducir el riesgo de sangrado. Asimismo también existen otros factores de riesgo de sangrado potencialmente modificables, como la función renal, sobre los que tenemos un margen de mejora para ayudar a limitar el riesgo hemorrágico. En la actualidad disponemos de diversas escalas de riesgo para la predicción del riesgo hemorrágico. De las herramientas más conocidas son los scores CRUSADE, el ACTION y el ACUITY3,4. De todas ellas, el score CRUSADE es el más difundido y validado, con una adecuada capacidad predictiva en todo el espectro de SCA.
Aunque los scores de riesgo hemorrágico no deben sustituir al juicio clínico para la predicción del riesgo hemorrágico, sí son herramientas de predicción complementarias que deben generalizarse en la práctica clínica diaria para ayudar a la optimización de las decisiones terapéutica, dado que existen escenarios especiales que incrementan la complejidad como son los pacientes ancianos, la presencia de insuficiencia renal o la necesidad de anticoagulación concomitante.
Recomendaciones:
- •
Los scores de sangrado CRUSADE, ACTION y ACUITY tiene una buena capacidad predictiva para eventos hemorrágicos mayores intrahospitalarios.
- •
De los 3, las escalas CRUSADE y ACTION son las que tiene mayor discriminación, especialmente en el grupo de pacientes con síndrome coronario agudo sin elevación del segmento ST (SCASEST). Sin embargo, ACTION posee una calibración subóptima por subgrupos de tipos de SCA. Por todo ello, el score CRUSADE es la escala de riesgo más precisa para predecir el riesgo hemorrágico intrahospitalario.
- •
La capacidad discriminativa de los scores de sangrado intrahospitalario baja en el subgrupo de pacientes manejados conservadoramente así como en aquellos con anticoagulación oral (ACO).
Las complicaciones hemorrágicas después del alta por SCA difieren en cuanto a incidencia y localización con respecto a las intrahospitalarias. La clasificación BARC representa un recurso adecuada para establecer la severidad de las hemorragias y su correlación con el pronóstico. La estratificación del riesgo isquémico-hemorrágico (balance) es esencial para optimizar el beneficio terapéutico. Entre 2 y 4 de cada 100 pacientes que han sido dados de alta por un SCA reingresan por sangrado en el primer año, la mayoría de origen gastrointestinal, con un impacto pronóstico en términos de mortalidad similar al del reinfarto. Entre los principales factores de riesgo de sangrado tras el alta por un SCA encontramos: la edad avanzada, la historia previa de sangrado, la presencia de anemia, la insuficiencia renal, el tabaquismo, la arteriopatía periférica, el antecedente de ictus isquémico y de cáncer. En el momento actual, el PARIS bleeding risk model es el único «score» existente para predecir el riesgo de sangrado tras el alta por un SCA, con una capacidad predictiva modesta y en pacientes únicamente con doble terapia con clopidogrel5,6.
Actualmente disponemos de scores de riego que permiten tomar decisiones sobre la duración de la doble terapia antiagregante (DAPT, por sus siglas en inglés), con la finalidad de minimizar los riesgos hemorrágicos y maximizar la protección de eventos isquémicos. El PRECISE-DAPT score, algoritmo que predice el riesgo hemorrágico extrahospitalario, para pacientes tratados con DAPT, tras intervencionismo coronario percutáneo (ICP) con implante de stent, con 5 ítems (edad, aclaramiento de creatinina, hemoglobina, recuento de glóbulos blancos y antecedente de hemorragia espontánea) permite balancear el riesgo hemorrágico con el riesgo isquémico en el SCA, siendo de utilidad para ayudar a seleccionar a aquellos pacientes que se benefician de una mayor o menor duración de la doble antiagregación; así, para los pacientes considerados de alto riesgo hemorrágico según PRECISE-DAPT (≥25), la prolongación de la doble terapia no se asocia con ningún beneficio isquémico, pero sí con un notable incremento del riesgo hemorrágico7.
El DAPT score, con 9 factores de riesgo identificables, balancea el riesgo hemorrágico con el riesgo isquémico a partir del primer año tras un SCA, siendo de utilidad para ayudar a seleccionar a aquellos pacientes que se benefician de prolongar la doble antiagregación a 30 meses, así pacientes con un score DAPT≥2 se podrían beneficiar de la prolongación de la DAPT8.
En pacientes con triple terapia, la tasa media de sangrado oscila entre el 5% y el 15%. Aunque las guías de práctica clínica recomiendan el HASBLED para la estratificación del riesgo hemorrágico en estos pacientes, su capacidad predictiva es subóptima, y es necesario mejorar en este apartado.
Recomendación:
Se recomienda la utilización de herramientas como los scores DAPT y PRECISE-DAPT para tomar la decisión de la duración de la DAPT (IIb A).
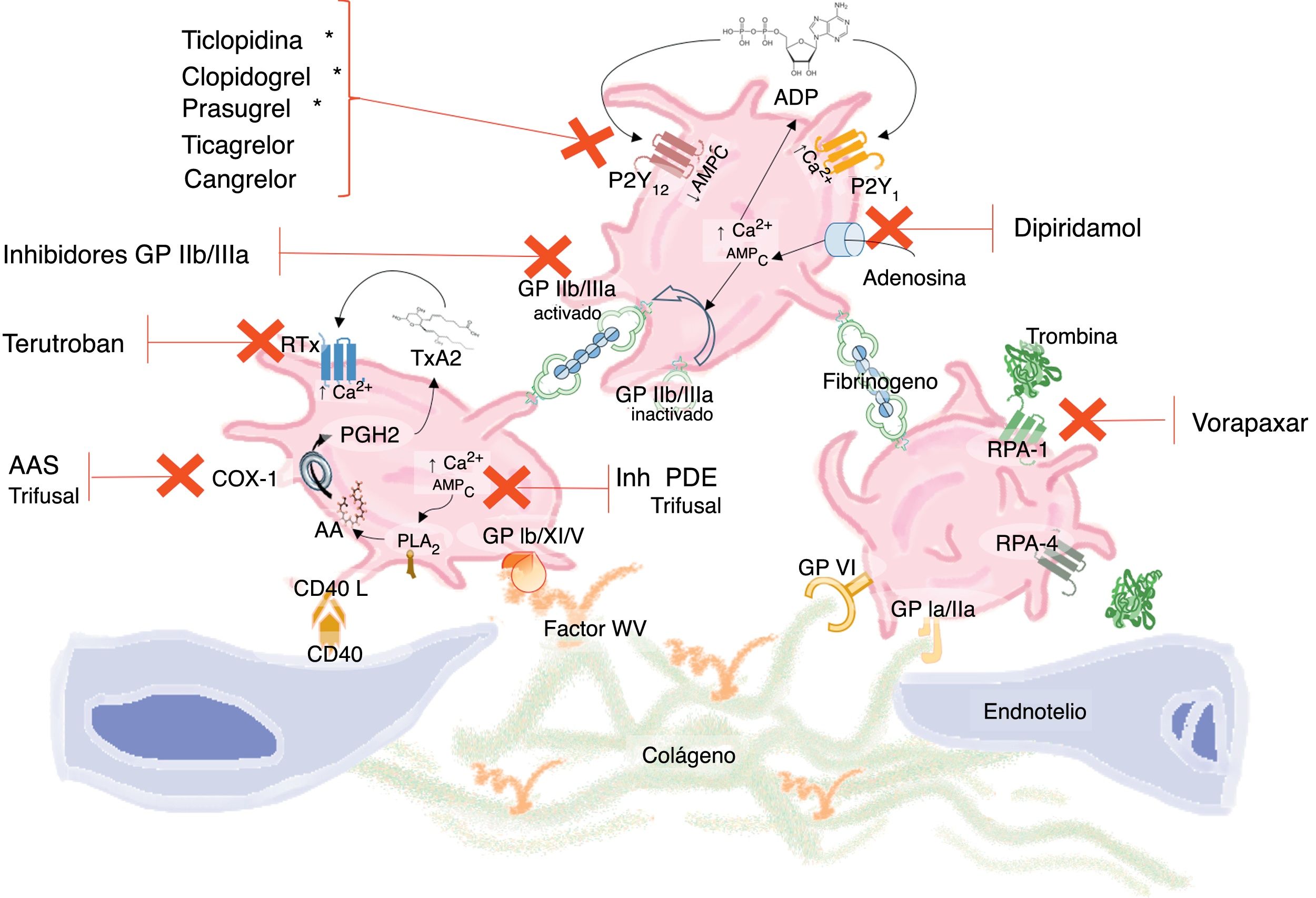
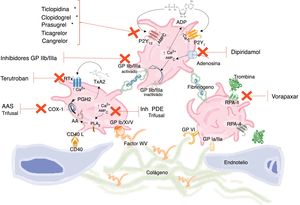
Clasificación de los antiagregantes plaquetarios. Test de función plaquetaria. Papel de los inhibidores de la bomba de protonesClasificación de los antiagregantes plaquetariosLas plaquetas tienen un papel vital en la hemostasia sanguínea inducida tras la lesión del endotelio vascular. La activación y adhesión plaquetaria son por tanto una respuesta fisiológica a la fisura o rotura de la placa aterosclerótica, contribuyendo así a su reparación. Sin embargo, la progresión incontrolada de dicho proceso a través de una amplificación autosostenida puede conducir a la formación de trombos intraluminales y oclusión del vaso9. Este fenómeno de activación y agregación está mediado por múltiples vías (fig. 1). No obstante, es importante tener presente que todas ellas se traducen en señales independientes para la activación plaquetaria y representan por tanto dianas terapéuticas no redundantes para su modulación farmacológica, lo cual se refleja en el efecto aditivo de la combinación de diferentes tipos de antiagregantes (tabla 1) con un impacto evaluable en el riesgo de trombosis arterial que no puede separarse del riesgo aumentado de sangrado.
Vías de activación plaquetaria y dianas terapéuticas de distintos fármacos antiagregantes.
En la activación plaquetaria interactúan diferentes vías que inducen numerosas respuestas, entre las que destacan: aumento de calcio intracelular, disminución de concentraciones de AMPc, activación de fosfolipasas con liberación de AA, sustrato de COX-1 y formación de TxA2, secreción de ADP y su unión a los receptores P2Y12, cambios en la superficie de membrana con generación de trombina y activación de los RPA-1 y RPA-4 y por último activación de la glucoproteína IIb/IIIa con unión a fibrinógeno y agregación plaquetaria.
AA: ácido araquidónico; ADP: adenosina difosfato; AMPc: adenosina monofosfato cíclico; COX-1: ciclooxigenasa-1; Inh PDE: inhibidores fosfodiesterasa; GP: glucoproteína; PGH2: prostaglandina H2; PLA2: fosfolipasa A2; RPA: receptor activado proteasa; RTx: receptor tromboxano; TxA2: tromboxano A2; VW: Von Willebrand; *: metabolito activo.
Fármacos antiagregantes disponibles y en investigación
| Inhibidores ciclooxigenasa 1 |
| Irreversible: aspirina |
| Reversible: trifusal |
| Inhibidores P2Y12 |
| Irreversible: ticlopidina, clopidogrel, prasugrel |
| Reversible: ticagrelor, cangrelor, elinogrel |
| Inhibidores fosfodiesterasa |
| Dipiridamol, cilostazol |
| Inhibidores glucoproteína IIb/IIIa |
| Abciximab, eptifibatide, tirofibán |
| Antagonistas receptor tromboxano |
| Terutrobán |
| Antagonistas receptor trombina |
| Vorapaxar, atopaxar |
La vía del ácido araquidónico dependiente de la ciclooxigenasa 1 (COX-1) genera principalmente tromboxano A2 (TxA2), que amplifica la activación plaquetaria mediante la unión a los receptores plaquetarios. La aspirina interfiere el proceso de agregación plaquetaria suprimiendo la formación de TxA2, vía inhibición irreversible la COX-1 mediante la acetilación selectiva de un residuo de serina (Ser-529) de la porción catalítica de la enzima. De esta forma, mediante bajas dosis de aspirina, se consigue una inhibición completa y duradera de la COX-1 lo cual se asocia con una reducción de eventos aterotrombóticos9. La aspirina se absorbe en el estómago y en el intestino delgado, ejerciendo su efecto antiagregante ya a nivel del sistema venoso portal. Su biodisponibilidad es de aproximadamente un 50% de la dosis administrada, en parte debido al proceso de biotransformación a su forma inactiva (isoenzima 2) que sufre por las carboxiesterasas a nivel intestinal, plasmático y hepático. Una vez en la circulación sistémica, alcanza la médula ósea actuando sobre megacariocitos y precursores plaquetarios, inhibiendo tanto COX-1 como COX-2.
Inhibidores del receptor de P2Y12Los inhibidores orales de los receptores plaquetarios de adenosina fosfato, P2Y12, son un grupo de fármacos en los que se incluyen las tienopiridinas (ticlopidina, clopidogrel y prasugrel) y el ticagrelor. Las tienopiridinas son profármacos, que requieren de su metabolización para generar el compuesto activo, de vida media corta, el cual inhibe de forma irreversible el receptor plaquetario y consecuentemente la activación plaquetaria inducida por adenosina difosfato. Por otro lado, el ticagrelor es un análogo de la adenosina trifosfato con capacidad para unirse de forma directa y reversible al receptor P2Y12 plaquetario. Las principales características de estos fármacos se resumen en la tabla 2. El bloqueo del receptor P2Y12 con clopidogrel, añadido al efecto sobre la COX-1 con bajas dosis de aspirina, produce una reducción adicional de un 10-20% en el riesgo relativo de presentar eventos cardiovasculares en pacientes de alto riesgo9. Este modesto beneficio podría reflejar el bajo grado de inhibición del receptor P2Y12 alcanzado por el clopidogrel en la mayoría de los pacientes. El rápido e intenso bloqueo del receptor P2Y12 conseguido con prasugrel y ticagrelor produce un beneficio adicional comparado con clopidogrel en el SCA, lo que sustenta la relevancia clínica de actuar de forma efectiva sobre 2 dianas no redundantes de la señalización plaquetaria10.
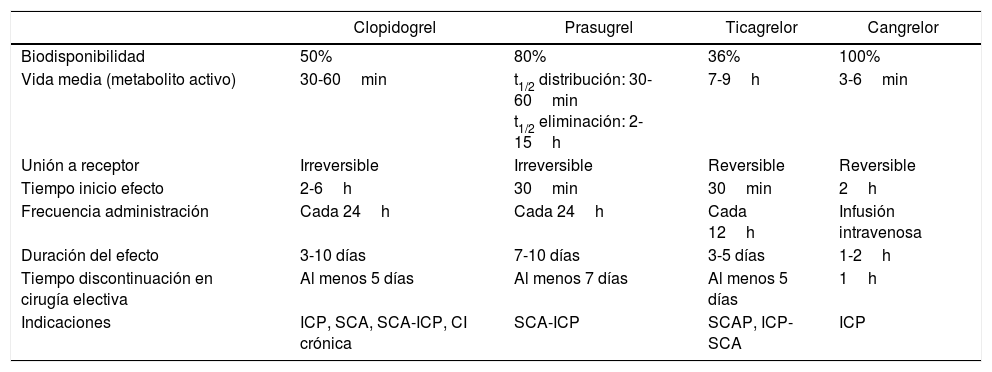
Características de los inhibidores de los receptores P2Y12
| Clopidogrel | Prasugrel | Ticagrelor | Cangrelor | |
|---|---|---|---|---|
| Biodisponibilidad | 50% | 80% | 36% | 100% |
| Vida media (metabolito activo) | 30-60min | t1/2 distribución: 30-60min t1/2 eliminación: 2-15h | 7-9h | 3-6min |
| Unión a receptor | Irreversible | Irreversible | Reversible | Reversible |
| Tiempo inicio efecto | 2-6h | 30min | 30min | 2h |
| Frecuencia administración | Cada 24h | Cada 24h | Cada 12h | Infusión intravenosa |
| Duración del efecto | 3-10 días | 7-10 días | 3-5 días | 1-2h |
| Tiempo discontinuación en cirugía electiva | Al menos 5 días | Al menos 7 días | Al menos 5 días | 1h |
| Indicaciones | ICP, SCA, SCA-ICP, CI crónica | SCA-ICP | SCAP, ICP-SCA | ICP |
CI: cardiopatía isquémica; ICP: intervencionismo coronario percutáneo; SCA: síndrome coronario agudo; t1/2: tiempo de vida media.
Al menos 2 receptores de proteasa activada, RPA-1 y RPA-4, están presentes en las plaquetas humanas; el primero es el que presenta mayor afinidad por la trombina siendo el principal efector de la cascada de señalización derivada de la interacción trombina-plaqueta. El vorapaxar es una molécula no proteica que actúa como potente antagonista competitivo de RPA-1 de la trombina. De rápida absorción, induce una precoz acción antiplaquetaria a las 2h de su administración. Presenta un metabolismo hepático, y su eliminación es principalmente vía fecal. Su adición a clopidogrel y ácido acetilsalicílico (AAS) no se asoció a una reducción significativa de los eventos cardiovasculares mayores en pacientes con SCA, pero sí a un aumento significativo de sangrados mayores y hemorragia intracraneal11.
Inhibidores de los receptores de tromboxano/prostaciclinaEstos fármacos tienen la capacidad de bloquear tanto la agregación plaquetaria como la vasoconstricción inducida por tromboxano. El terutrobán, antagonista específico del receptor del TxA2, presenta un potencial efecto antiaterosclerótico añadido a sus propiedades antiagregantes y vasodilatadoras, lo que le convertiría en una prometedora herramienta para la prevención secundaria de eventos isquémicos cardiovasculares. Sin embargo, no mostró beneficio comparado con AAS en pacientes con accidente cerebrovascular12.
Evaluación farmacodinámica de los fármacos antiagregantes. Test función plaquetariaLa determinación de TxB2 sérico ha sido determinante para la caracterización de la farmacología clínica de la inhibición de la COX-1 por la aspirina, estableciendo el rango de dosis diaria (30-160mg) que mostró su efectividad en los ensayos clínicos, donde dosis superiores no mostraron beneficio adicional13.
Se han desarrollado diferentes sistemas de evaluación de la función plaquetaria para determinar el grado de inhibición del receptor P2Y1214. En el caso del clopidogrel, la concordancia entre las determinaciones funcionales y la determinación y concentración en plasma del metabolito activo es moderada, con una variabilidad intrasujeto relativamente elevada y dependiente de diferentes factores farmacocinéticos. En pacientes sometidos a revascularización coronaria electiva, una estrategia de manejo antiagregante guiado por la evaluación de la función plaquetaria (VerifyNow P2Y12) no ha mostrado una mejora significativa en la reducción de eventos clínicos comparado con un manejo convencional. Esta falta de beneficio clínico se ha observado igualmente en pacientes ancianos con SCA, donde la monitorización de la función plaquetaria con ajuste del tratamiento antiagregante no se tradujo en menores eventos clínicos15.
Recientemente, el estudio Testing Responsiveness to Platelet Inhibition on Chronic Antiplatelet Treatment for Acute Coronary Syndromes (TROPICAL-ACS) ha demostrado que en pacientes con SCA sometidos a intervencionismo, el «desescalado» precoz del tratamiento antiagregante de prasugrel a clopidogrel, guiado mediante test de función plaquetaria es una estrategia factible y segura comparado con el tratamiento convencional, esto es mantenimiento de prasugrel durante 12 meses tras el intervencionismo16.
Recomendaciones:
- •
Actualmente no se recomienda la utilización rutinaria de test de función plaquetaria en pacientes subsidiarios de intervencionismo coronario urgente o electivo, debiéndose restringir su utilización al campo de la investigación17.
- •
Estos test funcionales se podrían plantear para «desescalar» o «escalar» en el tratamiento antiagregante ante eventos clínicos, así como para evaluar la cumplimentación del tratamiento.
Los fármacos antiplaquetarios pueden causar eventos adversos gastrointestinales de distinta severidad (hemorragia oculta, erosiones/ulceraciones gastroduodenales, hemorragia manifiesta, perforación) e incluso ser causa de muerte, particularmente en los ancianos18. El tabaquismo activo y la existencia de comorbilidades relevantes, como diabetes, insuficiencia cardíaca, enfermedad renal crónica o antecedentes de ictus, añaden un riesgo adicional para presentar estos eventos gastrointestinales, así como mortalidad asociada a los mismos17,18. Los inhibidores de la bomba de protones, a las dosis habituales, constituyen la profilaxis más eficaz en la prevención de la hemorragia gastrointestinal19. Desafortunadamente, esta terapia no es efectiva en la prevención de lesiones tanto a nivel de intestino delgado como grueso, para las cuales no existe en la actualidad una estrategia profiláctica20. Por otro lado, se ha observado una reducción de la eficacia del clopidogrel al administrarse conjuntamente con determinados inhibidores de la bomba de protones, debido a la interacción de estos últimos sobre el citocromo P450 2C19, lo que disminuye la activación hepática del clopidogrel21. Aunque ha sido ampliamente debatida la relevancia clínica de este fenómeno, en base a la evidencia actual no se puede desaconsejar esta asociación. En el estudio prospectivo Clopidogrel and the Optimization of Gastrointestinal Events Trial (COGENT), en pacientes de elevado riesgo cardiovascular el omeprazol redujo significativamente la incidencia del evento combinado gastrointestinal sin incremento en el combinado de eventos cardiovasculares22. Sin embargo, parece razonable utilizar inhibidores de la bomba sin efecto sobre el citocromo P450 2C19, como el rabeprazol y el pantoprazol, en pacientes en tratamiento con clopidogrel. Este tipo de interacción no ha sido documentado con otros antiplaquetarios como prasugrel y ticagrelor21.
Recomendaciones:
- •
Se recomienda el tratamiento con dosis estándar de inhibidores de la bomba de protones para la gastroprotección en todos los pacientes bajo terapia antiplaquetaria que tienen un mayor riesgo de hemorragia gastrointestinal (edad>65 años o uso concomitante de corticosteroides o anticoagulantes o antecedentes de úlcera péptica).
- •
En pacientes que reciben clopidogrel, puede preferirse elegir un inhibidor de la bomba de protones que carece de interferencia con las enzimas hepáticas CYP450. No existe una interacción demostrada entre los inhibidores de la bomba de protones y los nuevos anticoagulantes orales (ACO).
La doble terapia antiplaquetaria constituye uno de los pilares fundamentales del tratamiento del SCA. Las actuales guías de manejo de pacientes con esta enfermedad tienden a obviar la distinción inicial entre SCA con elevación del ST (SCACEST) o SCASEST en lo que respecta a esta parte del tratamiento23, salvo algunas consideraciones especiales (p. ej. pacientes fibrinolizados o en SCA de manejo conservador). Del mismo modo se unifica la terapia independientemente del tipo de stent empleado, stent no recubierto de fármaco (BMS, del inglés bare metal stent) o stent recubierto de droga (BMS, del inglés drug eluting stent) con la única excepción de los stents bioabsorbibles.
Momento de inicio del tratamientoLa elección del momento óptimo de inicio de la DAPT ha sido motivo de revisión y discusión en guías y estudios previos24,25. Parece razonable ajustarse a los momentos definidos en los correspondientes ensayos aleatorizados para cada uno de los P2Y12.
Recomendaciones:
- •
En pacientes con SCA sometidos a ICP, prasugrel (carga 60mg, 10mg/día) además de AAS en pacientes sin tratamiento previo con P2Y12con SCASEST o SCACEST de manejo inicialmente conservador si la indicación de ICP está establecida o en pacientes con SCACEST en los que se realiza coronariografía urgente, a menos que exista alto riesgo de sangrado que comprometa la vida u otras contraindicaciones (IB).
- •
En pacientes con SCA, está recomendado ticagrelor (carga 180mg, 90mg/12h) además de AAS independientemente de la estrategia inicial de tratamiento, incluyendo a pacientes pretratados con clopidogrel (que debe ser suspendido cuando se inicie tratamiento con clopidogrel) a menos que existan contraindicaciones (IB)
- •
Se recomienda clopidogrel (carga 600mg, 75mg/día) además de AAS en pacientes con SCA que no pueden recibir ticagrelor o prasugrel, incluidos aquellos con sangrado intracraneal previo o indicación de ACO (IA).
- •
Se recomienda clopidogrel (carga 300mg en pacientes≤75 años, 75mg/día) además de aspirina en pacientes con SCACEST que reciben trombólisis (IA).
- •
Estaría indicado iniciar el pretratamiento con clopidogrel (dosis de carga de 600mg, 75mg/día) o ticagrelor (dosis de carga de 180mg, 90mg/12h) más aspirina desde el momento que se realiza el diagnóstico en pacientes con SCASEST de manejo invasivo (IIa C).
- •
Pretratamiento con inhibidor P2Y12está recomendado generalmente en pacientes con anatomía coronaria conocida y se ha decidido realizar ICP así como en pacientes con SCACEST (IA).
- •
En pacientes con SCACEST que van a ser sometidos a ICP primario está indicado el tratamiento antes (o al menos en el momento del ICP) con ticagrelor (dosis de carga de 180mg, 90mg/12h), prasugrel (dosis de carga de 60mg, 10mg/ día) o clopidogrel (dosis de carga de 600mg, 75mg/ día) además de aspirina (IA)26.
- •
En pacientes con SCASEST en los que no se conoce la anatomía coronaria no se recomienda el uso de prasugrel (IIIB).
- •
No se recomienda tratamiento con prasugrel en pacientes con SCA y manejo médico (IIIB).
Las guías actuales sitúan a los antiagregantes más potentes (ticagrelor y prasugrel) como primera línea en el tratamiento del SCACEST o del SCASEST en los casos en que están indicados, relegando al clopidogrel a aquellas situaciones en las que existe mayor riesgo de sangrado (actual o por antecedentes de sangrado sobre todo intracraneal, pacientes fibrinolizados...), intolerancia, casos en los que no puedan usarse o en los que existe falta de evidencia actual (caso del uso concomitante con anticoagulantes); aunque presumiblemente este último supuesto sea el que pueda ser revisado a menor corto plazo a la luz de los estudios presentados recientemente27 y los que están aún en curso.
Duración de la doble terapiaLa duración de la doble terapia se establece en función del cuadro clínico y no en función del manejo invasivo o no, o del tipo de stent empleado en la revascularización percutánea (a excepción de los stents bioabsorbibles); así como del riesgo hemorrágico y riesgo isquémico del paciente.
Como norma general se recomienda:
- •
Mantener doble antiagregación durante 12 meses (IA).
- •
En pacientes con SCA tratados con cirugía cardíaca o revascularización percutánea con alto riesgo de sangrado (PRECISE-DAPT≥25) la doble terapia puede mantenerse solo durante 6 meses (IIa).
- •
En pacientes con SCA tratados medicamente y con alto riesgo de sangrado (p. ej. PRECISE-DAPT≥25) debe considerarse doble terapia durante al menos un mes (IIa C).
- •
En paciente con SCA tratados con stent bioabsorbible debe considerarse doble antiagregación durante al menos 12 meses (IIa C).
- •
En cuanto a la prolongación de la doble terapia más allá del año y en base a los resultados del estudio PEGASUS–TIMI 5428 se considera con un grado de recomendación IIb B, mantener el tratamiento con ticagrelor 60mg/12h además de aspirina hasta 36 meses en pacientes con infarto previo y alto riesgo isquémico que han tolerado la doble antiagregación sin complicaciones hemorrágicas. En pacientes que no son candidatos a tratamiento con ticagrelor, puede considerarse continuar con clopidogrel más aspirina durante más de 12 meses (IIb C).
Tanto la elección del tipo de terapia antitrombótica como la combinación de estas en los pacientes que van a someterse a intervencionismo coronario va a depender del escenario clínico donde nos encontremos. Por ello, vamos a ir desglosando la terapia por separado en función de cada escenario clínico:
Infarto agudo de miocardio con elevación del segmento ST26Dentro de este grupo podemos diferenciar 2 subgrupos según la estrategia de reperfusión elegida:
Fibrinólisis intravenosaEn este escenario clínico la terapia de antiagregación elegida es la combinación de aspirina con carga de entre 150 y 300mg seguida de una dosis de 75-100mg/día junto a clopidogrel, con carga de 300mg en el caso de que el paciente sea<75 años (>75 años se recomienda la administración de 75mg), con una dosis de mantenimiento de 75mg/día. Una vez realizada la fibrinólisis, podrá plantearse la realización de un «switch» de clopidogrel a un antiagregante de mayor potencia (ticagrelor/prasugrel) a partir de las 24h. En combinación con la carga de doble antiagregación, está indicada la administración de un anticoagulante. En este caso los fármacos recomendados son la enoxaparina o la heparina no fraccionada según la siguiente pauta:
- •
Enoxaparina:
- -
Menor de 75 años y no historia de disfunción renal: 30mg por vía intravenosos en bolo seguido de 1mg/kg/12h subcutáneo.
- -
Más de 75 años: 0,75mg/kg/12h subcutáneo.
- -
Filtrado glomerular menor a 30ml/min: dosis única cada 24h subcutánea ajustada.
- •
Heparina no fraccionada: 60UI/kg con máximo de 4.000UI seguido de infusión continua de 12UI/kg durante 24-48h con un objetivo de aPTT de 50-70seg.
- •
Fondaparinux únicamente está indicado si el fármaco fibrinolítico elegido es la estreptoquinasa, con una dosis de 2,5mg intravenoso seguido de 2,5mg subcutáneo durante un máximo de 8 días.
Recomendaciones:
- •
La terapia antiplaquetaria de elección en pacientes que van a ser sometidos a fibrinólisis intravenosa es la combinación de aspirina y clopidogrel.
- •
Como terapia anticoagulante a asociar se recomienda el uso de heparina no fraccionada o de enoxaparina, realizando ajuste de dosis en función de la edad, peso y función renal del paciente.
En este escenario la estrategia de antiagregación elegida es la combinación de AAS con carga de entre 150 y 300mg seguida de una dosis de 75-100mg/día junto a ticagrelor o prasugrel, salvo que exista contraindicación para su uso o alto riesgo hemorrágico, donde la opción elegida será clopidogrel con una dosis de carga de 600mg seguida de 75mg/día.
Ticagrelor: Dosis de carga de 180mg seguida de 90mg/12h. En pacientes intubados debe ser el fármaco de elección salvo contraindicación al haber demostrado su seguridad al ser administrado triturado29.
- •
Contraindicación: Pacientes con indicación de uso de ACO.
Prasugrel: Dosis de carga de 60mg seguida de 10mg/día salvo menos de 60kg o más de 75 años donde se recomienda 5mg/día.
- •
Contraindicación: Pacientes con indicación de uso de ACO. Historia previa de ACVA.
En combinación con la terapia antiagregante está indicado el uso de anticoagulación, pudiendo elegir entre:
- -
Heparina no fraccionada: Bolo de 70-100UI por kg de peso.
- -
Enoxaparina: 0,5mg/kg intravenoso
- -
Bivalirudina: 0,75mg/kg en bolo seguido de infusión de 1,75mg/kg/h hasta un máximo de 4h.
- -
Fondaparinux no tiene indicación para su uso en pacientes que se van a someter a ICP primario.
Más allá de la terapia estándar existen una serie de fármacos que pueden tener utilidad en situaciones concretas:
- -
Inhibidores de la glucoproteína IIb/IIIa: Está indicado su uso en situaciones de carga trombótica muy elevada, fenómeno de non-reflow, u otros fenómenos trombóticos.
- -
Cangrelor: Inhibidor de los receptores P2Y12 de uso intravenoso. Su uso, por su escasa evidencia en este escenario clínico, se reduce a pacientes en los que por cualquier motivo no se les haya administrado un inhibidor de P2Y12 vía oral o se considere que la absorción de estos no va a ser la adecuada30.
Recomendaciones:
- •
La terapia antiagregante de elección debe ser la combinación (salvo alto riesgo hemorrágico, necesidad de ACO o no disponibilidad) de aspirina con ticagrelor o prasugrel, con dosis de carga de ambos, siendo recomendable la administración tan pronto como se establezca la indicación de ICP primario, ya que parece que esta acción reduce el riesgo de trombosis aguda de stent.
- •
En caso de pacientes intubados, se recomienda la administración de ticagrelor, salvo contraindicación, como segundo antiagregante asociado a la aspirina, ya que ha demostrado no perder eficacia al ser administrado triturado.
- •
Como terapia anticoagulante se recomienda el uso de heparina no fraccionada, enoxaparina o bivalirudina, no existiendo beneficios claros respecto al uso de una de ellas con relación a las otras.
- •
La administración de otros antiagregantes como los inhibidores de GP IIb/IIIa o de cangrelor queda relegada a situaciones especiales durante la realización del ICP primario.
Los pacientes con diagnóstico establecido de SCASEST deben acudir al laboratorio con DAPT±terapia anticoagulante en función del riesgo isquémico/hemorrágico individual.
Terapia antiagregante- ∘
Aspirina: Salvo contraindicación debe ser el primer antiagregante administrado, con dosis de carga y mantenimiento igual a la explicada en el apartado de infarto agudo de miocardio con elevación del segmento ST (IAMCEST).
- ∘
Ticagrelor: De elección como segundo antiagregante en pacientes con riesgo isquémico moderado-alto o criterios clínicos/analíticos de alto riesgo, utilizando las dosis de carga, mantenimiento y contraindicaciones explicadas en el apartado de IAMCEST.
- ∘
Prasugrel: De elección en el escenario explicado para ticagrelor en pacientes en los que se conozca la anatomía coronaria o en los que la estrategia de revascularización elegida independientemente de los hallazgos vaya a ser la percutánea. Las contraindicaciones, precauciones y dosis de carga/mantenimiento son las mismas que las explicadas en el apartado de IAMCEST.
- ∘
Clopidogrel: De elección en pacientes con riesgo hemorrágico elevado, pacientes que no puedan recibir ticagrelor/prasugrel o pacientes que requieran ACO. La dosis de carga debe ser de 300-600mg seguida de una dosis de mantenimiento de 75mg/día.
- ∘
Otros antiagregantes: El uso de anti-IIb/IIIa y cangrelor queda restringido a las mismas situaciones que en el IAMCEST.
- ∘
Heparina no fraccionada: 70-100UI/kg.
- ∘
Enoxaparina: 1mg/kg/12hs subcutánea.
- ∘
Bivalirudina: Misma pauta que en SCACEST.
- ∘
Fondaparinux31: Recomendado su uso en pacientes con SCASEST y criterios de alto riesgo, con menores tasas de sangrado que enoxaparina. Se recomienda una dosis de 2,5mg/día subcutánea. En pacientes que acudan a la sala bajo este régimen anticoagulante, se recomienda suplementar con bolo de heparina no fraccionada (50-100UI/kg). Su uso está contraindicado en pacientes con enfermedad renal severa.
Recomendaciones:
- •
Salvo alto riesgo hemorrágico o contraindicación para uso de ticagrelor/prasugrel, la estrategia antiplaquetaria de elección en este escenario ha de ser la combinación de aspirina con ticagrelor (o con prasugrel en el caso de que no esté contraindicado y la anatomía coronaria sea conocida o la estrategia independientemente de dicha anatomía sea la revascularización percutánea).
- •
En pacientes de alto riesgo trombótico se recomienda añadir terapia anticoagulante previa a la realización del ICP, siendo en este sentido el fondaparinux por su perfil de seguridad el fármaco de elección.
- •
Como terapia anticoagulante durante el ICP se recomienda el uso de heparina no fraccionada, enoxaparina o bivalirudina, no existiendo beneficios claros respecto al uso de una de ellas con relación a las otras.
En este escenario clínico podemos a su vez diferenciar 2 grupos de pacientes:
- •
Pacientes con anatomía coronaria conocida o pacientes en los que la estrategia de revascularización elegida vaya a ser la percutánea independientemente de los hallazgos de la coronariografía. Es recomendable que los pacientes bajen a la sala con carga de doble antiagregación dada, ya que esta estrategia puede reducir el riesgo de trombosis aguda de stent.
- ∘
Aspirina: Antiagregante de elección. Dosis de carga y mantenimiento igual que apartados anteriores.
- ∘
Clopidogrel: De elección en pacientes de riesgo hemorrágico alto o pacientes en los que se prevé un tratamiento de lesiones no complejas y el implante de poca longitud de metal. La dosis de carga/mantenimiento es la misma que la explicada para el SCASEST.
- ∘
Ticagrelor/prasugrel: De elección en pacientes de bajo riesgo hemorrágico o en pacientes en los que se prevé el tratamiento de lesiones complejas y/o el implante de gran longitud de metal. Las dosis de carga y mantenimiento así como las contraindicaciones/precauciones son las mismas que las explicadas en apartados anteriores.
Como terapia anticoagulante en general es preferible administrar dosis única intraprocedimiento, bien con heparina no fraccionada, bien con bivalirudina con las dosis explicadas en el apartado de SCASEST.
- •
Pacientes con anatomía coronaria desconocida y/o pacientes en los que aún no esté decidida la estrategia de tratamiento elegida una vez conocida dicha anatomía coronaria. En general es recomendable administrar únicamente antiagregación simple (los pacientes de este escenario clínico suelen presentar tratamiento crónico con aspirina salvo contraindicación) hasta que la decisión sea el abordaje percutáneo. En tal caso, la elección del segundo antiagregante y del anticoagulante intraprocedimiento seguirá las mismas pautas que las explicadas en el apartado de pacientes con anatomía conocida/estrategia percutánea predeterminada.
Recomendaciones:
- •
En pacientes en los que la estrategia de revascularización no está definida acudirán bajo tratamiento simple antiplaquetario, donde será de elección la aspirina salvo contraindicación.
- •
En pacientes en los que esté predefinida la estrategia de revascularización percutánea, es recomendable que acudan a la sala bajo doble terapia antiplaquetaria con aspirina más un inhibidor de P2Y12, el cual deberá ser elegido en función del riesgo hemorrágico individualizado, la necesidad de terapia ACO y en función del tipo de lesiones a tratar
- •
Como terapia anticoagulante se recomienda dosis única intraprocedimiento.
La combinación antiagregante indicada es la de aspirina más clopidogrel, siguiendo las recomendaciones explicadas en los apartados anteriores, en función del escenario clínico del paciente.
Terapia anticoagulante- •
Pacientes que se encuentran recibiendo terapia anticoagulante crónica domiciliaria. A su vez distinguimos 2 grupos:
- ∘
Antivitamina K: La no suspensión de esta terapia si el INR se encuentra en rango ha demostrado superioridad con respecto a la terapia puente con heparina de bajo peso molecular, con disminución tanto del número de eventos embólicos como hemorrágicos. En caso de que el INR se encuentre por encima de 2,5 no es necesario suplementar el procedimiento con bolo de heparina no fraccionada. En caso de necesidad de triple terapia se recomienda mantener un INR lo más bajo posible dentro del rango de anticoagulación requerido.
- ∘
Anticoagulantes orales directos: Al igual que con los antivitamina K, se recomienda la no suspensión de su tratamiento, o la suspensión de la dosis previa a la realización del procedimiento intervencionista, siendo recomendable la suplementación en caso de que se vaya a realizar intervencionismo coronario, con bolo de heparina no fraccionada. En caso de necesidad de triple terapia se recomienda el uso de la dosis más baja de cualquiera de estos fármacos.
En este escenario, se acaban de publicar 2 ensayos clínicos con rivaroxabán35 y dabigatrán27. En ambos casos el uso de doble terapia con 15mg de rivaroxabán junto a clopidogrel, y ambas dosis de dabigatrán con clopidogrel o ticagrelor, demostraron una reducción de los eventos hemorrágicos comparados con la triple terapia con antivitamina K. Sin embargo, la eficacia en la prevención tromboembólica hay que interpretarla con cautela ya que el ensayo con rivaroxabán no estaba diseñado para valorar eficacia; y el ensayo con dabigatrán, que sí incluyó este «endpoint», no lo incluía como objetivo primario y además había un número de pacientes bajo para su valoración por lo que, como indican los autores, la ausencia de diferencias con respecto a la triple terapia debe ser interpretada con cautela. A la espera de los resultados de diferentes estudios ya en marcha, la estrategia de doble terapia desde el inicio debería estar reservada a pacientes con riesgo hemorrágico muy alto que impida la triple terapia, en los que es necesaria la implantación de stents coronarios.
Recomendaciones:
- •
La terapia antiplaquetaria indicada en pacientes que precisan tratamiento con ACO es la combinación de aspirina y clopidogrel.
- •
No es necesaria la suspensión de la terapia ACO que el paciente estuviese tomando previo a la realización del ICP.
- •
En caso de no existir contraindicación para el uso de anticoagulantes directos, la elección queda a criterio del equipo médico, aunque en este sentido los fármacos con más evidencia científica son los antivitamina K, rivaroxabán y dabigatrán.
Cerca de un 8% de los pacientes que se benefician del uso de una DAPT por haber presentado un evento coronario agudo o haberse realizado una angioplastia coronaria, tienen además indicación de ACO de manera permanente por diferentes motivos, siendo la más frecuente la fibrilación auricular. Esto implica la toma de un tratamiento indefinido con un anticoagulante, por la fibrilación auricular, y con doble antiagregación, por el evento isquémico, por un tiempo variable, que va, según el tipo de stent y el paciente, de uno a más de 12 meses. El añadir a la terapia anticoagulante la doble antiagregación, aumenta hasta 3 veces el riesgo de presentar un sangrado36, convirtiéndose en pacientes de alto riesgo hemorrágico, y por lo tanto debiéndose de reevaluar la necesidad de la anticoagulación para solo mantenerla en los casos totalmente necesarios, donde el beneficio sea superior al riesgo. Por tanto en estos pacientes, es fundamental establecer unas estrategias de tratamiento y tener unas consideraciones, para minimizar las complicaciones isquémicas y hemorrágicas23:
- 1.
Evaluación de los riesgos isquémicos y hemorrágicos usando los predictores de riesgo validados (CHA2DS2-VASC, ABC, HAS-BLED)
- 2.
Uso de la triple terapia el menor tiempo posible. Considerar la doble terapia (ACO+clopidogrel) después de un ICP en vez de la triple terapia.
- 3.
Como terapia anticoagulante valorar el uso de los ACO directos en vez de los antagonistas de la vitamina K (AVK).
- 4.
Usar la dosis más baja de ACO directos aprobada en los estudios de fibrilación auricular.
- 5.
El clopidogrel debe de ser el inhibidor P2Y12 de elección.
- 6.
Uso de baja dosis de AAS (100mg/día).
- 7.
Uso rutinario de inhibidores de la bomba de protones.
Entre los estudios publicados de doble o triple terapia con AVK o ACO directos, el estudio PIONEER AF-PCI35 mostró cómo en los pacientes con fibrilación auricular en los que se coloca un stent coronario, la administración de rivaroxabán más inhibidor de P2Y12 durante 12 meses o dosis muy baja de rivaroxabán más doble antiagregación durante 1, 6 o 12 meses se asoció con menores tasas de sangrado clínicamente significativo que la terapia estándar con AVK y doble antiagregación. El estudio no tiene potencia para analizar la eficacia de las distintas estrategias de tratamiento en la reducción de los eventos tromboembólicos, aunque en los datos observados los 3 grupos fueron similares en este sentido. En el estudio REDUAL PCI27, se estudia la utilidad de dabigatrán (dosis de 110mg y 150mg) junto a la doble antiagregación (incluyendo una tienopiridina) en pacientes con fibrilación auricular tras ICP, frente al tratamiento clásico de doble antiagregación y warfarina. Se demuestra que la primera estrategia es igual de eficaz en la reducción de eventos trombóticos, y presenta una menor tasa de sangrado. Igualmente, esta en marcha el ensayo AUGUSTUS (NCT02415400) que evalúa la seguridad de apixabán en pacientes con fibrilación auricular e ICP siendo el criterio de valoración primario la evaluación del tiempo hasta la primera ocurrencia de sangrado mayor o clínicamente significativo no mayor.
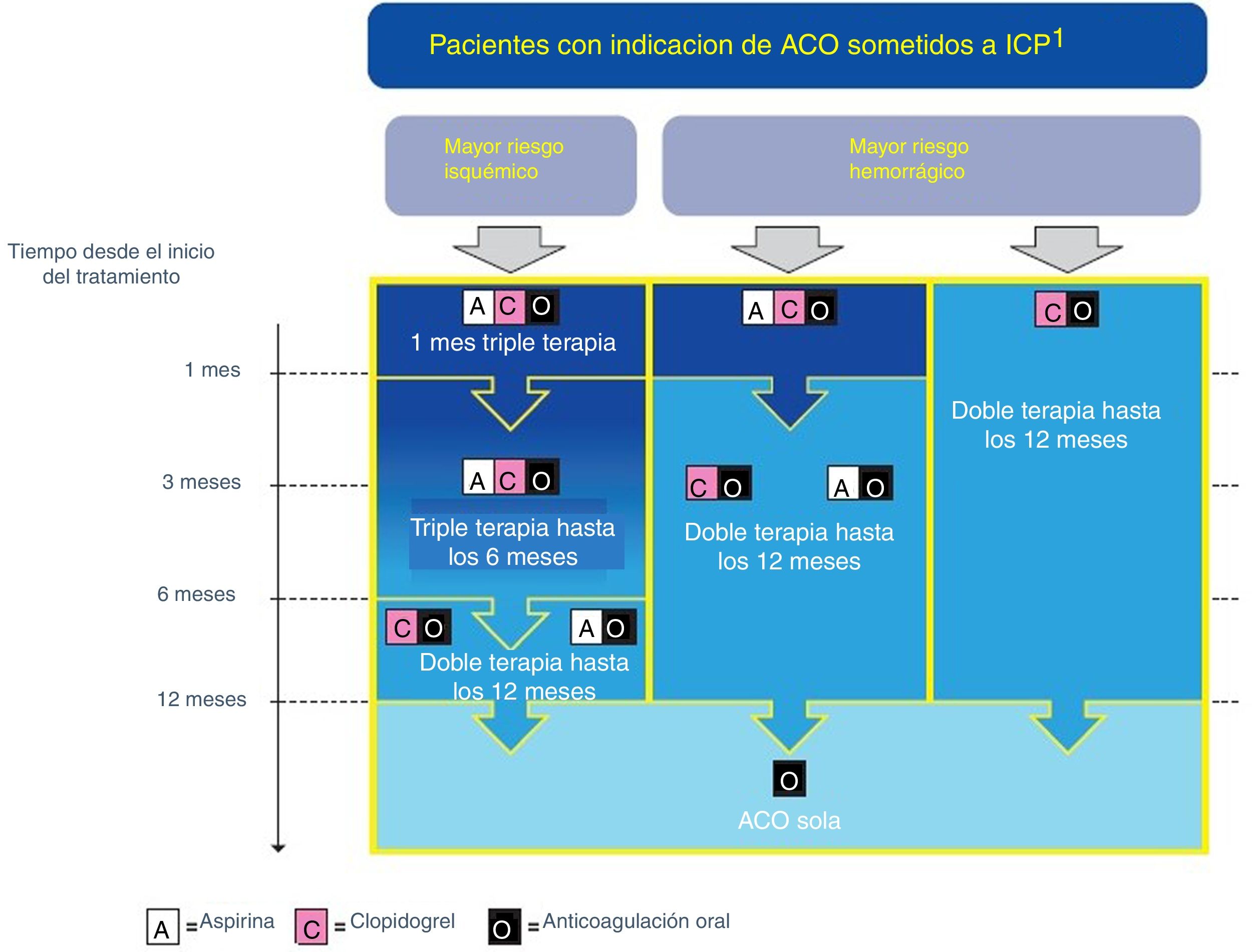
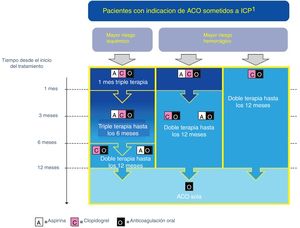
Recomendaciones (fig. 2):
- •
Todos los pacientes se deben tratar con AAS y clopidogrel en el período periprocedimiento, al menos hasta el alta hospitalaria (IC).
- •
La triple terapia con AAS, clopidogrel y ACO debe usarse durante un mes en los pacientes a los que se le ha implantado un stent (IIa B) y de uno a 6 meses, en los pacientes cuyo riesgo isquémico supere su riesgo hemorrágico (IIa B)37.
- •
La doble terapia con clopidogrel y ACO debe ser la alternativa a la triple terapia en el primer mes en pacientes con un riesgo hemorrágico superior al riesgo isquémico (IIa A)38.
- •
Considerar la suspensión de la terapia antiagregante al año, en aquellos pacientes en los que esté indicada la ACO de manera permanente (IIa B)39.
- •
En pacientes con indicación de ACO con AVK en combinación con AAS y/o clopidogrel, debemos de intentar fijar como objetivo de INR la parte más baja del rango recomendado y esforzarse en que su tiempo en rango terapéutico sea lo más alto posible (>65%) (IIa B).
- •
Cuando usemos un ACO en combinación con AAS y/o clopidogrel, debemos de prescribir la dosis más baja estudiada en los ensayos de prevención de ictus en fibrilación auricular (IIa C). Cuando usemos rivaroxabán debemos usar la dosis de 15mg/día (IIb B).
- •
No debemos de usar ticagrelor a prasugrel cuando esté indicada la triple terapia (IIIC).
La DAPT, consistente en la combinación de aspirina y un inhibidor oral del receptor P2Y12 de la plaqueta (tienopiridinas: clopidogrel y prasugrel, o una ciclopentil-triazolo-pirimidina: ticagrelor), es una de las piedras angulares del tratamiento antitrombótico después de un SCA, y después de la implantación de un stent coronario.
La DAPT es uno de los tratamientos que se han estudiado más intensivamente dentro del área cardiovascular. Ya en 1994, se evidenció que la DAPT con AAS más ticlopidina permitía prescindir de la anticoagulación sistemática en la implantación de los stents coronarios. Desde ese momento se ha convertido en un tratamiento habitual en los pacientes con enfermedad arterial coronaria (EAC).
La evolución de la DAPT ha tenido varias fases: una primera con la sustitución de la ticlopidina por el clopidogrel, debido a sus efectos adversos a nivel hematológicos, y una segunda fase en la que se buscó una antiagregación más potente y predecible, en la que se introdujeron el prasugrel y el ticagrelor. Cada uno de ellos demostró ser más eficaz que clopidogrel en el contexto del SCA, aunque incrementando el riesgo de sangrado40,41. La aparición de los stents liberadores de fármacos (DES) hizo que la DAPT cobrara más importancia. Las dudas surgidas respecto a las trombosis tardías (30 días-un año) y muy tardías (≥1año), con esos stents de primera generación hicieron que se fijara una recomendación general en cuanto a la duración de la DAPT de un año, que en cierta manera fue un poco arbitraria. Actualmente los esfuerzos investigadores en DAPT se están dirigiendo hacia la duración óptima del tratamiento. El tratamiento con DAPT ha demostrado reducir el riesgo de trombosis del stent y de nuevos eventos cardiovasculares, aunque a costa de aumentar el riesgo de sangrado. Por tanto, la duración óptima de la DAPT tendría que integrar un complejo balance entre la eficacia: reducción de eventos cardiovasculares y seguridad: aumento del riesgo de sangrado; y actualmente es una cuestión sometida a un intenso debate por la comunidad médica.
La aparición de una nueva generación de DES, más segura, y los resultados de recientes ensayos clínicos aleatorizados en los que se evalúa la eficacia y seguridad de pautas más cortas de DAPT en pacientes a los que se le han implantado stents coronarios ha hecho que empiece a considerarse una duración de la DAPT menor que un año. Por contra, cada vez existe más evidencia de que la prolongación más allá del año de la DAPT reduce el riesgo de eventos cardiovasculares (no relacionados con el stent) a largo plazo, sobre todo en pacientes con un infarto de miocardio previo28.
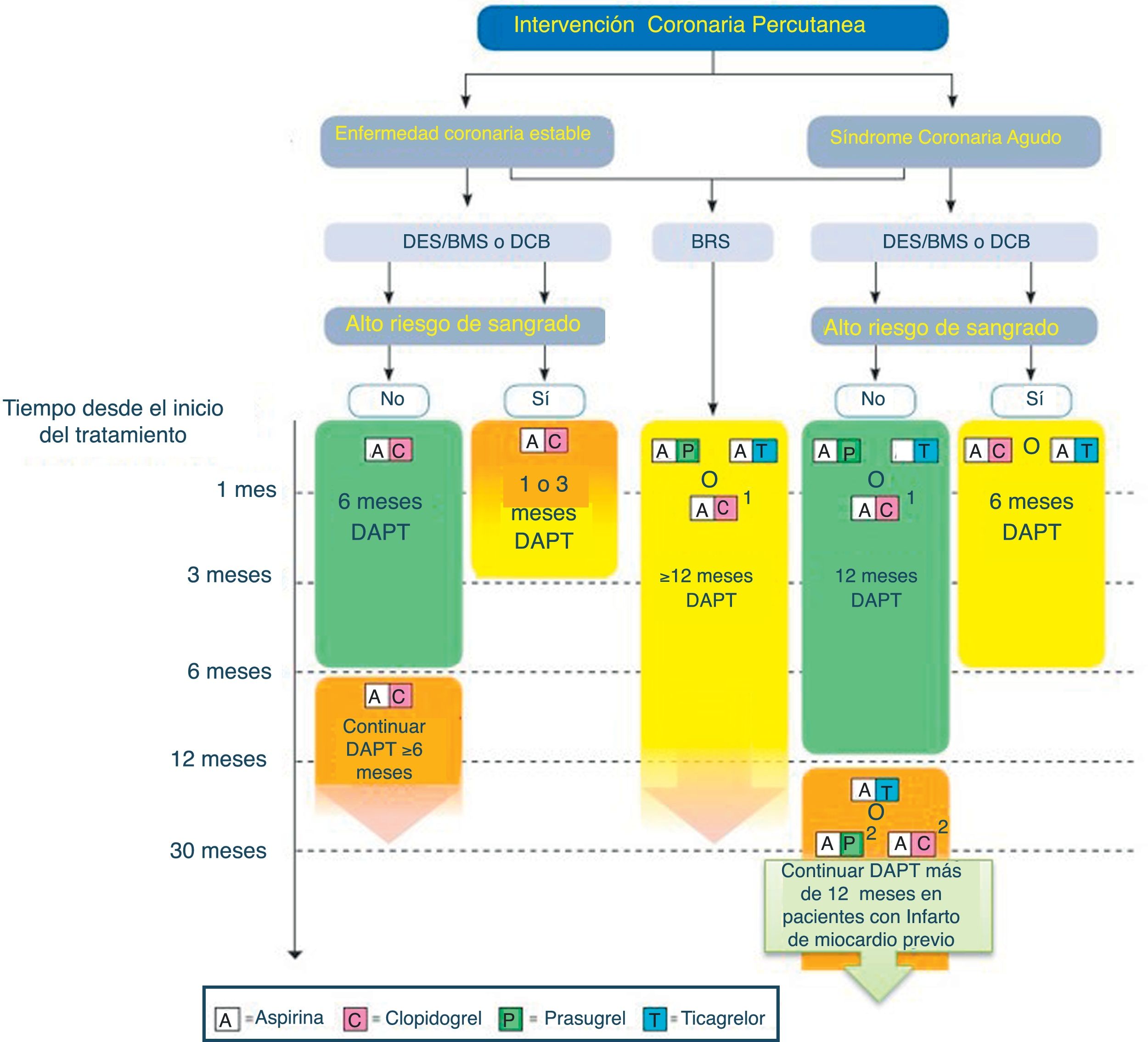
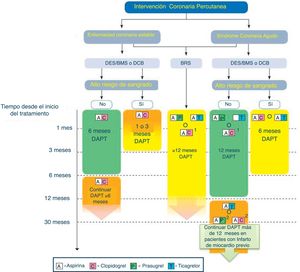
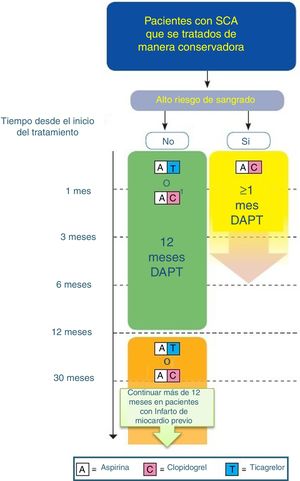
La indicación de DAPT tiene principalmente 2 escenarios clínicos: El primero de ellos sería los pacientes a los que se les implanta un stent y que tienen una EAC estable. En este contexto, la doble antiagregación estaría más orientada a evitar complicaciones propias del stent implantado. El segundo sería los pacientes que han sufrido un SCA, y que pueden ser tratados de forma invasiva (PCI o cirugía) o médica. En este caso la DAPT no solo estaría orientada a proteger el stent, sino también al paciente en su conjunto. (figs. 3–5).
Algoritmo de tratamiento antiagregante en paciente con SCA tratado con intervencionismo percutáneo (adaptado de ESC 2017).
BMS: stent no recubierto de fármaco; BRS: stent bioasorbible; DAPT: doble terapia antiagregante; DES: stent recubierto de fármaco. Código de colores según recomendación de la ESC: verde (clase i), amarillo (clase iia), naranja (clase iib). Consultar la figura a color en la web.
1: Cuando no se puede usar ticagrelor o pasugrel.
2: Cuando no se pueda usar ticagrelor.
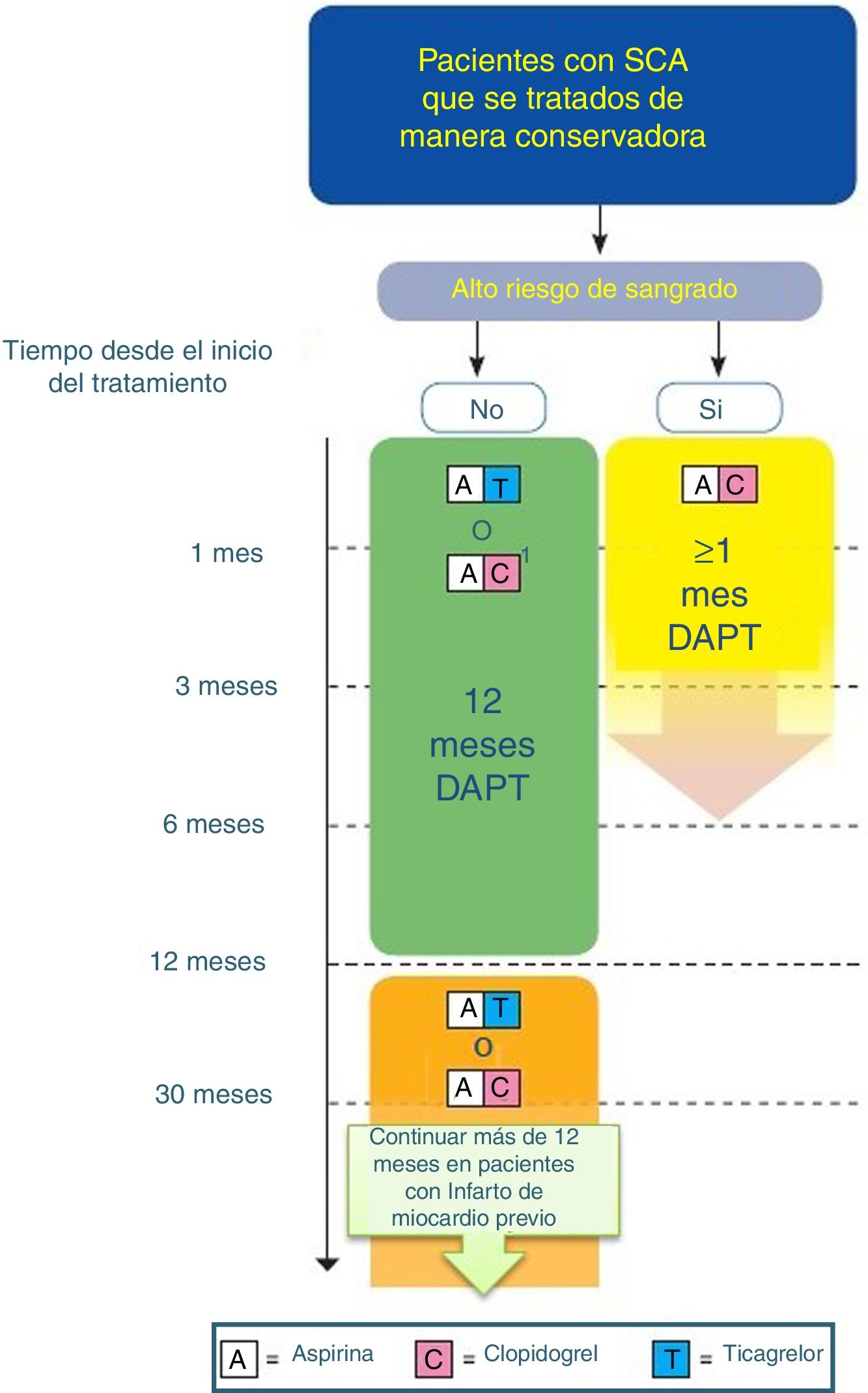
Algoritmo de tratamiento antiagregante en paciente con SCA tratado de manera conservadora/no invasiva/sin stent (adaptado de ESC 2017).
DAPT: doble terapia antiagregante. Código de colores según recomendación de la ESC: verde (clase i), amarillo (clase iia), naranja (clase iib). Consultar la figura a color en la web.
1: Cuando no se puede usar ticagrelor.
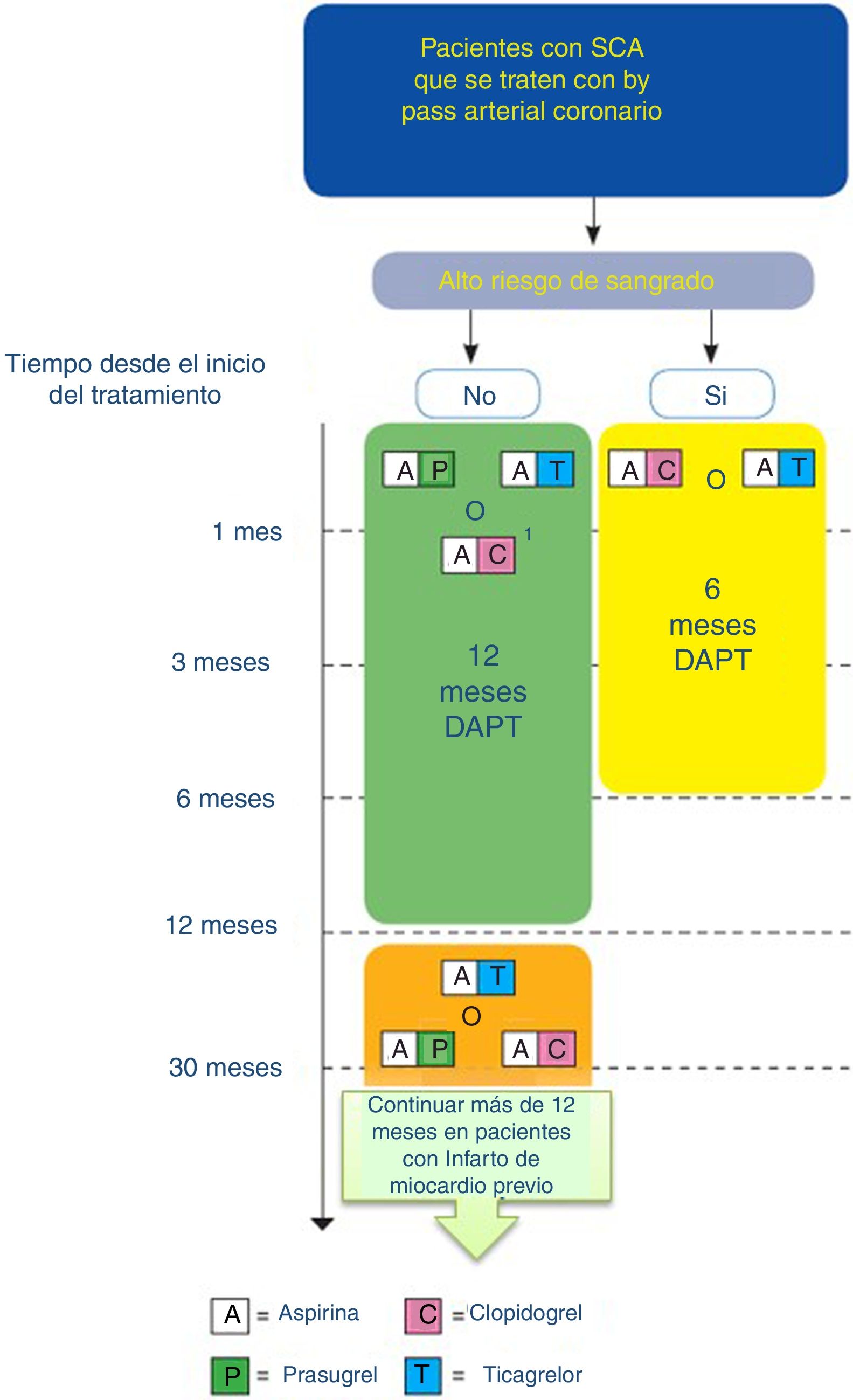
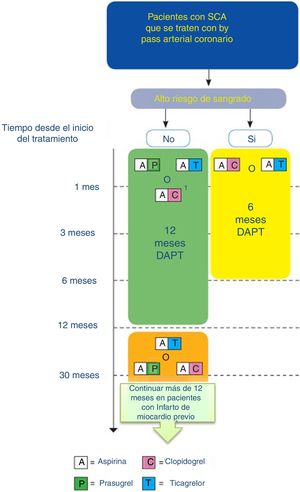
Algoritmo de tratamiento antiagregante en paciente con SCA que se tratan con bypass arterial coronario (adaptado de ESC 2017).
DAPT: doble terapia antiagregante Código de colores según recomendación de la ESC: Verde (clase i), amarillo (clase iia), naranja (clase iib). Consultar la figura a color en la web.
1: Cuando no se pueda usar ticagrelor o prasugrel.
Recomendaciones:
1. EAC estable
- •
En pacientes con EAC estable, a los que se le implanta un stent, la doble terapia (DAPT) con AAS+clopidogrel se recomienda generalmente durante 6 meses, independientemente del tipo de stent (IA), pero siendo el DES el stent de elección (IA).
- •
En pacientes con EAC estable con alto riesgo hemorrágico, debemos de considerar el uso de DAPT durante 3 meses (IIa B) y en aquellos en los que nos aporte dudas de seguridad, podemos reducirlo a un mes (IIb C).
- •
En pacientes con EAC estable tratado con balones recubiertos de fármaco, la DAPT se recomienda durante 6 meses (IIa B) y en los tratados con stents bioabsorbibles se debe mantener al menos 12 meses (IIa C).
- •
En pacientes con EAC estable los cuales han tolerado la DAPT, sin haber presentado complicaciones hemorrágicas y que tienen un alto riesgo trombótico, debemos considerar mantener la DAPT con clopidogrel entre 6 y 30 meses (IIb A)42.
2. SCA
- •
En pacientes con SCA tratado con intervencionismo coronario, debemos de considerar el uso de la DAPT durante al menos 12 meses43,44, salvo que el riesgo hemorrágico sea muy elevado (I A), en los que debemos de valorar reducirlo a 6 meses (IIa B)45.
- •
En pacientes con SCA tratados con stent bioabsorbibles, debemos mantener la DAPT durante al menos 12 meses (IIa C).
- •
En pacientes con SCA que han tolerado la DAPT sin complicaciones hemorrágicas, debemos considerar su uso durante más de 12 meses (IIb A)46.
- •
En pacientes con infarto de miocardio y alto riesgo trombótico (>50 años, y uno o más de los siguientes:> 65 años, diabetes mellitus que requiera medicación, un IAM previo, enfermedad coronaria multivaso o filtrado glomerular<60ml/min) que han tolerado la DAPT sin complicaciones hemorrágicas, debemos de considerar la continuación con ticagrelor 60mg/12h junto al AAS desde los 12 meses hasta los 3 años, sobre la combinación con clopidogrel o prasugrel (IIb B).
- •
En los pacientes con SCA en los que no se ha implantado un stent (tratamiento médico), se recomienda el uso de DAPT durante 12 meses (IA).
- •
Se prefiere el uso de ticagrelor frente al uso de clopidogrel, en pacientes cuyo riesgo de sangrado sea menor que el trombótico (IB).
- •
En los pacientes con SCA con actitud no invasivo y con alto riesgo hemorrágico, el uso de la DAPT se puede limitar a un mes (IIa C).
- •
En pacientes con un Infarto de miocardio previo y alto riesgo trombótico, que presenta un SCA con actitud no invasiva y que han tolerado la DAPT sin sangrados, el uso de DAPT con ticagrelor 60mg /12h junto con AAS se debe de mantener desde los 12 meses hasta los 36 meses (IIb B).
- •
En pacientes con Infarto de miocardio previo y no tratado con stent, que han tolerado DAPT sin complicaciones hemorrágicas y en los que no se puede utilizar ticagrelor, debemos considerar el uso de clopidogrel junto con AAS durante un tiempo superior a 12 meses.
- •
Prasugrel no se recomienda en pacientes con SCA que se tratan de manera conservadora (tratamiento médico).
- •
En pacientes intervenidos de cirugía de revascularización miocárdica con un infarto de miocardio previo, y alto riesgo de sangrado, el inhibidor de P2Y12se puede suspender a los 6 meses.
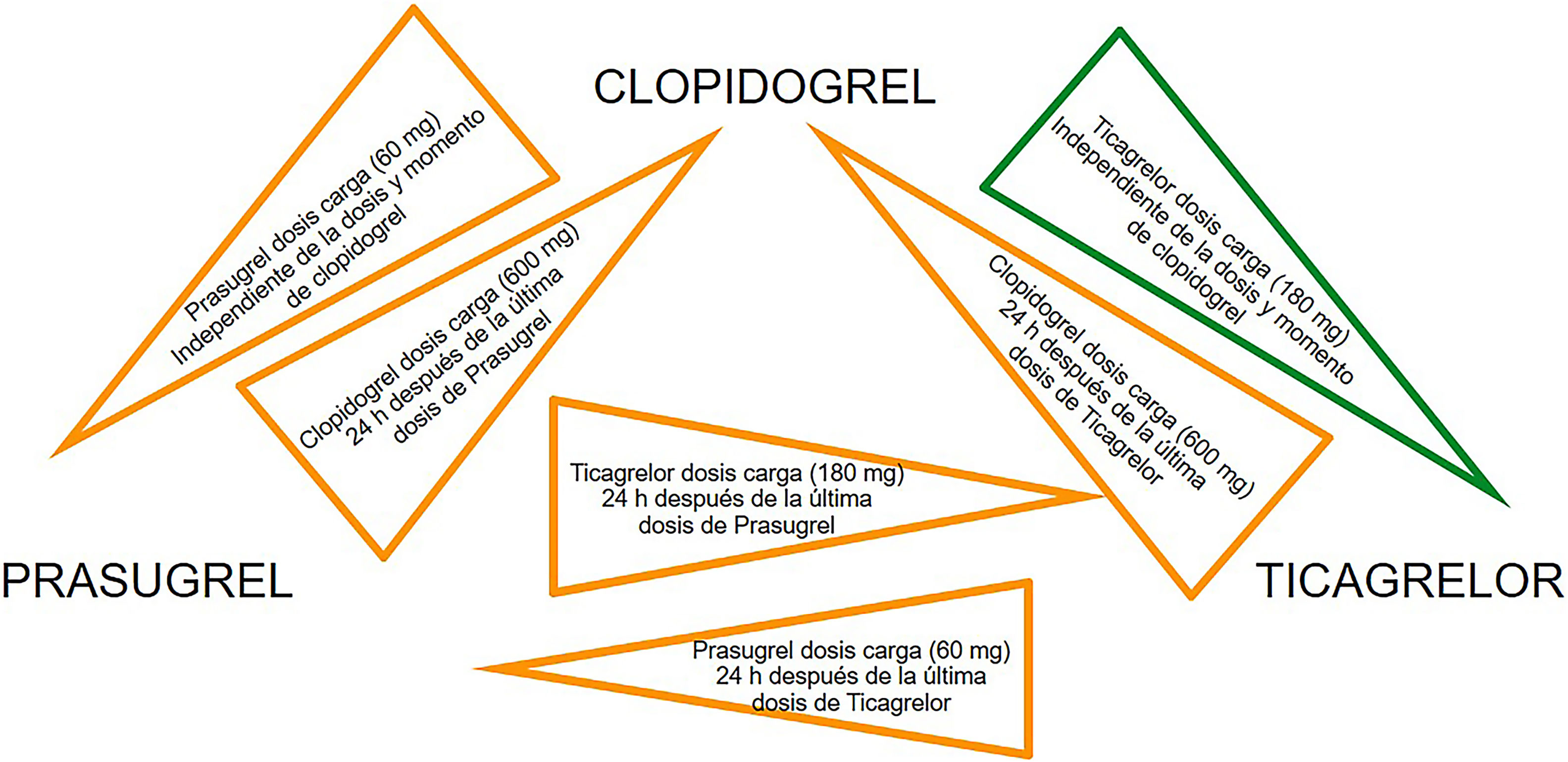
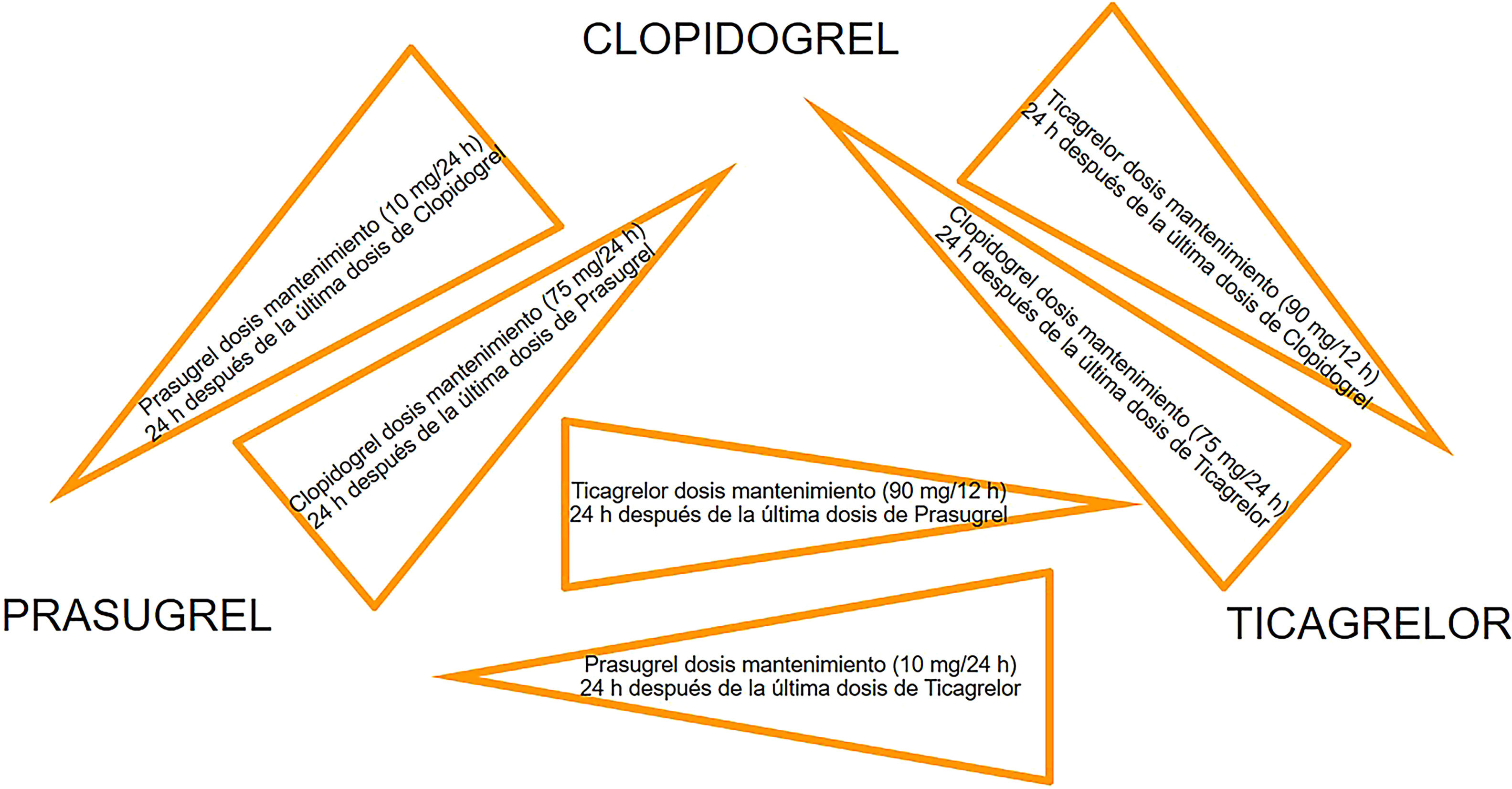
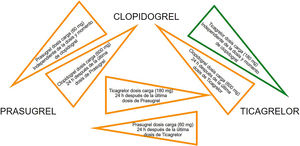
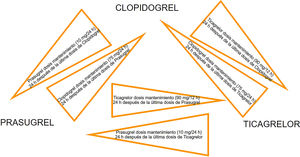
Las diferencias farmacocinéticas y farmacodinámicas de los inhibidores del receptor P2Y12 (lugar de unión, vida media y velocidad de inicio de acción) son factores importantes que pueden conducir a interacciones medicamentosas cuando se cambia de un agente a otro. La transición de clopidogrel a ticagrelor es el único cambio entre inhibidores de P2Y12 que se ha investigado en un ensayo clínico, a pesar de que el estudio no fue específicamente diseñado para evaluar la seguridad y la eficacia de la transición de clopidogrel a ticagrelor. En el ensayo PLATO, casi el 50% de los pacientes asignados a recibir ticagrelor habían sido pretratados con clopidogrel (dosis de carga de 300-600mg)40. La eficacia y la seguridad del ticagrelor no se vieron afectadas por la exposición previa al clopidogrel47. La necesidad del switch entre los diferentes inhibidores de P2Y12 puede surgir por razones clínicas (efectos secundarios o intolerancia al fármaco), y los datos de diferentes registros indican que no es infrecuente en la práctica, por lo que se han propuesto algoritmos de cambio basados en estudios farmacodinámicos (figs. 6 y 7).
Recomendaciones:
- •
En los pacientes con SCA previamente expuestos al clopidogrel, se recomienda el cambio precoz de clopidogrel a ticagrelor tras el ingreso hospitalario con una dosis de carga de 180mg, independientemente del momento y carga de la dosis de clopidogrel, a menos que existan contraindicaciones al ticagrelor.
- •
El switch adicional entre los inhibidores orales de P2Y12puede considerarse en aquellos casos con efectos secundarios o intolerancia a los fármacos según los algoritmos propuestos.
Actualmente no hay evidencia de un beneficio de supervivencia o una reducción de las complicaciones tromboembólicas con la DAPT en pacientes con enfermedad coronaria crónica estable sometida a cirugía de revascularización coronaria (CRC). Sin embargo, existen datos que indican que el uso de DAPT en pacientes con enfermedad coronaria crónica estable reduce el riesgo de oclusiones del injerto venoso (pero no arterial)23.
Recomendaciones:
- •
En pacientes con aspirina que necesitan someterse a una cirugía cardíaca no emergente, se recomienda continuar la aspirina con un régimen diario bajo durante el período perioperatorio.
- •
En pacientes con enfermedad coronaria crónica estable, la DAPT (con clopidogrel iniciado precozmente en el postoperatorio) durante 12 meses tras la CRC puede ser razonable para mejorar la permeabilidad del injerto venoso.
A pesar de no disponer de estudios que hayan valorado específicamente la eficacia clínica de la DAPT en pacientes con SCA y CRC, los subestudios de cirugía coronaria del TRITON-TIMI 38 y del PLATO que evaluaron prasugrel y ticagrelor respectivamente frente a clopidogrel (asociados a aspirina), mostraron una eficacia superior de los nuevos antiagregantes con un aumento de las hemorragias solo en el primer estudio48,49. La continuación de la DAPT hasta la CRC aumenta el riesgo de hemorragia perioperatoria, necesidad de transfusiones y reexploración por sangrado50, por lo que se recomienda que el inhibidor P2Y12 sea suspendido siempre que sea posible antes de la CRC electiva33. El período de interrupción seguro varía entre los diferentes inhibidores P2Y12 debido a variaciones en el efecto inhibidor de plaquetas y propiedades farmacodinámicas y farmacocinéticas51.
Recomendaciones:
- •
En los pacientes con SCA tratados con DAPT, sometidos a CRC y que no requieren terapia de ACO a largo plazo, se debe reanudar el tratamiento con inhibidores P2Y12tan pronto como se considere seguro después de la cirugía y continuar hasta 12 meses.
- •
En pacientes con inhibidores P2Y12que necesitan someterse a una cirugía cardíaca no urgente debe demorarse la cirugía durante al menos 3 días después de la interrupción del ticagrelor, 5 días después del clopidogrel y 7 días después del prasugrel.
- •
En los pacientes tratados con DAPT después del implante de un stent coronario que posteriormente se someten a cirugía cardíaca, se recomienda reanudar el tratamiento con inhibidores P2Y12después de la intervención tan pronto como se considere seguro, de manera que la DAPT continúe hasta que se complete la duración recomendada de la terapia.
- •
Se debe considerar la interrupción de los inhibidores P2Y12a partir de los 6 meses en pacientes con CRC e IAM previo que tienen un alto riesgo de sangrado severo.
- •
Se puede considerar la continuación de la DAPT entre 12 a 36 meses en aquellos pacientes con un alto riesgo isquémico e IAM previo y CRC, que han tolerado la DAPT sin complicaciones hemorrágicas.
El manejo de la DAPT en los pacientes que son referidos a procedimientos quirúrgicos no cardíacos implica la consideración de: (1) el riesgo de trombosis del stent (especialmente si se necesita interrumpir la DAPT); (2) las consecuencias de retrasar el procedimiento quirúrgico; y (3) el aumento del riesgo de sangrados intra- y periprocedimiento y las posibles consecuencias del sangrado si se continúa la DAPT52.
Cirugía electiva no cardíaca (fig. 8)La doble antiagregación reduce significativamente el riesgo de trombosis del stent, y su interrupción en las semanas posteriores a la implantación del mismo es uno de los factores de riesgo más potentes para su aparición. Los datos de estudios observacionales más recientes sugieren que el tiempo de mayor riesgo de trombosis del stent son los 6 primeros meses tras su implante, independientemente del tipo de stent (BMS o DES)53. Por ello, parece razonable mantener al menos 6 meses la DAPT después de un SCA o ICP compleja, para minimizar el riesgo de IAM perioperatorio cuando el riesgo de retrasar la cirugía es aceptable23,52.
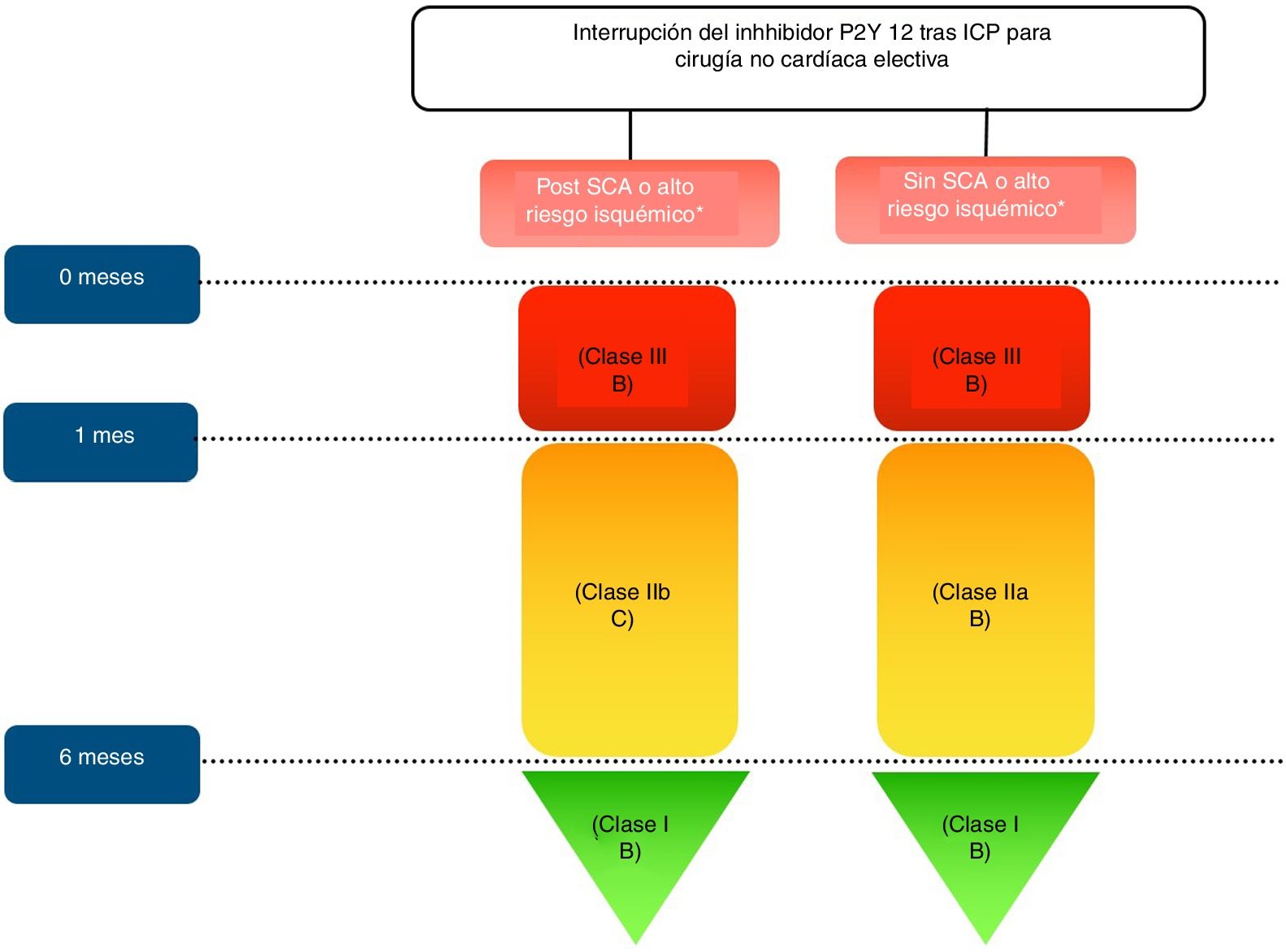
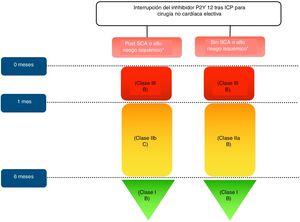
Algoritmo de interrupción del inhibidor de P2Y12 tras ICP para cirugía no cardíaca electiva. Características de alto riesgo isquémico*: Trombosis de stent previo con antiagregación adecuada, implante de stent en última arteria coronaria permeable, enfermedad multivaso difusa especialmente en diabéticos; IRC (FG<60ml/min), implante de al menos 3 stents, al menos 3 lesiones tratadas, bifurcación tratada con 2 stents, longitud total de stent>60mm, tratamiento de una oclusión crónica total.
En los procedimientos quirúrgicos con bajo riesgo de hemorragia no debe suspenderse la TAD perioperatoriamente, mientras que en los de riesgo moderado los pacientes deben mantenerse con aspirina y el tratamiento con inhibidores de P2Y12 debe interrumpirse siempre que sea posible. La toma de decisiones más difícil son en aquellos pacientes con DAPT que se someten a cirugías no cardíacas con alto riesgo de sangrado, incluyendo reconstrucciones vasculares, procedimientos viscerales complejos, neurocirugía, y operaciones transbronquiales. En estos casos, debe prestarse una atención especial a la interrupción adecuada de los inhibidores de P2Y12 para minimizar el período vulnerable sin DAPT antes de la intervención quirúrgica.
Para reducir el riesgo de hemorragia y necesidad de transfusión igualmente se recomienda posponer la cirugía electiva no cardíaca hasta completar el tiempo de la DAPT. En la mayoría de las situaciones clínicas, la aspirina proporciona beneficios sobre el riesgo de sangrado y debe continuarse54, salvo en procedimientos intracraneales, transuretrales, prostatectomía, procedimientos intraoculares y operaciones con riesgo de sangrado extremadamente alto.
Recomendaciones:
- •
Se recomienda continuar la aspirina perioperatoria si el riesgo de hemorragia lo permite, y reanudar la terapia antiplaquetaria recomendada tan pronto como sea posible después de la operación.
- •
Tras el implante de un stent coronario, la cirugía electiva que requiera la interrupción del inhibidor P2Y12podría considerarse tras el primer mes, independiente del tipo de stent, si puede mantenerse la aspirina durante el período perioperatorio.
- •
La interrupción de los inhibidores P2Y12debe considerarse al menos 3 días antes de la cirugía para el ticagrelor, 5 días para el clopidogrel y 7 días para el prasugrel.
- •
En pacientes con IAM reciente u otras características de alto riesgo isquémico que requieren DAPT, la cirugía electiva puede posponerse hasta los 6 meses.
- •
Si ambos fármacos antiplaquetarios orales tienen que interrumpirse perioperatoriamente, puede considerarse una estrategia puente con agentes antiplaquetarios intravenosos, especialmente si la cirugía tiene que realizarse dentro del primer mes después del implante del stent.
- •
No se recomienda suspender la TDA dentro del primer mes de tratamiento en pacientes que son sometidos a cirugía electiva no cardíaca.
En pacientes que requieran ser sometidos a cirugía no cardíaca tras un SCA o implante de stent reciente, los beneficios de la cirugía temprana para una enfermedad específica (p. ej., tumores malignos o la reparación de un aneurisma vascular) deben ser equilibrados frente al riesgo de eventos cardiovasculares y la estrategia debe ser discutida por un equipo multidisciplinario. En todo caso debe considerarse al menos un mínimo de un mes de DAPT, independientemente del tipo de stent implantado (es decir, BMS o DES de nueva generación). Además, estos procedimientos quirúrgicos deben llevarse a cabo en hospitales donde se disponga de laboratorio de hemodinámica 24h al día (7 días/semana) para poder tratar a los pacientes que sufran una trombosis perioperatoria23.
Tratamiento antiagregante y/o anticoagulante con las prótesis aórticas percutáneasLa razón principal para la terapia antitrombótica post-TAVI es prevenir eventos isquémicos cerebrales y se basa en la experiencia de la sustitución valvular quirúrgica, sin embargo, el tratamiento antitrombótico tras el TAVI ofrece grandes dificultades en la práctica clínica diaria, debido a que habitualmente se trata de pacientes ancianos con alto riesgo tanto hemorrágico como trombótico, que frecuentemente presentan otras condiciones clínicas como fibrilación auricular (aproximadamente un 40% de los pacientes) o cardiopatía isquémica, con enfermedad coronaria revascularizada percutáneamente con implantes de stents coronarios con sus propias indicaciones terapéuticas. Además, tanto las hemorragias como las complicaciones trombóticas son predictores independientes de mortalidad tras el TAVI55,56. La combinación de aspirina y una tienopiridina, básicamente clopidogrel, seguido de aspirina o una tienopiridina aislada, en pacientes que no tienen otra indicación para la ACO, ha sido comúnmente utilizada después del TAVI, desde sus comienzos en el 2002 y la estrategia terapéutica utilizada en la mayoría de los ensayos clínicos realizados con el TAVI57,58. Datos recientes indican que la monoterapia antiplaquetaria puede tener mejor perfil de seguridad que la DAPT después del procedimiento59,60. Los pacientes con doble terapia tienen mayor riesgo de cualquier tipo de sangrado que aquellos con simple terapia (36,5 vs. 27,5%), p=0,049 y sin tratamiento (36,5 vs. 21,3%, p=0,001), siendo la mayoría por la vía de abordaje55.
El objetivo del estudio ARTE fue comparar doble terapia con aspirina y clopidogrel vs. monoterapia con aspirina para la prevención de eventos isquémicos (infarto de miocardio, accidente cerebrovascular, accidente isquémico transitorio) y sangrados mayores y/o amenazantes de la vida. De los 222 pacientes incluidos, 111 en cada grupo, no hubo diferencias respecto al objetivo primario en los primeros 3 meses tras TAVI61. Varios estudios observacionales indican que la doble terapia no proporciona beneficio en la prevención de eventos cerebrovasculares tras TAVI, dado que hay un porcentaje elevado relacionado con episodios de fibrilación auricular, en los que la doble terapia ha demostrado un valor limitado, sin embargo, se ha asociado con un incremento de eventos hemorrágicos (10,8 vs. 3,6%, p=0,0038), la mayoría gastrointestinales62–64.
Otro de los problemas que encontramos es la trombosis valvular tras TAVI. Latib et al.65 informaron de una incidencia del 0,61% tras analizar a 4.266 pacientes tratados con TAVI. Sin embargo, Leetmaa et al.66 mostraron que si se utiliza imágenes por tomografía, en los primeros 3 meses, la trombosis valvular es más frecuente, cursando en su mayoría de forma asintomática (4% en los primeros 3 meses). Algunos estudios indican que la trombosis puede ocurrir durante los 2 primeros años, fundamentalmente en el primer año, lo que puede conducir a un deterioro de la función valvular, con incrementos del gradiente transvalvular. Entre las opciones de tratamientos se incluyen la anticoagulación con heparina, AVK o reintervención si no es resuelto con la anticoagulación. Se han identificado algunos mecanismos, como una posición inadecuada así como la infraexpansión valvular que conduce a un flujo turbulento o trastornos de la coagulación. Hasta hace poco, se pensaba que la trombosis valvular era una complicación rara, sin embargo, debido a los hallazgos encontrados al utilizar imágenes con 4D con la tomografía, se ha convertido en una cuestión preocupante. Este problema se identificó por primera vez con la prótesis Pórtico, que mostraba una reducción del movimiento de los velos, por trombosis. En el estudio SAVORY se realizó tomografía computarizada a los 3 meses de la intervención valvular, encontrando un movimiento reducido de las valvas, un 18,1% para los pacientes con TAVI y el 6,7% para aquellos con recambio valvular aórtico quirúrgico. El registro RESOLVE mostró una tasa de trombosis valvular similar, del 10% después de la TAVI y del 8% tras el recambio valvular quirúrgico. Aunque esta reducción de la movilidad de los velos no se asoció con síntomas, eventos clínicos o incremento el gradiente transvalvular. Basados en estos hallazgos, sugieren la necesidad de utilizar una terapia anticoagulante que pudiera reducir la incidencia de trombosis subclínica, aunque se necesitan los resultados de los ensayos clínicos que están actualmente en curso para demostrar el beneficio en comparación con la DAPT67.
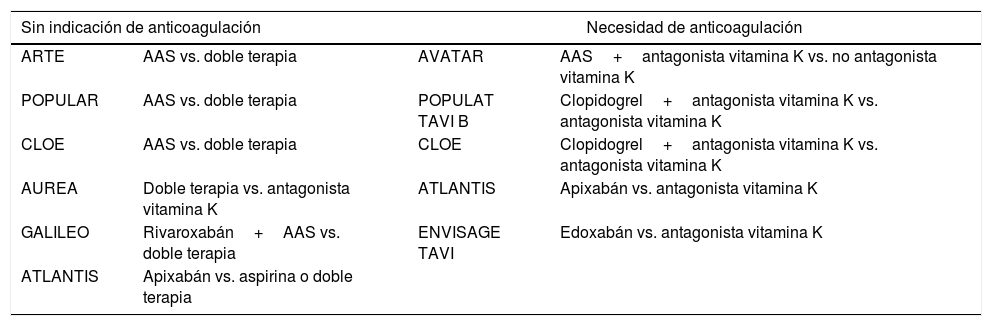
En la actualidad se están llevando a cabo varios estudios comparando diferentes regímenes antitrombóticos en pacientes sometidos a TAVI, que en un futuro aclararán estos aspectos. Se resumen en la tabla 3:
Clasificación de los distintos estudios que comparan diferentes regímenes antitrombóticos en pacientes sometidos a TAVI
| Sin indicación de anticoagulación | Necesidad de anticoagulación | ||
|---|---|---|---|
| ARTE | AAS vs. doble terapia | AVATAR | AAS+antagonista vitamina K vs. no antagonista vitamina K |
| POPULAR | AAS vs. doble terapia | POPULAT TAVI B | Clopidogrel+antagonista vitamina K vs. antagonista vitamina K |
| CLOE | AAS vs. doble terapia | CLOE | Clopidogrel+antagonista vitamina K vs. antagonista vitamina K |
| AUREA | Doble terapia vs. antagonista vitamina K | ATLANTIS | Apixabán vs. antagonista vitamina K |
| GALILEO | Rivaroxabán+AAS vs. doble terapia | ENVISAGE TAVI | Edoxabán vs. antagonista vitamina K |
| ATLANTIS | Apixabán vs. aspirina o doble terapia | ||
- •
La trombosis subclínica de los velos de las bioprótesis es frecuente, siendo mayor con las prótesis percutáneas en comparación a las quirúrgicas.
- •
La DAPT parece no ser eficaz en la prevención y/o tratamiento de la trombosis valvular subclínica.
- •
La trombosis valvular subclínica puede asociarse con un incremento en la incidencia de accidente cerebrovasculares tras TAVI.
- •
Las comorbilidades preexistentes determinan la elección de la terapia antitrombótica tras TAVI.
Recomendaciones:
Las recomendaciones en cuanto al tratamiento antitrombótico en pacientes sometidos a implante de TAVI, basándose en las recientes guías europeas de valvulopatía68 y los comentarios descritos previamente, podrían ser sintetizadas como:
- A)
Pacientes sin indicación de ACO.
- •
AAS a dosis de 100mg diarios de forma crónica.
- •
Clopidogrel a dosis de 75mg diarios de 3 a 6 meses tras el implante.
- •
La monoterapia antiplaquetaria podría ser considerada después del TAVI en pacientes con alto riesgo de sangrado.
- B)
Pacientes con indicación de ACO.
- •
AVK siguiendo las indicaciones de su enfermedad de base.
- •
AAS a dosis de 100mg diarios de 3 a 6 meses.
- •
En aquellos pacientes en los que se confirme en el seguimiento un deterioro hemodinámico valvular (incremento del gradiente transvalvular y/o la presencia de engrosamiento valvular con o sin movilidad reducida de los velos, tras utilizar una técnica de imagen), se debería iniciar tratamiento con AVK ante la sospecha de trombosis de los velos, con o sin síntomas asociados.
- •
A pesar de la ausencia de datos, a la espera de los resultados de los ensayos clínicos en curso, en los pacientes con intolerancia a los AVK o imposibilidad de un correcto control debido a las morbilidades de los pacientes tratados con TAVI, podría considerarse la opción de administrar un ACO directo.
Los autores declaran no tener ningún conflicto de intereses.
Los autores agradecen a AstraZeneca su inestimable ayuda técnica, además de contar con el apoyo a través de una beca no condicionada a la Sociedad Andaluza de Cardiología.