La insuficiencia cardiaca es una de las causas más importantes de morbimortalidad en nuestra sociedad. El origen más frecuente (más de la mitad de los casos) sigue siendo el infarto de miocardio. Aunque se han desarrollado numerosas estrategias terapéuticas, tanto farmacológicas (IECA, ARA-2, betabloqueantes, etc.) como mecánicas (apertura sistemática de la arteria responsable del infarto, desfibriladores, marcapasos de resincronización, etc.), muchos pacientes no consiguen recuperar la función ventricular; sus síntomas persisten y su pronóstico continúa siendo sombrío. Por ello, sobre todo en estos casos, la sustitución del tejido necrótico por tejido cardiaco normal con capacidad contráctil constituiría una alternativa terapéutica eficaz. El déficit de miocitos en los infartos que cursan con insuficiencia cardiaca se considera superior a mil millones de células, con una pérdida superior al 25% de la masa total del ventrículo izquierdo.
En los últimos años se ha demostrado, en contra del pensamiento clásico, que el miocardio humano destruido o lesionado puede regenerarse a partir de células madre. Se ha observado que después de un infarto de miocardio se produce un proceso de regeneración que tiende a sustituir la zona necrosada. Sin embargo, este fenómeno puede ser insuficiente para suplir el miocardio perdido de una forma funcional adecuada. La pobre capacidad de regeneración natural del corazón puede ser estimulada mediante diferentes tipos de células progenitoras extracardiacas. En estudios experimentales se ha demostrado que tras un infarto de miocardio hay movilización de células procedentes de la médula ósea, que son atraídas por factores quimiotácticos hacia el tejido necrótico, colaborando con las células residentes en la reparación del mismo. Este fenómeno «natural» puede ser potenciado por la administración de células progenitoras pluri o totipotenciales a nivel cardiaco o a nivel sistémico.
Pero aún existen muchos interrogantes que resolver en el tratamiento regenerativo del corazón:
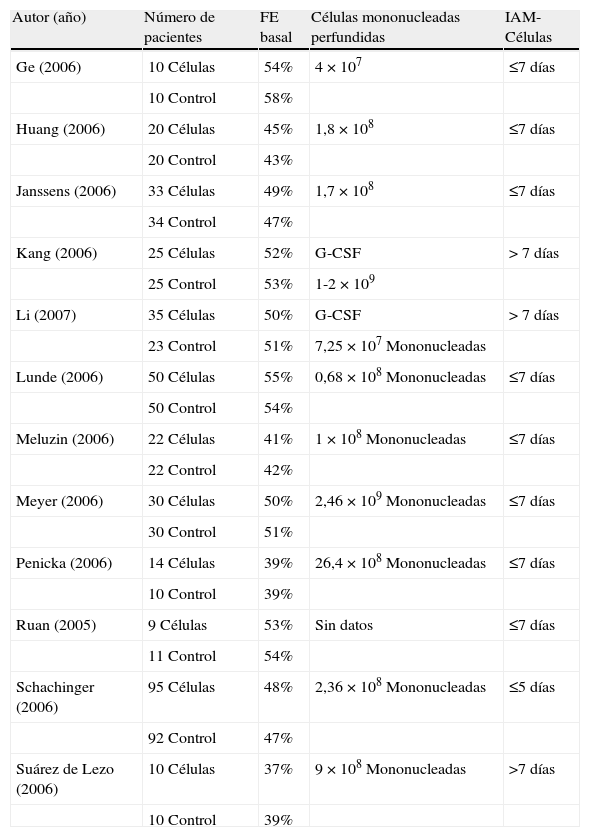
¿Qué tipo de células y que vía de administración?Existe una gran heterogeneidad en el tipo, el número y la vía de administración de las células administradas en los estudios clínicos publicados. En la actualidad se considera que la alternativa más segura y eficaz es la administración intracoronaria de células mononucleares de médula ósea. Diferentes estudios durante los últimos años han demostrado que esta estrategia en pacientes con infarto agudo de miocardio provoca mejora, en mayor o menor grado, de la función ventricular, sin que hayan aparecido efectos adversos significativos dependientes de la terapia celular1,3 (tabla 1).
Terapia celular en el infarto agudo de miocardio
| Autor (año) | Número de pacientes | FE basal | Células mononucleadas perfundidas | IAM-Células |
| Ge (2006) | 10 Células | 54% | 4×107 | ≤7 días |
| 10 Control | 58% | |||
| Huang (2006) | 20 Células | 45% | 1,8×108 | ≤7 días |
| 20 Control | 43% | |||
| Janssens (2006) | 33 Células | 49% | 1,7×108 | ≤7 días |
| 34 Control | 47% | |||
| Kang (2006) | 25 Células | 52% | G-CSF | > 7 días |
| 25 Control | 53% | 1-2×109 | ||
| Li (2007) | 35 Células | 50% | G-CSF | > 7 días |
| 23 Control | 51% | 7,25×107 Mononucleadas | ||
| Lunde (2006) | 50 Células | 55% | 0,68×108 Mononucleadas | ≤7 días |
| 50 Control | 54% | |||
| Meluzin (2006) | 22 Células | 41% | 1×108 Mononucleadas | ≤7 días |
| 22 Control | 42% | |||
| Meyer (2006) | 30 Células | 50% | 2,46×109 Mononucleadas | ≤7 días |
| 30 Control | 51% | |||
| Penicka (2006) | 14 Células | 39% | 26,4×108 Mononucleadas | ≤7 días |
| 10 Control | 39% | |||
| Ruan (2005) | 9 Células | 53% | Sin datos | ≤7 días |
| 11 Control | 54% | |||
| Schachinger (2006) | 95 Células | 48% | 2,36×108 Mononucleadas | ≤5 días |
| 92 Control | 47% | |||
| Suárez de Lezo (2006) | 10 Células | 37% | 9×108 Mononucleadas | >7 días |
| 10 Control | 39% |
FE: fracción de eyección; IAM: infarto agudo de miocardio.
Otras alternativas serían:
- •
La utilización de células totipotentes de origen embrionario. Ello implica la destrucción de embriones o la creación de los mismos con fines exclusivamente terapéuticos, lo que conlleva problemas éticos no resueltos. Además, la excesiva plasticidad de estos elementos plantea dudas respecto al riesgo de crecimientos imperfectos (tumores, teratomas.).
- •
Las células mesenquimales (mioblastos). Son fáciles de obtener a partir de la grasa, pero han generado arritmias en diversos estudios y es necesario su cultivo, lo que hace más complejo su empleo en la clínica.
- •
La movilización de células madre residentes en la médula ósea mediante la administración de factor estimulante de colonias granulocíticas (G-CSF). Provoca la liberación de progenitores hematopoyéticos al torrente circulatorio, lo que teóricamente facilitaría su anidamiento en la zona infartada. Sin embargo, no ha demostrado beneficios en términos de recuperación funcional con respecto a grupos control en pacientes con infarto agudo de miocardio. La exposición de células madre a citocinas como el G-CSF ha demostrado inducir cambios en la expresión de moléculas de adhesión, tanto in vivo como in vitro. La pérdida de propiedades adhesivas en las células circulantes podría dificultar su potencial anidamiento en el miocardio infartado. Además, también favorece la liberación de otras estirpes celulares que median en el proceso inflamatorio y de fibrosis y que podrían entorpecer la regeneración adecuada del tejido muscular cardiaco4.
- •
La inyección intramiocárdica de células, quirúrgica o percutánea, permite un mayor anidamiento pero ha originado gran cantidad de arritmias ventriculares malignas, tanto agudas como en el seguimiento, por lo que su uso está actualmente muy restringido.
El infarto agudo de miocardio constituye, a juicio de la mayoría de los investigadores, el mejor escenario para la regeneración cardiaca con perfusión de progenitores hematopoyéticos. En esta situación clínica, las posibilidades de recuperación son grandes, como ya se demostró con la terapia de reperfusión y revascularización precoz. En los días siguientes al infarto reperfundido, el miocardio lesionado emite llamadas quimiotácticas a las células madre circulantes y favorece el anidamiento de las mismas mediantes diferentes factores adhesivos. Además, la médula ósea responde con la liberación de células pluripotenciales. Por todo ello, la perfusión de células supondría una «dosis» adicional en un proceso natural, sin que se conozca aún el mecanismo biológico que provoca la regeneración. Sin embargo, se sabe que algunos factores parecen influir en un grado mayor de regeneración1,2:
- •
La cantidad de células perfundidas y el tamaño del infarto. En los estudios publicados se observa que la ganancia funcional es mayor cuanto más número de células se inyectan y cuanto mayor es el tamaño del infarto2.
- •
La administración intracoronaria en la arteria responsable del infarto. En estudios experimentales se ha comprobado que tras la administración intracoronaria de células mononucleares de médula ósea marcadas se produce anidamiento de una pequeña fracción de las células trasplantadas, mientras que tras la administración intravenosa de células marcadas no se detectó anidamiento.
- •
El tipo de células administrado. Determinados subgrupos celulares han demostrado mayor eficacia regenerativa en diferentes estudios clínicos. Sin embargo, los resultados son dispares entre los estudios y aún no se han identificado las estirpes celulares más eficaces. Pero existe otra cuestión por resolver: ¿Cuándo administrar los progenitores? En los primeros 7 días post-infarto se produce un incremento en los niveles séricos de citocinas (VEGF, HGF y G-CSF). El factor de crecimiento vasculoendotelial presenta dos picos, el primero en la fase aguda (24-48h) y el segundo en la fase subaguda (alrededor del día 7). Sin embargo, en los metaanálisis el incremento en fracción de eyección fue mayor en aquellos pacientes en que la perfusión se realizó a partir del sexto día post-infarto. A la vista de estos conocimientos, la mejor indicación de terapia celular en el infarto agudo de miocardio sería la perfusión en la arteria responsable a partir del sexto día en pacientes con infarto extenso, función ventricular deprimida y médula rica en progenitores hematopoyéticos.
Los pacientes con infarto antiguo y disfunción ventricular representan una situación completamente diferente a la anterior. En ellos, el remodelado adverso está consumado y los «mecanismos regenerativos naturales», agotados. No obstante, hay estudios clínicos que demuestran mejoría de la función ventricular tras terapia celular en pacientes crónicos. En las series publicadas, la mejoría neta en fracción de eyección se encuentra en torno al 5%. Sin embargo, en este tipo de pacientes existe una variabilidad significativa en la respuesta a la perfusión de células madre. En las escasas series publicadas hay una proporción variable de pacientes que no obtienen un efecto beneficioso con este tratamiento5. Hasta la fecha, a pesar de la intensa investigación destinada a identificar a los pacientes «respondedores» no disponemos de factores clínicos concluyentes que predigan un buen resultado tras la citoterapia. El mecanismo de acción de las células mononucleares aún no es conocido, y probablemente sea multifactorial. Además, la mayoría de las hipótesis proceden de estudios experimentales, sin que tengan correlación con los estudios en humanos. La teoría más extendida es que la terapia celular con progenitores hematopoyéticos debe su efecto beneficioso a la activación de «células madre residentes» mediante un mecanismo paracrino. En ratones se ha demostrado que células progenitoras hematopoyéticas implantadas en el miocardio infartado pierden su fenotipo hematopoyético y adquieren linajes cardiacos y endoteliales que permiten formar cardiomiocitos funcionantes y estructuras vasculares. Por tanto, el nicho miocárdico que encuentren las células trasplantadas parece ser decisivo en su anidamiento y diferenciación. En este tipo de pacientes son necesarios aún estudios clínicos de mayor tamaño para determinar la eficacia de la terapia celular e identificar factores predictores de buen resultado.
Miocardiopatía dilatada idiopáticaActualmente existen en marcha varios estudios clínicos destinados a conocer la eficacia terapéutica del trasplante de células madre en esta patología. Aún no se conocen los resultados, pero estudios piloto han demostrado su seguridad y mejorías notables de la función ventricular.
En conclusión, la terapia celular ha demostrado su eficacia clínica en pacientes con insuficiencia cardiaca de diferentes etiologías, sin que se conozca todavía su mecanismo de acción ni los factores predictores de buena respuesta al tratamiento, por lo que sus indicaciones están aún por determinar.