El tratamiento endovascular de la patología aórtica se expande gracias a varios factores:
- 1.
El paciente es más proclive a la cirugía endovascular por el menor dolor postoperatorio y menor riesgo de complicaciones agudas.
- 2.
El cirujano va inclinándose por la cirugía endovascular debido a:
- -
El volumen de casos complejos por centro es escaso, sin constituirse centros de referencia.
- -
Una curva de aprendizaje más dilatada en cirugía abierta.
- -
La elevada morbimortalidad de la cirugía abierta en la patología de aorta torácica. La asociación entre el bajo volumen y una mayor mortalidad en la cirugía abierta en todos los segmentos aórticos ha quedado demostrada en múltiples estudios1–3. Igualmente la paraplejia es más frecuente en cirugía endovascular que en cirugía abierta.
- 3.
La relación coste-eficacia acaba apoyando a la cirugía endovascular:
Los parámetros de gestión (hospitalización, costes…) cada vez serán más favorables a la cirugía endovascular, por la reducción del precio de las prótesis, menor consumo de hemoderivados y menor dependencia de las unidades de cuidados intensivos.
- 4.
La mejora de las técnicas diagnósticas: la principal información para su diagnóstico y tratamiento surge de los estudios de imagen.
Existen otras técnicas (p. ej. ecocardiografía, ecocardiografía transesofágica y angio-RMN) que pueden ser de utilidad en ciertos casos, pero el angio-TAC desempeña un papel principal en la valoración.
En concreto ha mejorado el tratamiento de la aorta por la disponibilidad de estudios de angio-TAC realizados con TAC multicorte con cortes de espesor menor de 2mm, lo que ha permitido asegurar las medidas de diámetro y longitud de las zonas de sellado de la endoprótesis.
La disponibilidad de aplicaciones que permiten la visualización y el tratamiento de las imágenes DICOM (Osirix, Horos, Endosize...) por el médico implantador han permitido una más precisa decisión y planificación terapéutica.
Estos factores determinan un aumento de la cirugía endovascular, no tanto por desplazamiento de pacientes desde la cirugía abierta sino por un aumento de las indicaciones sobre pacientes que se habrían desestimado.
El autor no conoce que exista ningún estudio randomizado que compare cirugía abierta con endovascular en aorta torácica o toracoabdominal. Si bien, la expansión de las técnicas endovasculares y la progresiva reducción de la cirugía abierta es la mejor prueba de que la experiencia de los profesionales es favorable a la cirugía endovascular.
¿Hasta dónde el tratamiento endovascular?La correcta planificación es fundamental para el éxito inmediato y a medio-largo plazo de cualquier procedimiento endovascular, garantizando un segmento de sellado (cuello) proximal y distal.
En aorta torácica se exige al menos 25-20mm de longitud y menos de 40mm de diámetro en ambos cuellos.
Cuellos aún más cortos se permiten en las recomendaciones, pero ponen en riesgo la durabilidad.
¿Cómo optimizar el tratamiento endovascular?La expansión del uso de las técnicas endovasculares hacia pacientes cada vez con mayor supervivencia esperada, debe hacernos buscar no solo el éxito inicial sino la durabilidad de nuestros resultados. Dado que la aorta es una estructura dinámica cuyo diámetro oscila con el latido cardíaco y que crece con la edad del paciente, la calidad del cuello de sellado es un elemento fundamental. La longitud de cuello por debajo de los 20mm en aorta torácica pone en riesgo la durabilidad del sellado y por tanto la eficacia del tratamiento.
Aceptando que el principio básico del tratamiento endovascular es la cobertura de la pared aórtica para excluirla del torrente sanguíneo y la presión arterial e impedir la rotura de la misma, cuanto más localizada sea la patología mejor eficacia. Obviamente dicha cobertura debe respetar la salida de ramas principales cuya oclusión genera complicaciones mayores (en principio, troncos supraaórticos, arteria de Adamkiezwick, tronco celíaco y mesentérica superior, arterias renales y arterias hipogástricas).
En los inicios, la planificación de los casos excluía muchos pacientes que anatómicamente no reunían estos requisitos, p. ej. dado que la disección tipo B suele iniciarse adyacente a la salida de la arteria subclavia y muchos aneurismas incluyen incluso la salida de los troncos supraaórticos.
Pronto se llegó a sacrificar ciertas ramas principales no imprescindibles, como la arteria subclavia asumiendo un porcentaje ligero de complicaciones derivadas de su oclusión que no suelen ser severos y evitándose en casos concretos donde su oclusión tiene alto riesgo (p. ej. oclusión de subclavia en pacientes con bypass mamario coronario).
Cayado y aorta torácica descendente proximalComo hemos comentado anteriormente, el segmento torácico es abordable por vía endovascular con excepción de la raíz aórtica y la aorta ascendente, que siguen siendo zona quirúrgica abierta (salvo casos excepcionales).
La cirugía endovascular nos permite el abordaje de: aneurismas, pseudoanerisma, disección de aorta, hematoma intramural, úlcera penetrante, disección tipo B, aneurisma micótico.
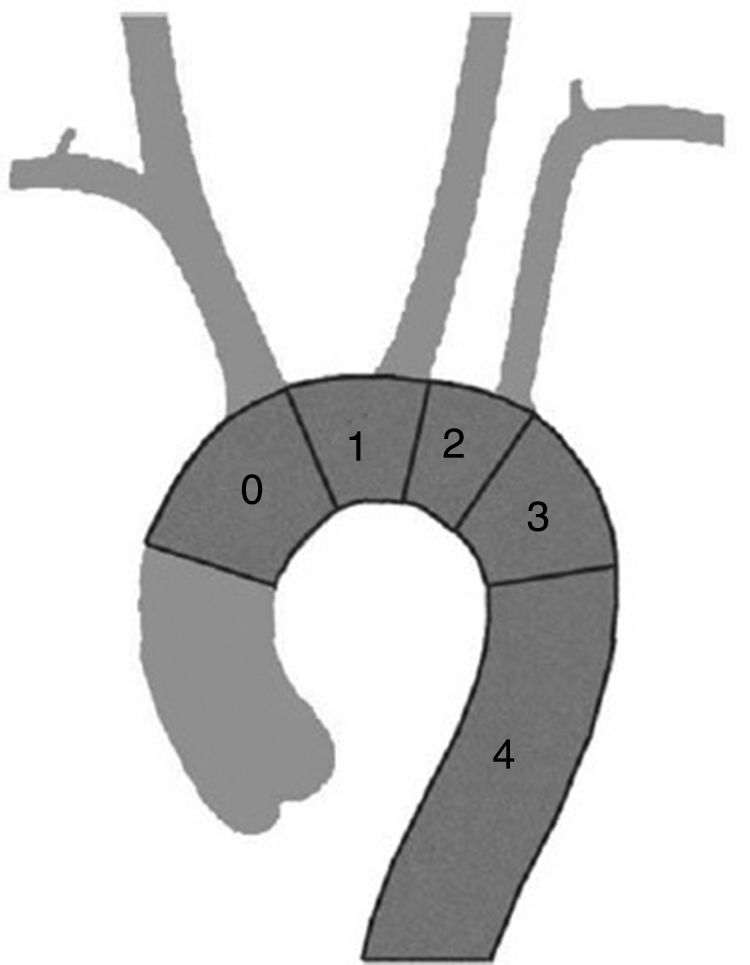
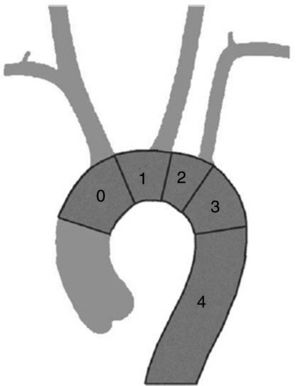
En el cayado aórtico, la clasificación de Ishimaru (fig. 1) nos permite sistematizar las técnicas de aplicación de la cirugía endovascular de aorta, independientemente de la etiología que lo motiva. La zona de sellado, respetando los criterios mínimos de longitud y diámetro ya expuestos puede definirse en función del número de troncos supraaórticos que deja sin cubrir, añadiendo una zona 4 correspondiente a la aorta torácica descendente cuando pierde la curvatura típica del cayado (unos dos cm distal a la salida de la arteria subclavia). En función de esta clasificación podemos mejorar el cuello de sellado proximal con las siguientes técnicas.
La zona 4 es la zona para la que se diseñaron los primeros dispositivos y no precisa técnica adicional. La zona 3, con algo más de curvatura, tampoco exige técnica adicional dado que los actuales dispositivos se adaptan con facilidad y precisión. Para casos con sellado en zona 2, 1 o 0 existen recursos adicionales que permiten el uso de técnicas endovasculares.
Cirugía híbridaConsiste en la realización de bypass para evitar la oclusión de las ramas principales con origen en la zona patológica o la zona de sellado.
- A)
La zona 2 puede asociarse a la revascularización de la arteria subclavia izquierda que será mandatoria de forma preoperatoria en casos de bypass mamario-coronario permeable, arteria vertebral derecha hipoplásica y de forma postoperatoria en caso de síndrome de robo de subclavia izquierda. En general, la revascularización de la subclavia izquierda reduce el riesgo de AVC posterior, isquemia del brazo e isquemia medular, pero también aumenta el riesgo de AVC carotídeo, linforragia o lesión de plexo braquial, con un balance riesgo beneficio favorable en centros con experiencia y en pacientes jóvenes.
En caso de optar por la revascularización, se recomienda el bypass con prótesis (preferiblemente de PTFE), con mejor permeabilidad que con el uso de vena safena y menos complicaciones técnicas que con la técnica de traslocación que obliga a una mayor disección de las estructuras. El abordaje para dicho bypass es una incisión supraclavicular izquierda, por tanto extratorácico.
- B)
La zona 1 exige la revascularización al menos de la carótica derecha, así como de la subclavia en los casos de bypass mamario coronario o arteria vertebral derecha hipoplásica o ausente.
Dicha revascularización se puede realizar de forma extratorácica, mediante la realización de un bypass carótido-carótido dispuesto en tejido celular subcutáneo o en posición retroesofágica, en función de la experiencia de los centros.
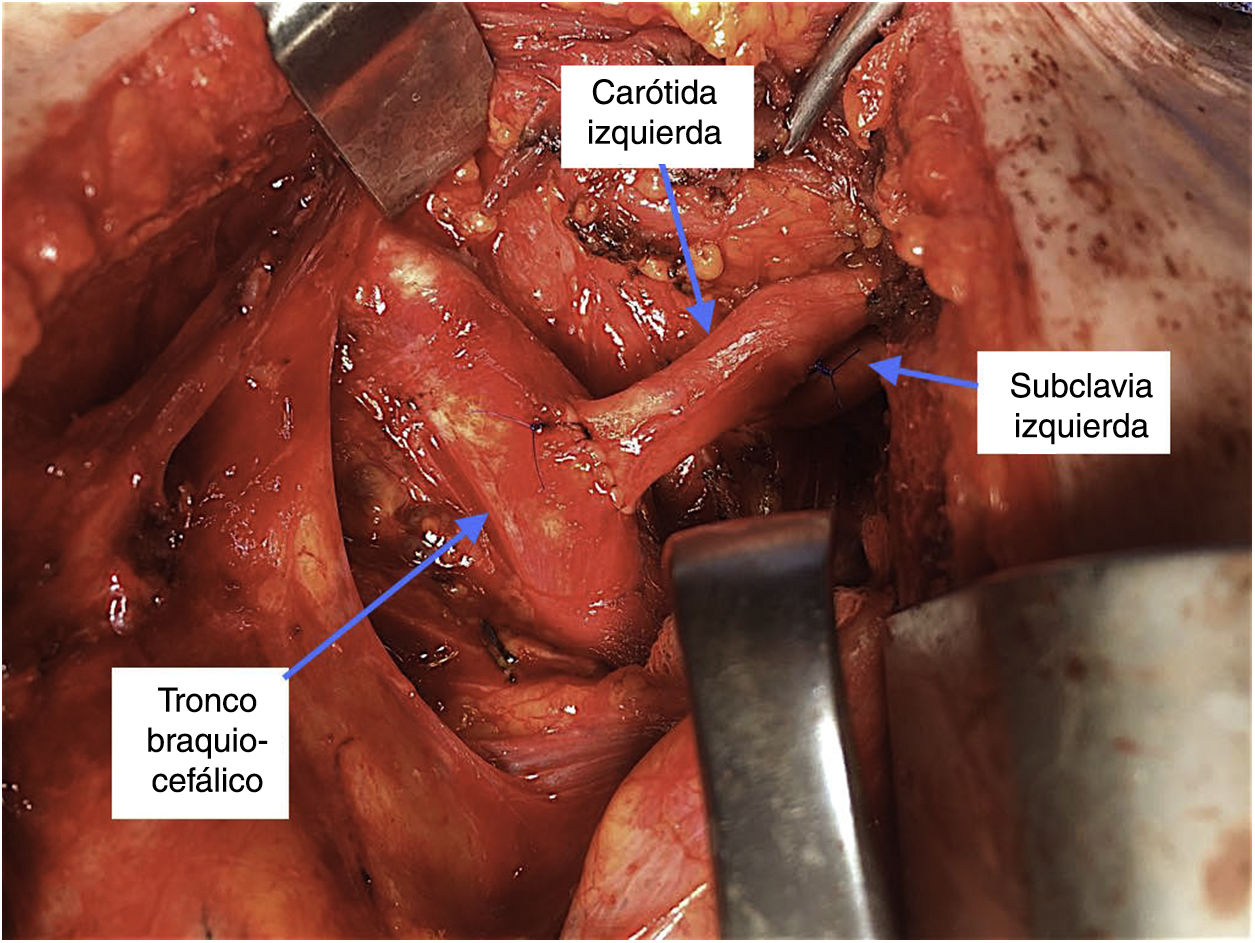
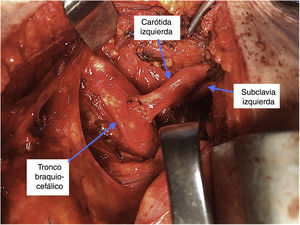
Nuestro grupo prefiere en estos casos evitar la manipulación retroesofágica o la colocación subcutánea del bypass y optamos por una revascularización de la carótida y la subclavia de forma intratorácica, mediante la traslocación de la carótida izquierda sobre el tronco braquicefálico y de la subclavia sobre la carótida izquierda. Esta técnica se realiza mediante miniesternotomía superior por tercer espacio y evita el uso de material protésico, al tiempo que permite una excelente exposición y disección de los troncos supraaórticos (fig. 2).
- C)
La zona 0 exige la revascularización de todos los troncos supraaórticos (o al menos de braquiocefálico y carótida izquierda) mediante un bypass desde aorta ascendente con material protésico (habitualmente dacron) gracias a un clampaje aórtico lateral y el clampaje secuencial de cada uno de los TSAo. Dicha técnica puede hacerse mediante esternotomía completa o hemiesternotomía superior hasta 4.° espacio intercostal. Nuestra serie de casos muestra un porcentaje de complicaciones bajo, a pesar de tratar pacientes con comorbilidad muy severa (EPOC con oxigenoterapia domiciliaria, etc.).
Los resultados a corto, medio y largo plazo de estas técnicas de derivación en cayado aórtico son excepcionales con una tasa de complicación muy baja, por lo que son la técnica empleada como primera elección en muchos centros.
Implantación de chimeneasSe denomina así a la introducción endoprótesis menores (que llamaremos stent recubiertos para evitar confusión con la endoprótesis aórtica) en paralelo a la endoprótesis que permiten la entrada de sangre a las ramas principales (técnicas de chimenea).
Las ventajas de esta técnica son la escasa agresión y rápida disponibilidad, con relativo bajo coste.
En casos en que el riesgo quirúrgico para cirugía abierta sea excesivo, la chimenea puede ser una técnica de recurso.
Es una técnica reproducible, pero la estabilidad a medio-largo plazo de las chimeneas es inferior, con aumento de la presencia de fugas periprotésicas respecto de la cirugía endovascular sin chimeneas. A mayor número de chimeneas o periscopios mayor riesgo de complicaciones a corto y medio plazo.
Endoprótesis con ramasPara pacientes con riesgo quirúrgico inaceptable para cirugía híbrida, también se han implantado prótesis a medida con una o dos ramas o fenestraciones para los troncos supraaórticos (Jotec, Cook, Terumo Aortic) pero implican una demora de 3-4 semanas hasta su disponibilidad y un coste alto.
Está pendiente de aprobación EMEA y FDA una endoprótesis estándar de cayado aórtico con una rama para troncos supraaórticos para la revascularización de carótida izquierda o incluso tronco braquiocefálico previa realización de bypass carótido-carotídeo (Gore Tag Thoracic Branch endoprosthesis) que permitiría evitar esta demora y reducir coste.
Stent multicapa modulador de flujoEl stent multicapa o modulador de flujo es un stent cuya pared se configura como una red que permite conservar el flujo hacia la salida de las arterias por su alto flujo, al tiempo que provoca flujo turbulento en la zona excluida, salvo en la zona central del flujo hacia las ramas arteriales. Igualmente busca la endotelización de la pared del stent, por lo que confiere protección a la pared aórtica patológica. Se esperan los resultados de series a medio largo plazo que demuestren la eficacia de los stents modulares de flujo (p. ej. Aortic MFM de Cardiatis), lo cual abriría un nuevo camino para el tratamiento de pacientes con gran complejidad para la preservación de ramas con un abordaje técnicamente muy sencillo.
Por todos estos recursos podemos decir que actualmente solo la raíz aórtica y la aorta ascendente son terrenos no abordables por cirugía endovascular de la aorta.
Esto no significa que necesariamente sean la primera opción terapéutica, dado que la cirugía abierta sin participación de la cirugía endovascular sigue teniendo un papel en muchos casos, que deberá valorarse en función de la patología y anatomía a tratar.
Conflicto de interesesEl primer autor es proctor para el implante de endoprótesis Gore y Medtronic.