La insuficiencia mitral (IM) es la enfermedad valvular más frecuente en la población y su prevalencia aumenta con la edad, estimándose que el 7% en la población>75 años tiene una IM al menos moderada. El mecanismo de la IM puede tener su origen en las valvas (afectación mixoide, reumática o degenerativa), en el aparato subvalvular (alargamiento o retracción de cuerdas, rotura o disfunción de músculos papilares) o en el miocardio ventricular (disfunción global o segmentaria). En los países desarrollados la mayor parte de las IM significativas son de origen degenerativo y/o isquémico.
La IM crónica, aunque inicialmente suele ser asintomática y bien tolerada, con el tiempo conduce a dilatación ventricular, disfunción sistólica del VI, fibrilación auricular e insuficiencia cardíaca. El seguimiento ecocardiográfico y clínico estrecho permite identificar a pacientes con pocos síntomas pero mal pronóstico antes de que la disfunción ventricular establecida comprometa los resultados del tratamiento quirúrgico.
En la actualidad la cirugía reparadora es el tratamiento de elección en pacientes con IM y anatomía apropiada ya que se asocia a baja mortalidad (1-2%) y buenos resultados en pacientes de bajo riesgo con función ventricular conservada. No obstante, la reparación no es posible en todos los pacientes requiriendo algunos la implantación de una prótesis, lo que implica una mayor morbimortalidad a corto y a largo plazo. Por otra parte, muchos pacientes con indicación quirúrgica son desestimados para cirugía mitral (reparación o prótesis) por considerarse de alto riesgo por disfunción ventricular severa o comorbilidad asociada. Algunos de estos pacientes mejoran con la resincronización cardíaca pero otros permanecen en mala situación funcional y con un pronóstico vital malo. Estos pacientes podrían beneficiarse del tratamiento percutáneo de su IM.
Tratamiento percutáneo de la insuficiencia mitralLa reparación quirúrgica de la válvula mitral se realiza mediante varias técnicas, habitualmente combinadas, entre las que se incluyen la resección del tejido valvular redundante, la reducción del tamaño del anillo mitral, la reparación y reinserción de cuerdas y la aproximación del borde libre de las valvas para favorecer su coaptación (técnica de Alfieri).
Las técnicas percutáneas dirigidas al tratamiento de la IM están mucho menos desarrolladas que las quirúrgicas y hasta la fecha dirigidas a 3 objetivos terapéuticos:
- 1.
Aproximación de las valvas anterior y posterior (similar a la técnica de Alfieri) mediante el dispositivo MitraClip® (Abbot Vascular, Abbot Park, IL, USA) comercializado en Europa desde 2008 y del que se dispone de una información considerable.
- 2.
Reducción del tamaño del anillo mitral por medio del acortamiento del longitudinal del seno coronario dada su accesibilidad y cercanía al anillo mitral (anuloplastia indirecta). Varios de estos dispositivos se han utilizado ya en humanos con diversas indicaciones en estudios de factibilidad y seguridad aunque ninguno de ellos está comercializado.
- 3.
Desarrollo de una prótesis para implantación por vía anterógrada transeptal en fase de desarrollo muy inicial (experimentación animal).
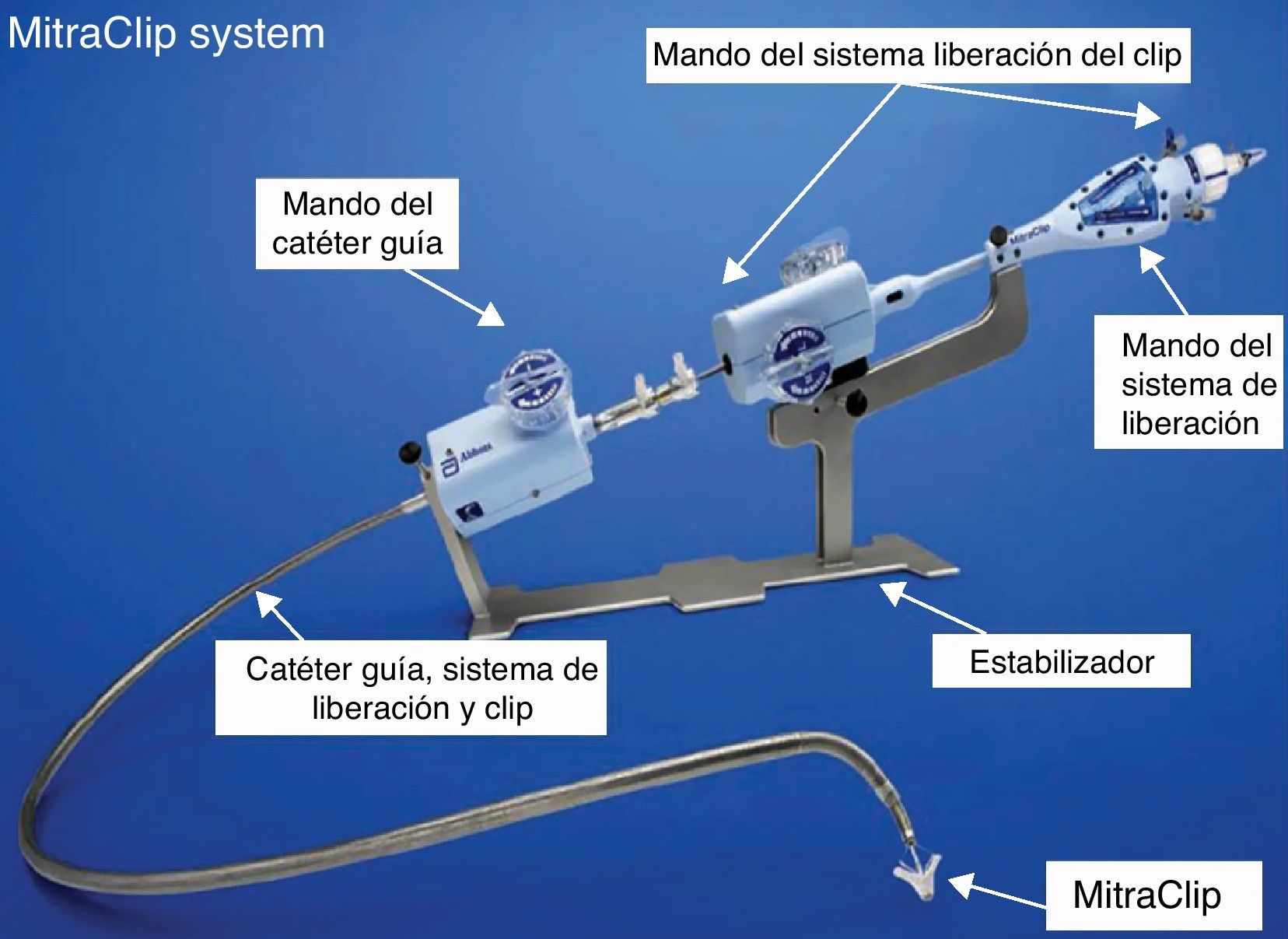
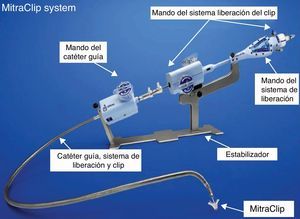
El sistema completo está compuesto por el dispositivo, el catéter guía y el sistema de liberación.
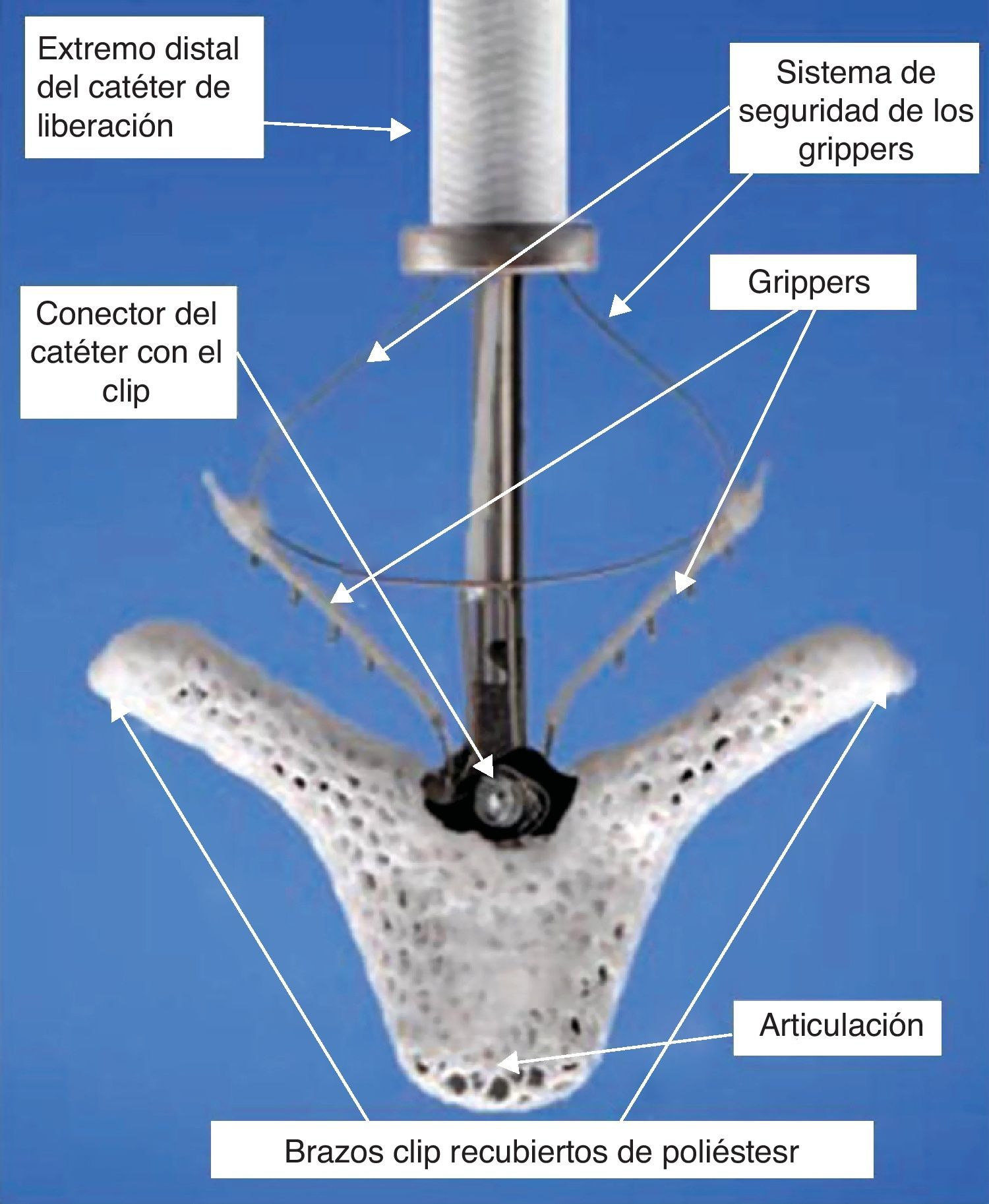
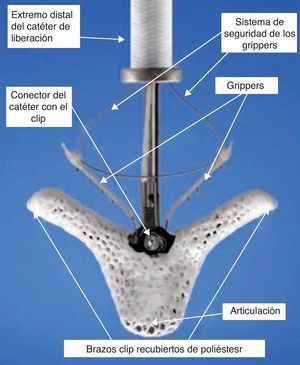
El dispositivo MitraClip® (fig. 1) es de cromo cobalto y esta recubierto de poliéster para favorecer la formación de un puente de tejido fibroso entre ambas valvas. Tiene 2 brazos articulados que se mueven de forma simétrica y cuyo ángulo de apertura varía entre 0 (posición cerrada) y 240° (posición de reversión). Cada brazo en su parte interna tiene un gripper o gancho que le permite atrapar tejido valvular. Cuando ambos brazos han capturado tejido valvular el dispositivo se deja en posición de cierre con lo que se consigue la aproximación de los velos.
El sistema de liberación (fig. 2) se compone de: 1) un catéter guía de 24 F con punta móvil para ayudar a dirigir el dispositivo; 2) el dispositivo que se introduce a través del catéter guía y que es también deflectable en múltiples direcciones; 3) el estabilizador donde se apoyan los mandos del catéter guía y del dispositivo y que previene los movimientos indeseables del sistema, y 4) en la parte más proximal se encuentran los mandos que permiten la apertura y cierre de los grippers así como los movimientos y la liberación final del MitraClip®.
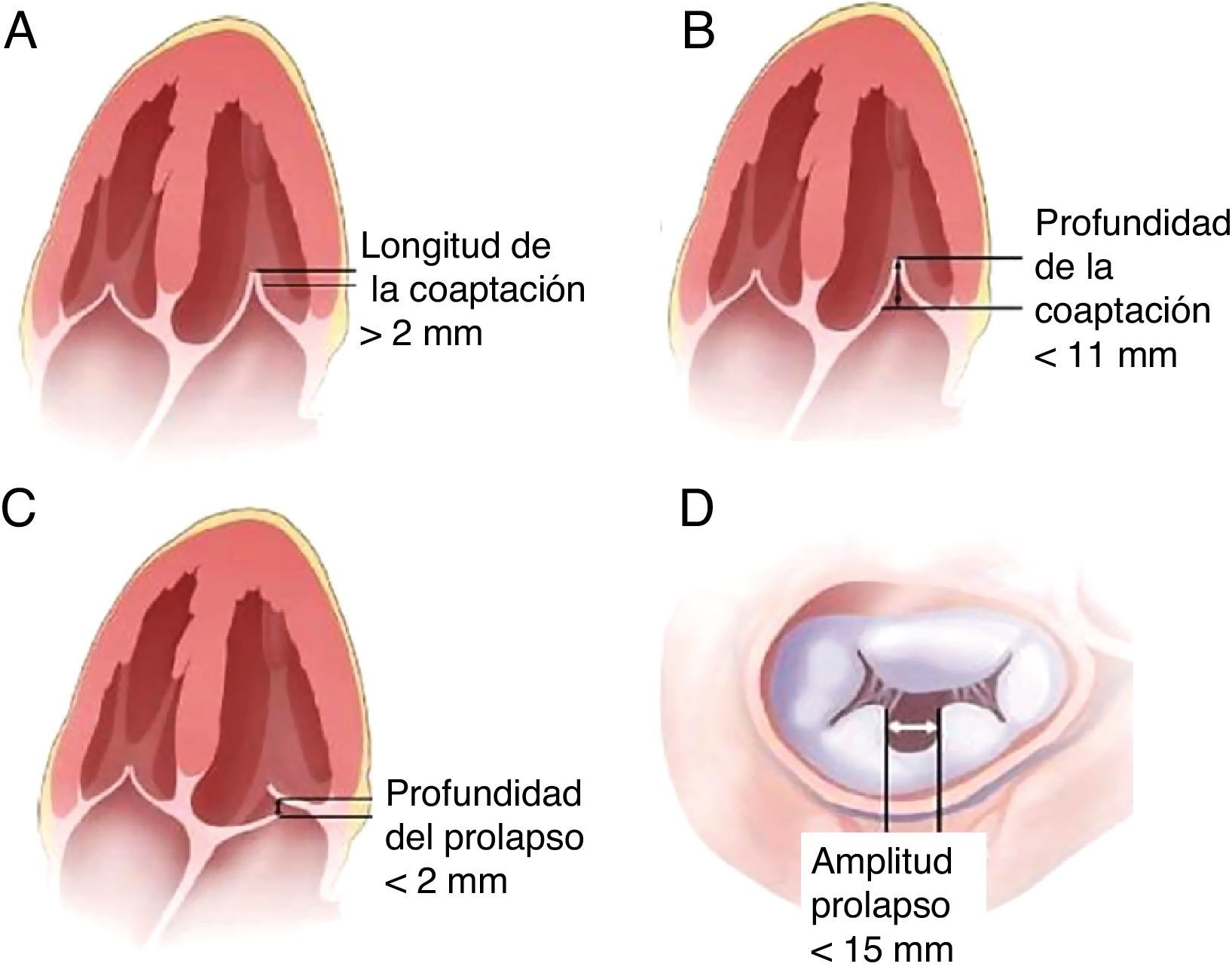
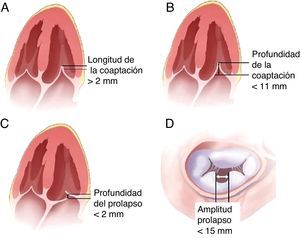
Criterios anatómicos de elegibilidadNo todas las válvulas son aptas para esta técnica. Los requisitos anatómicos se detallan en la figura 3.
- •
Regurgitación central entre A2 y P2.
- •
Ambas valvas móviles y no calcificadas.
- •
Coaptación de velos>2mm.
- •
Profundidad de la coaptación con respecto al plano mitral<11mm.
- •
Si existe un flail este debe ser menor de 10mm y con una profundidad de coaptación<15mm.
- •
Área mitral>4cm2.
La finalidad de la técnica es la aproximación de los festones A2 y P2 de las valvas anterior y posterior, creando un doble orificio mitral en diástole y una válvula competente en sístole.
El procedimiento ha de realizarse con anestesia general dada la necesidad de la inmovilización total del paciente, y con heparinización completa (ACT de 250-300). El eco transesofágico (ETE) 2D, y preferiblemente también 3D, es la principal guía y por tanto imprescindible desde el principio al fin del procedimiento.
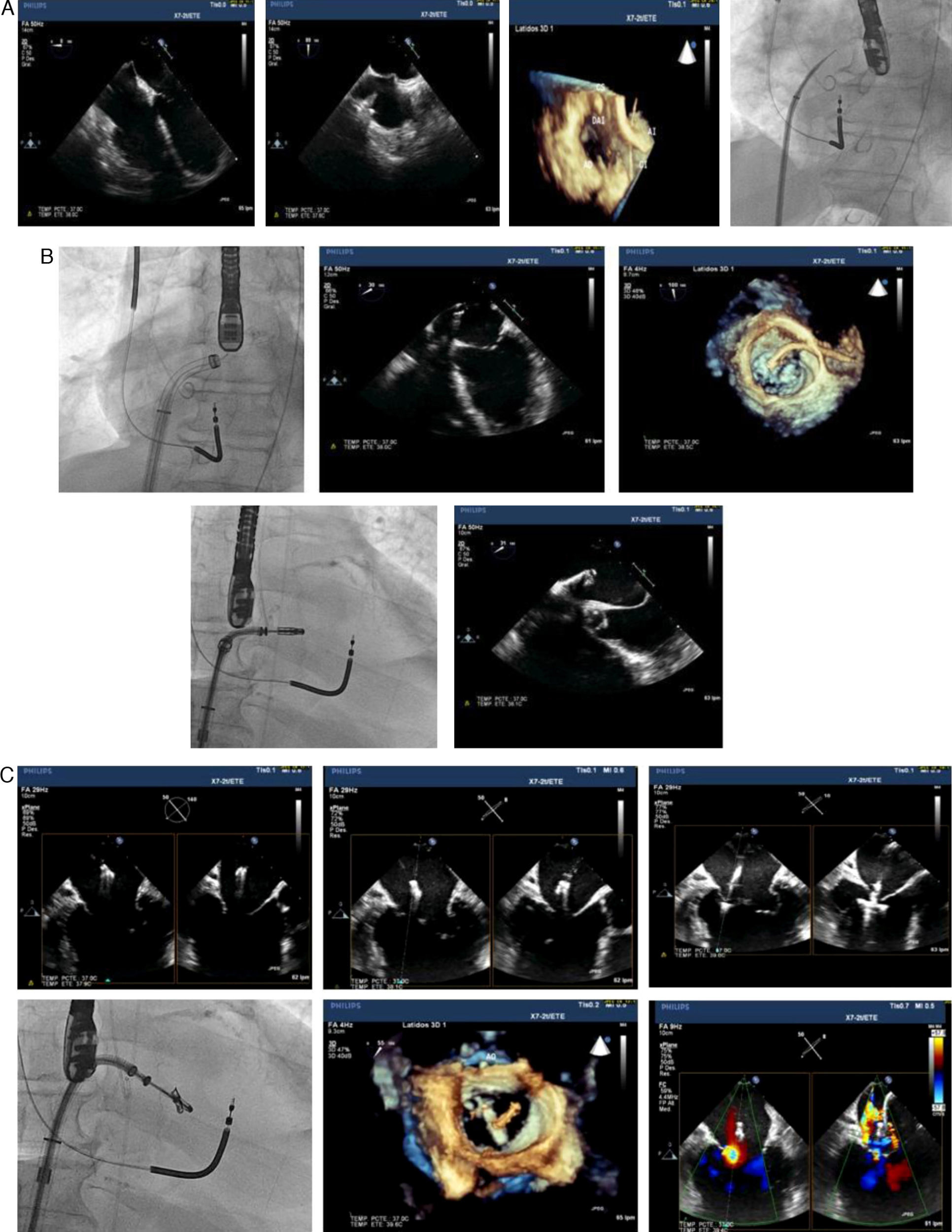
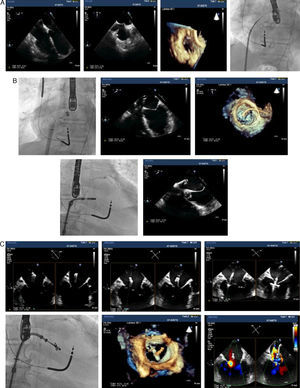
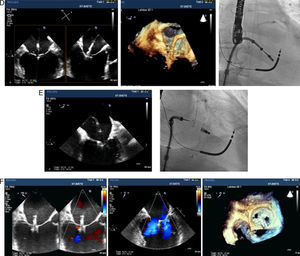
El abordaje es a través de la vena femoral derecha y requiere una punción transeptal que debe realizarse guiada por ETE en la porción más superior y posterior de la fosa oval (fig. 4A) con el objeto de permitir una distancia suficiente hasta el plano mitral para poder maniobrar el sistema.
Tras la punción transeptal se avanza el catéter guía hasta la aurícula izquierda y a su través el sistema de liberación que se posiciona en la parte distal del catéter guía (fig. 4B). En ese punto se inician una serie de maniobras de acercamiento al plano mitral (fig. 4C) de forma que el dispositivo atraviese el plano mitral de forma perpendicular, en su parte central y con los brazos del MitraClip® abiertos. Una vez en el ventrículo se gira el dispositivo hasta que los brazos están perpendiculares a la línea de coaptación de ambas valvas. Se inicia entonces la retirada del mismo con los brazos del dispositivo abiertos buscando el contacto de cada uno de los brazos con la parte inferior del borde libre de cada una de las valvas (fig. 4D). Obtenido el contacto, se bajan los clippers con lo que el tejido valvular queda atrapado entre cada brazo y su clipper correspondiente. Se cierra entonces el dispositivo con el consiguiente acercamiento de los tejidos valvulares enganchados en cada brazo (fig. 4E).
Una vez comprobada por ETE la correcta posición del dispositivo, la reducción del grado de IM y la ausencia de gradiente transmitral significativo, se libera el dispositivo (fig. 4F) y se retira el sistema de liberación. En casos de IM residual se puede colocar un segundo dispositivo que será liberado una vez realizados los controles antes mencionados.
Posteriormente se retira el catéter guía, se revierte la heparina y se realiza hemostasia en el sitio de punción. La duración total del procedimiento depende del caso y la experiencia del operador (unas 4 h para operadores con poca experiencia, unos 120 min para operadores expertos y casos sencillos).
En algunos pacientes no se consigue colocar el dispositivo. Estos fallos técnicos dependen de la anatomía valvular y de la experiencia del operador. Utilizando criterios estrictos de selección de pacientes y con experiencia los fallos técnicos ocurren en<5% de los pacientes.
Las complicaciones generales del procedimiento son escasas y se relacionan con la punción transeptal, la utilización de guías rígidas (taponamiento), la duración del procedimiento (problemas trombóticos) y el tamaño los introductores (complicaciones vasculares). La mayoría pueden prevenirse con una técnica rigurosa. Las complicaciones específicas incluyen la pérdida de contacto de uno de los velos, la embolización y el daño a estructures valvulares y subvalvulares. La comprobación exhaustiva de la posición del MitraClip® antes de la liberación es indispensable para prevenir estos problemas.
Resultados inmediatos y a medio plazoEl registro EVEREST I incluyó 27 pacientes y demostró la factibilidad del procedimiento (82% de implantación) con reducción significativa de la IM al año en el 60% de los pacientes que recibieron el dispositivo. El fallo técnico inicial y la pérdida de contacto de uno de los velos (desenganche parcial) fueron las principales causas de la falta de efectividad del dispositivo.
En el estudio EVEREST II, 279 pacientes con IM de etiología mayoritariamente degenerativa y riesgo quirúrgico intermedio/bajo fueron aleatorizados 2:1 frente a cirugía de reparación o reemplazo mitral. Al año las tasas de mortalidad (6% en ambos grupos) e insuficiencia mitral III/IV (21 y 20%, respectivamente) fueron similares en ambos grupos si bien la necesidad de cirugía fue mayor (20 vs. 2%) en el grupo MitraClip®. En los pacientes asignados a grupo percutáneo y que requirieron cirugía la reparación mitral fue posible en la mayoría. En ambos grupos se observó una mejoría similar en el grado funcional y en la reducción de los diámetros ventriculares. A los 2 años (ACC Late Braking Clinical Trials en Nueva Orléans, 14 de abril de 2011) tanto la mortalidad (11 y 10,8%) como la persistencia de IM severa fue similar (19,8 vs. 21,7%) en ambos grupos siendo la necesidad de cirugía mayor (22 vs. 3,6%) en los pacientes tratados de forma percutánea. Como puede observarse la mayoría de las cirugías del grupo MitraClip® ocurrieron en el primer año.
En el año 2008 el dispositivo fue comercializado en Europa donde se ha utilizado fundamentalmente en pacientes con IM de origen predominantemente isquémico o degenerativo y alto riesgo quirúrgico. Los resultados en estos pacientes forman parte del registro ACCESS EU cuyos resultados globales no están todavía disponibles. Los resultados iniciales de alguno de los centros más activos sí se han comunicado mostrando una tasa de éxito del 95% con el uso de uno o más dispositivos, reducción significativa de la IM con IM residual<3 en más del 90%, reducción de los diámetros del VI y mejoría clínica significativa con 2/3 de los pacientes en clase funcional I o II. En la actualidad hay más de 100 centros en Europa están implantando este dispositivo. A finales de abril de 2012 se habían implantado ya 5.000 dispositivos en el mundo, 4.200 de ellos en Europa.
Con la información disponible hasta la fecha podemos concluir que el procedimiento es factible en un elevado porcentaje de pacientes con anatomía apropiada, que las complicaciones son infrecuentes, que la efectividad en reducir la insuficiencia mitral es alta aunque menor que la cirugía y que los resultados se mantienen a 2 años, si bien no hay datos de seguimiento a más largo plazo.
¿Cuáles son hoy en día las indicaciones del procedimiento?Dados los buenos resultados de la cirugía de reparación mitral hoy en día se considera que éste es el tratamiento de elección en los pacientes con IM moderada/severa, datos clínicos o ecocardiográficos de repercusión hemodinámica, anatomía apropiada para reparación y bajo riesgo quirúrgico.
El MitraClip® quedaría por tanto reservado para aquellos pacientes con:
- •
IM moderada/severa de origen degenerativo o funcional (isquémica y no isquémica).
- •
Repercusión hemodinámica (síntomas, dilatación ventricular, etc.).
- •
Alto riesgo quirúrgico (disfunción ventricular, cirugía coronaria previa, etc.).
- •
Anatomía apropiada para MitraClip®.
La implantación del dispositivo MitraClip® es una nueva opción terapéutica para pacientes con IM degenerativa o funcional debido a un jet central. En pacientes que cumplen los criterios anatómicos descritos, el procedimiento es relativamente seguro y efectivo a corto-medio plazo tanto en lo referente a mejoría sintomática como en la reducción de los volúmenes ventriculares. Sin embargo, no se dispone de información sobre la durabilidad a largo plazo de los resultados por lo que la técnica debe ser reservada para aquellos pacientes inoperables o con alto riesgo quirúrgico.