Los datos epidemiológicos revelan un aumento de la prevalencia de la insuficiencia cardíaca (IC) en nuestro país, encontrándose globalmente en un 6,8%, y una incidencia anual del 1% en pacientes mayores de 65 años. La mortalidad de esta enfermedad alcanza el 50% a los 5 años, aun con tratamiento médico adecuado. Si bien se han logrado grandes avances en el tratamiento mediante el bloqueo farmacológico neurohormonal, éste parece haber alcanzado el límite de sus posibilidades en muchos pacientes. Desde el punto de vista quirúrgico las remodelaciones cardíacas y otros dispositivos solamente obtienen resultados discretos. Los estudios experimentales mediante miogénesis podrían convertirse en una alternativa, pero aún se encuentran en fase de desarrollo. Así, el trasplante cardíaco es la terapia con mejores resultados pero con gran limitación en la disponibilidad de injertos. Tras el estudio comparativo entre tratamiento médico óptimo e implante de asistencia ventricular en pacientes con IC avanzada (REMATCH) se ha abierto una nueva alternativa de tratamiento, aunque con resultados discretos. Se ha obtenido mejor supervivencia en aquellos pacientes tratados con asistencia ventricular, e incluso con mejores resultados en los pacientes incluidos más tardíamente en el estudio, posiblemente por mayor experiencia clínica. Podríamos concluir que se han mejorado dispositivos existentes disminuyendo sus fallos estructurales y han aparecido nuevas alternativas que intentan resolver los problemas fundamentales de esta terapia, así como intentos de unificación de criterios en los tratamientos anticoagulantes y antiagregantes plaquetarios y profilaxis antibiótica más agresiva.
Epidemiological data reveals an increase in the prevalence of the congestive heart failure in our country, currently 6,8% and an annual incidence of 1% in patients older than 65 years. the mortality of this pathology reaches 50% at 5 years even with appropriate medical treatment. Although important developments have been observed in the treatment through pharmacological neurohormonal blockade, it seems it has reached the limit of its possibilities in many patients. From a surgical point of view, surgical reshaping of the dilated heart and other devices only get discreet results. Experimental studies through myogenesis could be an alternative, but they are still in developmental phase. Therefore, cardiac transplantation is the alternative with best results but with a major limitation in graft availability. Following the comparative study between optimal medical treatment and left ventricular assist device (LVAD) in patients with heart congestive failure advanced (REMATCH) a new alternative has been opened with discreet results, although better survival in those patients treated with LVADs and even with better results in those patients who came into the study later on, probably due to more clinic experience. We can conclude that devices have improved, decreasing structural failures. There are new alternatives that try to solve main problems of this therapy as well as to unify criteria in anticoagulation treatment, antiplatelet therapy and most aggressive antibiotic prophylaxis.
En términos epidemiológicos podemos considerar la IC como la tercera causa de muerte en nuestro país. Según el estudio PRICE la prevalencia ponderada se encuentra en un 6,8%, con afectación similar en varones que en mujeres (6,5 y 7%, respectivamente). La distribución por edades es del 1,3% entre los 45–54 años; del 5,5% entre los 55–64 años; el 8% entre los 65–74 años, y el 16,1% en personas de 75 o más años. La incidencia aumenta con la edad alrededor del 1% anual en la población mayor de 65 años, siendo la primera causa de hospitalización en este grupo de pacientes, alcanzando las 74.000 hospitalizaciones/año. Así pues, es preciso considerarla como un proceso progresivo y letal, aun con tratamiento médico adecuado alcanza una mortalidad del 50% a los 5 años1,2.
El tratamiento farmacológico actual está basado en los grandes avances realizados en las dos décadas pasadas, reconociendo que la progresión del fallo cardíaco viene determinada por la estimulación neurohormonal. Así pues, los fármacos que bloquean esta respuesta (inhibidores de la enzima convertidora de la angiotensina, β-bloqueadores e inhibidores de la aldosterona) han demostrado una mejoría en la supervivencia y calidad de vida por la detención o enlentecimiento de estos mecanismos3,4. Por otro lado, recientes estudios revelan que un bloqueo excesivo de la activación neurohormonal podría ser inefectivo e incluso perjudicial, asumiéndose que el tratamiento farmacológico actual estaría alcanzando sus límites en muchos pacientes5,6. También se han desarrollado tratamientos como la terapia de resincronización cardíaca, implante de desfibriladores, así como estudios experimentales en el campo de la miogénesis cardíaca mediante implantes de células madre, y otros estudios mediante terapias eléctricas en los que hay depositadas grandes expectativas7,8. Algunos procedimientos quirúrgicos, como la remodelación miocárdica, cardiomioplastia y dispositivos externos solamente han logrado resultados discretos, siendo el trasplante cardíaco la mejor alternativa en términos de calidad y cantidad de vida, aunque con grandes limitaciones en su disponibilidad, por lo que son requeridos criterios de selección exigentes, no respondiendo a las necesidades actuales9.
Selección de pacientes para la asistencia circulatoria como terapia definitivaLos datos más valiosos de los que se dispone en la actualidad sobre esta terapia provienen de varias fuentes:
- –
Estudio REMATCH (Randomized Evaluation of Mechanical Assistance for the Treatment of Congestive Heart Failure)10. En él se comparan los resultados de pacientes en IC avanzada mediante dos grupos: uno con tratamiento médico óptimo y el otro con asistencia ventricular (AV).
- –
Estudio INTrEPID (Investigation of Nontrans-plant-Eligible Patients Who Are Inotrope Dependent). Similar al anterior, pero no aleatorizado11.
- –
Criterios para el implante de AV como terapia definitiva de la División de Cardiología de la Universidad de Columbia12.
- –
Recomendaciones de la ISHLT (International Society for Heart and Lung Trasplantation)13.
Si bien los autores difieren en algunos criterios como la fracción de eyección del ventrículo izquierdo (FEVI), el resto presentan gran similitud. Puede concluirse que los investigadores han seguido unos criterios de inclusión similares a los utilizados para la indicación de trasplante cardíaco, pero difieren los de exclusión.
Criterios de inclusión- –
Pacientes no candidatos para trasplante cardíaco con IC crónica.
- –
Clase funcional IV de la NYHA durante al menos 90 días a pesar de tratamiento médico óptimo (diuréticos, digoxina, inhibidores de la enzima convertidora de la angiotensina).
- –
Fracción de eyección del ventrículo izquierdo inferior a 0,25 con tratamiento óptimo.
- –
Pico de consumo de O2 inferior a 12ml/kg/min, alcanzando el umbral anaeróbico o imposibilidad de retirada de fármacos inotrópicos endovenosos durante los 14 días previos a la decisión del implante.
- –
Fallo cardíaco secundario a enfermedades tiroideas no corregidas, miocardiopatía obstructiva, enfermedades pericárdicas, amiloidosis o miocarditis activa.
- –
Contraindicaciones técnicas.
- –
Ratio internacional normalizada (INR) superior a 1,3 o tiempo de protrombina superior a 15 s durante las 24h anteriores al implante.
- –
Superficie corporal inferior a 1,5m2 (posibilidad de dispositivo de flujo continuo).
- –
Índice de masa corporal superior a 40.
- –
EPOC con volumen espiratorio forzado igual o inferior a 1,5l/min.
- –
Embarazo.
- –
Hipertensión pulmonar por resistencia vascular fija igual o superior a 8U Wood que no responden al tratamiento en los 90 días previos.
- –
Paciente con otras posibilidades quirúrgicas convencionales.
- –
Antecedentes de trasplante cardíaco, cardiomioplastia o reducción ventricular.
- –
Presencia de prótesis valvular aórtica mecánica que no es posible sustituir por una biológica en el momento del implante del dispositivo.
- –
Enfermedad hepática con transaminasa oxalacética glutámica (GOT), transaminasa pirúvica glutámica (GPT) o bilirrubina (BLR) total superior a cinco veces el valor normal 4 días antes del implante.
- –
Accidente cerebrovascular (ACV) en los 90 días anteriores al implante o enfermedad carotídea superior al 80%.
- –
Presencia de enfermedad de Alzheimer u otra demencia irreversible.
- –
Aneurisma abdominal superior a 5cm.
- –
Sospecha o infección activa sistémica 48h antes del implante.
- –
Recuento plaquetario inferior a 50.000/mm3 24h antes del implante.
- –
Creatinina superior a 3,5mg/dl o diálisis crónica.
- –
Enfermedad vascular periférica con lesiones isquémicas en MMII.
- –
Tratamiento durante los 28 días anteriores al implante con β-bloqueadores de los canales del calcio (excepto amlodipino), quinidina, procainamida, disopiramida, encainida, flecainida, propafenona o morocizina.
- –
Intervención abdominal prevista.
- –
Historia reciente de enfermedades psiquiátricas, incluyendo abuso de alcohol y drogas, así como dificultad para entender los cuidados y signos de alerta tras el implante del dispositivo.
- –
Presencia de otra enfermedad que limite la supervivencia a menos de 3 años10–12.
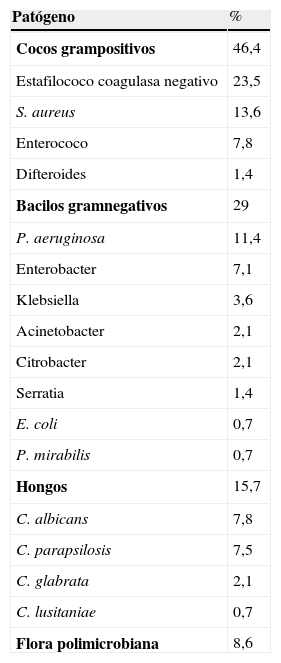
La infección continúa siendo uno de los mayores problemas y origen de fracaso tras el implante de una AV. La incidencia de las infecciones nosocomiales alcanza en estos pacientes un 49%, siendo un 38% las relacionadas con el dispositivo (superficie interna, externa y línea de alimentación eléctrica o neumática). Las alteraciones inmunológicas tras el implante de una AV parecen desempeñar un papel importante en la predisposición de estos pacientes a sufrir infecciones14. Por otra parte, es preciso prestar gran atención a aquellos gérmenes productores de biocapa (biofilm) (matriz polimérica generada por una serie de gérmenes y que rodea protegiendo a una colonia del sistema de defensa del organismo y de los antibióticos). Tienen la capacidad de fijarse tanto a superficies inertes como vivas. Los gérmenes que con mayor frecuencia se encuentran involucrados en las infecciones de dispositivos de AV aparecen en la tabla I, y son hacia los que se dirige la profilaxis antibiótica15.
Distribución De Gérmenes Productores De Infección En Pacientes Con AV
| Patógeno | % |
| Cocos grampositivos | 46,4 |
| Estafilococo coagulasa negativo | 23,5 |
| S. aureus | 13,6 |
| Enterococo | 7,8 |
| Difteroides | 1,4 |
| Bacilos gramnegativos | 29 |
| P. aeruginosa | 11,4 |
| Enterobacter | 7,1 |
| Klebsiella | 3,6 |
| Acinetobacter | 2,1 |
| Citrobacter | 2,1 |
| Serratia | 1,4 |
| E. coli | 0,7 |
| P. mirabilis | 0,7 |
| Hongos | 15,7 |
| C. albicans | 7,8 |
| C. parapsilosis | 7,5 |
| C. glabrata | 2,1 |
| C. lusitaniae | 0,7 |
| Flora polimicrobiana | 8,6 |
La aparición de la infección suele ser en los primeros 30 días, aunque también aparecen más tardíamente. Los gérmenes gramnegativos son los más precoces con 19 días, grampositivos 24 días y 28 para los hongos16. La prevención es la principal herramienta en el control de este problema, y para ello se recomienda: optimizar el estado nutricional del paciente, sustituir vías venosas, arteriales, etc. con más de 5–7 días y tratar las contaminaciones nasales de S. aureus y una evaluación microbiológica meticulosa.
Profilaxis antibiótica- –
Vancomicina, 15mg/kg ev. 1h antes de la intervención y continuar con una dosis cada 12h durante las siguientes 48h.
- –
Levofloxacino, 500mg ev. 1h antes de la cirugía y continuar con una dosis cada 24h durante las siguientes 48h. Otra alternativa es trovafloxacino 400mg ev. 1h antes de la intervención, para continuar con una dosis cada 24h las siguientes 48h.
- –
Rifampicina, 600mg v.o. 1–2h antes de la intervención y continuar con una dosis cada 24h durante 48h más.
- –
Fluconazol, 200mg ev. 1h antes de la intervención y continuar cada 24h durante las siguientes 48h.
- –
Mupirocina aplicada nasalmente la mañana antes de la intervención (opcional).
Los resultados publicados del estudio REMATCH revelan una supervivencia de aquellos pacientes libres de infección a 1 año del 60%, frente a un 39% de aquellos que sí la presentaron; a los 2 años la supervivencia fue del 38%, frente a un 8%, respectivamente. Las infecciones que aparecieron en las líneas de alimentación del dispositivo o en la bolsa de éste no afectaron a la supervivencia, encontrándose la mayor incidencia en las primeras 3 semanas tras el implante17.
Si bien el protocolo de profilaxis antibiótica mencionado previamente es el recomendado de forma global, es precisa una evaluación microbiológica individualiza-da y una adaptación de este protocolo a la flora de cada centro si fuese necesario.
Manejo de la anticoagulación y antiagregaciónLa hemorragia es la complicación más frecuente tras el implante de una AV izquierda. La necesidad de reintervenciones alcanza entre el 40–60%, independientemente del dispositivo utilizado o la indicación de éste. La necesidad de politransfusiones determina complicaciones infecciosas, respiratorias, fallo ventricular derecho, e incluso complica en algunos casos la indicación de trasplante debido a la sensibilización que estas politransfusiones pueden originar, aumentando la morbilidad y la mortalidad.
Optimización preoperatoriaTras una primera evaluación se debe optimizar el paciente mediante transfusiones, administración de vitamina K y vitamina C, e incluso utilizar inotrópicos si es preciso para mejorar en lo posible la función ventricular derecha, disminuir la presión venosa central y congestión hepática hasta optimizarla. Las determinaciones y correcciones recomendadas son:
- –
Recuento plaquetario superior a 150.000.
- –
Tiempo de protrombina inferior a 16 s.
- –
Tiempo de tromboplastina parcial activado inferior a 40 s.
- –
Hemoglobina superior a 11g/dl.
- –
Albumina superior a 2,5g/dl.
- –
Presión venosa central inferior a 16mmHg.
- –
Vitamina K: 10mg/8 h sc.
- –
Vitamina C: 250mg/12 h v.o.
- –
Suspender (si es posible):
- •
Aspirina. AINE, heparina de bajo peso molecular.
- •
Dicumarínicos, cefalosporinas, penicilinas y ranitidina.
- •
En la insuficiencia renal con creatinina superior a 2mg/dl es aconsejable la utilización preoperatoria de desmopresina con el fin de optimizar la función plaquetaria.
Estrategia postoperatoriaEl implante de una AV presenta gran tendencia a las coagulopatías, siendo preciso practicar evaluaciones cada 4h de tiempo parcial de tromboplastina activada (APTT), INR, recuento plaquetario y fibrinógeno, así como su corrección si es preciso para alcanzar valores en el postoperatorio inmediato:
- –
Tiempo de protrombina inferior a16 s.
- –
Ratio internacional normalizada inferior a 1,5.
- –
Tiempo de tromboplastina parcial activada inferior a 40 s.
- –
Recuento plaquetario superior a 150.000mm3.
- –
Fibrinógeno superior a 100mg/dl.
En situaciones de gran dificultad para el control de hemorragia postoperatoria se ha utilizado factor VII recombinante con buenos resultados18.
Se han publicado diferentes pautas de anticoagulación y antiagregación dependiendo de los centros y de los dispositivos utilizados, no existiendo en la actualidad un protocolo generalizado, ya que depende de la experiencia de los centros en muchos casos (Tabla II). Si bien los protocolos de anticoagulación son similares entre los diferentes autores y dispositivos (excepto para HeartMate®, sólo es necesaria la antiagregación plaquetaria), las pautas de antiagregación difieren, aunque en la actualidad y debido a diferentes respuestas de pacientes a este tratamiento se debe ajustar de forma individual con las diferentes pruebas de agregación. Dependiendo del genotipo P1A puede observarse una respuesta a este tratamiento muy diferente19. Así, algunos fabricantes hacen recomendaciones para protocolizar la antiagregación plaquetaria ajustando dosis de forma individual y basada en los resultados de las mencionadas pruebas, recomendándose seguir el siguiente protocolo:
- –
Comenzar el primer día postoperatorio si el débito por los drenajes torácicos es inferior a 100cc/8 h y el recuento de plaquetas superior a 100.000.
- –
Iniciar antiagregación con AAS.
- •
Dosis inicial: AAS 100mg.
- •
Ajuste de dosis según PFA-100* es un dispositivo de análisis de función plaquetaria y estudio de antiagregación con ácido araquidónico (el objetivo es conseguir una agregación con ácido araquidónico < 30%).
- •
Si la antiagregación con AAS es inadecuada (PFA - agregación ácido araquidónico - amplitud del tromboelastograma > 80mm) se pautará clopidogrel 75mg/24 h.
- •
Protocolos De Anticoagulación Y Antiagregación Plaquetaria En Pacientes Con AV
| HeartMate® VE | Novacor® | Berlin Heart (INCOR®) | LionHeart® | Thoratec® implantable | |
| El-Banayosy A21 | Sin anticoagulación las primeras 24hHeparina sódica en perfusión para APTT 1,5 el controlA semana 2 de la intervención iniciar AAS v.o. 1mg/kg de peso | Sin anticoagulación las primeras 24hHeparina sódica en perfusión para APTT 1,5 el controlTras retirada de drenajes torácicos iniciar dicumarínicos para INR 2,5–3,5A la semana 2 de la intervención iniciar AAS v.o. 1mg/kg de peso | Sin anticoagulación las primeras 24hHeparina sódica en perfusión para APTT 40–50 s las primeras 24h y posteriormente 50–60 sTras retirada de drenajes torácicos iniciar dicumarínicos para INR 2,5–3,5A la semana 2 de la intervención iniciar AAS v.o. 1mg/kg de peso | ||
| Hetzer R20 | Tras la corrección de la coagulación se inicia heparina sódica para APTT de 60–80 sTras retirada de drenajes torácicos iniciar dicumarínicos para INR 3,5AAS, dipiridamol y clopidogrel ajustando la dosis para alcanzar un test de agregación plaquetaria (adenosina y ácido araquidónico) alrededor del 30% | ||||
| Koster A22 | Tras corrección completa de la coagulación (entre 6–12h postoperatorias) iniciar heparina sódica para alcanzar el tiempo de coagulación activado entre 160–180 s y tras retirada de drenajes torácicos:
| ||||
| Slaughter MS23 | Heparina sódica en perfusión para APTT 1,5 el control (1.o–2.o día post)Tras retirada de drenajes torácicos iniciar dicumarínicos para INR 2,5– 3,5+AAS y dipiridamol (en algunos pacientes) |
v.o.: vía oral.
La gran experiencia acumulada con dispositivos de larga duración en el tratamiento como puente al trasplante ha permitido evaluarlos también como terapia definitiva, aunque revisaremos otras experiencias con distintas AV que podrían ser utilizadas en el futuro en esta misma terapia (Tabla III).
Características Y Resultados De Dispositivos En Evaluación Para Terapia De Destino
| Dispositivos pulsátiles | Resultados y características |
| Novacor®(WorldHeart Inc, Salt Lake City, Utah, USA) | Estudio comparativo con HeartMate® VE como puente al trasplante. No se ha observado diferencia de supervivencia, aunque sí mayor número de fenómenos tromboembólicos en el Novacor® frente a un mayor número de infecciones en el HeartMate® VECorrecciones de la cánula del tracto de salida han disminuido los eventos tromboembólicosdel 21–12%21 |
| Thoratec® implantable(Thoratec Corporation, Pleasanton, California, USA) | Biventricular. Implante preperitonealEvaluado en estudio multicéntrico como puente al trasplante y poscardiotomía con supervivencia del 70 y 67%, respectivamente. No se observaron fallos estructurales. Tiempo medio de duración 101 días23 |
| LionHeart® LVD 2000(Arrow International, Reading, PA, USA) | Transferencia de energía transcutánea.Supervivencia a 18 meses del 50%, siendo el fallo multiorgánico la principal causa demuerte. No se observaron eventos adversos en relación con el dispositivo. Excesivotamaño27 |
| Dispositivos de flujo continuo | Resultados y características |
| HeartMate® II LVAS(Thoratec Corporation, Pleasanton, Calif) | Evaluado en estudio prospectivo multicéntrico con 133 pacientes como puente al trasplante 75% de supervivencia a 6 meses y 68% a los 12 meses. Causas de muerte FMO, ACV sepsis y un caso por fallo estructural. Dos casos de trombosis del dispositivo28 |
| Berlin Heart (INCOR®) | Levitación magnética, sin rozamientoPequeño tamaño. Experiencia inicial con 24 pacientes. Mortalidad a 30 días 8%. No seobservaron fallos estructurales. Se ha modificado la cánula de salida ventricular20 |
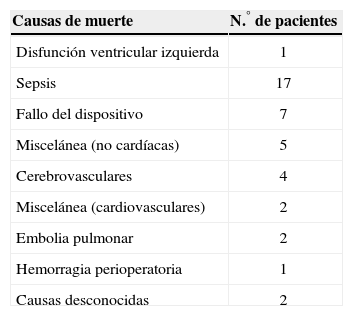
Estudio prospectivo, multicéntrico y aleatorizado a terapia medica óptima (61 pacientes) o al implante de AV HeartMate® VE (Thoratec, Pleasanton, California, USA) (68 pacientes). Las complicaciones graves observadas en el grupo tratado con AV, así como las causas de muerte, se encuentran encabezadas por la sepsis y la disfunción del dispositivo con un 41 y 17%, respectivamente (Tabla IV).
Causas De Mortalidad En El Estudio REMATCH
| Causas de muerte | N.° de pacientes |
| Disfunción ventricular izquierda | 1 |
| Sepsis | 17 |
| Fallo del dispositivo | 7 |
| Miscelánea (no cardíacas) | 5 |
| Cerebrovasculares | 4 |
| Miscelánea (cardiovasculares) | 2 |
| Embolia pulmonar | 2 |
| Hemorragia perioperatoria | 1 |
| Causas desconocidas | 2 |
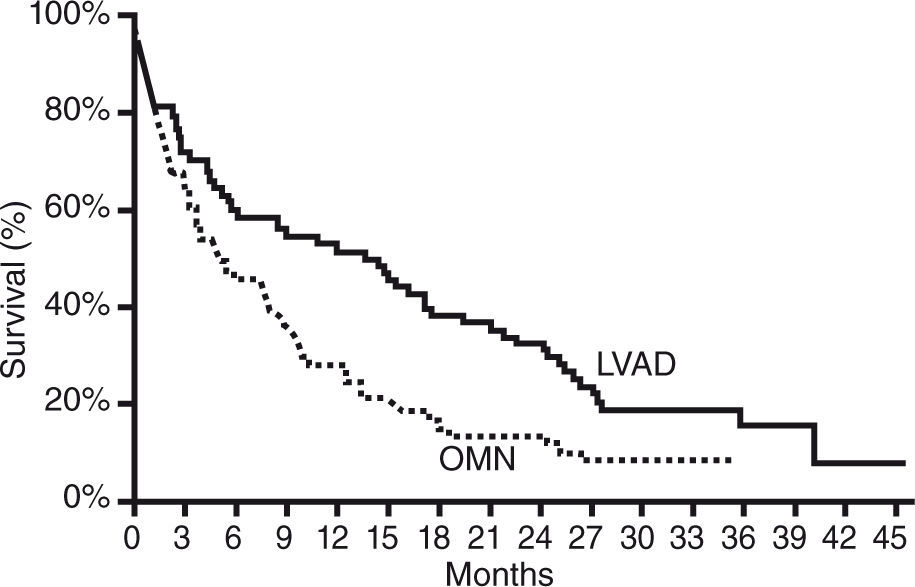
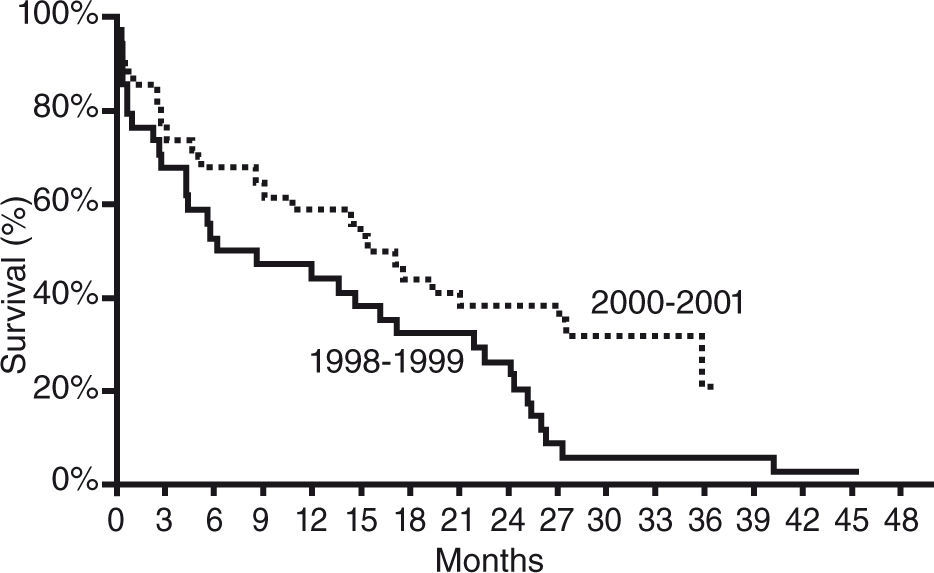
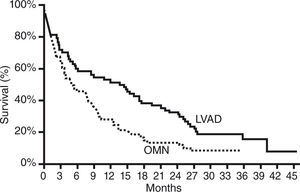
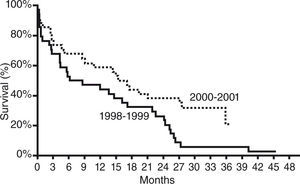
La comparación de la supervivencia y la calidad de vida a los 2 años fueron significativamente mejores en el grupo tratado con AV frente al tratamiento médico óptimo24. Durante el primer año de seguimiento sobre-vivieron el 52% de pacientes del grupo de la AV frente a un 25% en el brazo del tratamiento médico. Durante el segundo año el 23% del grupo de AV continuaban vivos frente a un 8% en el tratamiento médico (Fig. 1). Seguimientos posteriores en este estudio han demostrado una mejor supervivencia en aquellos pacientes que fueron incluidos más tardíamente en el estudio, posiblemente en relación con una experiencia clínica mayor25 (Fig. 2).
Como se ha especificado previamente, la segunda causa de mortalidad en el estudio REMATCH se encuentra en relación con fallos del dispositivo en un 17% de los casos, con una probabilidad de fallo a los 24 meses del 35%, y necesidad de ser sustituido en 10 pacientes. Se han evaluado los resultados de una serie de modificaciones en el dispositivo anterior HeartMate® VE, dando como resultado una nueva versión XVE. El estudio compara retrospectivamente el modelo original y el modelo mejorado con una tasa libre de fallos a 1 año en el modelo original del 76±6% frente a un 97±2% en el modelo modificado25.
ComentarioPreviamente, se han comentado las diferentes posibilidades terapéuticas en la IC, pero con gran dificultad para dar respuesta a un número creciente de pacientes1,2 en los que han agotado las posibilidades de tratamiento. Tras el estudio REMATCH se ha intentado dar soluciones mediante el implante de una AV comparándola con la terapia médica óptima; aun con mejores resultados que ésta, los resultados revelan el fallo estructural de los dispositivos como una de las causas de fracaso, así como la infección y los problemas de anticoagulación (hemorrágicos y tromboembólicos)10. El fallo ventricular derecho es otra de las grandes complicaciones que presenta este tratamiento y que determina pobres resultados.
Si bien éstos son los problemas más importantes observados, también es cierto que parecen resueltos en gran medida, aunque no en un solo dispositivo. Tras este estudio se ha impulsado el desarrollo no solamente de los dispositivos sino también el de unificación de criterios en la toma de decisiones y protocolo médicos. Así, tenemos una serie de respuestas posibles para la mejora de este tratamiento:
- –
Recomendaciones generales para el implante de una AV.
- –
Profilaxis antibióticas y estudios microbiológicos meticulosos14.
- –
Protocolización de anticoagulación y sobre todo de antiagregación plaquetaria de forma individualizada19.
- –
Dispositivos con superficies internas especiales poco trombogénicas como HeartMate®.
- –
Mejoras estructurales en los dispositivos clásicos25.
- –
Intentos de disminución del fallo estructural mediante ausencia de rozamiento20.
- –
Sistemas completamente implantables sin comunicación con el exterior y transferencia cutánea disminuyendo el riesgo de infecciones26.
- –
Posibilidad de asistencia biventricular en fallo ventricular derecho asociado22.
- –
Posibilidad de implantes en pacientes con superficie corporal inferior a 1,5m2.
- –
Descenso significativo en los costes económicos globales tras el estudio REMATCH.
Ante estas expectativas parece razonable pensar en una futura consolidación de esta alternativa terapéutica en pacientes con fallo cardíaco.
PFA-100 valora la hemostasia dependiente de las plaquetas. Se valora la capacidad de un coágulo para ocluir una abertura de 150 μ en una membrana recubierta con colágeno (COL)-epinefrina (EPI) o COL-Adenosín difosfato (ADP). El PFA-100 es capaz de detectar el deterioro de la agregación de la plaqueta causado por AAS. La prueba de COL-EPI es muy sensible a todos los efectos de función plaquetaria, incluida la disfunción inducida por AAS; por el contrario, COL-ADP es insensible a los efectos de la administración de AAS por periodos cortos de tiempo. La prueba PFA-100 depende de la función plaquetaria, del factor Von Willebrand plasmático y del hematocrito. Un valor normal de PFA COL-EPI normal (< 183 s) excluye disfunción plaquetaria. Si está prolongado se hace el PFA de COL-ADP, que si es normal (< 122 s) indica que la alteración de la función de las plaquetas probablemente se deba a la AAS. Si ambas pruebas están prolongadas, puede deberse a anemia, trombocitopenia o alteración de la función plaquetaria por otra causa distinta de la AAS. Si se ha descartado anemia y trombocitopenia, podría deberse a otras alteraciones hereditarias o adquiridas de la función plaquetaria como la enfermedad de Von Willebrand20.