La infección de una endoprótesis de aorta abdominal es una patología potencialmente mortal, sobre todo si se produce en un paciente con un trasplante renal, ya que este hecho es excepcional. La perfusión del riñón trasplantado conservando la función renal supone un desafío quirúrgico importante, así como la necesidad de utilizar unas técnicas específicas para la perfusión de dicho riñón. Presentamos el caso de un paciente con un trasplante renal, en el cual apareció una infección de la endoprótesis que se implantó a nivel de la aorta abdominal, un año antes por un aneurisma. Para proteger el riñón de la isquemia y la hipoperfusión secundaria al pinzamiento aórtico, se utilizó la bomba de circulación extracorpórea.
Aortic endograft infection in a patient with a previous renal transplant is a rare occurrence. Perfusion to the transplanted kidney graft and preservation of renal function poses a surgical challenge and the need for specific perfusion techniques. The case is presented of a patient with a previous renal transplant and aortic endograft infection one year after endovascular repair of an abdominal aortic aneurysm. Perfusion by extracorporeal circulation was used during the operation to protect the kidney against hypoperfusion and ischemia.
Los aneurismas de la aorta abdominal (AAA) son cada vez más frecuentes en pacientes con un trasplante renal, en torno al 1,01% de los trasplantados renales, provocando un problema técnico en la reparación de dicho aneurisma1, ya que la isquemia que se produce durante el pinzamiento aórtico en el riñón trasplantado puede provocar un desenlace fatal para este riñón.
La terapia intravascular para la reparación de los AAA en los últimos años ha sido una opción válida, ya que evita el pinzamiento de la aorta abdominal para la reparación de dicho aneurisma, evitando la isquemia a nivel del trasplante renal y favoreciendo la conservación de la función renal. Existen varias técnicas para evitar que el riñón trasplantado presente una isquemia innecesaria; hoy día la utilización de las endoprótesis ha provocado que no sean necesarios mecanismos añadidos para la reparación de los AAA en pacientes con un trasplante renal.
Un problema importante surge cuando aparecen complicaciones derivadas de estas terapias intravasculares, sobre todo en los pacientes con un trasplante renal; la infección de la endoprótesis es una de ellas.
Aunque la infección es una complicación extraña, con una incidencia del 0,6%, en algunas series2, puede suponer un desenlace devastador para el paciente, ya que tiene un porcentaje elevado de mortalidad.
Presentamos el caso de un paciente, con un trasplante renal, que acudió a nuestro centro con una infección de una endoprótesis de aorta abdominal, implantada por un AAA un año antes de acudir con la infección.
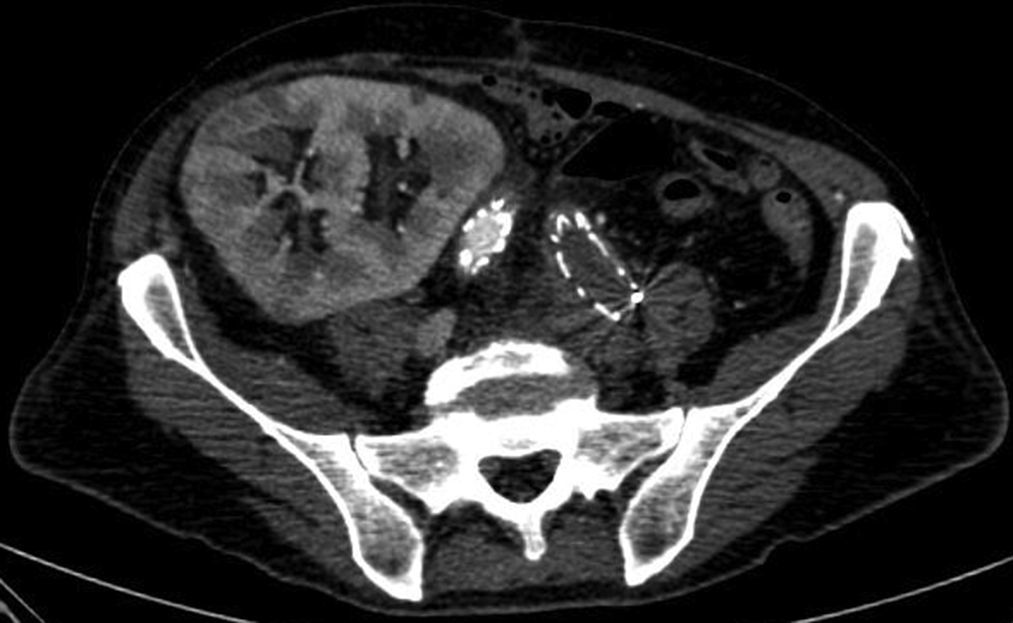
Caso clínicoExponemos el caso de un paciente varón de 71 años de edad, trasplantado renal, con la implantación de una endoprótesis por un AAA un año antes de acudir a nuestro centro e infecciones de repetición del tracto urinario (que pudieron ser el foco de origen de la infección). Consultó por un cuadro de varias semanas de evolución de fiebre, vómitos, astenia y pérdida de 8 kg de peso; por este motivo, se realizó una angiotomografía computarizada (angio-TAC) de abdomen, donde se objetivó la infección de la endoprótesis, con una oclusión de la rama izquierda del injerto implantado (figs. 1 y 2). El riñón trasplantando dependía de la rama derecha y la creatinina se encontraba en 1,6mg/dl, ligeramente superior a los valores normales (0,5-1,3mg/dl). Se inició tratamiento antibiótico de forma empírica y posteriormente cirugía.
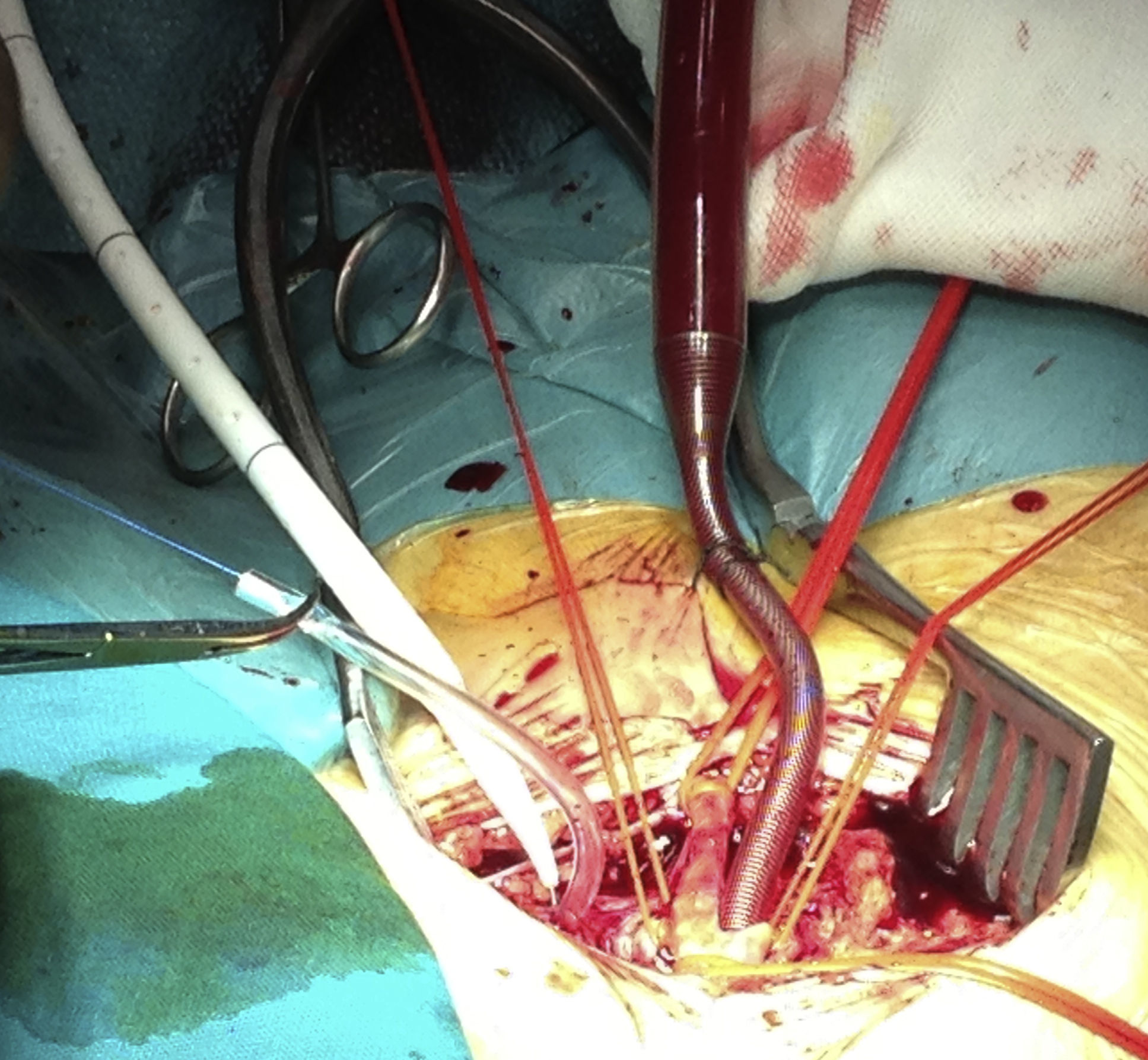
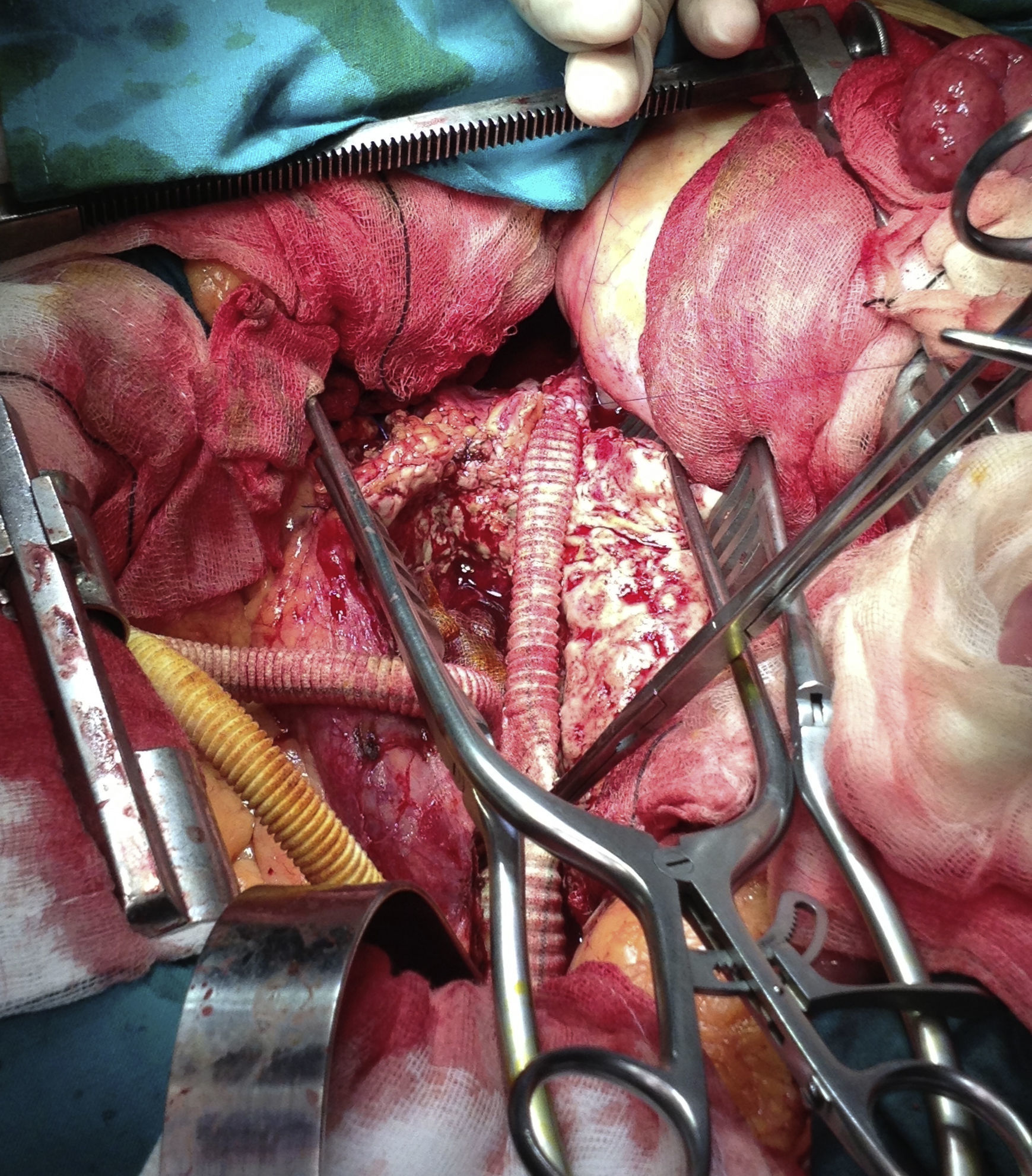
En quirófano y bajo anestesia general, se realizó la disección de la arteria y la vena femoral derechas, seguidamente se canularon ambos vasos femorales, para mantener un bypass aterio-venoso femoral derecho con la bomba de circulación extracorpórea (CEC) y permitir la perfusión del riñón trasplantado (fig. 3), una vez pinzada la aorta.
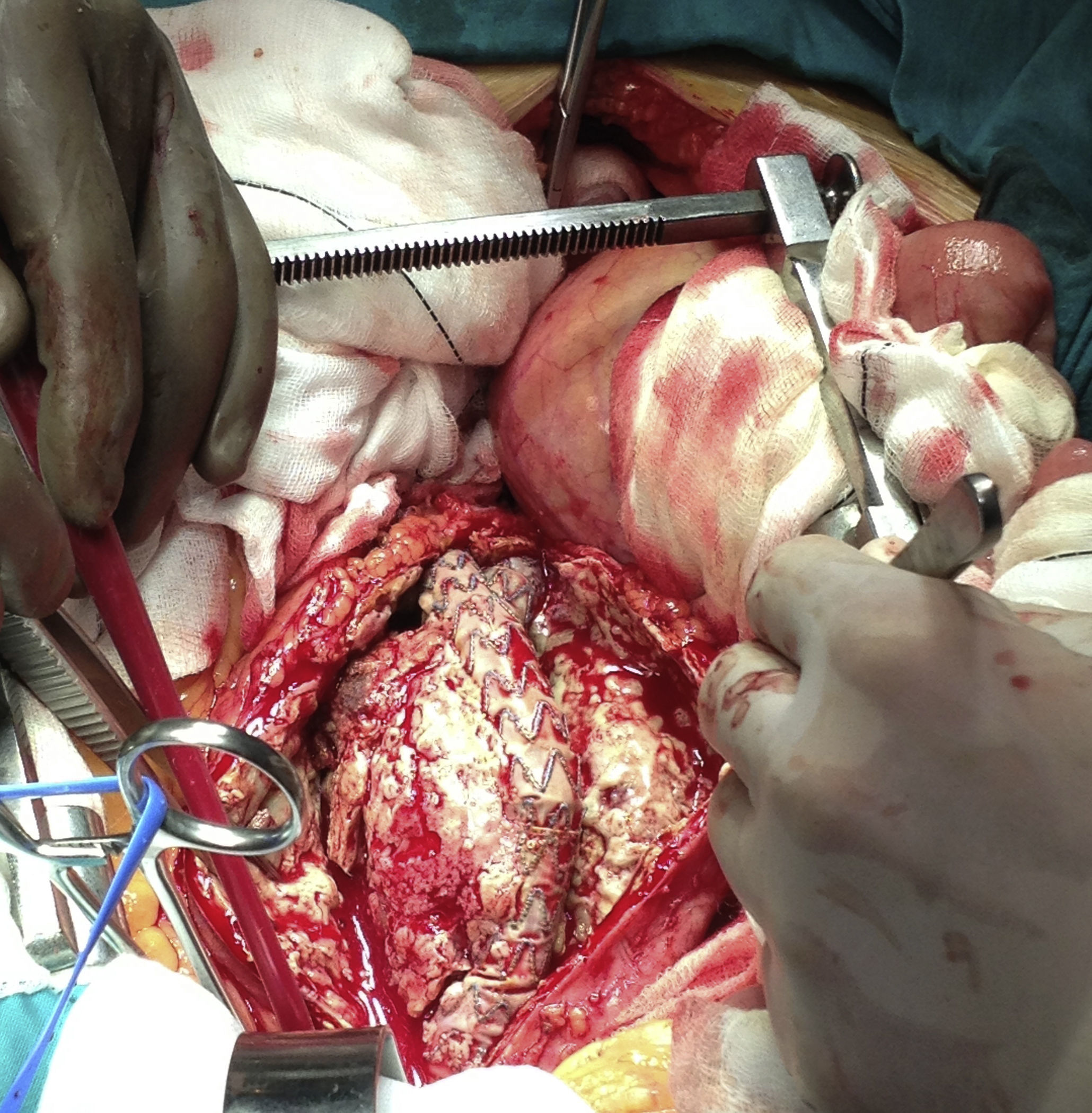
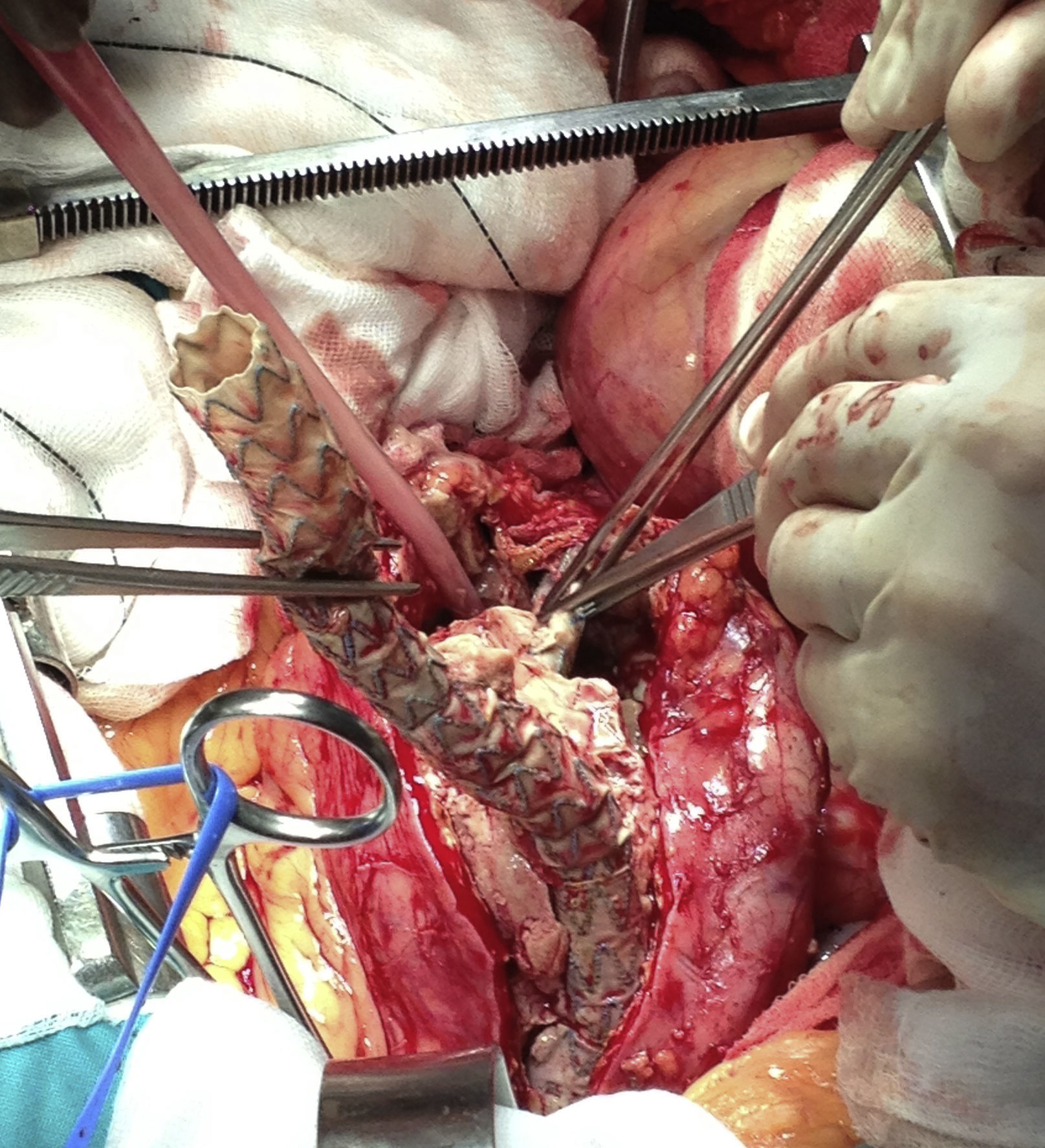
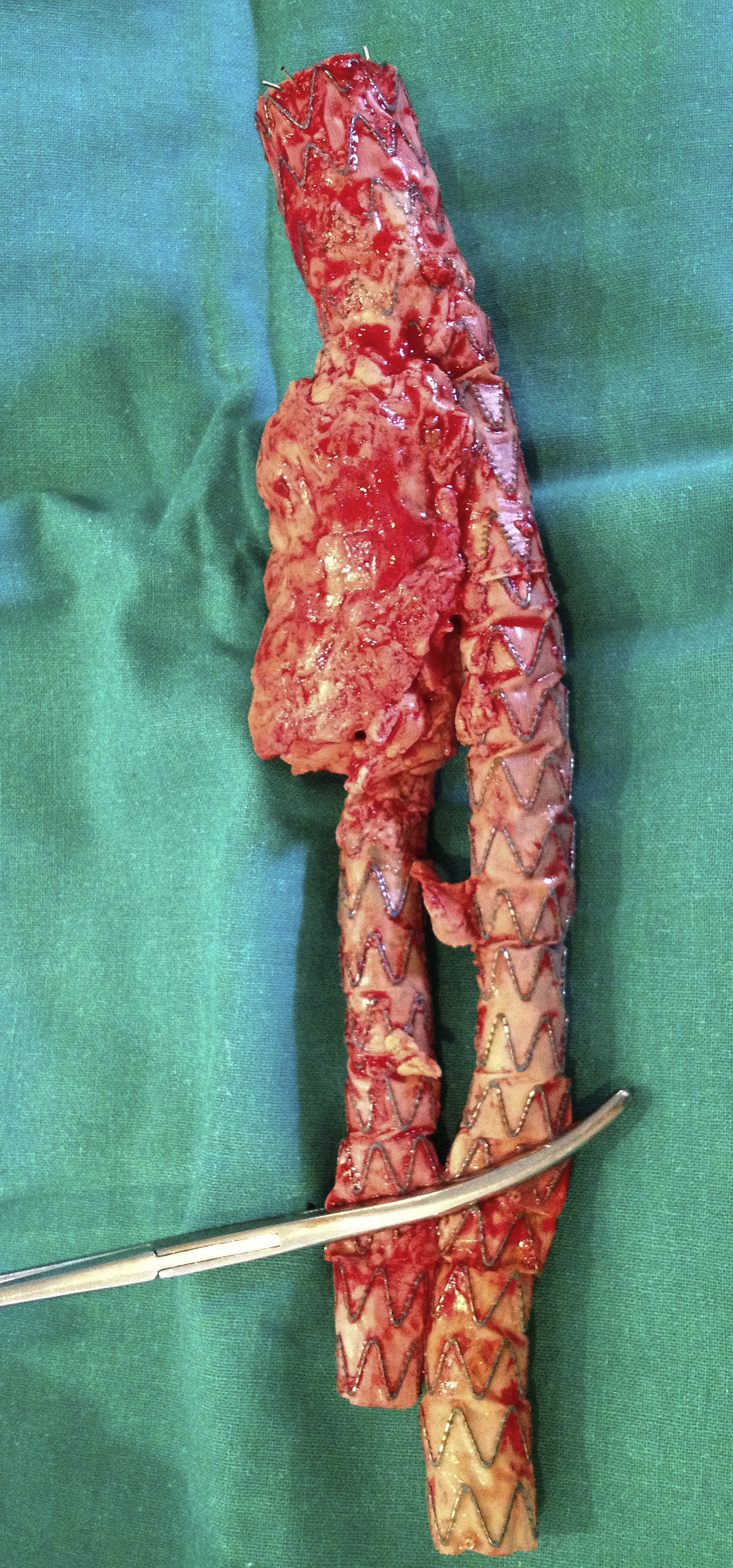
Se llevó a cabo un abordaje por laparotomía media; se realizó una disección cuidadosa hasta la aorta infrarrenal, donde se pinzó a dicho nivel; también se pinzaron al mismo tiempo ambas arterias ilíacas para evitar el reflujo de sangre. Tras el pinzamiento, se inició el bypass arterio-venoso femoral derecho; una vez establecido, se abrió el saco aneurismático, donde se evidenció gran cantidad de secreción purulenta (fig. 4). Se llevó a cabo la extracción de la endoprótesis (figs. 5 y 6), que estaba fuertemente anclada a la aorta y, posteriormente, se realizó un bypass desde la aorta abdominal (con un injerto de dacrón bifurcado, impregnado en plata), hasta la ilíaca común derecha y la arteria femoral común izquierda (fig. 7). Una vez que se finalizó la anastomosis de la arteria ilíaca derecha, se pudo retirar la pinza vascular y se restableció el flujo a través del injerto de dacrón al riñón trasplantado.
Durante 57 min, el riñón trasplantado estuvo perfundido a través de la bomba de CEC, con un flujo medio de 0,9 l por minuto y una presión media de 91mmHg.
Una vez se restableció el flujo a través del injerto hacia ambos miembros inferiores, se retiraron las cánulas insertadas en la arteria y la vena femoral derechas.
El estudio microbiológico de la endoprótesis y del trombo que se extrajo del saco aneurismático estableció un crecimiento de Escherichia coli.
El paciente mantuvo un postoperatorio tórpido debido a complicaciones en las heridas quirúrgicas, pero los cultivos realizados de las heridas fueron negativos para cualquier tipo de microorganismo.
Finalmente, fue dado de alta asintomático, sin sufrir alteraciones significativas en su función renal, con una creatinina de 1,2mg/dl días previos al alta y permaneciendo asintomático a los 12 meses de la intervención.
DiscusiónLa reparación de un AAA en pacientes con un trasplante renal mediante una endoprótesis es una alternativa segura, ya que evita la isquemia del riñón trasplantado y también evita realizar un bypass axilo-femoral, un shunt aorto-ilíaco o un bypass fémoro-femoral con la bomba de CEC previo a la cirugía de reparación3. Diversos autores afirman no requerir medidas adicionales, como podría ser la hipotermia local, tras el pinzamiento aórtico en la reparación de un AAA para preservar correctamente el riñón trasplantado4.
En nuestro caso, se presentaron varios puntos conflictivos, debido a que se trataba de un paciente con una infección de una endoprótesis, considerándose esta como grave, debido a que puede llegar a tener una mortalidad del 25%5, y al trasplante renal, que suponía un riesgo añadido.
Se optó desde el primer momento realizar alguna medida de soporte para el riñón trasplantado, debido a la dificultad técnica que se preveía al retirar la endoprótesis anclada en la aorta. Esto hacía suponer que el tiempo quirúrgico se alargaría, con la consecuencia de que el riñón sufriese un tiempo de isquemia peligroso.
Creímos que la bomba de CEC nos podría aportar un mayor beneficio a la hora de trabajar en el campo quirúrgico y así mantener la perfusión del riñón. Estamos convencidos de que no supone un método complejo para los cirujanos cardiovasculares y simplifica el realizar otros métodos de perfusión, como podría ser un bypass axilo-femoral.
Al realizar el bypass, creímos acertado utilizar un injerto recubierto de plata, ya que ofrece una mayor resistencia a las infecciones que uno normal, y en nuestra experiencia hemos tenido un resultado aceptable. Una alternativa habría sido utilizar un homoinjerto, pero esta opción aporta unos gastos mucho mayores, con unos resultados similares6.
ConclusiónEn nuestro caso, la bomba de CEC nos permitió mantener un flujo adecuado sobre el riñón trasplantado y, de esta manera, poder actuar sobre la aorta abdominal sin riesgo de dañar el riñón.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.