En el presente artículo se realiza una revisión de aspectos que van más allá de la cirugía coronaria convencional. La primera parte define y explica qué son los procedimientos coronarios híbridos y en qué consiste la revascularización transmiocárdica con láser y células madre. La segunda parte aborda las anomalías congénitas coronarias, sus variantes anatómicas y cuándo deben ser intervenidas quirúrgicamente. Describe el tratamiento de los aneurismas ventriculares, la Dor y otras técnicas para tratar el remodelado ventricular. Finalmente, se describen el tratamiento de los aneurismas ventriculares, la cirugía de Dor y otras técnicas para tratar el remodelado ventricular.
In this article we review different aspects beyond the CABG First, we will define the concept of hybrid revascularization and the use of transmyocardial revascularization and stem cell therapy in coronary patients. Secondly, we will define coronary anomalies and when and how they must be managed. Finally, we will focus on left ventricle aneurysm management, Dor surgery and other techniques in left ventricle remodeling.
La cirugía coronaria abarca un campo mucho más amplio que el mero hecho de realizar una anastomosis en una arteria coronaria. En este artículo de revisión se describen de forma breve pero práctica aspectos quirúrgicos de la enfermedad coronaria fuera de lo que es la cirugía convencional de bypass aorto-coronario.
La primera parte del artículo describe el concepto de procedimiento coronario híbrido y el tratamiento con técnicas láser y células madre. Es un debate constante en la literatura evaluar los beneficios de la cirugía coronaria frente al intervencionismo percutáneo. Frente al innegable beneficio de la arteria mamaria izquierda (AMI) a la descendente anterior (DA) se encuentra el tratamiento percutáneo con stents, una técnica, por definición, poco invasiva. Los procedimientos coronarios híbridos persiguen obtener el máximo beneficio de ambas técnicas, las cuales se realizan casi simultáneamente. Esta primera parte se complementa con el tratamiento que se intenta ofrecer en aquellos pacientes con zonas miocárdicas irrevascularizables y angina refractaria mediante técnicas de revascularización transmiocárdica y células madre.
En la segunda parte del artículo se analizan las variantes congénitas de la enfermedad coronaria. Son patologías donde, a pesar de no existir una enfermedad arterioesclerótica de base, las variantes anatómicas que los pacientes presentan se pueden asociar a angina coronaria y a un alto riesgo de muerte súbita.
Finalmente, se describe en qué consiste la cirugía del remodelado ventricular. Como es sabido, la enfermedad coronaria puede producir complicaciones mecánicas, normalmente en fase aguda de un infarto, pero también puede producir un remodelado ventricular crónico con zonas aneurismáticas perjudiciales para el paciente. Estos territorios aneurismáticos aquí o disquinéticos pueden producir insuficiencia cardiaca (IC) y/o asociarse a arritmias malignas, por lo que puede ser necesaria la resección quirúrgica de los mismos.
Cirugía coronaria híbridaEl concepto híbrido según la Real Academia de la Lengua Española se refiere a «aquella cosa que es producto de elementos de distinta naturaleza». En el caso de la cirugía coronaria, una estrategia híbrida combina el tratamiento percutáneo que se realiza en la sala de hemodinámica con el tratamiento de revascularización miocárdica que se ofrece en los quirófanos de cirugía cardiaca, con el objetivo de, dadas unas lesiones coronarias determinadas en un paciente, ofrecer a dicho paciente lo mejor de ambos procedimientos1. Este concepto no es reciente, ya que muchos pacientes acaban siendo tratados tanto de forma percutánea como con cirugía coronaria. Sin embargo, el concepto actual de procedimiento coronario híbrido implica que ambas terapias (percutánea y cirugía coronaria) se realizan de forma conjunta, separados tan solo por minutos u horas.
A medida que la complejidad de los pacientes aumenta, crece paralelamente el desarrollo de nuevas tecnologías que permiten el acercamiento de los hemodinamistas hacia procedimientos quirúrgicos y el de los cirujanos cardiacos a técnicas poco invasivas. Esto permite que los procedimientos híbridos sean una realidad creciente no solo en el tratamiento de la enfermedad coronaria, sino también de las valvulopatías, tratamiento de la fibrilación auricular y patología de la aorta.
La cirugía coronaria es un procedimiento muy seguro y estandarizado con excelentes resultados tanto a corto como a largo plazo, especialmente en pacientes diabéticos, pacientes con disfunción ventricular izquierda y aquellos con una anatomía compleja (SYNTAX medio-alto). El beneficio de la cirugía coronaria radica especialmente en el uso de la AMI a la DA. La permeabilidad de la AMI es superior al 90% a los 10 años. Desde hace años distintos grupos han buscado abordajes mínimamente invasivos para realizar el bypass de AMI a la DA, evitando así los efectos deletéreos de la esternotomía total2. Algunos grupos han publicado series de pacientes intervenidos de cirugía coronaria con técnicas mínimamente invasivas con excelentes resultados3.
La idea de añadir a la cirugía coronaria mínimamente invasiva el tratamiento intervencionista percutáneo se basa en que la tasa de permeabilidad de los injertos venosos disminuye claramente con los años, con una tasa de oclusión cercana al 50% a los 10 años2,4. Actualmente, con los stents farmacoactivos de nueva generación, ha disminuido la tasa de reestenosis intra-stent, teniendo una permeabilidad, según algunos autores, similar a la de los injertos venosos a largo plazo2.
Combinando estas ideas, el concepto de procedimientos coronarios híbridos implica la realización de bypass de AMI a la DA con técnicas mínimamente invasivas y tratamiento percutáneo del resto de las arterias coronarias.
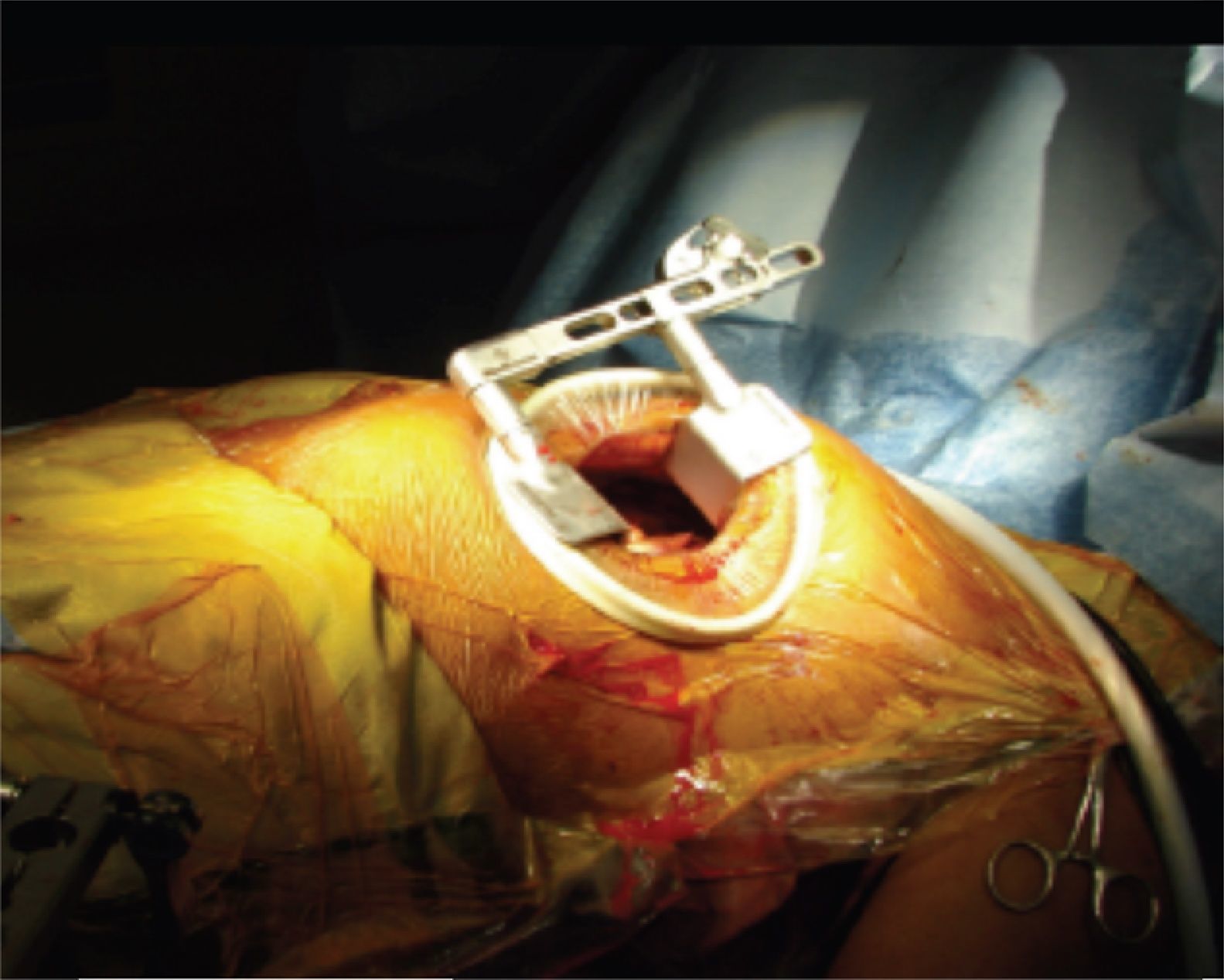
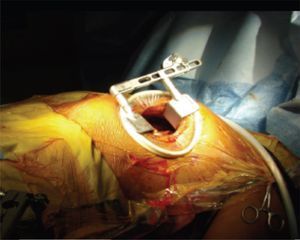
Existen 3 técnicas para la cirugía coronaria mínimamente invasiva. La minimally invasive direct coronary artery bypass (MIDCAB), donde se realiza una pequeña toracotomía izquierda para disecar la AMI y posteriormente realizar sin circulación extracorpórea la anastomosis (fig. 1). La endoscopic atraumatic coronary artery bypass (ENDOACAB), donde se diseca la AMI por técnicas endoscópicas y posteriormente con una incisión submamaria y un puerto se realiza sin circulación extracorpórea la anastomosis. Un paso más es la totally endoscopic coronary artery bypass (TECAB), donde se realiza todo el proceso con técnicas endoscópicas.
Técnicamente, se puede proceder primero a la realización del bypass quirúrgico y posteriormente al tratamiento percutáneo o viceversa. Las ventajas de realizar primero el bypass de AMI a DA son: posibilidad de comprobar el resultado de la anastomosis mediante angiografía, realizar angioplastias complejas con mayor seguridad, el tener protegida la DA y el poder usar desde el inicio doble antiagregación sin elevar el riesgo de sangrado. La ventaja de realizar primero la revascularización percutánea es una mayor seguridad al realizar el bypass, al tener el resto de los vasos coronarios protegidos.
Sin embargo, la mayor limitación pare el desarrollo de los procedimientos híbridos hoy en día es, sin duda, la necesidad de realizar dichos procedimientos en una sala híbrida (de escaso número en los centros hospitalarios de nuestro país).
Aunque no son muchos los grupos que trabajan la cirugía coronaria híbrida, los resultados descritos ofrecidos son buenos y con una alta satisfacción por parte de los pacientes3,5,6.
Revascularización transmiocárdica con láser. Terapia celularLa revascularización transmiocárdica con láser (TMR) es una técnica que consiste en la creación de canales transmurales (generalmente mediante energía tipo Holmyum:YAG o CO2) en el músculo cardiaco con la idea de crear canales sinusoides que irriguen el miocardio, mimetizando así el corazón de los anfibios. Esta técnica se emplea en pacientes con angina refractaria al tratamiento médico y sin opciones de revascularización quirúrgica o percutánea. Tuvo su auge a finales de la década de los 90 a raíz de un estudio publicado por Allen et al., donde de forma aleatorizada se comprobó que los pacientes que eran tratados con TMR presentaban una mejor clase funcional para angina que los pacientes tratados médicamente7. La TMR podía darse de forma aislada mediante técnicas mínimamente invasivas (toracotomía anterior izquierda) o asociada a cirugía coronaria en aquellos territorios con enfermedad coronaria no revascularizable.
Son varios los estudios que desde entonces han comunicado su experiencia con resultados bastante variables, especialmente en aquellos casos en los que se usa de forma combinada a la cirugía coronaria, al ser difícil el cuantificar de una forma objetiva el beneficio que pueda aportar la TMR8. Esto, asociado el desarrollo de nuevos fármacos para el manejo de la angina refractaria, como la ranolazina, ha hecho que la TMR sea un procedimiento poco frecuente hoy en día.
Varios grupos han tratado de potenciar el efecto de la TMR con la terapia celular en la cardiopatía isquémica al tener un teórico efecto sinérgico entre ambas terapias9, ya que la respuesta inflamatoria que teóricamente producen las fuentes de energía en el miocardio crea una base fisiopatológica ideal para el mantenimiento y el desarrollo de las células madre totipotenciales.
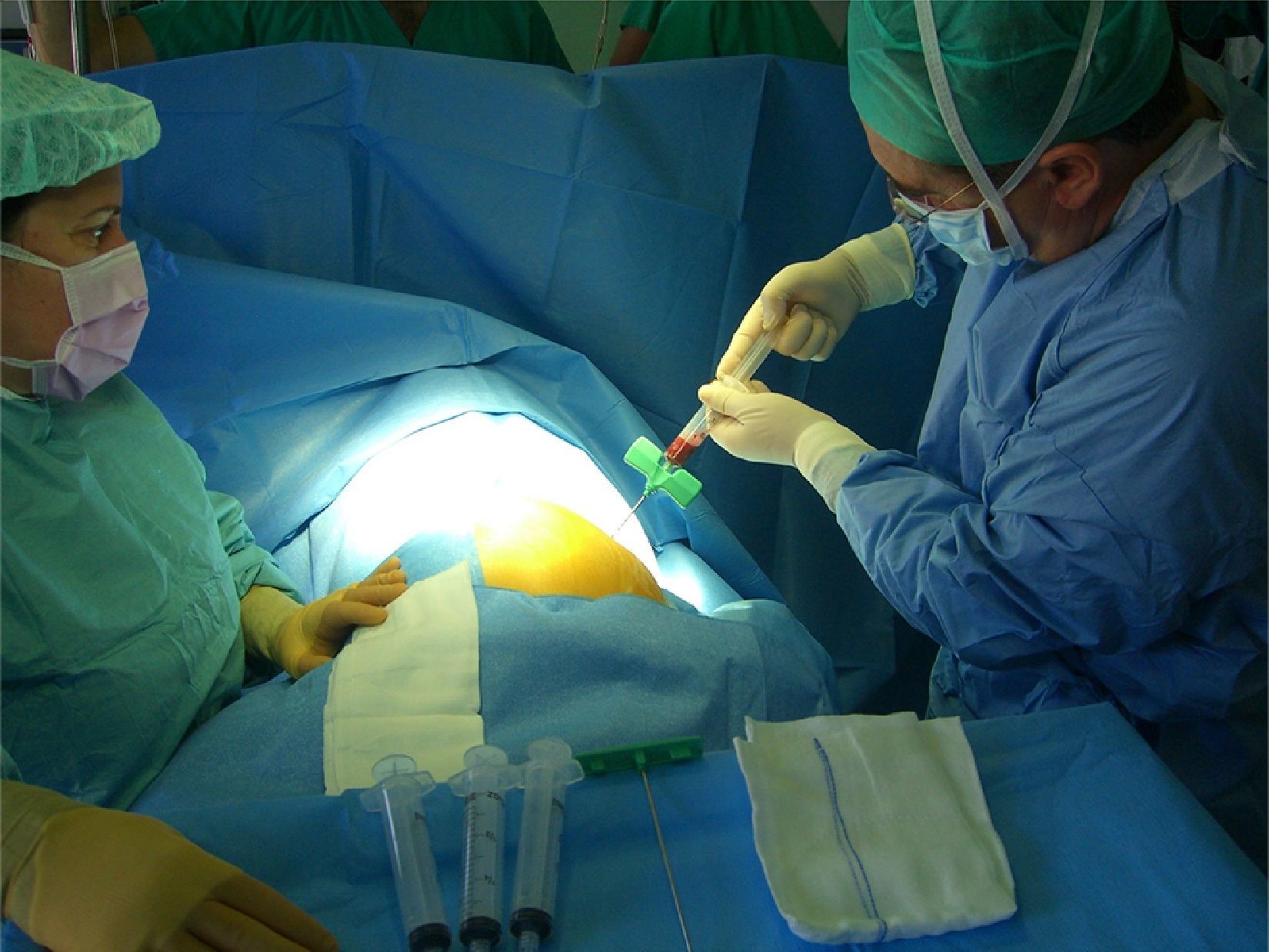
Estas células madre se pueden obtener en el mismo procedimiento quirúrgico por punción de la cresta iliaca del paciente (fig. 2). Posteriormente, se centrifugan y el remanente resultante se inyecta al mismo tiempo que se crean los canales láser con la idea de aumentar el número de sinusoides sanguíneos en el miocardio.
Pero no solo la terapia celular se puede emplear de esta forma. Al mismo tiempo que se realiza la cirugía coronaria, algunos grupos han asociado la administración directa de células madre en el miocardio, especialmente en pacientes con disfunción ventricular severa. Parece que esta asociación podría mejorar los parámetros ecocardiográficos del ventrículo izquierdo y existen varios estudios en marcha para comprobar esto10.
Anomalías coronarias. ¿Cuándo tenemos que intervenirlas?Se calcula que existen anomalías congénitas de las arterias coronarias entre el 0,1 y el 1% de la población general11. Su importancia radica en la posibilidad de producir isquemia miocárdica y arritmias ventriculares que pueden derivar en muerte súbita.
Sin embargo, no todas las anomalías coronarias tienen repercusión clínica, variando su espectro desde las denominadas variantes anatómicas de la normalidad y benignas, sin ningún tipo de repercusión, hasta anomalías que amenazan la vida.
En este capítulo revisaremos la clasificación, los métodos diagnósticos actuales y trataremos de resumir las indicaciones de tratamiento de aquellas anomalías coronarias que pueden tener repercusión clínica.
Definición y clasificaciónAntes de clasificar las anomalías coronarias, es importante recordar algunas consideraciones al respecto de lo que consideramos normal. En primer lugar:
- –
Definimos arteria coronaria como aquella que vasculariza el miocardio.
- –
El segmento proximal de una arteria coronaria se origina perpendicular a la pared aórtica, en un ángulo que varía de 45 a 90°; su recorrido es esencialmente epicárdico, terminando en una red capilar adecuada según la zona del miocardio dependiente.
- –
El nombre de las arterias coronarias se define por el territorio que irriga, no por el seno del que se origina, mientras que el nombre de estos se designa en función de su topografía y no por la arteria coronaria a la que dan origen (tabla 1)12.
Tabla 1.Características anatómicas de las arterias coronarias
Características Tipo Número de orificios coronarios Entre 2 y 4 Localización En la parte media-superior de los senos derecho e izquierdo Orientación proximal Saliendo de la pared aórtica en un ángulo entre 45 a 90° Tronco común proximal Solo izquierdo (DA y CX) Curso proximal Directo desde el orificio al destino Curso medio Extramural (subepicárdico) Ramas Adecuadas para el miocardio dependiente Territorios CD (pared libre del VD) DA (anteroseptal) OM (pared libre del VI) Finalización Lecho capilar Modificada de Angelini12.
Muchas han sido las clasificaciones de las anomalías coronarias, aunque la mayoría son morfológicas y no tienen significado clínico o pronóstico. Recientemente, los avances en los métodos diagnósticos (TC y RM) han permitido definir y clasificar estas anomalías, y planificar, en caso necesario, el tratamiento quirúrgico más idóneo. En la tabla 2 reproducimos una clasificación que conjuga las variantes anatómicas con su repercusión hemodinámica13.
Clasificación anatómica de las anomalías coronarias
| Anomalías de las arterias coronarias | |
|---|---|
| Hemodinámicamente significativas | Sin repercusión hemodinámica |
| Anomalías en el origen | |
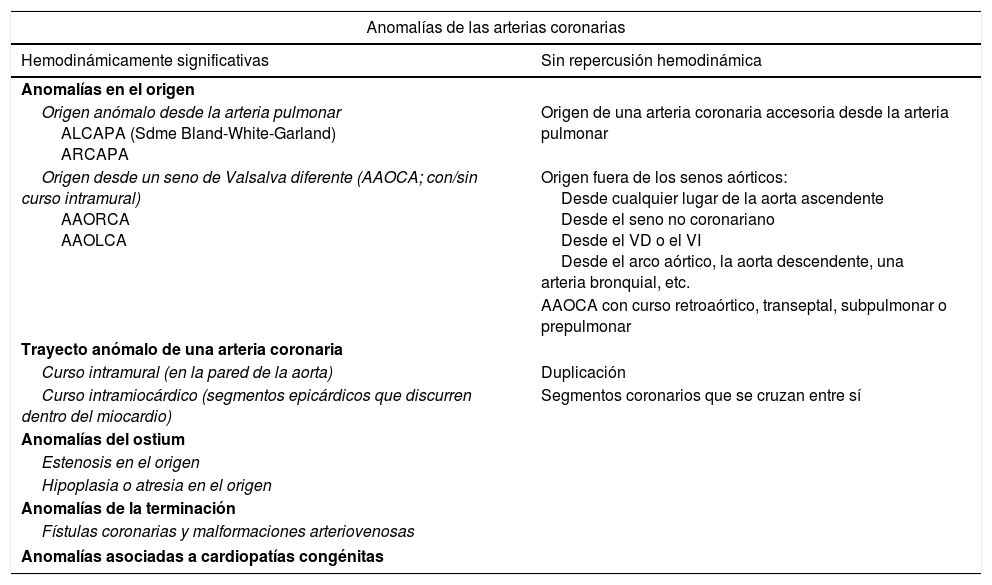
| Origen anómalo desde la arteria pulmonar ALCAPA (Sdme Bland-White-Garland) ARCAPA | Origen de una arteria coronaria accesoria desde la arteria pulmonar |
| Origen desde un seno de Valsalva diferente (AAOCA; con/sin curso intramural) AAORCA AAOLCA | Origen fuera de los senos aórticos: Desde cualquier lugar de la aorta ascendente Desde el seno no coronariano Desde el VD o el VI Desde el arco aórtico, la aorta descendente, una arteria bronquial, etc. |
| AAOCA con curso retroaórtico, transeptal, subpulmonar o prepulmonar | |
| Trayecto anómalo de una arteria coronaria | |
| Curso intramural (en la pared de la aorta) | Duplicación |
| Curso intramiocárdico (segmentos epicárdicos que discurren dentro del miocardio) | Segmentos coronarios que se cruzan entre sí |
| Anomalías del ostium | |
| Estenosis en el origen | |
| Hipoplasia o atresia en el origen | |
| Anomalías de la terminación | |
| Fístulas coronarias y malformaciones arteriovenosas | |
| Anomalías asociadas a cardiopatías congénitas | |
AAOCA: origen de una arteria coronaria desde un seno inapropiado (prepulmonar o retroaórtico); AAOLCA: origen anómalo de la coronaria izquierda desde un seno diferente; AAORCA: origen anómalo de la coronaria derecha desde un seno diferente; ALCAPA: origen anómalo de la arteria coronaria izquierda desde la arteria pulmonar; ARCAPA: origen anómalo de la arteria coronaria derecha desde la arteria pulmonar; VD: ventrículo derecho. VI: ventrículo izquierdo.
Modificada de Heermann et al.13
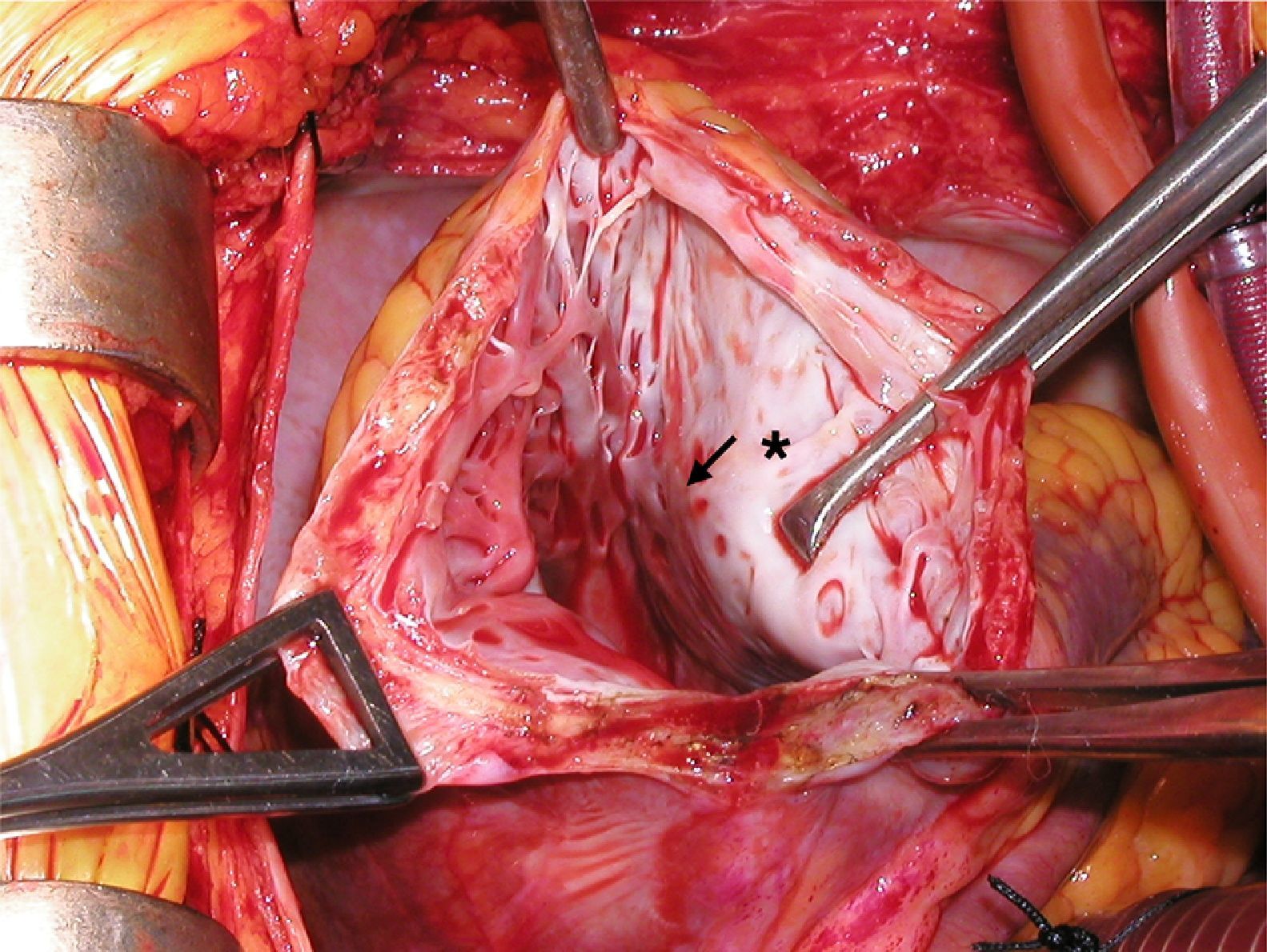
Las anomalías coronarias que comprometen la vascularización miocárdica pueden ser el origen de isquemia miocárdica y/o arritmias ventriculares malignas, que en la mayoría de los casos constituyen los primeros síntomas. Diferentes factores influyen en su presentación clínica, entre los que destacan la estenosis del origen, junto con una salida oblicua de la pared aórtica, mayor predisposición al vasoespasmo, la presencia de segmentos anormalmente hipoplásicos, o la compresión de la coronaria anómala bien por su recorrido intramural o bien entre las grandes arterias.
La anomalía que más frecuentemente se ha relacionado con la presencia de muerte súbita es el origen anómalo de una arteria coronaria desde un seno coronario diferente (AAOCA)4. Entre ellas, los pacientes portadores de AAOLCA (origen anómalo de la arteria coronaria izquierda desde el seno coronario derecho) presentaron mayor incidencia de muerte súbita no atribuible a ninguna otra causa.
En los últimos años, la preocupación por la presencia de muerte súbita en jóvenes deportistas ha condicionado el aumento de programas de cribado mediante ecocardiografía para la detección de este tipo de anomalías.
Actualmente, el primer método diagnóstico que se utiliza en pacientes con sospecha de AAOCA es la ecocardiografía transtorácica con doppler color para definir el origen y el trayecto inicial de las arterias coronarias. La TC de arterias coronarias o la RM confirman el diagnóstico. Una vez establecida la anatomía, es imprescindible realizar una prueba de esfuerzo combinada con perfusión de isótopos que descarte la presencia de isquemia.
TratamientoResulta imposible realizar en esta revisión un resumen de las indicaciones y las técnicas utilizadas en la corrección de las anomalías coronarias que presentan significado clínico. El tratamiento general incluye el manejo conservador en algunos casos, la monitorización periódica, el tratamiento percutáneo y la cirugía.
A modo de sumario, a continuación, incluimos algunas pinceladas del tratamiento más idóneo en las entidades más comunes:
- 1.
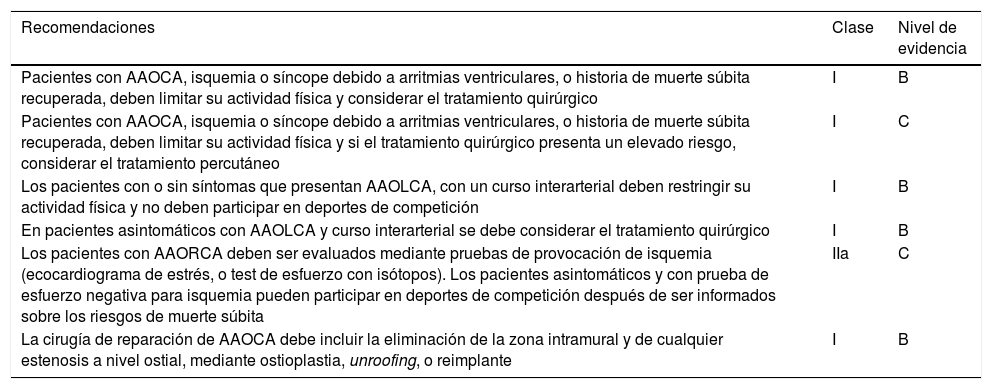
Origen anómalo de una arteria coronaria desde el seno opuesto. Las recomendaciones se recogen en la tabla 314.
Tabla 3.Recomendaciones de tratamiento en los pacientes que presentan una coronaria anómala con origen en un seno opuesto
Recomendaciones Clase Nivel de evidencia Pacientes con AAOCA, isquemia o síncope debido a arritmias ventriculares, o historia de muerte súbita recuperada, deben limitar su actividad física y considerar el tratamiento quirúrgico I B Pacientes con AAOCA, isquemia o síncope debido a arritmias ventriculares, o historia de muerte súbita recuperada, deben limitar su actividad física y si el tratamiento quirúrgico presenta un elevado riesgo, considerar el tratamiento percutáneo I C Los pacientes con o sin síntomas que presentan AAOLCA, con un curso interarterial deben restringir su actividad física y no deben participar en deportes de competición I B En pacientes asintomáticos con AAOLCA y curso interarterial se debe considerar el tratamiento quirúrgico I B Los pacientes con AAORCA deben ser evaluados mediante pruebas de provocación de isquemia (ecocardiograma de estrés, o test de esfuerzo con isótopos). Los pacientes asintomáticos y con prueba de esfuerzo negativa para isquemia pueden participar en deportes de competición después de ser informados sobre los riesgos de muerte súbita IIa C La cirugía de reparación de AAOCA debe incluir la eliminación de la zona intramural y de cualquier estenosis a nivel ostial, mediante ostioplastia, unroofing, o reimplante I B Tomado de Brothers et al.14
- 2.
Origen anómalo de la arteria coronaria desde la arteria pulmonar. Los pacientes que presentan ALCAPA (origen anómalo de la arteria coronaria izquierda en la arteria pulmonar), desde épocas muy tempranas manifiestan isquemia por lo que el tratamiento quirúrgico está indicado en el momento del diagnóstico. La técnica de elección en la reimplantación del tronco izquierdo desde la pulmonar a la aorta. Los pacientes con ARCAPA se diagnostican más tardíamente. No obstante, el tratamiento quirúrgico mediante la reimplantación en la aorta constituye también la técnica de elección. En todos los pacientes se recomienda el seguimiento periódico, ya que pueden presentarse a largo plazo complicaciones del tipo de estenosis pulmonar, estenosis del botón coronario reimplantado o desarrollo de aneurismas en esta zona.
- 3.
Las fístulas coronarias tienen una incidencia entre el 0,1-0,2% de los pacientes sometidos a coronariografía15. En general, el tratamiento está indicado en todos los pacientes sintomáticos y generalmente su cierre se puede realizar por vía percutánea. En caso de fístulas de gran tamaño o tortuosas, se prefiere el tratamiento quirúrgico16.
Existe un amplio espectro de anomalías coronarias, cuya prevalencia es mayor en los pacientes que presentan cardiopatías congénitas de cualquier origen. El principal riesgo de estas anomalías deriva de la posibilidad de presentar isquemia, arritmias ventriculares y muerte súbita. Tanto la diversidad anatómica como las implicaciones clínicas de cada una de las variantes obligan a la evaluación y la planificación del tratamiento y el seguimiento de forma individualizada.
Aneurismas ventriculares. Cirugía de Dor. Otras técnicas para tratar el remodelado ventricularLa principal causa de IC en el mundo occidental es la enfermedad coronaria. Si un infarto es suficientemente grande pondrá en marcha una serie de mecanismos desde el primer momento que darán lugar a una serie de cambios en el músculo sano, el remodelado ventricular, que consiste en la alteración de la forma (pasando de morfología elíptica a esférica) y el volumen (dilatación) del ventrículo izquierdo (VI). Estos cambios condicionan una contracción menos eficaz y un aumento de la tensión de la pared, que ponen en marcha una serie de mecanismos humorales que perpetúan el remodelado ventricular, la disfunción sistólica y diastólica, y llevan al desarrollo de la IC. Si el área de aquinesia es suficientemente grande, pondrá en marcha los mismos mecanismos que llevarán a la dilatación progresiva del ventrículo y al desarrollo de IC. La única manera de romper este círculo vicioso es con la eliminación del área aquinética/disquinética.
Evolución de las técnicas quirúrgicasLos orígenesBeck, en 1944, fue el primero en tratar quirúrgicamente un aneurisma ventricular. La cirugía consistió exclusivamente en reforzar su pared con fascia lata buscando disminuir el riesgo de rotura.
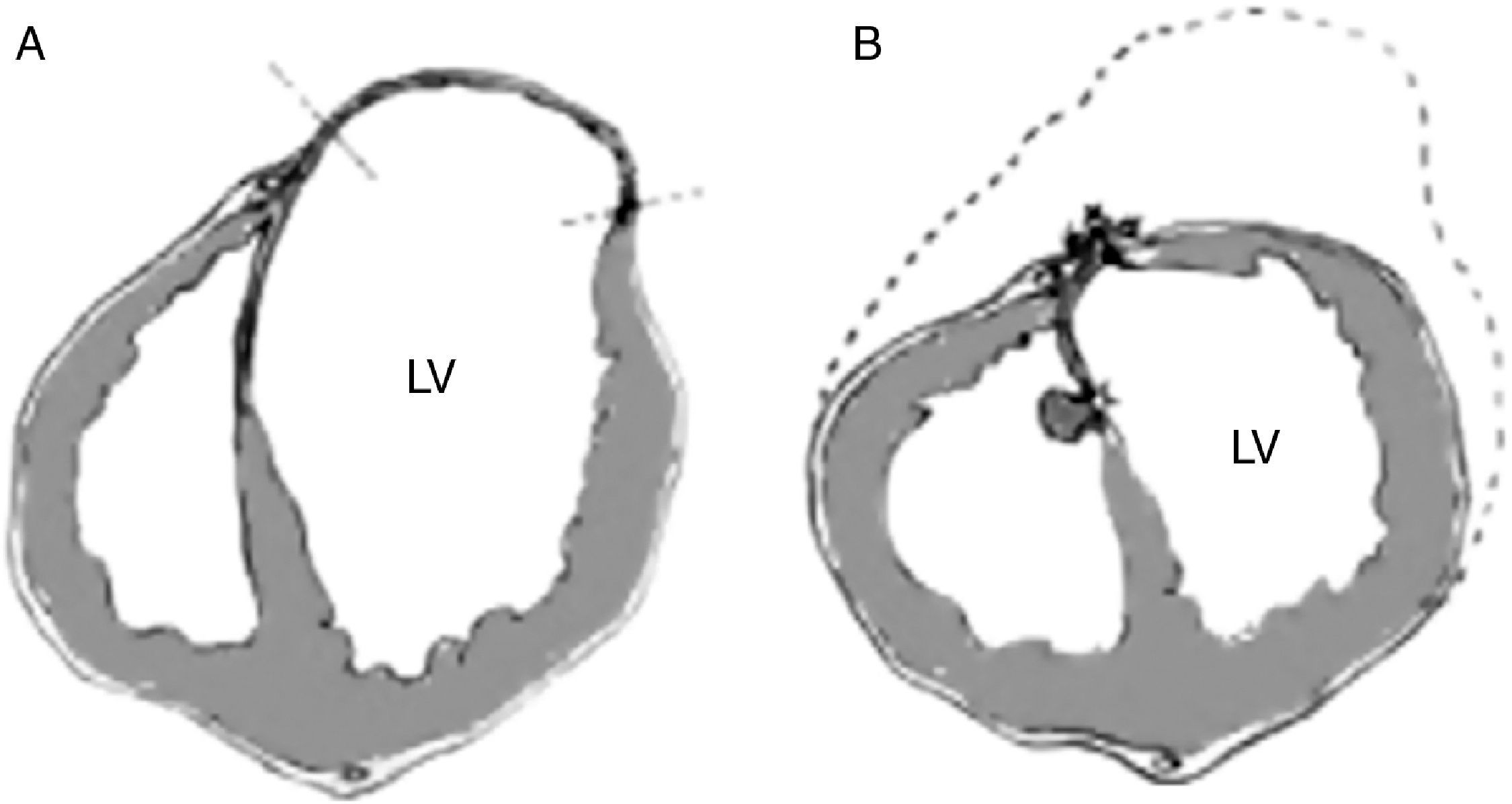
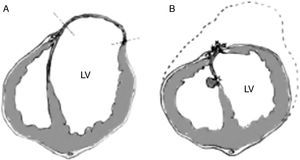
Las técnicas de reparación linealLa llegada de la circulación extracorpórea permitió el desarrollo de técnicas más sofisticadas. Así, Cooley, en 1958, hizo la primera reparación lineal. Esta técnica consiste en la apertura del aneurisma, la resección de su pared y el cierre del defecto mediante una doble sutura apoyada en teflón o pericardio. Independientemente de la reconstrucción de la geometría original del VI, con esta técnica no se trataba la porción aquinética correspondiente al septo interventricular. Desde el principio se comprendió que el problema no podría resolverse si no se abordaba la cicatriz septal (fig. 3).
Remodelado ventricular. La ventriculoplastia con parcheEn la técnica de Jatene, una vez resecado el aneurisma, se realiza una bolsa de tabaco en el borde de la resección que frunce el defecto, redirige las fibras musculares y disminuye el tamaño del VI. El defecto resultante se repara mediante un cierre lineal o con un parche de dacrón. La porción septal de la cicatriz se plica con puntos sueltos.
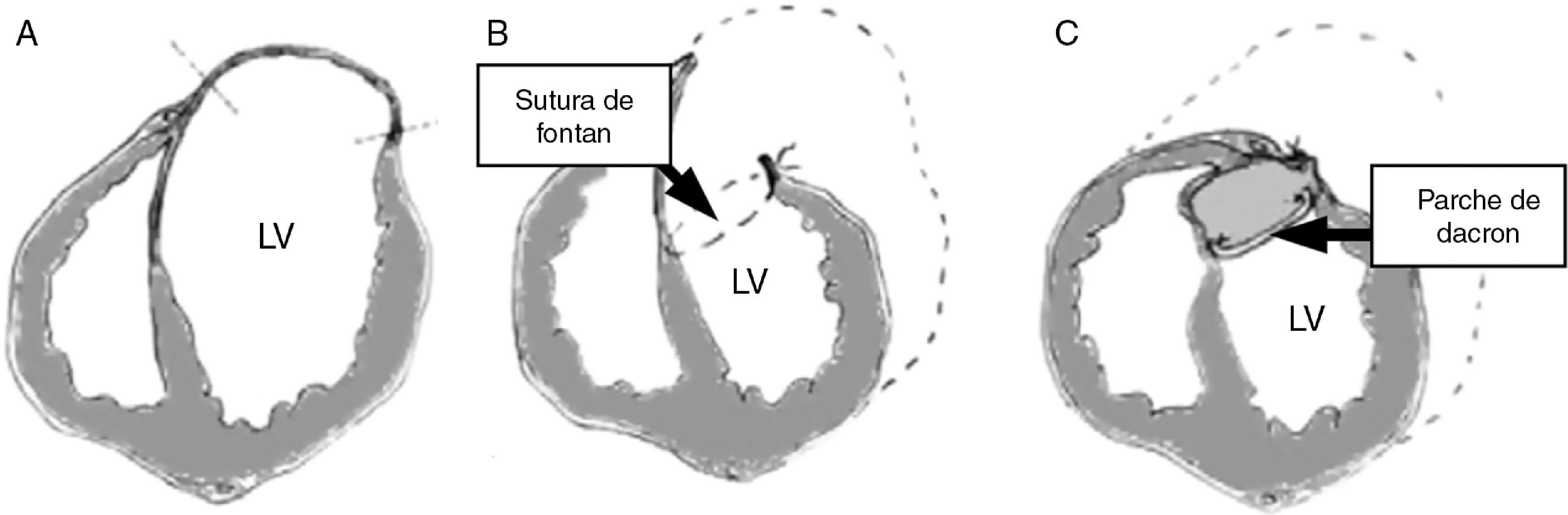
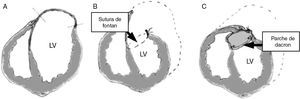
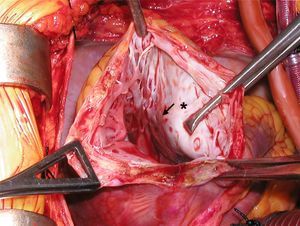
La técnica de Dor, llamada endoventriculoplastia, busca la exclusión de toda el área aquinética o disquinética, incluyendo el septo (fig. 4)17. Tras abrir el VI a través de la cicatriz, se realiza una bolsa de tabaco en la zona de transición (fig. 5) entre el miocardio sano y el no viable (sutura de Fontan), y posteriormente el defecto residual se cierra con un parche sintético. De esta forma, se excluye de la cavidad ventricular la zona necrosada y la aquinesia queda reducida a un pequeño segmento correspondiente al parche.
Ventriculectomía parcial izquierdaEn 1997 Batista publicó esta técnica, que consiste en resecar una porción de la pared libre del VI con el objeto de disminuir su diámetro, y con ello la tensión de la pared y frenar o revertir el remodelado. A pesar de los buenos resultados iniciales, se comprobó que la recurrencia de la IC y la mortalidad eran elevadas a partir de los 2 años de seguimiento, y la técnica ha sido abandonada.
La restauración ventricularBasándose en la endoventriculoplastia de Dor, Athanasuleas y Buckberg desarrollaron, a finales del siglo pasado, el concepto de restauración ventricular18. Surge como un abordaje integral de la miocardiopatía isquémica, actuando sobre sus 3 componentes: el miocardio, la enfermedad coronaria y la insuficiencia mitral.
Estudios anatómicos y de RM han demostrado que el principal determinante de la función del VI es la disposición de las fibras musculares19. Cuando el VI infartado se dilata y se vuelve esférico, las fibras se orientan transversalmente en vez de manera oblicua y la fracción de eyección puede disminuir del 60 al 30%. Además, la insuficiencia mitral residual tras el infarto potencia los mecanismos de remodelado. Por último, es necesaria una revascularización lo más extensa posible.
IndicacionesLos candidatos a esta intervención son pacientes con historia de infarto previo, generalmente anterior y síntomas avanzados de IC. La evaluación preoperatoria del tamaño y forma del VI mediante ecocardiograma y resonancia cardiaca son la clave para definir la operabilidad. La presencia de un VI dilatado (VTSVI>60ml/m2), con una cicatriz (aqui o disquinética) ≥ 35% del perímetro del VI y con viabilidad en los segmentos restantes son los criterios para indicar la técnica. La insuficiencia mitral ≥ ii o la presencia de un anillo dilatado son indicación de reparación mitral.
La técnica quirúrgicaUna vez realizadas la revascularización y la reparación mitral, la endoventriculoplastia puede hacerse con el corazón latiendo o parado. El aspecto más importante es la orientación del parche, que es lo que determinará la morfología elíptica de la cavidad residual y reorientar las fibras musculares creando un neoápex. En casos con gran dilatación ventricular, con extensión inferior de la cicatriz o en aquellos en los que la cicatriz no está claramente definida son de gran utilidad los balones diseñados específicamente para la endoventriculoplastia.
Los resultadosSon varias las series publicadas, pero quizás la más interesante es la correspondiente al grupo RESTORE20. Este registro internacional incluyó a 1.198 pacientes sometidos a restauración ventricular. El 86% estaba en clase funcional de la NYHA III o IV. En el 90% de los casos se asoció revascularización y la reparación mitral se realizó en el 20%. La mortalidad hospitalaria fue del 5,3% y la supervivencia a 5 años del 68%. La FE aumentó del 29,6 al 39,6% y el VTSVI disminuyó de 80,4ml/m2 a 56,6ml/m2.
El ensayo clínico STICHCuando comparamos los resultados de la restauración ventricular en las distintas series con la historia natural de la enfermedad, se indica un impacto favorable en la supervivencia sobre el tratamiento médico o la revascularización aislada. El STICH fue diseñado para demostrar por un lado la superioridad de la cirugía coronaria sobre el tratamiento médico en pacientes con disfunción ventricular (hipótesis 1) y, por otro, el beneficio en términos de muerte o nueva hospitalización de asociar la restauración ventricular a la cirugía coronaria (hipótesis 2).
La publicación de los resultados de la hipótesis 2 en el New England Journal of Medicine en 200921 causó un gran revuelo y se consideró la «defunción» oficial de la técnica. Tras aleatorizar a 1.000 pacientes, y con un seguimiento mediano de 48 meses, aunque la restauración disminuyó significativamente el volumen ventricular, no hubo diferencias en la clase funcional, la necesidad de reingreso hospitalario ni en la mortalidad. Aunque de entrada los resultados parecen incontestables, este estudio presentaba múltiples defectos de diseño y de ejecución, que llegaron a hacer que determinados autores solicitaran incluso su retirada22.
A modo de ejemplo, se debe decir que se incluyó a pacientes con alteraciones en la contractilidad de la cara anterior pero sin el diagnóstico de la cicatriz (solo el 50% de los pacientes presentaba aquinesia anterior) y el volumen ventricular solo se midió en el 33% de los pacientes.
De esta manera, el estudio incluyó a un gran número de pacientes sin cicatriz anterior; se desconoce el volumen ventricular en la mayoría de los casos y se aplicó la técnica quirúrgica de manera incorrecta. Por todo ello, el STICH es el ejemplo claro de que un estudio mal diseñado y peor ejecutado puede llevar a conclusiones equivocadas22.
ConclusionesAunque no existen estudios aleatorizados comparando la reparación lineal con la endoventriculoplastia, en general, se acepta esta última como la técnica de elección en las cicatrices extensas, sobre todo anteriores, quedando reservada la reparación lineal para los aneurismas de pequeño tamaño, sobre todo inferiores.
La presencia de una cicatriz en la pared ventricular suficientemente grande es la causante de la puesta en marcha de los mecanismos de remodelado que llevan al desarrollo de disfunción ventricular progresiva e IC congestiva. La cirugía de restauración ventricular es capaz de disminuir el tamaño del VI, recuperar su morfología elíptica y mejorar la función sistólica, consiguiendo mejorar significativamente la clase funcional a largo plazo y disminuir el número de reingresos hospitalarios por IC.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.