La rotura septal ventricular postinfarto es una entidad clínica poco frecuente de pronóstico fatal. Analizamos los factores de riesgo relacionados con la mortalidad hospitalaria y la supervivencia tras la reparación quirúrgica de la comunicación interventricular (CIV) postinfarto.
Material y métodosdesde noviembre de 1990, 27 pacientes con CIV postinfarto se han sometido a reparación quirúrgica (medianas: edad 65 años; Euroscore logístico 74%). La CIV fue posteroin-ferior en 16 (59,3%) casos. El diagnóstico de CIV se realizó 3,2±3,4 días tras el infarto agudo de miocardio (IAM). La intervención quirúrgica se realizó con carácter de urgencia en 21 pacientes (77,8%). se realizaron seis (22,2%) revascularizaciones quirúrgicas concomitantes.
ResultadosLa mortalidad hospitalaria fue 44,4% (IC 95%: 25,5–64,7%). La causa principal de mortalidad fue el shock cardiogénico. Los factores predictores de mortalidad fueron la localización de la CIV (posteroinferior 62,5 vs anterior 18%; p=0,028), el intervalo de tiempo desde el diagnóstico de CIV hasta la intervención (fallecidos 0±0 días vs supervivientes 7±12 días; p=0,004), el carácter de urgencia del procedimiento quirúrgico (urgente 57,1 vs diferido 0%; p=0,017) y la hipertensión pulmonar (HTP) preoperatoria (p=0,022).
El seguimiento medio es de 119,1±10,6 meses. la supervivencia actuarial a 11 años es de 67,5±20,7%. durante el seguimiento el 91% de los pacientes evidencian NYHA I-II, siendo la causa fundamental de fallecimiento el IAM.
Conclusionesla reparación de la CIV postinfarto presenta mortalidad hospitalaria elevada. La localización posteroinferior de la CIV y el carácter de urgencia de la intervención constituyen factores predictivos negativos. la supervivencia a largo plazo es adecuada y los pacientes evidencian un estatus funcional excelente.
Postinfarction ventricular septal defect is an uncommon entity that is usually fatal without surgical treatment. We analyze predictive factors of operative mortality and long-term survival after surgical repair.
Materials and methodsFrom november 1990, 27 patients with postinfarction ventricular septal defect underwent surgical repair (median age 65 years; median logistic Euroscore 74%). the site of the rupture was posterior in 16 patients (59.3%). the mean interval between myocardial infarction and ventricular septal defect was 3.2±3.4 days. The intervention was urgent in 21 patients (77.8%). six patients (22.2%) received a concomitant myocardial revascularization.
ResultsOperative mortality was 44.4% (CI 95%: 25.5–64.7%). the main cause of death was cardio-genic shock. Predictors for early death were the location of the ventricular septal defect (posterior 62.5 vs. anterior 18%; p=0.028), the interval between ventricular septal defect and surgical intervention (dead patients 0±0 days vs. alived patients 7±12 days; p=0.004), urgent procedure (urgent 57.1 vs. delayed 0%; p=0.017) and pre-operative pulmonary hypertension (p=0.022).
Mean follow-up is 119.1±10.6 months. Actuarial survival rate is 67.5±20.7% at 11 years. NYHA functional class after operation is I-II in 91% of the patients and the main cause of late death is myo-cardial infarction.
Conclusionssurgical repair of postinfarction ventricular septal defect is associated with very high operative risk. the posterior location of the defect and short time interval between ventricular septal defect and surgical intervention are negative factors influencing early outcome. long-term survival is appropriate and patients show optimal functional status.
La CIV postinfarto es una complicación mecánica grave del IAM. Antes de la instauración sistemática de la terapia de reperfusión la incidencia de la CIV postinfarto era del 1–2%1. El estudio GUSTO-I determinó que la terapia de reperfusión ha disminuido la incidencia hasta el 0,2–0,4%2. El compromiso hemodinámico asociado a la CIV postinfarto evoluciona hacia el establecimiento de shock cardiogénico y ulterior fracaso multiorgánico. El tratamiento médico de la CIV no es efectivo, con una mortalidad superior al 80% en el primer mes y al 90% en el primer año2–5. En este contexto, la reparación quirúrgica de la CIV postinfarto se ha definido como el tratamiento de elec ción5,6. Los resultados de la reparación quirúrgica de la CIV postinfarto han mejorado sustancialmente en la última década. Ello es consecuencia del desarrollo de las técnicas de diagnóstico precoz, inclusión sistemática en las medidas de apoyo hemodinámico preoperatorio del balón de contrapulsación intraaórtico (BCIAo), establecimiento del carácter de urgencia de la corrección quirúrgica y del desarrollo de técnicas quirúrgicas que preservan la integridad del miocardio no infartado4,5.
El objetivo de nuestro estudio es identificar predic-tores de mortalidad hospitalaria y de supervivencia a largo plazo en los pacientes sometidos a corrección quirúrgica de CIV postinfarto.
Material y métodosPoblaciónDesde noviembre de 1990, 27 pacientes con diagnóstico de CIV postinfarto han sido sometidos a la reparación quirúrgica de ésta en el Servicio de Cirugía Cardíaca del Hospital Universitario 12 de Octubre de Madrid. Todos los pacientes con sospecha de CIV postinfarto fueron ingresados en la unidad coronaria si previamente no lo estaban.
Evaluación hemodinámicaEn todos los casos de sospecha de CIV postinfarto se realizó cateterismo cardíaco derecho mediante la inserción de catéter de Swan-Ganz. El diagnóstico de CIV postinfarto se confirmó inicialmente mediante la presencia de salto oximétrico entre la aurícula derecha y la arteria pulmonar. La magnitud de la derivación de flujo izquierda-derecha se estimó a partir de la razón de los flujos pulmonar (Qp)/sistémico (Qs) según la metodología estándar7.
Evaluación ecocardiográficaActualmente, la ecocardiografía-Doppler es la prueba complementaria de elección para el diagnóstico de la CIV postinfarto, con sensibilidad y especificidad prácticamente del 100%8. La ecocardiografía localiza y caracteriza el defecto septal, determina el grado de disfunción ventricular derecha e izquierda, valora la presión pulmonar y excluye la coexistencia de insuficiencia mitral o rotura de la pared libre ventricular9 (Fig. 1).
La ecocardiografía-Doppler es la prueba complementaria de elección para el diagnóstico de la CIV postinfarto. A: ecocardiografía bidimensional que caracteriza y localiza una CIV posteroinferior. B: el modo Doppler define la derivación de flujo izquierda-derecha. VI: ventrículo izquierdo; AI: aurícula izquierda.
En todos los pacientes con sospecha de CIV postinfarto se realizó ecocardiografía bidimensional con medición de flujos mediante el efecto Doppler. En los pacientes derivados desde otros centros sanitarios con el diagnóstico establecido de CIV postinfarto se repitió el estudio ecocardiográfico para confirmar los ha-llazgos y valorar la posible progresión del deterioro de la función ventricular.
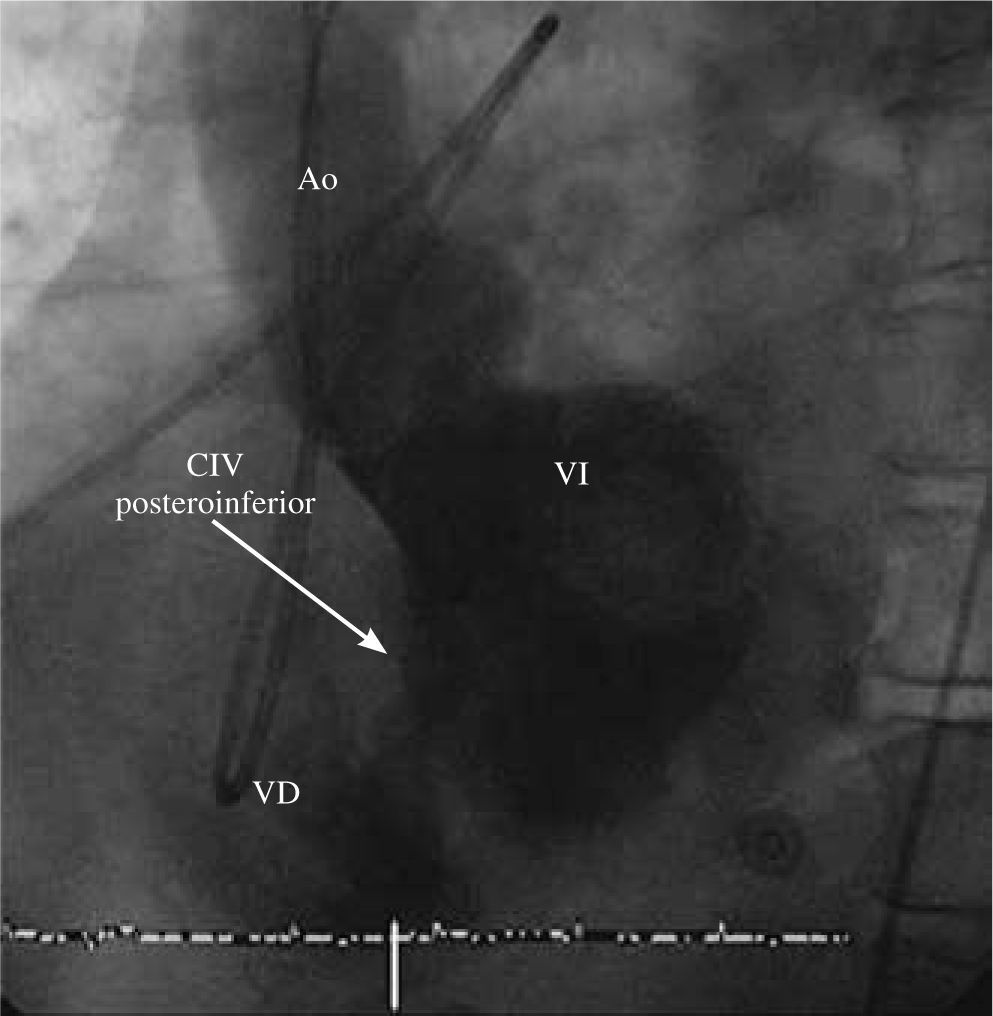
Coronariografía y ventriculografíaEl protocolo de valoración de los pacientes afectos de CIV postinfarto incluye la realización de coronariografía. Se realizó coronariografía cuando las condiciones hemodinámicas de los pacientes permitieron su trasla-do a la sala de hemodinámica, así como diferir la in-tervención quirúrgica el tiempo que supone la realiza-ción del estudio angiográfico. En los pacientes en que se realizó coronariografía también se realizó ventricu-lografía para la confirmación de la localización y carac-terísticas de la CIV (Fig. 2).
Apoyo médico preoperatorioEl protocolo de tratamiento médico preoperatorio incluye como elemento esencial la aplicación de apoyo hemodinámico mecánico con BCIAo con objeto de disminuir la poscarga y la cuantía de la derivación de flujo izquierda-derecha1. Como medidas complementarias dirigidas a disminuir la poscarga y mantener la estabilidad hemodinámica se emplearon diuréticos, nitroprusiato y agentes inotropos cuando fue preciso.
Técnica quirúrgicaRespecto a la técnica quirúrgica aplicada para la reparación de las CIV postinfarto se distinguen dos perio-dos. Un primer periodo hasta el año 1995 que incluye a nueve pacientes, y en el que se aplican distintas técnicas quirúrgicas hasta ese momento descritas, y un segundo periodo a partir de 1995 que incluye a los 18 pacientes restantes y en el que sistemáticamente se aplica la técnica de exclusión del infarto con parche endocárdico descrita por David, et al.10.
En los pacientes en que se realizó coronariografía y se objetivó enfermedad coronaria multivaso se realizó revascularización quirúrgica concomitante tras la reparación de la CIV postinfarto.
SeguimientoEl seguimiento de los pacientes se ha realizado me-diante visita médica en el Hospital Universitario 12 de Octubre de Madrid, tomando como fecha de inicio del seguimiento la fecha de la intervención quirúrgica.
Análisis estadísticoSe ha analizado la influencia de variables clinicodemográficas, operatorias y hemodinámicas sobre la mortalidad hospitalaria y la supervivencia. Las variables continuas son presentadas como media ± DS y las cate-góricas como frecuencias. La asociación entre variables categóricas se analizó mediante el test χ2 de Pearson o el estadístico exacto de Fisher. Las variables cuantitativas se analizaron aplicando el test t de Student o el test U de Mann-Whitney en función de la normalidad de las distribuciones según el test de Shapiro-Wilk.
La capacidad discriminativa de variables cuantitativas continuas para definir categorías excluyentes se evaluó mediante curva ROC.
Las curvas de supervivencia fueron calculadas mediante el método de Kaplan-Meier, y para la comparación de la supervivencia entre grupos en función de cada uno de los factores pronósticos considerados se empleó el test log-rank.
Se consideró estadísticamente significativo un valor de p <0,05.
ResultadosCaracterización de la serieLa edad media de la serie es de 65±10 años. El 78% (21/27) de los pacientes eran hombres. El riesgo quirúr-gico promedio de la serie, estimado según EuroScore logístico, es del 67,1±18,4% (IC 95%: 59,8–79,4%). La CIV fue posteroinferior en 16 (59,3%) casos y anterior en 11 (40,7%). Siete pacientes (26%) presentaron insuficiencia mitral isquémica asociada a la CIV. El mecanismo responsable de la insuficiencia mitral isquémica fue disfunción ventriculopapilar en cinco ca-sos (18,5%) y rotura del músculo papilar en dos (7,5%). El diagnóstico de CIV se realizó 3,2±3,4 días (IC 95%: 1,65–4,75 días) tras el IAM; en las primeras 24 h de evolución del IAM se realizaron el 42,9% de los diagnósticos de CIV, y dentro de la primera semana postinfarto el 95,2%. La CIV postinfarto condicionó el desarrollo de shock cardiogénico en el 66% (18/27) de los pacientes, y en el 36,4% de ellos se evidenció HTP en grado grave (presión sistólica pulmonar ≥ 60mmHg). En el 96% (26/27) de la serie se implantó BCIAo preopera-toriamente. El 74% de los pacientes se intervinieron inmediatamente tras el diagnóstico de CIV postinfarto, con lo que el tiempo de apoyo preoperatorio con BCIAo fue inferior a 24 h en estos casos. En todos los pacientes se mantuvo postoperatoriamente el apoyo con BCIAo un mínimo de 72 h, con la excepción de aquellos casos en que se objetivó síndrome de malperfusión del miembro inferior secundario al BCIAo.
Se realizó coronariografía en el 59% (16/27) de los pacientes. Se objetivó enfermedad de un vaso en el 62% (10/16) de los casos, enfermedad de dos vasos en el 19% (3/16), y enfermedad de tres vasos en el 19% (3/16).
El tiempo medio desde el diagnóstico de CIV hasta la intervención quirúrgica fue de 3,6±9,2 días (IC 95%: 0–7,36 días), que fue urgente en 21 pacientes (77,8%) y diferida en seis (22,2%).
Se aplicó la técnica de exclusión del infarto mediante parche endocárdico en los últimos 18 pacientes de la serie (67%). Se realizó revascularización quirúrgica concomitante en el 22% (6/27) de los casos. Ello re-presenta el 100% de los pacientes en que el estudio coronariográfico objetivó enfermedad coronaria multivaso. El número de injertos/paciente fue de 1,50±0,84 (IC 95%: 0,62–2,38 injertos/paciente). Se empleó sistemáticamente la arteria mamaria interna izquierda para revascularizar la arteria descendente anterior e injertos de vena safena interna para el resto de arterias coronarias.
Mortalidad hospitalariaSe ha considerado mortalidad hospitalaria la que acontece en los 30 días subsiguientes a la intervención quirúrgica o mientras el paciente permanezca hospitalizado tras la corrección quirúrgica de la CIV. La morta-lidad hospitalaria fue del 44,4% (IC 95%: 25,5–64,7%) y la tasa de mortalidad ajustada al riesgo quirúrgico 0,66. La causa principal de mortalidad fue el shock car-diogénico (75%). Los factores predictores de mortalidad identificados mediante análisis univariante fueron la localización de la CIV (posteroinferior 62,5 vs anterior 18%; p=0,028), el intervalo de tiempo desde el diagnóstico de CIV hasta la intervención (fallecidos 0±0 días vs supervivientes 7±12 días; p=0,004), el carácter de urgencia del procedimiento quirúrgico (urgente 57,1 vs diferido 0%; p=0,017) y la presencia de HTP preoperatoria (p=0,022; OR: 11; IC 95%: 1,4–85,2).
El EuroScore logístico también se comporta como factor pronóstico de mortalidad (EuroScore exitus: 77,5±9,2% vs EuroScore vivos: 58,7±19,8%; p=0,012). El 75% de los pacientes que integran la mortalidad hospitalaria presentan EuroScore logístico preoperatorio mayor de 70%, mientras que el 75% de los pacientes que sobreviven a la corrección quirúrgica de la CIV postinfarto presentan EuroScore logístico preoperatorio menor de 70%. La curva ROC de distribución de los distintos valores de Euro Score logístico establece como punto de corte para definir pacientes de riesgo quirúrgico especialmente alto el valor de EuroScore logístico de 71,61% (sensibilidad 83%, especificidad 74%) (Fig. 3).
El 75% de los pacientes que fallecen presentan EuroScore logístico preoperatorio mayor de 70%, mientras que el 75% de los pacientes que sobreviven a la corrección quirúrgica de la CIV presentan EuroScore logístico preoperatorio menor de 70% (A). La curva ROC de distribución de los distintos valores de EuroScore logístico establece como punto de corte para definir pacientes de riesgo quirúrgico especialmente alto el valor de EuroScore logístico de 71,61% (B)
La principal complicación postoperatoria objetivada fue la situación de bajo gasto cardíaco (14/27; 52%). Dos pacientes (7,4%) presentaron IAM perioperatorio, y en otros dos (7,4%) se evidenció CIV residual en el posto-peratorio inmediato que requirió reintervención. El 44% de la serie (12/27) precisó ventilación mecánica prolon-gada (> 24 h), y la estancia postoperatoria global fue de 14,4±12,6 días (rango: 0–45 días; mediana 12 días).
Supervivencia a largo plazoEl seguimiento medio de la serie es de 119,1±10,6 meses. En el cálculo de la supervivencia actuarial se ha excluido la mortalidad hospitalaria. La supervivencia actuarial a 11 años es del 67,5±20,7% (Fig. 4). Durante el seguimiento el 91% de los pacientes evidencian NYHA I-II, y ningún paciente presentó CIV residual significativa. La causa de fallecimiento de todos los pacientes durante el seguimiento es el IAM.
DiscusiónIncidencia y factores de riesgoLa incidencia de la CIV postinfarto se ha reducido hasta el 0,2–0,4% tras la aplicación sistemática de los procedimientos de reperfusión en la atención del IAM2. Esta complicación mecánica aparece fundamentalmente en la primera semana postinfarto, con una distribución temporal bimodal que presenta un primer pico de incidencia en las primeras 24 h y otro más marcado entre el tercer-quinto día postinfarto3,4,11. En nuestra serie el diagnóstico de CIV postinfarto se efectúa principalmente en las primeras 24 h de evolución del IAM (42,9%), exis-tiendo un segundo pico de incidencia entre el tercer-quinto día, pero de menor magnitud (38,1%), y confirmándose dentro de la primera semana postinfarto el 95,2% de los diagnósticos de CIV postinfarto. Estos hallazgos están en consonancia con los de los grupos de trabajo, que han demostrado que, en los pacientes sometidos a terapia de trombólisis, la aparición de la CIV se anticipa a las primeras horas de evolución del IAM debido a la facilitación de la necrosis hemorrágica1,12.
Los factores clinicodemográficos identificados como factores de riesgo para el desarrollo de una CIV postinfarto son: sexo femenino, ausencia de episodios isquémicos previos, oclusión aguda de un único vaso, escaso desarrollo de la circulación colateral y transmuralidad de la zona de necrosis13. La ausencia de angina/IAM previos y la oclusión de un único vaso informan de la ausencia de desarrollo de precondicionamiento isquémico y circulación colateral, lo que determina la transmuralidad del infarto y en última instancia la disrupción miocárdica. En nuestra serie, se objetivó la presencia de oclusión de un único vaso en el 62% de los pacientes sometidos a coronariografía, hallazgo superponible con el informado por los grupos de trabajo que realizan coronariografía en la valoración preoperatoria de los pacientes con CIV postinfarto14.
Diagnóstico: idoneidad de la realización de coronariografíaEl escenario clínico de presentación de la CIV postinfarto es común al de la insuficiencia mitral secundaria a la rotura de un músculo papilar en el seno de un IAM, y ambas complicaciones mecánicas pueden coexistir hasta en un tercio de los casos15. La ecocardiografía-Doppler ha de considerarse el patrón oro para el diagnóstico de la CIV postinfarto, con sensibilidad y especificidad del 100%8. Existe controversia en cuanto a la idoneidad de la realización de la coronariografía debido al consumo de tiempo asociado y a la morbimortalidad inherente de este procedimiento en pacientes en situación de shock cardiogénico. Nuestro grupo considera que la realización de coronariografía en los pacientes afectos de CIV postinfarto se ha de incluir en el protocolo de valoración preoperatorio, pues se ha demostrado que la revascularización miocárdica concomitante con la reparación de la CIV optimiza los resultados a largo plazo en términos de supervivencia4,5,10,14,16. En nuestra serie se realizó co-ronariografía en el 59% (16/27) de los pacientes, que son aquellos pacientes cuya estabilidad hemodinámica relativa permitió su traslado a la sala de hemodinámica y diferir la intervención quirúrgica el tiempo que consume la realización del estudio. Debe evitarse la realización de ventriculografía pues supone una sobrecarga de volumen biven-tricular e incide negativamente sobre la función renal7.
TratamientoTratamiento médico y balón de contrapulsación intraaórticoEl diagnóstico de CIV postinfarto en situación de shock cardiogénico marca la necesidad de tratamiento quirúrgico urgente5,6. El apoyo farmacológico está dirigido a conseguir estabilidad hemodinámica temporal que permita efectuar la intervención quirúrgica en las mejores condiciones posibles. El empleo de vasodilatadores disminuye la derivación de flujo izquierda-derecha, lo que optimiza el gasto cardíaco. Sin embargo, la presencia de grado grave de shock cardiogénico imposibilita la administración de vasodilatadores, precisando apoyo vasopresor. Los agentes inotrópicos y vasopresores incrementan el gasto cardíaco pero también la poscarga y el consumo miocárdico de oxígeno. En este contexto específico de shock cardiogénico el apoyo hemodinámico temporal más eficiente es el BCIAo. En nuestra serie, en la práctica totalidad de los pacientes (96%) se implantó BCIAo como apoyo hemodinámico preoperatorio. La estabilidad hemodinámica preoperatoria mejora el pronóstico de los pacientes, pero no se ha de prolongar el tiempo hasta la intervención quirúrgica en favor de alcanzar una mayor estabilidad hemodinámica, pues reducir el tiempo de shock cardiogénico es lo único que puede evitar una situación de fracaso multiorgánico irreversible5,17,18.
Tratamiento quirúrgicoCooley, et al.19 realizaron la primera reparación quirúrgica de una CIV postinfarto en 1957. Desde entonces el tratamiento quirúrgico se ha establecido como la opción terapéutica «de elección» para esta enfermedad de tan difícil manejo4,5. Inicialmente se consideró que la cirugía habría de diferirse 3–6 semanas desde el diagnóstico debido a que la fragilidad del tejido miocárdico no garantizaría una reparación segura. Sin embargo, menos del 5% de los pacientes afectos de CIV postinfarto presentan una estabilidad hemodinámica que les permita ser sometidos a una intervención diferida. Actualmente existe consenso en que los pacientes con CIV postinfarto han de ser sometidos a cirugía urgente, pues la mortalidad asociada a la evolución natural del proceso sobrepasa el alto riesgo quirúrgico de la reparación precoz1,6. En nuestra institución la intervención quirúrgica se ha realizado con carácter de urgencia vital (< 24h desde el diagnós-tico de CIV) en el 74,1% de los casos, con carácter urgente (entre las 24–72h del diagnóstico) en el 3,7%, y se realizó de forma diferida (> 72h desde el diagnóstico) en el 22,2%. Los motivos que condicionaron que estos seis pacientes fueran intervenidos con carácter diferido son fundamentalmente dos: 1) pacientes en los que el diagnóstico se realiza en otra institución sanitaria y se empleó un tiempo superior a las 72h en su estabilización hemodinámica relativa antes de efectuarse el traslado, y 2) pacientes con estabilidad hemodinámica absoluta que inicialmente no precisaron apoyo inotrópico/diurético y mantenían diuresis y marcadores de función renal en el rango de la normalidad; en estos pacientes se realizó la intervención quirúrgica cuando cualquiera de los criterios anteriores se modificó o cuando transcurrieron 4–6 semanas desde el diagnóstico. En la gran mayoría de pacientes que inicialmente presentaban estabilidad hemodinámica absoluta, la indicación de la intervención quirúrgica se realizó como consecuencia de deterioro hemodinámico antes de esas 4–6 semanas (5/6; 83%).
Las técnicas quirúrgicas actuales se fundamentan en: 1) establecimiento expeditivo de circulación extracorpórea y exquisita protección miocárdica con cardioplejía; 2) acceso a la CIV mediante ventriculotomía izquierda limitada determinada por la localización del infarto transmural; 3) inspección de los músculos papilares y sustitución de la válvula mitral concomitante sólo si se evidencia rotura papilar; 4) mínima atricción del miocardio ventricular sano; 5) mantenimiento de la geometría ventricular, y 6) cierre del defecto septal sin tensión mediante la aplicación de material protésico.
La técnica de exclusión del infarto con parche endocárdico, descrita por David, et al.10, en 1995, se ajusta perfectamente a tales principios, manteniendo la geometría ventricular y protegiendo al ventrículo derecho de la agresión quirúrgica, cuya disfunción representa un claro deter-minante de la mortalidad hospitalaria4,5,10,14,16. Desde el año 1995 se aplica sistemáticamente en nuestra institución esta técnica para la reparación de la CIV postinfarto, y ha sido realizada en 18 pacientes, lo que representa la técnica en que mayor experiencia acumulamos (67% de los casos).
Como ya ha sido señalado, la necesidad de la realización de revascularización quirúrgica concomitante es un aspecto controvertido. En nuestra serie la realización de revascularización miocárdica concomitante con la reparación de la CIV no evidencia asociación con la mortalidad hospitalaria, resultados compatibles con los informados por otros grupos20. Ello no implica que la realización de cirugía de revascularización concomitante no sea rentable en términos de mortalidad hospitalaria, ya que no condiciona una mayor mortalidad hospitala-ria, y sin embargo se ha demostrado que la revascularización de los pacientes con enfermedad multivaso se asocia con mayor supervivencia a largo plazo tras la reparación de la CIV postinfarto14,16.
En los dos pacientes en que se evidenció insuficiencia mitral isquémica aguda secundaria a rotura de múscu-lo papilar, se corrigió la misma mediante el implante de prótesis mitral con técnicas de preservación del aparato subvalvular.
Cierre percutáneo de las comunicaciones interventriculares postinfartoRecientemente se han publicado casos de cierre percutá-neo de las CIV postinfarto21,22. Aunque el cierre percutáneo se ha presentado como alternativa a la corrección quirúr-gica, el número de casos informado es muy reducido, y existen varios aspectos conflictivos en la aplicación de los dispositivos actuales1. La fragilidad del tejido miocárdico adyacente a la CIV condiciona que los intentos de progresar el dispositivo de cierre percutáneo a través del defecto septal pueda aumentar las dimensiones del mismo, además de que la manipulación de este tejido adyacente necrótico puede derivar en la embolización sisté-mica de fragmentos del mismo. En el caso particular de las CIV posteroinferiores, los defectos septales presentan frecuentemente localización basal en inmediata vecindad de las válvulas mitral y tricúspide, por lo que la expansión de los dispositivos de cierre puede condicionar la aparición de regurgitación mitral y/o tricúspide.
Por otro lado, la evolución del proceso de necrosis miocárdica provoca una alta incidencia de CIV residual tras el cierre inicial del defecto septal con dispositivos percutáneos21. No obstante, quizá la indicación con mayor rentabilidad de los dispositivos de cierre percutáneo sea precisamente el cierre de defectos septales residuales tras cierre quirúrgico primario23. En este contexto el resultado del cierre del defecto septal suele ser satisfactorio debido a que el anclaje del dispositivo se realiza sobre bordes de tejido fibroso.
En nuestra serie se objetivaron dos casos de CIV residual en el postoperatorio inmediato (7%) que precisaron reintervención quirúrgica, pues condicionaron importante deterioro hemodinámico de los pacientes, que fallecieron en el periodo postoperatorio inmediato. Du-rante el seguimiento no se objetivaron datos de CIV residuales significativas en ninguno de los pacientes.
Mortalidad hospitalariaLa mortalidad de los pacientes afectos de CIV postinfarto sometidos a manejo conservador supera el 90% en el primer mes, mientras que la mortalidad hospitalaria de los pacientes sometidos a tratamiento quirúrgico es del 30–50%2–6,16,24. La mortalidad hospitalaria registrada en nuestra serie se encuentra dentro del rango comunicado por la mayoría de grupos: 44,4% (IC 95%: 25,5–64,7%). Sistemáticamente, el shock cardiogénico aparece como la principal causa de mortalidad hospitalaria, lo cual es también reafirmado por los resultados de nuestra serie, en la que la causa última de mortalidad tras la reparación de la CIV postinfarto es el shock cardiogénico en el 75% de los casos.
Como en otras series, la localización posteroinferior de la CIV ha mostrado asociación con la mortalidad hospitalaria6,20,25. La mayor mortalidad de las CIV pos-teriores pudiera estar relacionada con la mayor dificultad técnica de la reparación de las CIV de localización posterior17, la posible afectación de la válvula mitral en los IAM de localización posteroinferior y la mayor inci-dencia de fallo del ventrículo derecho. El componente de mortalidad en las CIV posteriores atribuible a la mayor dificultad técnica pudiera haber sido neutralizado por la técnica de exclusión del infarto10.
El intervalo de tiempo desde el diagnóstico de CIV hasta la intervención y el carácter de urgencia del procedimiento quirúrgico se muestran como claros determinantes del pronóstico inmediato de los pacientes. Mientras que la mortalidad en los pacientes intervenidos con carácter urgente es prácticamente del 60%, ninguno de los pacientes intervenidos de forma diferida por presentar inicialmente estabilidad hemodinámica, fallece. Este resultado es compatible con los informados por la gran mayoría de grupos, y entre las razones que justificarían la mayor mortalidad hospitalaria en los pacientes que son intervenidos precozmente se encuentran el carácter crítico de los pacientes en el seno de un IAM transmural extenso y la mayor dificultad técnica que conlleva la reparación de la CIV en un miocardio con necrosis en evolución6,16,17.
La disfunción del ventrículo derecho ha sido definida como factor de riesgo independiente para la mortalidad hospitalaria1,5,10,16,20,25. En nuestra serie no existe valoración sistemática documentada preoperatoria de la función del ventrículo derecho. No obstante, la presencia de HTP grave preoperatoria ha evidenciado fuerte asociación con la mortalidad hospitalaria (OR: 11; IC 95%: 1,4–85,2). La instauración de HTP en grado grave de forma aguda es un claro determinante del fracaso ventricular derecho, y muy posiblemente ésa sea la causa de que la HTP se compor-te en nuestra serie como factor pronóstico negativo.
La curva ROC de distribución de los distintos valores de EuroScore logístico establece como punto de corte para definir pacientes de riesgo quirúrgico especial-mente alto el valor de EuroScore logístico del 71,61% (sensibilidad 83%, especificidad 74%). Sin embargo, convergemos con aquellos grupos que han informado de que el único criterio que debe considerarse contraindicación para someter a un paciente a la reparación quirúrgica de una CIV postinfarto es la presencia de fracaso multiorgánico7.
Supervivencia a largo plazoEn las series más extensas la supervivencia actuarial a 5 años tras la reparación quirúrgica de la CIV se sitúa por encima del 60%, con un excelente estatus funcional (NYHA I-II) en más del 90% de los pacientes1,2,7,10,14,17. Los resultados objetivados por nuestro grupo reafirman la efectividad de la reparación quirúrgica de la CIV postinfarto, con supervivencia actuarial a 11 años del 67,5±20,7% y clase funcional NYHA I-II del 91% de los pacientes durante el seguimiento.
Uno de los aspectos más importantes a considerar al evaluar la supervivencia a largo plazo tras la reparación de la CIV postinfarto es la relevancia de la realización de revascularización miocárdica concomitante. Varios gru-pos han demostrado que la revascularización miocárdica concomitante evidencia impacto positivo sobre la super-vivencia a largo plazo16, e incluso se ha informado de que la realización de revascularización incompleta repre-senta un factor de riesgo mayor para mortalidad de causa cardíaca a largo plazo14. En nuestra serie no hemos podido demostrar asociación entre la revascularización miocárdica concomitante y la supervivencia a largo plazo. Hemos de señalar que nuestra serie está integrada por un número reducido de casos y que sólo se realizó coronario-grafía en el 59% de los pacientes, inconvenientes ambos para alcanzar conclusiones firmes en este aspecto particular. No obstante, aunque la revascularización quirúrgica concomitante no ha condicionado una mayor supervivencia a largo plazo, es muy posible que los pacientes en que se realizó revascularización quirúrgica hubieran pre-sentado peor pronóstico vital a largo plazo si dicha revas-cularización concomitante no hubiese sido realizada.
La revascularización quirúrgica concomitante no in-fluye sobre la mortalidad precoz tras la reparación de la CIV5,20, pero su influencia positiva sobre el pronóstico vital a largo plazo de los pacientes está en relación con la reducción de la incidencia de ulteriores eventos isquémicos; es decir, la cirugía de revascularización concomi-tante con la reparación de la CIV representa tratamiento de la cardiopatía isquémica crónica, y sus beneficios por ello se objetivan sobre la supervivencia a largo plazo y no sobre la mortalidad hospitalaria. En nuestra serie, los pacientes que fallecen durante el seguimiento lo hacen como consecuencia de IAM. Aun no habiendo podido demostrar asociación entre la revascularización miocárdica concomitante y la supervivencia a largo plazo, es importante reseñar que todos los fallecimientos durante el seguimiento son casos en que no se realizó revascularización miocárdica concomitante con la reparación de la CIV. En estos pacientes que fallecieron durante el seguimiento por IAM no se realizó coronariografía previa a la corrección de la CIV postinfarto. Nuestro grupo considera que se ha de realizar coronariografía preoperatoria en todos los pacientes que vayan a ser sometidos a co-rrección de la CIV postinfarto, y que se ha de realizar revascularización miocárdica concomitante cuando se objetive enfermedad multivaso, obviando ésta en aque-llos casos de enfermedad de un único vaso, pues el territorio miocárdico dependiente de éste presenta necrosis transmural extensa, y la revascularización miocárdica no resultaría rentable.
ConclusionesLa CIV postinfarto es una entidad clínica infrecuente. La reparación quirúrgica de la CIV postinfarto asocia mortalidad hospitalaria elevada. La localización posteroinferior de la CIV y el carácter de urgencia de la intervención constituyen factores predictivos negativos. A pesar de que la mortalidad de la reparación quirúrgica se relaciona con la proximidad temporal entre el IAM y la intervención quirúrgica, ésta ha de indicarse con carácter de ur-gencia para evitar que el desarrollo de shock cardiogénico derive en fracaso multiorgánico. En los pacientes que sobreviven, la supervivencia a largo plazo es adecuada y los pacientes evidencian un estatus funcional excelente.