El uso de dispositivos de asistencia ventricular se ha ido extendiendo en las últimas décadas. La mejora de los resultados ha ido acompañada del diseño de nuevos aparatos más pequeños y eficientes como son las bombas de flujo axial. las características técnicas básicas de estos dispositivos se hallan en la generación de un flujo continuo unidireccional conseguido mediante sistemas de turbina que obtienen su alimentación de una fuente eléctrica. Las ventajas principales de estos dispositivos son: su facilidad de implantación por su tamaño reducido, su prolongada durabilidad gracias a su sencillo diseño y su eficiencia energética al utilizar energía eléctrica. Su utilidad se ha podido demostrar en diferentes indicaciones de asistencia circulatoria mecánica, como en el caso de puente al trasplante o dispositivo de recuperación miocárdica, si bien donde radica más interés es en su uso como sistemas de asistencia circulatoria mecánica definitiva. Existe una variedad de modelos de diversos diseños. Son dispositivos que permiten soporte normalmente univentricular izquierdo, que se implantan en el tórax con cánula de entrada a nivel ventricular y cánula de salida a nivel aórtico. En este artículo se efectúa una descripción de los principales sistemas disponibles en la actualidad, comentando las características técnicas, ventajas e inconvenientes y un resumen de la experiencia existente.
There has been a wide use of mechanical circulatory support devices in the last three decades. Improvement of results has been followed by the design of new devices with small size and high efficiency as the axial flow pumps. The technical characteristics of those devices are based on their ability to generate unidirectional flow with an electrical supplied turbine. Major advantages of axial flow pumps are: the easy of implantation due to the smaller size, the long durability because of the simple design and the high energetic efficiency with the direct electrical supply. The usefulness of those devices has been proved in different indications of mechanical circulatory support as bridge to transplantation or in myocardial recovery, but there is special interest as long-term or destination therapy. there is a large variety of devices; they follow the same working principle but differ on design. They mostly provide univentricular left heart support and can be implanted inside the chest. The inflow cannula is placed in the ventricle and the outflow cannula in the aorta. A description of the different available models of axial flow devices along with their technical characteristics, advantages and disadvantages and a brief review of the global experience is performed.
Los buenos resultados obtenidos con los dispositivos de asistencia ventricular neumáticos1 han llevado al desarrollo de nuevos sistemas de asistencia más pequeños y compactos. Uno de los motivos para disminuir el tamaño se debe a que la mayoría son demasiado grandes para pacientes con una superficie corporal inferior a 1,5m2, lo que los hace inapropiados para su uso en niños y en adultos de talla pequeña. Su excesivo tamaño también conlleva complicaciones de hemorragia e infecciones especialmente en implantes a largo plazo. En los últimos años se han desarrollado dispositivos eléctricos de flujo axial que permiten disminuir las complicaciones derivadas del tamaño y de las características de los sistemas pulsátiles.
Sistemas de flujo axialDefiniciónSon dispositivos de asistencia ventricular que utilizan un sistema de turbina que proporciona un flujo paralelo a su eje de rotación.
FuncionamientoSu funcionamiento se basa en el principio del tornillo sinfín o de Arquímedes, que permite obtener un flujo unidireccional gracias a la diferencia de presión que genera el movimiento rotativo de la turbina helicoidal2.
Características comunesLas bombas axiales están constituidas básicamente por una estructura cilíndrica conectada a una cánula de entrada y a una cánula de salida en ambos polos. En su interior se aloja un sistema de turbina helicoidal rotativo impulsado por un motor que permite generar un flujo unidireccional entre las cánulas de entrada y salida. Habitualmente se trata de micromotores eléctricos de alta eficiencia energética, controlados por una unidad externa a la que se conectan mediante un cable por donde también llega su alimentación eléctrica. La cánula de entrada suele implantarse en el ápex, y la de salida en la aorta por encima de la válvula aórtica.
VentajasEstos dispositivos tienen pocas partes móviles, no requieren válvulas y la superficie de contacto con la sangre es menor. Debido a su construcción optimizada se consigue un funcionamiento de larga duración sin prácticamente ningún desgaste y con baja disipación calórica. El hecho de haber reducido su tamaño facilita también tanto su implantación como su explantación3.
InconvenientesUno de los inconvenientes potenciales es su incapacidad para generar un flujo pulsátil, aunque en estudios publicados no se han podido observar diferencias en cuanto a la recuperación de organos4. Entre otros inconvenientes, la hemólisis, que parece superior en según qué dispositivos axiales5.
TiposEntre los diferentes tipos de bombas axiales encontramos básicamente dos tipos: de corta duración y de larga duración.
Bombas axiales de corta duraciónDispositivos que permiten asistencia ventricular de corta duración, es decir, inferior a 1 mes. El único disponible es Impella Recover® (Abiomed Inc, Danver, MA, USA), que permite soporte ventricular izquierdo por acceso periférico femoral o esternotomía.
Impella Recover®Desarrollado inicialmente por Impella Cardiotechnik AG, en Alemania, fue adquirido por Abiomed Inc. Los dispositivos Impella Recover® consisten en un micromotor que mueve un rotor suspendido en levitación magnética, montado en un cilindro metálico con una entrada y una salida que permite impulsar la sangre. El dispositivo cilíndrico se introduce a través de la válvula aórtica, en el caso de las asistencias izquierdas, o a través de la válvula pulmonar en las derechas.
En el caso de los sistemas de asistencia izquierda, existen modelos que pueden ser implantados por vía periférica retrógrada a través de la arteria femoral, por vía percutánea (Impella LP 2.5) o canulación directa de la arteria femoral (Impella LP 5.0), y modelos que se implantan por canulación directa de la aorta ascendente (Impella LD). El sistema de asistencia derecha sólo puede implantarse quirúrgicamente por esternotomía (Impella RD).
Su tamaño es de 4–7mm de diámetro y 13mm de longitud. Su velocidad de rotación es de hasta 51.000rpm, consiguiendo flujos de 2,5 l/min (Impella LP 2.5), y de hasta 33.000 con flujos de 5l/min (Impella LP 5.0 y LD 5.0). Existe una consola de control (Impella Mobile Console) con un sistema de bomba de infusión continua de solución glucosa al 20% para su lubricación.
Los sistemas percutáneos (Impella LP 2.5) se utilizan habitualmente en el laboratorio de hemodinámica en procedimientos de riesgo o en caso de infarto de miocardio (IAM). Con ellos se consiguen flujos de 2,5l/min, y su utilización aconsejada es de menos de 5 días.
Con los sistemas LP 5.0 y LD 5.0 se consiguen flujos de hasta 5l/min, por lo que su indicación será soporte ventricular en pacientes con fallo poscardiotomía o en shock cardiogénico post-IAM con un tiempo de soporte de hasta 10 días.
ImplantaciónEl sistema percutáneo puede implantarse mediante técnica de Seldinger por punción de la arteria femoral con el uso de un introductor 12 F. Se introduce retrógradamente hasta atravesar la válvula aórtica. Los dispositivos quirúrgicos pueden ser implantados a nivel femoral por disección de las arterias femoral o ilíaca (21 F). En caso de implante transtorácico es necesaria la utilización de una prótesis de dacrón de 10mm de diámetro que es suturada a la aorta ascendente y por la cual se introducirá el dispositivo hasta atravesar la válvula aórtica.
ExperienciaHasta la fecha los sistemas de soporte circulatorio Impella Recover® han sido utilizados en más de 1.170 pacientes, en más de 200 centros. El 53% LP 2.5, el 23% LD, el 13% LP 5.0 y el 12% RD. En el caso de la LP 2.5, la mayoría se usó en pacientes de alto riesgo durante procedimientos coronarios percutáneos (63%), aunque también en casos de insuficiencia cardíaca por bajo gasto (30,5%).
En cirugía cardíaca, el uso mayoritario ha sido la LD (48%), RD (25%), LP 5.0 (21%) y LP 2.5 (6%). El objetivo prioritario ha sido la recuperación en el 94% de los casos, puente al trasplante (2,5%) o puente a otro dispositivo de soporte (3,5%). En un 46% de casos en los se implantó una Impella LD se logró la desconexión del sistema. En el caso de Impella LP 2.5 y 5.0 se desconectaron el 89 y 52% de los casos, respectivamente. Finalmente, en caso de asistencia derecha con Impella RD, sólo se logró la desconexión en el 26% de los pacientes6. El dispositivo Impella posee la certificación CE europea.
Bombas axiales de larga duraciónDispositivos que permiten asistencia ventricular básicamente de tipo ventricular izquierda. Actualmente, los sistemas más utilizados son los siguientes: Jarvik 2000®, HeartMate® II, MicroMed-DeBakey®, Berlin Heart INCOR®.
Jarvik 2000 FlowMaker®Desarrollado desde 1987 conjuntamente por el Texas Heart Institute, el Oxford Heart Center y Transicoil Inc (Norristown, PA, USA).
Características técnicasEstá constituido por un cilindro de titanio donde se aloja un micromotor que mueve una turbina de titanio. El rotor se encuentra suspendido por cojinetes de tipo cerámico y es la única parte móvil del dispositivo. Existe un modelo pediátrico cuyo tamaño es cinco veces menor. La cánula de salida está configurada con una prótesis de dacrón. Posee una batería de litio que permite una autonomía de 8–10 h con la que se conecta mediante un cable a través de la piel. La conexión transcutánea puede realizarse con un conector a nivel abdominal o en la región posterior del lóbulo auricular.
La velocidad del rotor es regulada a través de un microprocesador situado en la unidad externa junto a las baterías que puede llevarse a modo de bolso o de cinturón. El sistema se recarga mediante conexión a la red eléctrica doméstica. El funcionamiento del dispositivo permite crear un flujo sanguíneo entre el ápex ventricular y la aorta ascendente o descendente que puede llegar hasta los 7l/min. El diseño para adultos opera a una velocidad determinada por la unidad de control (entre 8.000–12.000rpm), que está en relación con la frecuencia cardíaca y es ajustable por el paciente de acuerdo con su nivel de actividad (cinco niveles).
La diferencia entre el modelo de puente al trasplante y el de uso permanente está en el modo en que se conecta a la unidad externa. Para el uso permanente, se hace a través de un conector de titanio fijado detrás de la oreja, un diseño que procede de los implantes óseos con una baja incidencia de infecciones en casos con más de 20 años7.
ImplantaciónSe hace por esternotomía o toracotomía. Habitualmente requiere circulación extracorpórea, aunque no es imprescindible8. La cánula de entrada se implanta a nivel del ápex ventricular izquierdo, donde es fijada gracias a un anillo de sutura en poliéster. La sangre es dirigida hacia la aorta ascendente o descendente gracias a una prótesis de dacrón que es anastomosada en terminolateral.
ComplicacionesSe han observado complicaciones tromboembólicas en el 8–12% de los pacientes con recuperación significativa o completa en la mayoría9. Es importante el control de la coagulación con pautas específicas. La hemólisis producida por el sistema no es significativa. Las complicaciones infecciosas se han minimizado gracias a las características de la bomba, que es implantada en el interior de la cavidad ventricular en prácticamente su totalidad. A nivel de la zona de exteriorización del cable conector, también se ha logrado reducir significativamente los problemas sépticos, especialmente al utilizar los conectores implantados en la calota craneal en su área retroauricular.
ExperienciaEn los últimos 5 años, el Jarvik 2000® se ha utilizado para tratar a más de 200 pacientes en todo el mundo, un 79% como puente al trasplante y un 21% como terapia de destino. Ha obtenido altas tasas de éxito, tanto como paso previo al trasplante (70% de pacientes trasplantados) como para su uso continuado. Con su uso, pacientes extremadamente graves han conseguido una calidad de vida cercana a la normal, con bajas cotas de infección, sin fallos mecánicos registrados hasta la fecha9. El primer paciente con un Jarvik 2000® para uso definitivo sigue en activo y con buena salud casi 6 años después del implante10. Se trata del paciente que más ha sobrevivido con la ayuda continua de cualquier tipo de corazón mecánico. Muchos otros pacientes con Jarvik 2000® sobreviven más de 5 años tras el implante y el consiguiente trasplante. El dispositivo Jarvik 2000® posee recientemente la marca CE en Europa, y sigue pendiente de su autorización por la FDA.
Thoratec HeartMate® II LVASSu desarrollo se inició en 1991 entre la empresa Nimbus Corporation, ahora Thoratec Corporation (Pleasanton, California, USA) y la Universidad de Pittsburgh, dentro del programa National Institutes of Health-Innovative Ventricular Assist System (NIH-IVAS)11.
Características técnicasConsta, como todos, de tres partes básicas: un motor-bomba, cánulas de entrada y salida, y una unidad de control. El sistema emplea un rotor axial accionado electromagnéticamente y un estátor que permite asegurar un flujo laminar a la salida de la bomba. El rotor, fabricado en titanio, es la única parte móvil de la bomba y se apoya en cojinetes lubricados por el fluido sanguíneo.
ImplantaciónLa bomba se implanta por debajo del reborde costal izquierdo, por detrás del músculo recto anterior. Su cánula de entrada de titanio, en ángulo recto, cuenta con un manguito de fieltro para ser insertada y suturada a través del diafragma en el ápex del ventrículo izquierdo (VI). La cánula de salida está conectada a un tubo de polite-trafluoroetileno expandido (PTFE®) de 14mm que se anastomosa a la aorta ascendente. Una única línea de conducción eléctrica sale a través de la piel hacia la unidad de control que ajusta la velocidad de la bomba. La rotación de la turbina del HeartMate® II varía entre 6.000–15.000 rpm y proporciona hasta 10l/min de flujo continuo. Existen dos modos de control: uno de velocidad fija y otro que se establece a partir de la interpretación del nivel y de la dinámica de la corriente consumida por el motor con adaptación a las demandas. En la actualidad se encuentra en desarrollo un sistema transcutáneo de transmisión de energía con el objetivo de eliminar la necesidad de líneas de alimentación percutáneas. Este sistema emplea dos anillas de inducción, una implantada y otra externa, que actuarían como transmisores de la energía a través de la piel12. Un detalle interesante es que la superficie interna de esta bomba está texturizada, al igual que el dispositivo eléctrico HeartMate®, lo cual minimiza los requerimientos de anticoagulación.
ExperienciaLa primera implantación de una bomba de este tipo en un paciente con insuficiencia cardíaca refractaria al tratamiento médico se realizó en Israel, en el año 2000, aunque los resultados iniciales fueron desfavorables. Después de ciertas modificaciones en el diseño, la FDA autorizó su ensayo de nuevo en 2003. Actualmente, ha sido implantado en más de 1.200 pacientes en todo el mundo, con edades comprendidas entre los 14–82 años y con superficie corporal de 1,3–2,8m2. El 80% de ellos han podido ser trasplantados, desconectados o continúan con soporte. La duración máxima es de 3,6 años.
El dispositivo HeartMate® II ha sido ampliamente estudiado en su uso como puente al trasplante cardíaco con el HeartMate® II Pivotal Trial, que incluyó a 194 pacientes de 32 centros desde marzo de 2005 a septiembre de 2006. La duración media del soporte fue de 132 días, con un tiempo total acumulado de soporte de 109 años. El 80 y 77% de los pacientes habían sido trasplantados, pudieron ser desconectados o aún se mantenían en asistencia a los 6 meses y 1 año, respectivamente. El 84% de los pacientes pudieron ser dados de alta o fueron trasplantados. La incidencia de eventos adversos como infecciones, sangrado o accidentes embólicos disminuyó significativamente con respecto a otros dispositivos. Y la mayoría de los pacientes observaron una mejora significativa de sus síntomas de insuficiencia cardíaca, pasando en un 85% a clase funcional I y II, y 15% a clase III de la NYHA13.
En noviembre de 2005, recibió la conformidad CE de la CEE, y recientemente, en abril de 2008, ha sido aprobado por la FDA para su uso como puente al trasplante cardíaco.
MicroMed-DeBakey® VADEl sistema MicroMed-DeBakey® es un pequeño dis-positivo de asistencia ventricular de flujo axial desarrolla-do a partir de 1993 entre el Baylor College of Medicine y el NASA/Johnson Space Center14.
Características técnicasSe trata de una bomba axial miniaturizada de titanio que, debido a sus características de hemocompatibilidad, es especialmente utilizable para asistencias de larga duración. Está conectada a una cánula de entrada en titanio que se implanta en el ápex del VI y a una cánula de salida confeccionada por una prótesis de dacrón impermeabilizada que se anastomosa a la cara anterolateral de la aorta ascendente. Dispone de un medidor eco-Doppler de flujo que permite monitorizar continuamente el flujo a través de la bomba que puede llegar hasta los 10l/min.
El sistema se conecta a través de un cable transcutáneo con la unidad de control (Smart Controller SC) con sus dos baterías (VADPACK). También se dispone de un sistema de gestión de datos (Clinical Data Acquisition System CDAS) y un sistema de soporte domiciliario (Patient Home Support System PHSS).
ImplantaciónEl procedimiento de implante consiste en la conexión de la entrada de la bomba con el ápex del VI y la salida de la bomba con la aorta torácica ascendente. El sistema es intracorpóreo. El cable de conexión con la unidad de control se exterioriza a nivel de la cresta ilíaca derecha.
ComplicacionesEl índice de complicaciones y de infecciones es bajo (< 5%). Con el suministro de anticoagulantes por vía oral, la formación de trombos parecería ser mínima.
ExperienciaSe trata del primer dispositivo de tipo axial utilizado como asistencia definitiva15,16. Los resultados clínicos son buenos. Ha sido utilizado en asistencias de duración corta o intermedia en pacientes como puente al trasplante cardíaco, o como alternativa a éste en pacientes con contraindicación. Más de 400 pacientes lo han llevado como puente al trasplante o terapia definitiva con una experiencia acumulada de 110 años/paciente. El 55% de ellos han podido ser trasplantados, desconectados o siguen con el soporte. El tiempo de soporte medio es de 75 días, el más prolongado ha superado los 518 días (1,5 años). Posee la autorización CE en Europa desde abril de 2001.
Berlin Heart INCOR®En 1997, con la adquisición de un dispositivo paracorpóreo de la compañía Fehling Medical AG, se creó Mediport Berlin Heart GMBH Kardiotechnik. En junio de 2002 se realizó el primer implante de un dispositivo INCOR® en el Deutsches Herzzentrum Berlin17.
Características técnicasSe trata de una bomba axial cuya característica principal reside en disponer de un rotor que se mantiene en posición por levitación magnética, con lo que no existe fricción ni generación de calor. Está construida en titanio con su superficie interna recubierta con Carmeda BioActive Surface CBAS® (superficie bioactiva heparinizada) (Upplands Väsby, Suecia). Su velocidad de rotación está entre las 5.000–10.000 rpm. A 7.500 rpm (velocidad habitual) se obtienen 5l/min de gasto, contra una presión arterial media del paciente de 70mmHg.
Posee cánulas de silicona preformadas. Existen dos modelos de cánula de entrada con diferentes longitudes de punta: una larga para su uso en casos estándar, y otra corta utilizable en casos especiales. La cánula de salida, también en silicona, es ajustable en longitud, y se sutura a la cara anterior de la aorta ascendente.
El sistema es controlado por una unidad externa a la que se conecta mediante un cable que se exterioriza transcutáneamente. La unidad de gestión dispone de un algoritmo de software para prevenir la succión y el colapso. El flujo de bomba y la presión diferencial es calculado mediante la detección de cambios de posición del rotor dentro de su campo magnético.
El sistema obtiene su energía gracias a sus dos baterías conectadas a la unidad externa que le proporcionan una autonomía de hasta 8–10h. Esto permite una gran movilidad e independencia a los pacientes implantados. El sistema dispone de una unidad de carga de ambas baterías con conexión a la red doméstica. También dispone de una consola informática para el control y almacenamiento de los datos obtenidos a través de la unidad de control, con posibilidad de conexión por internet al centro hospitalario o central en Berlín.
ImplantaciónSu disposición es intratorácica. Su cánula de entrada es introducida en el VI a través del ápex, donde es fijada mediante sutura sobre una banda de teflón.
La cánula de salida es suturada a nivel de la cara anterolateral de la aorta ascendente con oclusión parcial. El cable de alimentación y control es tunelizado en la zona subcostal derecha y exteriorizado a través de la piel. Se conecta a la unidad de control.
ComplicacionesCon la modificación de la cánula de entrada de mayor longitud, la tasa de eventos tromboembólicos se ha reducido hasta el 4,9%18.
ExperienciaEl dispositivo ha sido implantado en más de 330 pacientes como puente al trasplante, puente a la recuperación o terapia definitiva. El 87% se trataba de hombres con una edad media de 52,6 años (rango: 15–75 años). Las indicaciones prioritarias han sido cardiomiopatías dilatadas en un 42%, e isquémicas en el 37%. El tiempo medio de soporte ha sido de 188 días, con un máximo de 1.344 días (3,5 años) y con más de 70 pacientes asistidos durante más de 1 año. La tasa de eventos tromboembólicos fue de 4,9%19. Posee la certificación CE europea desde marzo de 2003.
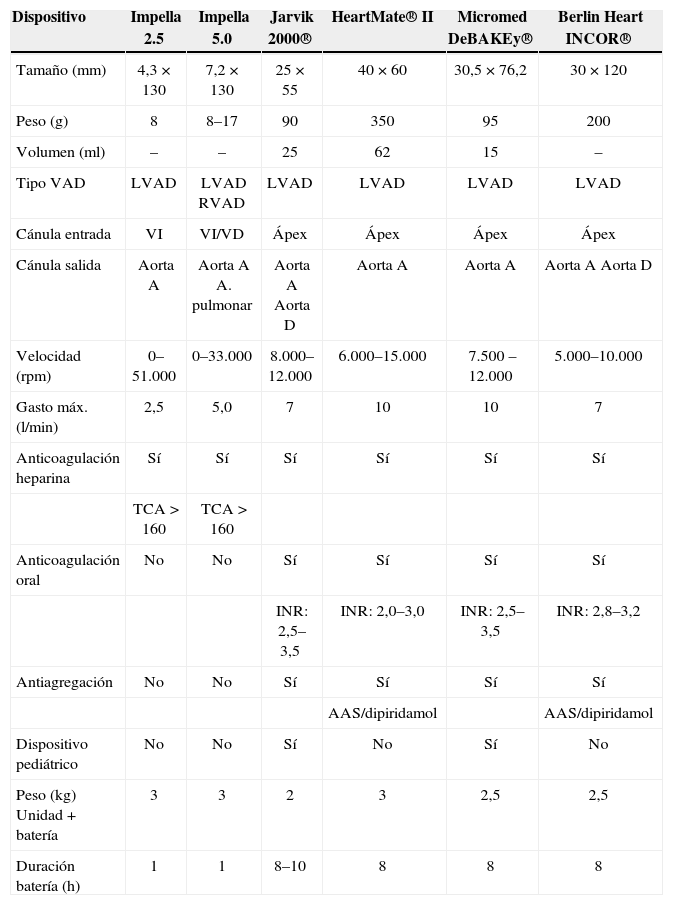
ConclusionesLos dispositivos de flujo axial han demostrado su validez como sistemas de soporte circulatorio mecánico, con unos resultados aceptables en su uso como puente al trasplante o recuperación, lo que ha permitido su indicación como sistemas de larga duración o de tipo definitivo. Su facilidad de implantación y su baja incidencia de complicaciones hace muy prometedor su futuro si se continúa acompañando con la introducción progresiva de mejoras en su diseño (Tabla I).
Características Técnicas
| Dispositivo | Impella 2.5 | Impella 5.0 | Jarvik 2000® | HeartMate® II | Micromed DeBAKEy® | Berlin Heart INCOR® |
| Tamaño (mm) | 4,3×130 | 7,2×130 | 25×55 | 40×60 | 30,5×76,2 | 30×120 |
| Peso (g) | 8 | 8–17 | 90 | 350 | 95 | 200 |
| Volumen (ml) | – | – | 25 | 62 | 15 | – |
| Tipo VAD | LVAD | LVAD RVAD | LVAD | LVAD | LVAD | LVAD |
| Cánula entrada | VI | VI/VD | Ápex | Ápex | Ápex | Ápex |
| Cánula salida | Aorta A | Aorta A A. pulmonar | Aorta A Aorta D | Aorta A | Aorta A | Aorta A Aorta D |
| Velocidad (rpm) | 0–51.000 | 0–33.000 | 8.000–12.000 | 6.000–15.000 | 7.500 –12.000 | 5.000–10.000 |
| Gasto máx. (l/min) | 2,5 | 5,0 | 7 | 10 | 10 | 7 |
| Anticoagulación heparina | Sí | Sí | Sí | Sí | Sí | Sí |
| TCA > 160 | TCA > 160 | |||||
| Anticoagulación oral | No | No | Sí | Sí | Sí | Sí |
| INR: 2,5–3,5 | INR: 2,0–3,0 | INR: 2,5–3,5 | INR: 2,8–3,2 | |||
| Antiagregación | No | No | Sí | Sí | Sí | Sí |
| AAS/dipiridamol | AAS/dipiridamol | |||||
| Dispositivo pediátrico | No | No | Sí | No | Sí | No |
| Peso (kg) Unidad + batería | 3 | 3 | 2 | 3 | 2,5 | 2,5 |
| Duración batería (h) | 1 | 1 | 8–10 | 8 | 8 | 8 |
LVAD: dispositivo de asistencia ventricular izquierda; RVAD: dispositivo de asistencia ventricular derecha; TCA: tiempo de coagulación activado; INR: ratio internacional normalizada.