Una de las complicaciones a tener en cuenta en la corrección del conjunto de patologías denominadas «situación Fallot» la constituye el llamado síndrome de edema de reperfusión pulmonar. La utilización precoz de una asistencia tipo ECMO mejora el pronóstico de estos pacientes y evita el fracaso multiorgánico secundario a este síndrome.
Presentamos dos pacientes con diferentes patologías del espectro, en quienes la utilización del ECMO resultó fundamental para el tratamiento del edema de reperfusión pulmonar.
Reperfusion pulmonary edema in the early postoperative period is a severe complication after Fallot situation correction. The use of ECMO improves the prognosis of these patients and avoids multiorgan failure secondary to this syndrome.
We present two clinical cases with different spectrum conditions, in which the use of ECMO was essential for the treatment of pulmonary reperfusion edema.
El conjunto de pacientes diagnosticados de situación Fallot incluye un grupo heterogéneo de cardiopatías congénitas de diferente complejidad que pueden clasificarse en base al origen del flujo pulmonar. Este abanico de patologías tiene en común la hipoxia debido a la deficiente irrigación del lecho pulmonar. La sangre, en estos pacientes, puede llegar a los pulmones en grado variable, exclusivamente: 1)a través de arterias intrapericárdicas; 2)gracias o no a un ductus arterioso patente; 3)a través de arterias intrapericárdicas y colaterales aortopulmonares, y 4)solo a través de colaterales aortopulmonares.
De cualquier manera, el objetivo de la reparación quirúrgica de cualquiera de estas patologías va dirigido al aumento del flujo pulmonar y la septación del corazón en su caso. La adaptación del lecho vascular pulmonar a esta nueva situación puede desencadenar una cascada inflamatoria que desemboca en un daño pulmonar denominado daño de reperfusión. Típicamente se manifiesta por un edema pulmonar tras el aumento del flujo sanguíneo en las áreas previamente hipoperfundidas. El riesgo de que se produzca este daño de reperfusión aumenta con el grado de hipoperfusión previo a la cirugía y en casos en los que la corrección quirúrgica se realiza a una edad más avanzada.
A menudo la aparición de este daño de reperfusión condiciona una hipoxia severa por hemorragia pulmonar y fracaso del corazón derecho en el período postoperatorio precoz, alcanzando una mortalidad que puede llegar al 70% de los pacientes1. La utilización de una asistencia tipo ECMO en estas situaciones constituye una alternativa terapéutica que mejora el pronóstico de estos pacientes.
Caso número 1Niña de 5 años procedente de Guinea-Bissau ingresada para corrección de una cardiopatía tipo tetralogía de Fallot. 14kg, 113cm. A la exploración física se observaba un fenotipo normal, postura en acuclillamiento adoptada frecuentemente, cianosis central, acropaquías y ausencia de signos de insuficiencia cardiaca. A la auscultación un soplo rudo sistólico corto precordial en base, segundo ruido único. ECG: ritmo sinusal a 120lpm. Eje a 120°. La radiografía de tórax mostraba disminución de la vascularización pulmonar e hipertrofia ventricular derecha. El ecocardiograma se informó como situs solitus, levocardia, levoápex, Fallot severo y un ductus permeable pequeño con gradiente entre aorta y pulmonar de 70mmHg. VI de pequeñas dimensiones (Z score −4dS, Detroit data) por hipoaflujo. Anillo pulmonar 7,5-8mm (Z −4,8dS), RPD 9mm (Z −0,61dS), RPI 7-8mm (Z −0,85dS). VD hipertrófico. Patrón coronario normal.
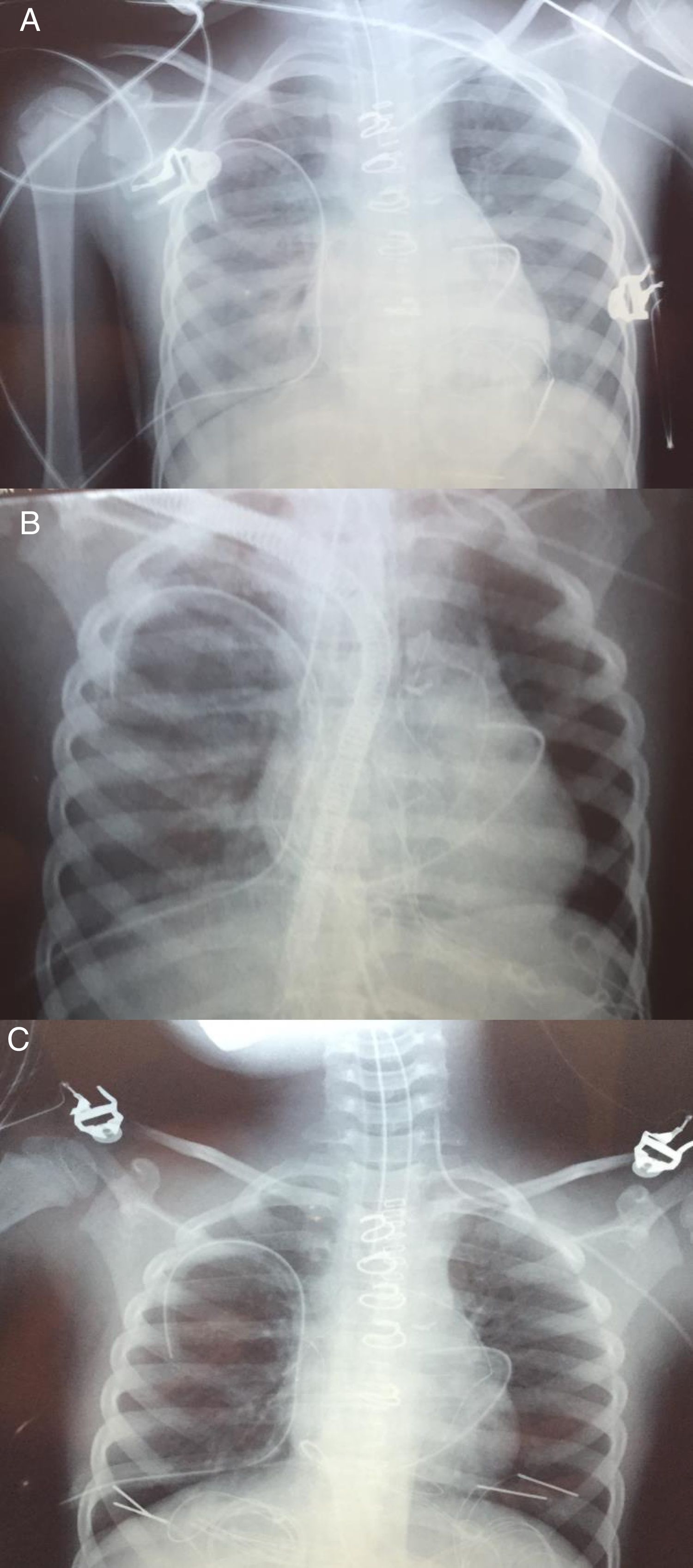
Cirugía. Con el diagnóstico de tetralogía de Fallot y ductus permeable se intervino realizándose cierre de ductus, cierre de CIV a través de AD, resección de zona hipertrófica de VD y parche transanular monocúspide del n.° 12 (Contegra®). El ecocardiograma intraoperatorio mostró ausencia de cortocircuitos residuales y un gradiente VD-pulmonar de 30mmHg. Tiempo de clampaje 88’, tiempo de CEC 170’. Se desconectó de circulación extracorpórea con ayuda de milrinona, dopamina y adrenalina 0,7, 5 y 0,2μg/kg/min, respectivamente. A la salida de quirófano la PA fue de 100/60mmHg, la FC de 160lpm, y la PVC de 14mmHg, lo que permitió ir descendiendo la dosis de adrenalina hasta 0,04μg/kg/min. El láctico a su llegada a UCIP fue de 2,8mmol/l. La radiografía de tórax inicial postoperatoria no mostró complicaciones. El primer día de postoperatorio se comportó hemodinámicamente algo inestable, por lo que no se progresó en el destete respiratorio, manteniendo una pO2 de alrededor de 80 con FiO2 de 0,4, PIP de 16 y PEEP de 10. A las 24h se decidió extubación, si bien en la placa de tórax se observaban cambios incipientes sugestivos de hiperaflujo pulmonar. Dos horas después de la extubación se produjo una desaturación súbita (86%) con hipoxemia (PaO256). Esta situación se mantuvo las siguientes 2h asociándose agitación, esputos hemoptoicos y fracaso de los intentos de ventilación no invasiva. Se procedió a reintubación urgente, observándose en la radiografía de tórax infiltrados intersticiales bilaterales, sin derrame pleural ni condensaciones (fig. 1A). El ecocardiograma no observó defectos residuales, estimándose una presión en VD por IT de 60mmHg (aproximadamente sistémica). Se conectó marcapasos transitorio por bloqueo AV completo de nueva aparición. Se observó una situación de oligoanuria y bajo gasto cardiaco que precisó el aumento de dosis de adrenalina hasta 0,4μg/kg/min, inicio de noradrenalina a 0,4μg/kg/min, así como comienzo de diálisis peritoneal. La situación respiratoria empeoró, produciéndose un aumento de las secreciones hemáticas por el tubo endotraqueal y dificultad para la oxigenación, con alta necesidad de FiO2.
En esta situación se decidió la colocación de ECMO central (canulación de aorta ascendente y AD) alcanzando unos flujos entre 0,7 y 1,2l/min/m2, lo que permitió disminuir la adrenalina hasta su retirada y la noradrenalina a 0,6μg/kg/min. La ECMO se mantuvo con parámetros de ventilación mínimos para evitar atelectasias (FR 15rpm), una FiO2 del 0,8 (0,6 en el respirador) y PaO2 en torno a 80-100. Diuresis 6,6cc/kg/h.
Progresivamente la radiografía de tórax fue mejorando (fig. 1B), pudiéndose disminuir la asistencia el día +5 y ser retirada completamente el día +6, manteniéndose el esternón abierto y drogas vasoactivas (adrenalina 0,2, noradrenalina 0,8, dopamina 5, milrinona 0,7μg/kg/min) para mantener una PA 85/60 y una PaO2 de 78.
Se evidenció progresiva mejoría de la oxigenación. El día +7 se realizó el cierre esternal, disminuyendo progresivamente la sedación y permitiendo su extubación definitiva el día +10.
La niña se trasladó a planta al día +20, siendo dada de alta 5días más tarde. El ecocardiograma de control mostró rama pulmonar izquierda más pequeña que la derecha con gradiente leve (23mmHg), no CIV residual, tracto de salida amplio con gradiente de 17mmHg y buena función biventricular.
Caso número 2Paciente de 16 años con antecedentes de atresia pulmonar con CIV subaórtica y CIA. Dextroposición aórtica. Al nacimiento, ductus permeable tratado inicialmente con prostaglandinas hasta la realización de una fístula BT modificada izquierda de 4mm de diámetro.
A los 2años se realizó cierre quirúrgico de la fístula y corrección completa, incluyendo cierre de CIA, cierre de CIV con parche de dacrón y conexión de VD a AP con conducto heterólogo de yugular bovina (Contegra®) de 12mm, confirmándose una hipoplasia severa de la rama pulmonar izquierda.
A los 4 años se reintervino por estenosis severa del origen de ambas ramas pulmonares, cambiando el conducto de VD a arterias pulmonares por uno de mayor tamaño (Contegra® n.° 18), ampliando el origen de ambas. Tras la intervención persistió hipoplasia severa de la arteria pulmonar izquierda.
Progresivamente se observó estenosis del conducto VD-AP, y a los 16años se realizó nuevo cateterismo para implante de stent en el conducto VD-AP. En este procedimiento las presiones objetivadas fueron: VD: 67/8/16; aorta 83/53/63; arteria pulmonar derecha 41/17/26.
Un año más tarde se aceptó para cirugía con el diagnóstico de estenosis pulmonar severa del conducto e insuficiencia pulmonar severa. La resonancia magnética mostraba un IVTDVD de 149ml/m2, con una FEVD 38%, insuficiencia triscuspídea grave, con anillo de 47,5mm. En el ECG presentaba QRS 180ms.
Se realizó preacondicionamiento durante 24h con levosimendán. La cirugía se llevó a cabo bajo hipotermia moderada (34°C) y sin clampaje aórtico. Se abrió el conducto y se comunicó el tracto de salida nativo con válvula imperforada y el conducto hasta la zona de inserción de este en el tronco pulmonar. En el lecho pulmonar nativo se colocó una prótesis biológica (Edwards Perimount® n.° 25, techándose esta zona hasta la bifurcación pulmonar con parche de Contegra n.° 20 y disminuyendo el tamaño del VD en su parte anterior. Se asoció anuloplastia tricuspídea con anillo Carpentier-Edwards Physio34®. El tiempo de bomba fue de 144min. Se realizó ETE en quirófano, en el que se observó aceptable función biventricular, TIA íntegro, anillo tircuspídeo con IT central leve, que estimó PSVD 45mmHg (33mmHg +15AD). TSVD libre irregular, prótesis pulmonar normofuncionante con gradiente pico residual de 19mm, IP trivial de lavado central. Ausencia de derrame pericárdico.
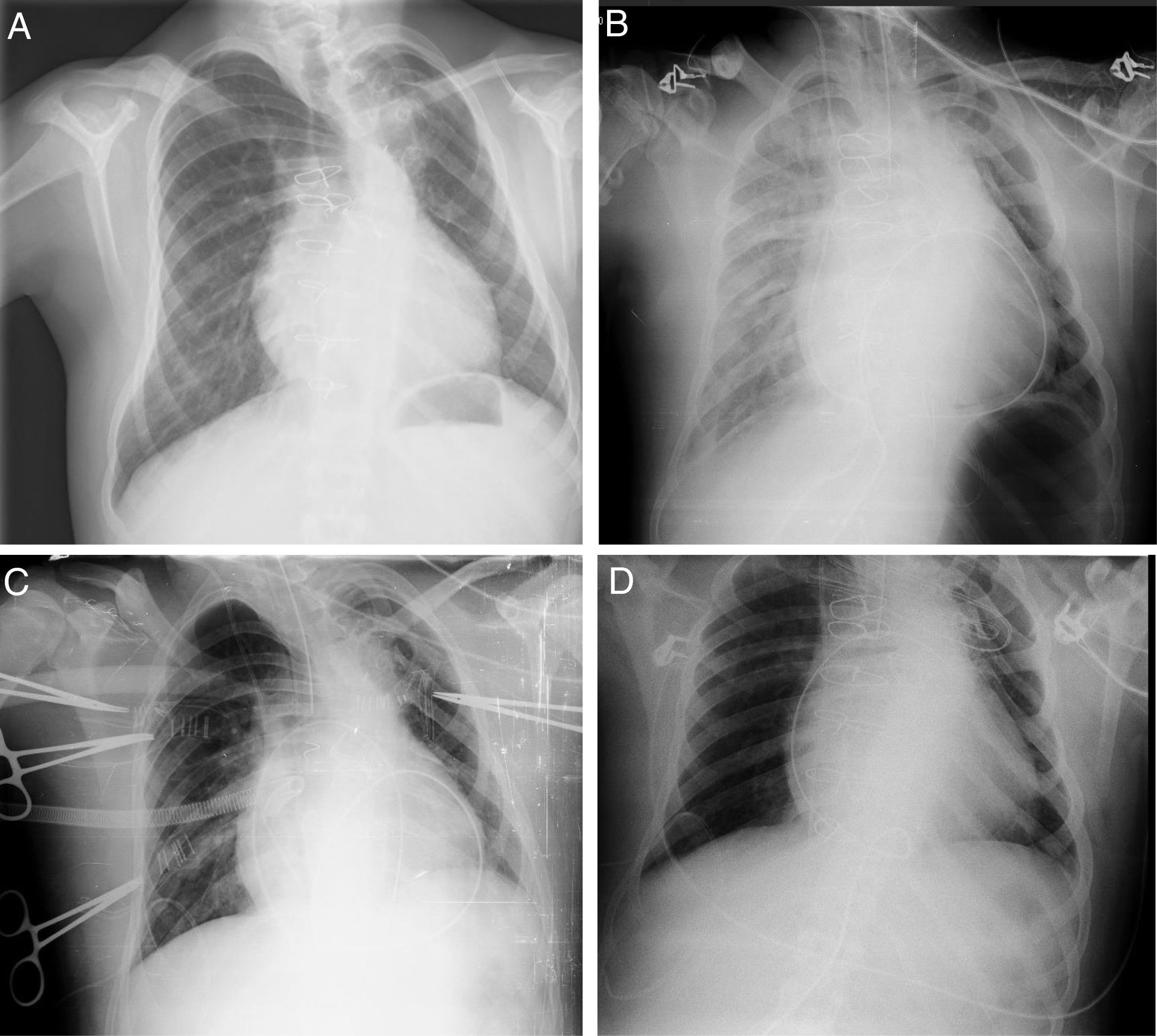
Ingresó en UCIP estable, en ritmo sinusal con PA normal y buena perfusión periférica, en tratamiento con noradrenalina 0,1μg/kg/min y dopamina 5μg/kg/min. En la radiografía de tórax no se observaron complicaciones (fig. 2A). Equilibrio ácido base normal con láctico 1,7mmol/l. Presión venosa10-12. A lo largo de la tarde aparecieron secreciones serohemáticas abundantes que obligaron a aspiraciones frecuentes (30min). Se asoció furosemida y se aumentó la dopamina hasta 7,5μg/kg/min. A las 3h del ingreso comenzó desaturación progresiva y se repitió radiografía de tórax, observándose un derrame pleural derecho severo y colocándose tubo de tórax. Progresivamente se objetivó labilidad hemodinámica, que precisó aumentar noradrenalina a 0,9μg/kg/min. Taquicardia mantenida con aumento progresivo de láctico (máximo 2,9mmol/l). Diuresis en torno a 1,5cc/kg/h. Progresivo empeoramiento de gases pO2 94-79 con una PaO2/FiO2 de 125-128. Se siguió incrementando la FiO2 hasta el 75%. Ante la sospecha de SDRA secundario a reperfusión pulmonar se administra actocortina 100mg. La radiografía de control empeoró progresivamente durante la noche (fig. 2B), con un drenaje pleural derecho severo de contenido seroso. Asimismo, se asoció un deterioro hemodinámico que obligó a aumentar las drogas vasoactivas, disminuyendo la diuresis y aumentando la acidosis: láctico 9,7mmol/l, EB −10pH de 7,18 con FiO2 85% y PEEP de 7.
Evolución radiológica en el segundo caso clínico. Se observa radiografía de tórax: A)a la llegada de quirófano, con progresivo empeoramiento a lo largo de la tarde, B)previa a la implantación de ECMO, C)tras la implantación de ECMO y D)previa a la extubación una vez retirado el soporte.
Ante estos datos se decidió colocación de ECMO venoarterial central (Centrimag®), con un flujo de 3,35lpm 90% del flujo total 505rpm. Se mantuvo inicialmente con noradrenalina a 0,6μg/kg/min, consiguiéndose progresivamente mejorar los datos hemodinámicos y respiratorios (fig. 2C).
El paciente se mantuvo durante 48h en asistencia de ECMO con flujos de 3-3,5lpm. Progresivamente disminuyó el débito de los drenajes y mejoró la radiografía previa. PEEP12, FR8, volumen corriente 250ml y FiO2 21%. Diuresis 7ml/k H.
A las 72h se decidió comenzar con el destete. En el ecocardiograma se observó adecuada contractilidad biventricular con movimiento anormal del TIV, IT leve, PSVD de 40-45mmHg para una PA de 92/65. Prótesis pulmonar con buena apertura y gradiente pico de 25mmHg. IP central trivial. VD hipertrófico. No trombos. Mínimo derrame pericárdico.
Se retiró la asistencia ECMO sin complicaciones, pudiendo ser extubado el día +16 de la cirugía tras mejoría de la tonicidad muscular y buenos parámetros: Gases con vapotherm, FiO2 50%, 10lpm, FR 19, SaO2 99% y mejoría sustancial de la radiografía de tórax (fig. 2D).
Alta a planta a los 21días.
En el último seguimiento 5años más tarde el paciente se encuentra asintomático, en clase funcionalI, con buena función biventricular, prótesis pulmonar normofuncionante y volúmenes biventriculares por resonacia dentro de los límites de la normalidad (IVTDVD: 86,3ml/m2).
DiscusiónEl edema de reperfusión pulmonar secundario a la reparación de patologías que cursan con isquemia crónica del lecho pulmonar constituye una de las complicaciones más severas de la cirugía de los pacientes en situación Fallot, fundamentalmente en niños con edades fuera del período de lactancia.
Las ventajas de la reparación precoz de este grupo de patologías están ampliamente aceptadas, entre ellas la corrección de la cianosis y el consecuente daño orgánico, la preservación de la función miocárdica, la disminución del estímulo que desarrolla hipertrofia ventricular y fibrosis, la menor incidencia de arritmias, el desarrollo en el tamaño de las ramas pulmonares, así como el menor impacto psicológico tanto en el niño como en su familia. Es cierto que continúa existiendo controversia acerca del momento óptimo para la reparación, pero en general todos los autores coinciden que debería corregirse durante el período de lactancia1-3.
Sin embargo, no son infrecuentes los casos que, bien procedentes de países en desarrollo, o bien portadores de correcciones previas que han mantenido una situación de hipoperfusión en el lecho pulmonar, se corrigen en nuestros servicios a una edad mayor de lo deseable y que son proclives a desarrollar un daño de reperfusión pulmonar en el postoperatorio inmediato.
El diagnóstico diferencial con el síndrome post-perfusión o con el síndrome de distrés respiratorio secundario a la circulación extracorpórea resulta fundamental. El síndrome post-perfusión es una complicación rara (0-4-2% de los pacientes tras CEC4) desencadenada por la activación del complemento, el secuestro pulmonar de neutrófilos y la activación de endotoxinas circulantes durante la circulación extracorpórea. Es un síndrome que puede ser refractario al tratamiento donde la utilización de ECMO es controvertida y que presenta según las series una mortalidad entre el 50 y el 91,6%5, tras el desarrollo frecuente de un fracaso multiorgánico. El síndrome de distrés respiratorio agudo se desarrolla en situaciones de estrés tales como traumatismos, cirugías, infecciones, procesos inflamatorios, embolismos grasos o interacciones farmacológicas, entre otras. La incidencia es mayor (1,5-8,3 casos por 100.000 habitantes/año)6. El tratamiento incluye las medidas de soporte según la etiología, soporte ventilatorio prolongado y ECMO.
El daño pulmonar tras cirugía de reparación en situación Fallot, aunque descrito ampliamente en la literatura, presenta una fisiopatología incierta. En general se define como un edema pulmonar que se localiza en las regiones pulmonares asociadas con obstrucciones vasculares previas, en las que aparece un edema hidrostático secundario al aumento de perfusión en un lecho pulmonar previamente hipoperfundido. Parece aceptado que, tras la apertura de las zonas estenóticas, el aumento de flujo en el lecho pulmonar aumenta de forma súbita la presión a este nivel7. La microvasculatura pulmonar no puede adaptarse de forma inmediata para modular el flujo, por lo que se produce un síndrome respiratorio agudo que progresivamente aumenta la presión en cavidades derechas y deriva en alteraciones hemodinámicas y metabólicas que sin tratamiento intensivo dan como consecuencia un fracaso multiorgánico y el fallecimiento del paciente.
El reconocimiento precoz de este síndrome y la instauración de una asistencia tipo ECMO resulta de vital importancia para la recuperación de estos pacientes.
En los casos presentados utilizamos la canulación central, por preferencias del servicio. No obstante, la utilización de canulación periférica (carótida-yugular, o fémoro-femoral) puede aportar beneficios como la disminución de la tasa de infecciones, la posibilidad de cierre esternal y la consecuente disminución de sangrado.
La utilización de ECMO veno-venosa en lugar de veno-arterial podría plantearse en etapas más precoces de presentación de este síndrome. No obstante, en general se recomienda la utilización de ECMO veno-arterial por las alteraciones hemodinámicas y metabólicas secundarias al edema pumonar.
Consideraciones éticasLos autores obtuvieron el consentimiento informado de los tutores legales de los pacientes para la publicación de este artículo, en el que se ha preservado la confidencialidad y el anonimato de sus datos personales.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.