Bartonella henselae es un bacilo intracelular facultativo que puede infectar al ser humano después de ser arañado o mordido por gatos portadores y es uno de los agentes causantes de endocarditis con hemocultivo negativo. Se presenta el caso de una paciente de 73 años portadora de una bioprótesis aórtica que un año después de la mordedura de su gato fue ingresada por cuadro sistémico de astenia, anorexia y fiebre ocasional de varios meses de evolución. Los hemocultivos resultaron negativos, pero las pruebas serológicas indicaron infección por B. henselae. La realización de una tomografía por emisión de positrones/tomografía computarizada demostró la afectación de la prótesis valvular. La paciente fue reintervenida y la evolución postoperatoria fue satisfactoria. El estudio de la prótesis infectada mediante técnicas moleculares permitió identificar B. henselae. Se discuten algunos aspectos relacionados con el diagnóstico y tratamiento de esta enfermedad.
Bartonella henselae is a facultative intracellular rod that can infect humans after being scratched or bitten by carrier cats. It is one of the causative agents of blood culture-negative endocarditis. We report the case of a 73-year-old patient with an aortic bioprosthesis. She had been bitten by her cat. One year later she was admitted for systemic symptoms of asthenia, anorexia and occasional fever of several months of evolution. Blood cultures were negative, but serological tests indicated infection with B. henselae. Positron emission tomography/computed tomography demonstrated prosthetic valve involvement. The patient underwent a redo procedure, and the postoperative evolution was satisfactory. The study of the infected prosthesis using molecular techniques allowed the identification of B. henselae. Some considerations regarding the diagnosis and management of this entity are discussed.
Bartonella henselae es un bacilo aerobio gramnegativo facultativo intracelular responsable de varios procesos infecciosos como son la enfermedad por arañazo de gato, bacteriemia, neurorretinitis, encefalitis, endocarditis y, en pacientes inmunodeprimidos, angiomatosis bacilar y peliosis hepática1,2.
La infección por B. henselae es una zoonosis cuyo reservorio es el gato. Se calcula que la mitad de los gatos tienen anticuerpos frente a B. henselae, transmitiéndose de unos animales a otros por picaduras de la pulga del gato (Ctenocephalides felis)1,3. B. henselae infecta al ser humano debido a arañazos o mordeduras por un gato portador y probablemente también por la picadura de pulgas1,2.
B. henselae es una causa conocida de endocarditis infecciosa con hemocultivo negativo. El principal factor de riesgo para desarrollar endocarditis por B. henselae es la presencia de una anomalía valvular o de una prótesis1,2.
B. henselae es un microorganismo difícil de cultivar. Por este motivo el diagnóstico etiológico de la endocarditis por B. henselae se basa en la detección de anticuerpos mediante pruebas serológicas y en técnicas moleculares como la reacción en cadena de la polimerasa en tiempo real2,4.
Presentamos el caso de una paciente con sospecha de endocarditis infecciosa por B. henselae en el que el estudio con tomografía por emisión de positrones/tomografía computarizada (PET/TC) permitió confirmar el diagnóstico.
Presentación del casoSe trata de una mujer de 73 años con antecedentes de hipertensión arterial y síndrome depresivo. Había sido intervenida previamente de mioma uterino, safenectomía y apendicectomía. Fue diagnosticada de estenosis aórtica severa sintomática con función ventricular conservada y coronarias angiográficamente normales, y remitida a nuestro hospital para recambio valvular aórtico. Se procedió a implantar bajo circulación extracorpórea una bioprótesis aórtica de pericardio bovino de 21mm Crown® PRT (LivaNova, Saluggia, Italia). El postoperatorio cursó sin complicaciones y la paciente fue dada de alta 6 días más tarde.
Dos años después acudió a su médico de familia al haber recibido varias mordeduras de su gato en la mano y antebrazo izquierdos. Se pautaron curas locales de las heridas y cloxacilina 500mg/8h por vía oral durante 20 días. La evolución de las heridas fue tórpida, desarrollando una lesión papulosa que fue tratada con mupirocina tópica. Las heridas curaron después de 6 semanas de tratamiento.
Un año después de la mordedura la paciente ingresó en el hospital por cuadro de síndrome general con anorexia, febrícula ocasional, pérdida de peso y astenia de varios meses de evolución, acompañado de molestias en el epigastrio e hipocondrio izquierdos.
En la analítica al ingreso destacaba hemoglobina de 10,9g/dl, leucocitos 3,74×103/μl (neutrófilos 56%, linfocitos 35,6%, monocitos 4,9%), plaquetas 106×103/μl, VSG 49mm, concentración sérica de proteína C reactiva 10,768mg/dl (rango 0-0,5), beta-2-microglobulina 13,7mg/l (rango 1-2,5), gammaglobulinas 2,97g/dl (rango 0,74-1,91), IgG 3.165mg/dl (rango 700-1.600), cadenas ligeras kappa 817mg/dl (rango 170-370) y cadenas ligeras lambda 401mg/dl (rango 90-210).
Se realizó una endoscopia digestiva, que no reveló anomalías. La TAC toracoabdominal evidenció la presencia de esplenomegalia e infarto esplénico.
Los hemocultivos resultaron negativos. Los estudios serológicos frente a Bartonella henselae fueron positivos para IgM e IgG con un título mayor de 1/65.356. La IgM frente a Coxiella burnetii y Bartonella quintana resultó positiva baja, probablemente por reacción cruzada.
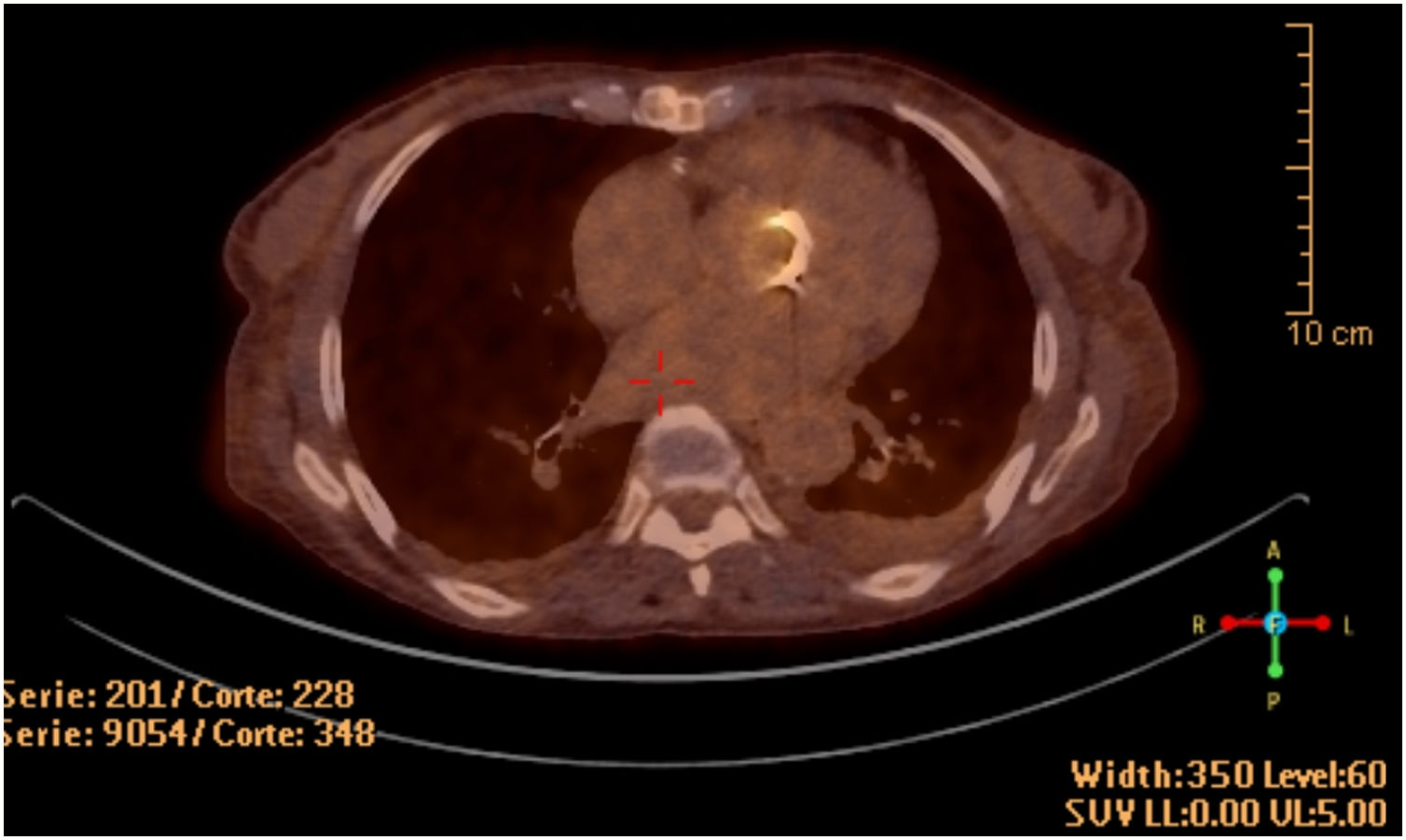
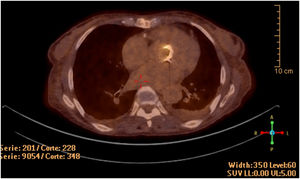
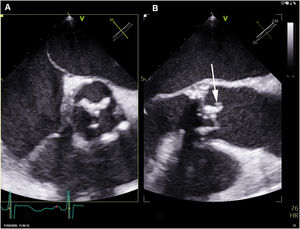
La ecocardiografía transesofágica demostró la presencia de velos engrosados en la bioprótesis, sin imágenes indicativas de vegetaciones ni afectación anular. Se realizó PET/TC con flúor-18-fluorodesoxiglucosa, observándose un intenso depósito hipermetabólico sobre la prótesis valvular aórtica, así como captación difusa a nivel esplénico (fig. 1).
Ante la sospecha de endocarditis protésica por B. henselae se indicó tratamiento con doxiciclina 100mg/12h por vía oral. Se asoció gentamicina por vía intravenosa durante 15 días.
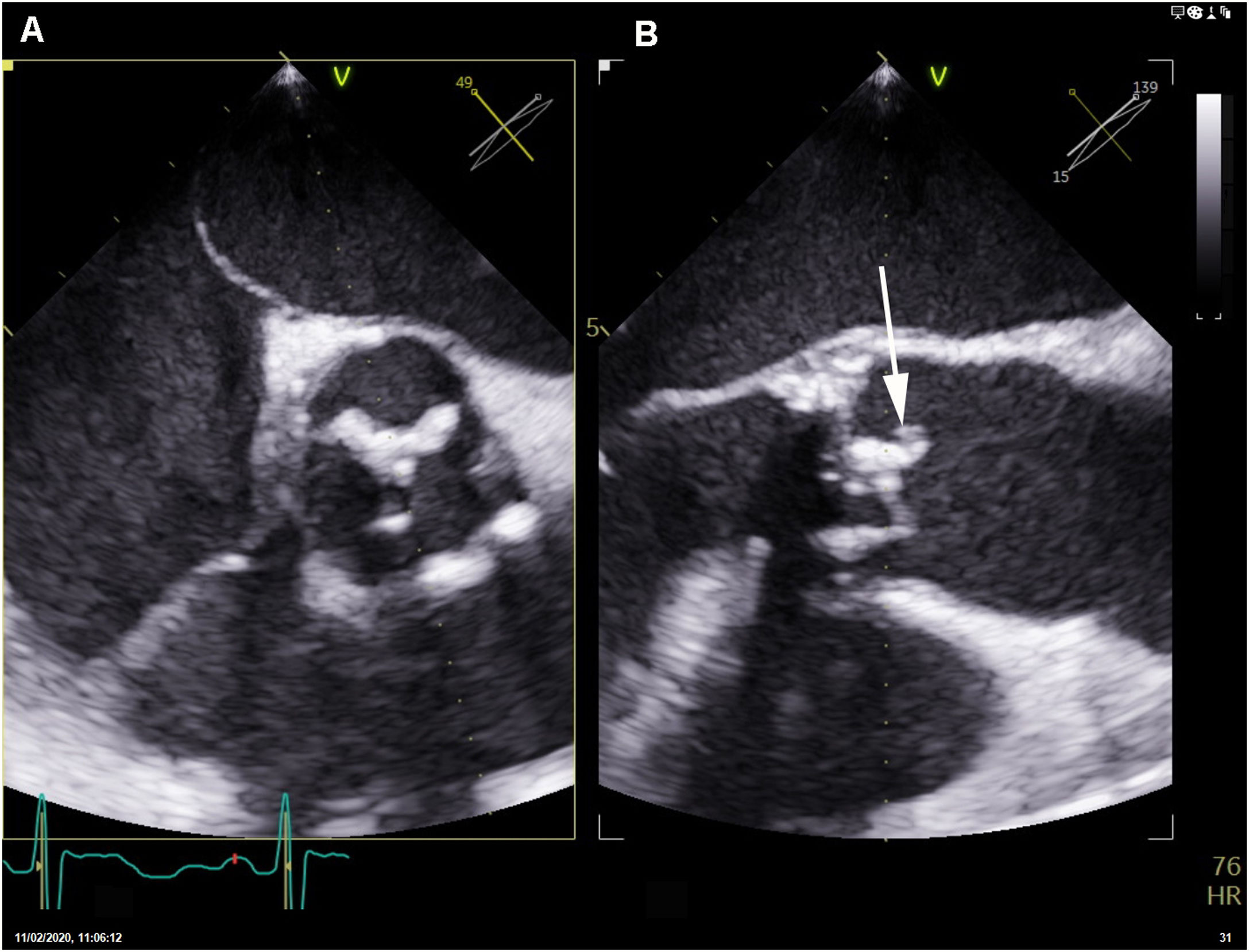
Inicialmente se planteó tratar el cuadro solamente con tratamiento médico. Doce días después de iniciar el tratamiento antibiótico se repitió el ecocardiograma transesofágico, que demostró la presencia de una imagen móvil en el borde libre del velo no coronariano de la prótesis, por lo que se indicó tratamiento quirúrgico consistente en la resección de la prótesis infectada e implante de una nueva (fig. 2).
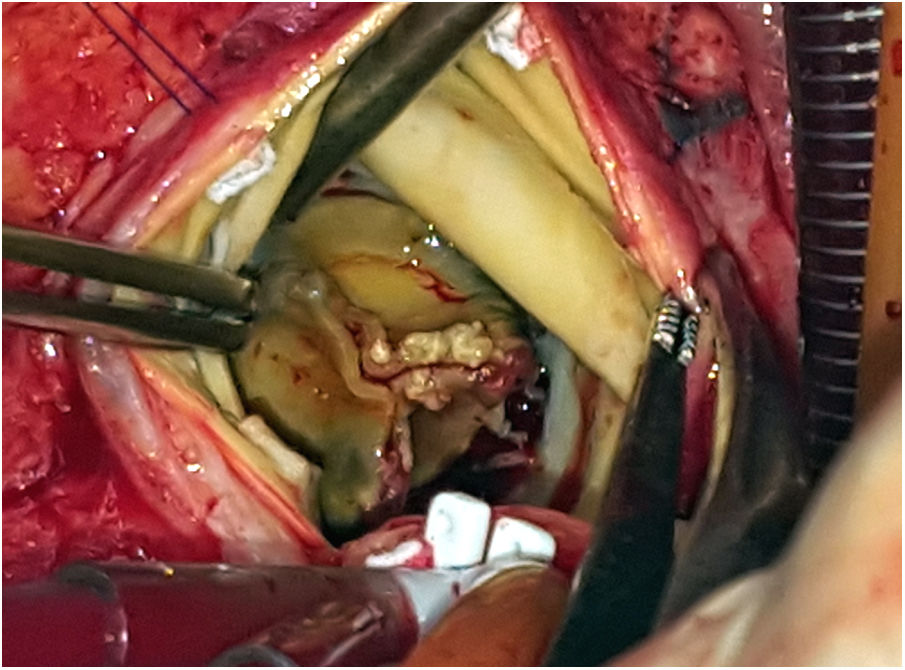
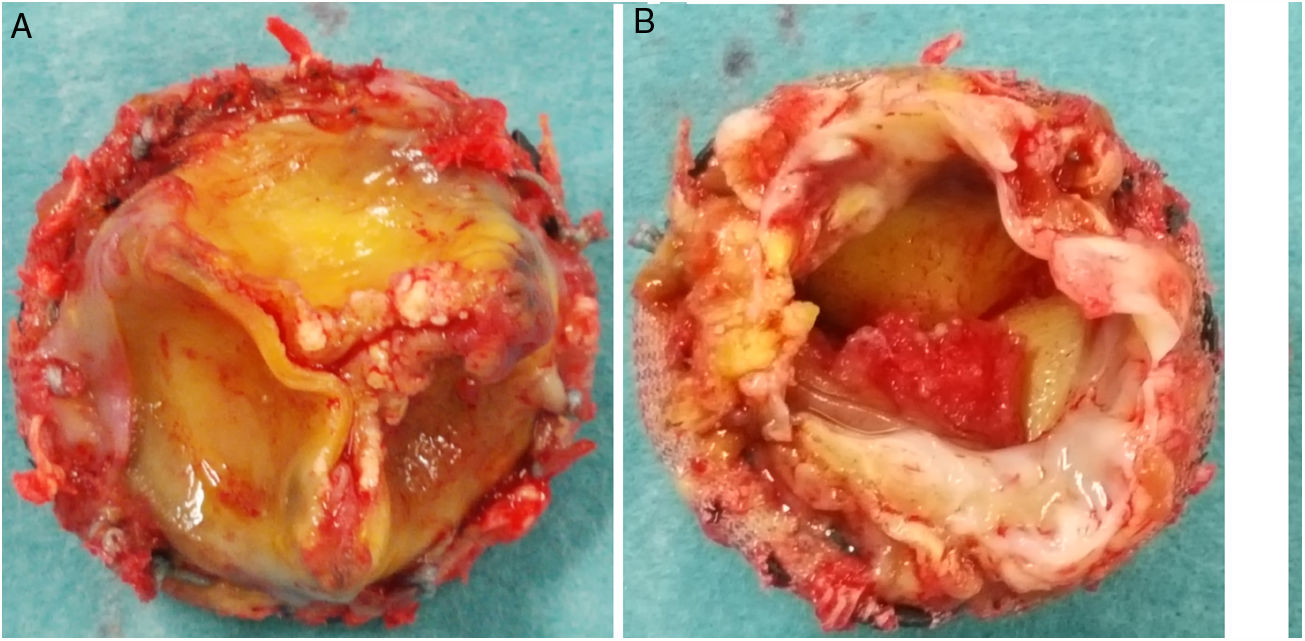
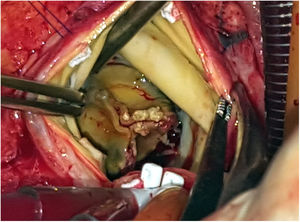
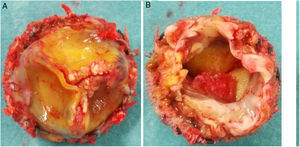
Durante la intervención se observó la presencia de una prótesis con velos engrosados y bordes libres calcificados, así como una vegetación en la cara ventricular a nivel del velo no coronariano (figs. 3 y 4). El anillo aórtico estaba respetado, por lo que se decidió implantar una bioprótesis sin sutura Perceval® L (LivaNova, Saluggia, Italia) con el fin de acortar los tiempos de isquemia y de circulación extracorpórea, que fueron de 52 y 74min, respectivamente. El estudio de la prótesis mediante reacción en cadena de la polimerasa en tiempo real confirmó la presencia de B. henselae.
La evolución postoperatoria transcurrió satisfactoriamente. Por indicación de la Unidad de Enfermedades Infecciosas se mantuvo el tratamiento con doxiciclina 100mg/12h por vía oral durante 6 meses después de la intervención. Se observó una reducción de la titulación de IgG frente a B. henselae, siendo de 1/4.096 y 1/2.096 a los 3 y 6 meses, respectivamente.
DiscusiónEl género Bartonella spp. es responsable del 2% de las endocarditis con cultivo negativo4,5. Entre las diferentes especies de Bartonella spp. que pueden causar endocarditis destacan la B. quintana, causante de la fiebre de las trincheras, asociada a inmunosupresión, alcoholismo y pobreza, y que representa el 70% de los casos, y B. henselae, detectada aproximadamente en el 25%2.
La endocarditis por B. henselae se debe a mordeduras o arañazos por gatos infectados. Inicialmente, en las heridas producidas por el animal pueden desarrollarse pequeñas pápulas, como ocurrió en nuestro caso, así como adenopatías locales y fiebre. A continuación el microorganismo se disemina por vía hematógena y puede afectar a hígado, bazo y a las válvulas cardiacas1,2.
El cuadro clínico de la endocarditis por B. henselae suele ser subagudo y fluctuante e incluye cefaleas, fiebre de origen desconocido, astenia, anorexia, sudores nocturnos y pérdida de peso. Los pacientes suelen referir dolor abdominal y en algunos casos pueden observarse embolismos periféricos y glomerulonefritis mediada por inmunocomplejos2,6,7.
Desde el punto de vista analítico existe anemia, elevación de la proteína C reactiva e hipergammaglobulinemia policlonal. El recuento leucocitario suele ser normal2,6–10.
Debido a la dificultad para cultivar B. henselae, el diagnóstico etiológico se basa en estudios serológicos. Sin embargo, los test serológicos tienen como inconveniente la existencia de reacciones cruzadas con Chlamydia spp. y C. burnetii, así como la dificultad para distinguir B. henselae de B. quintana10,11.
Para el diagnóstico etiológico, las técnicas moleculares de reacción en cadena de la polimerasa y secuenciación del ADN en los tejidos valvulares permiten lograr una especificidad del 100%2,5.
Ecocardiográficamente los pacientes con endocarditis por B. henselae pueden presentar vegetaciones móviles con afectación de las cúspides12, abscesos7 y perforaciones de los velos valvulares o bioprotésicos2,7. En ocasiones las vegetaciones no existen o son tan pequeñas que pasan desapercibidas6. En los casos donde los hallazgos ecocardiográficos no son concluyentes la PET/TC puede demostrar un aumento de la captación a nivel valvular y esplénico, constituyendo una herramienta útil para el diagnóstico y un criterio mayor de acuerdo con las guías europeas para el manejo de la endocarditis6,9.
B. henselae es habitualmente sensible a rifampicina, macrólidos, betalactámicos y tetraciclinas. La asociación con aminoglucósidos proporciona buenos resultados3.
Se han descrito casos anecdóticos de curación de endocarditis protésica por B. henselae con tratamiento antibiótico a largo plazo10. Sin embargo, en general es preciso intervenir quirúrgicamente a estos pacientes2. La reducción del título de anticuerpos después de iniciado el tratamiento suele ser lenta, observándose títulos elevados hasta 2 años después10,11.
Las guías actuales recomiendan administrar doxiciclina 100mg/12h por vía oral durante 4 semanas y asociar gentamicina intravenosa durante las 2 primeras semanas13.
Sin embargo, algunos autores son partidarios de mantener a largo plazo el tratamiento con doxiciclina3,7,9,10.
Este caso subraya la necesidad de tener en cuenta la endocarditis por B. henselae en pacientes portadores de prótesis valvulares y contacto con gatos a pesar de obtener hemocultivos negativos, así como la utilidad de la PET/TC para confirmar la afectación valvular.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.