Se presenta el caso de un varón de 76 años con endocarditis precoz sobre una bioprótesis aórtica por Propionibacterium acnes. El diagnóstico se estableció con base en el cuadro clínico de fiebre y escalofríos, los hallazgos ecocardiográficos de vegetaciones y absceso periprotésico y el hemocultivo positivo. El paciente fue reintervenido, resecando la bioprótesis y administrando antibióticos durante seis semanas. La evolución postoperatoria fue satisfactoria. Nueve años después de la intervención, el sujeto se encuentra asintomático y sin signos de recidiva. Se comentan algunos aspectos relacionados con la patogenia, el diagnóstico y el tratamiento de esta enfermedad.
We report the case of a 76-year-old male patient who presented with early prosthetic aortic valve endocarditis due to Propionibacterium acnes. Diagnosis was established based on clinical picture of high temperature and positive blood cultures associated with echocardiographic findings of prosthetic valve vegetations and perivalvular abscess. Patient underwent redo sternotomy and re-replacement of the aortic valve bioprosthesis. He received a full course of antibiotics for six weeks and his postoperative course was uneventful. After follow-up for nine years, the patient has remained asymptomatic without any signs of recurrence. Some aspects related to the pathogenesis, diagnosis and treatment of this condition are discussed.
Propionibacterium acnes (P. acnes) es un bacilo grampositivo anaerobio facultativo, no formador de esporas, que coloniza los folículos pilosebáceos de la cara, cuero cabelludo y parte alta del tronco y forma parte de la microbiota cutánea. Puede encontrarse también en la mucosa de la cavidad oral, conjuntiva, próstata, vías urinarias, tracto digestivo y conducto auditivo externo1–3.
P. acnes presenta un bajo nivel de virulencia y es causante de la inflamación asociada al acné vulgar4. Cuando se identifica en hemocultivos, es considerado, en muchas ocasiones, un contaminante5. Sin embargo, cada vez con más frecuencia se describen infecciones oligosintomáticas, crónicas, recurrentes y potencialmente graves, causadas por P. acnes, generalmente en relación con implantes de material protésico ortopédico, mamario, cardiovascular u ocular4,5. En estos casos, la virulencia de P. acnes está relacionada con su capacidad de adherencia a la superficie extraña del material protésico y de sintetizar biofilm2,4.
P. acnes puede provocar cuadros de osteomielitis, abscesos cerebrales, endoftalmitis secundaria a la infección de lentes intraoculares, infección de prótesis articulares, de prótesis mamarias, de glándulas salivales, de derivaciones ventrículo-peritoneales, odontológicas y endocarditis sobre válvulas nativas y protésicas1,2,6.
La endocarditis por P. acnes es infrecuente y representa aproximadamente el 0,3% de los casos totales y el 1,4% de las endocarditis sobre prótesis valvulares7. Otros estudios observan tasas de prevalencia en torno al 1,8 y 3,8% para las endocarditis nativas y protésicas, respectivamente5. Estas diferencias parecen deberse a la utilización de técnicas de biología molecular que permiten confirmar el diagnóstico en muchos casos en los que el cultivo ordinario es negativo5,8.
En general, las infecciones por P. acnes son oligosintomáticas y poco agresivas. En el caso de las prótesis articulares solo el 50% de los casos infectados presentan elevación de los marcadores séricos de inflamación o acúmulo de material purulento durante la reintervención9. Estos hallazgos contrastan con la endocarditis protésica donde, debido a la evolución indolente inicial, se retrasa el diagnóstico y ocurre una lenta destrucción tisular local con invasión de las estructuras perianulares y formación de abscesos3,5,8.
Caso clínicoSe trata de un varón de 76 años con antecedentes de alopecia generalizada, hipertensión arterial, obesidad y síndrome depresivo. Este fue diagnosticado de estenosis aórtica severa sintomática sobre la válvula bicúspide con función ventricular conservada y coronarias angiográficamente normales y fue remitido a nuestro hospital para realizarle una intervención quirúrgica. El paciente fue sometido a un recambio valvular aórtico bajo circulación extracorpórea, implantándose una bioprótesis de pericardio bovino de 23 mm Mitroflow 12A (Sorin Group Inc., Mitroflow Division, Vancouver, Canadá). La evolución postoperatoria transcurrió satisfactoriamente y el sujeto fue dado de alta al sexto día del postoperatorio.
El paciente permaneció asintomático y, diez meses más tarde, fue ingresado por presentar un cuadro de febrícula de cuatro días de evolución acompañado de escalofríos. En la analítica realizada al ingreso, se observó hemoglobina de 11,6 g/dL, leucocitos 7,63x103 μL con fórmula normal, 165x103 plaquetas/μL, proteína C reactiva de 49,3 mg/L (rango normal 0 a 5) y, ese mismo día, coincidiendo con un episodio de escalofríos, se extrajeron tres hemocultivos seriados por venopunción.
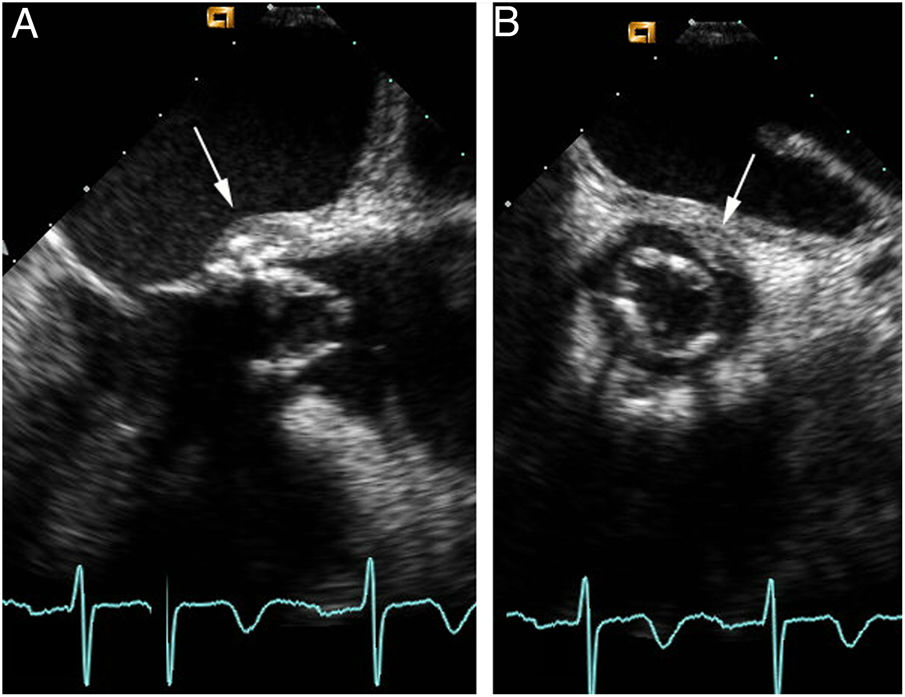
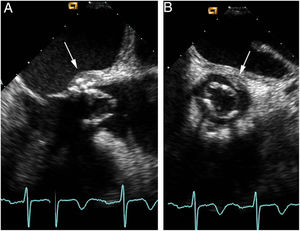
Al día siguiente del ingreso, el paciente presentó un episodio de mareo, demostrándose en el electrocardiograma bradicardia sinusal con bloqueo auriculoventricular (AV) de primer grado y extrasístoles ventriculares frecuentes. Se realizó un ecocardiograma transesofágico, observándose la presencia de una bioprótesis con velos engrosados, sin insuficiencia, con imágenes móviles sugestivas de vegetaciones y un absceso periprotésico a nivel del velo no coronariano (fig. 1). Hemodinámicamente, la bioprótesis se comportaba como una estenosis ligera-moderada con un área por ecuación de continuidad de 1,56 cm2 y gradiente transprotésico máximo/medio de 56/32 mmHg, respectivamente.
Con el diagnóstico de endocarditis protésica precoz, se inició un tratamiento empírico con vancomicina, gentamicina y rifampicina y el paciente fue remitido inmediatamente a nuestro hospital, permaneciendo apirético desde el inicio de la terapia antibiótica.
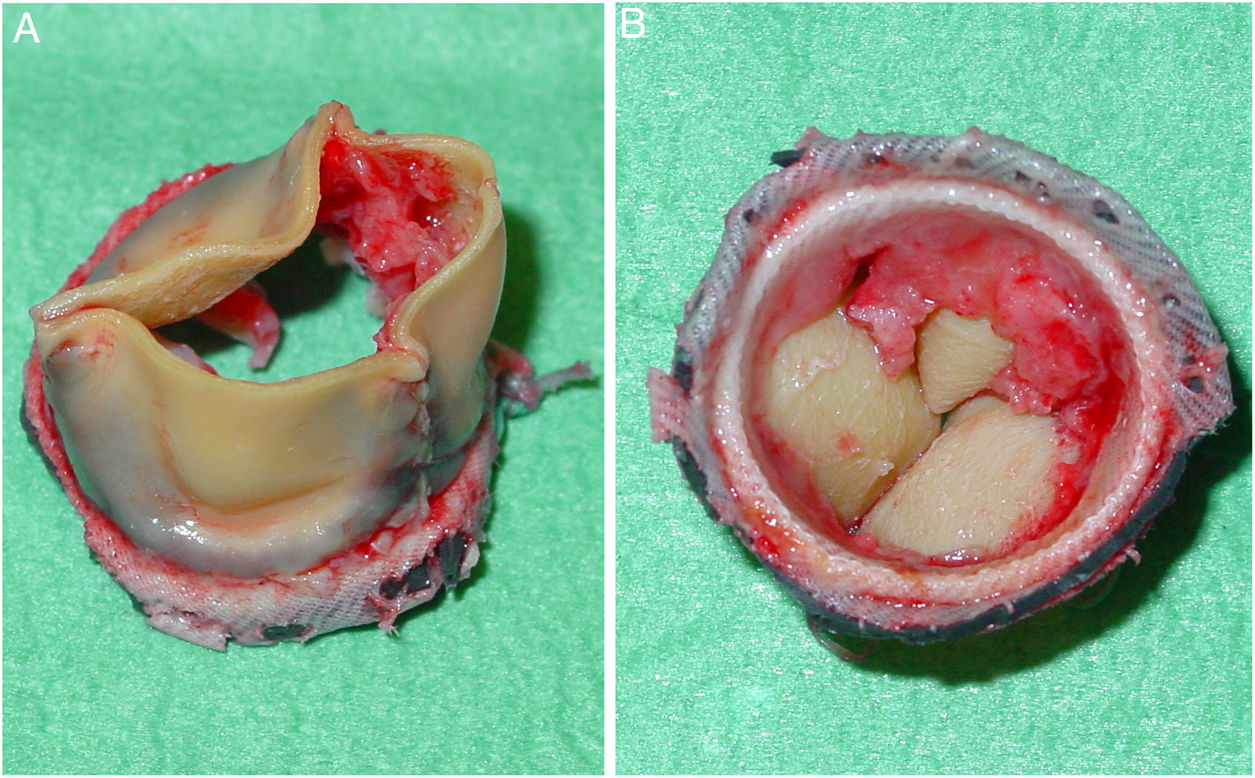
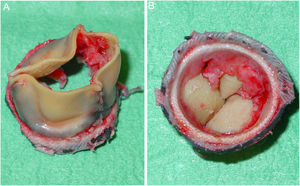
El paciente fue intervenido con carácter preferente cuatro días más tarde. Durante la intervención, se resecó la prótesis valvular y se observó gran cantidad de pannus y material fibrino-hemático adherido a la cara ventricular de los velos de la prótesis, así como un absceso anular a nivel del velo aórtico no coronariano (fig. 2). El absceso fue desbridado y la cavidad cerrada con un parche de pericardio bovino. Seguidamente, se implantó una nueva bioprótesis de pericardio bovino de 21 mm y un marcapasos ventricular epicárdico definitivo. El material extraído se envió para cultivo y para estudio histopatológico. El cultivo del material quirúrgico resultó negativo. En las muestras de pannus enviadas para el estudio microscópico, se observó la presencia de tejido fibrinoleucocitario sin evidencia de gérmenes.
Nueve días después de extraídos los hemocultivos, se observó un crecimiento de P. acnei sensible a betalactámicos en las tres muestras. El tratamiento antibiótico empírico fue sustituido por ampicilina. La evolución postoperatoria fue lenta pero satisfactoria y el paciente fue dado de alta una vez completadas seis semanas de antiinfecciosos. Nueve años después de la intervención, el sujeto permanecía asintomático y con una prótesis valvular normofuncionante, falleciendo al año siguiente por un proceso neoplásico.
DiscusiónLa endocarditis infecciosa por P. acnes es infrecuente4,5,7. Afecta con preferencia a los varones3,5 y al lado izquierdo del corazón5. Aunque se han descrito casos sobre la válvula nativa el factor predisponente más importante es la presencia de prótesis valvulares y de electrodos endocavitarios1,5.
La mayor afectación de los varones se observa también en la infección de las prótesis articulares del hombro9 y podría deberse a la elevada densidad de glándulas sebáceas en la parte alta del tórax de los varones3,4,9.
El período transcurrido entre el implante protésico y el diagnóstico de endocarditis por P. acnes es variable (entre cuatro meses y 12 años)5,9. Se ha sugerido que el mecanismo de infección en la endocarditis precoz es la contaminación de la prótesis desde la piel del paciente durante la cirugía5. Es posible que el lapso transcurrido entre la contaminación de la prótesis y el diagnóstico de endocarditis en algunos casos sea muy prolongado, llegando incluso hasta 24 a 36 meses. Esto se debe a la baja virulencia del germen, a la indolencia del cuadro en las fases iniciales y a la profilaxis antibiótica administrada durante la intervención, que, si bien no impide la infección es capaz de disminuir el tamaño del inóculo3,8.
En los casos de la endocarditis tardía, la siembra hematógena parece el mecanismo de infección más probable3. Algunos autores han descrito antecedentes de manipulación de la barrera cutáneo-mucosa (procedimientos odontológicos, pinchazos accidentales e intervenciones quirúrgicas) en casos de endocarditis tardía por P. acnes8. Se ha sugerido que los varones serían más propensos a bacteriemias transitorias al estar colonizados por P. acnes4 con mayor frecuencia.
En las fases precoces de la enfermedad, el curso clínico suele ser indolente. Este hecho unido a que los cultivos suelen ser negativos durante los cinco primeros días de incubación y a la tendencia a considerar este microorganismo como un contaminante hacen que con frecuencia se retrase el diagnóstico o bien se infraestime la verdadera prevalencia de esta infección1,5,8.
En el momento del diagnóstico, los pacientes suelen presentar un estado avanzado de la enfermedad3,5. La insuficiencia cardiaca por dehiscencia de la prótesis protésica está presente en el 62,5 al 85%3,8, fiebre y escalofríos en el 43 al 88%4,5,8, embolismos periféricos en el 11 al 17%4,5 y manifestaciones inmunológicas en el 6,2%8.
P. acnes activa los fagocitos, aunque estos son incapaces de destruir el microorganismo y además liberan productos enzimáticos que lesionan los tejidos y favorecen la dehiscencia de la prótesis8. Además, el biofilm limita notablemente los síntomas infecciosos que aparecen cuando pasan bacilos al torrente circulatorio8.
En el momento del diagnóstico, la ecocardiografía suele demostrar enfermedad invasiva perianular con dehiscencia de la prótesis en el 33 al 92%3–5, y abscesos en el 7 al 46%3,8. En algunos trabajos se ha observado intraoperatoriamente la formación de criptas o aneurismas hasta en el 74% de los pacientes3. La identificación de vegetaciones mediante ecocardiografía oscila entre 7 y 64%3–5,8.
Desde el punto de vista hemodinámico, la endocarditis sobre prótesis mecánica se suele comportar a nivel aórtico como insuficiencia periprotésica y a nivel mitral como estenosis. Las prótesis biológicas en posición aórtica, al igual que observamos en nuestro caso, pueden comportarse como estenosis8.
P. acnes es un bacilo de crecimiento lento. El tiempo medio para su aislamiento en hemocultivo es de seis a 11 días y hasta de tres semanas en las muestras de tejidos1,6,8. Cuando se cultiva material quirúrgico, fragmentos de anillo valvular o vegetaciones, se recomienda procesar las muestras triturándolas antes de su siembra6,8.
El diagnóstico microbiológico de la endocarditis por P. acnes es difícil pues las muestras deben ser incubadas durante un período superior al habitual y, a menudo, el aislamiento del bacilo es interpretado como contaminación de la flora cutánea1. Por este motivo, es posible que la prevalencia real de la endocarditis por P. acnes esté infraestimada1,5.
Se calcula que entre el 25 y el 46% % de las endocarditis por P. acnes presentan cultivos negativos5,6. En estos casos, las técnicas de biología molecular sobre tejidos o material quirúrgico permiten identificar el bacilo en pacientes que, de otro modo, quedarían etiquetados como endocarditis con cultivo negativo5,8.
En algunas series, el estudio histopatológico de las muestras quirúrgicas permite observar microorganismos compatibles con P. acnes5,6 mientras que, en otras, al igual que en nuestro caso, los hallazgos patológicos se limitan a la presencia de pannus sin observar restos de microorganismos8.
El tratamiento de la endocarditis protésica por P. acnes incluye la administración de antibióticos y, en la mayoría de los casos, el explante de la prótesis5. El bacilo suele ser sensible a betalactámicos y clindamicina, si bien, como ocurrió en nuestro paciente, muchos sujetos reciben inicialmente vancomicina como parte del tratamiento empírico hasta conocer el resultado de los cultivos4,5. Es posible asociar rifampicina para facilitar su penetración en el biofilm3.
Los resultados del tratamiento combinado antiifinfeccioso y quirúrgico son buenos. Las tasas de mortalidad hospitalaria oscilan entre 18,78 8,55 y 2%4. En algunos trabajos, no se observa mortalidad ni recidiva3.
El tratamiento únicamente con antibióticos sin cirugía asociada puede lograr la curación en algunos casos anecdóticos10, pero, en general, la endocarditis suele recidivar cuando no se reseca todo el material protésico4,8. En estos casos, la recidiva suele ser muy tardía pues se trata de un germen de baja virulencia y además el tratamiento antiinfeccioso reduce la actividad bacteriana, aunque no logra esterilizar la prótesis. Por este motivo, el seguimiento mínimo recomendado de estos pacientes es de dos años8.
Este trabajo ha sido aprobado por el comité ético del hospital y, por tratarse de un paciente fallecido, no requiere consentimiento informado para su publicación
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.