La estenosis aórtica es una valvulopatía frecuente en nuestro medio que afecta aproximadamente al 2-7% de los pacientes mayores de 65 años1 y que presenta una alta morbimortalidad. La prevalencia de esta enfermedad aumenta a medida que envejece la población, siendo por tanto pacientes con mayores comorbilidades que contraindican en muchas ocasiones una cirugía de recambio valvular convencional.
Así, a la propia edad avanzada se pueden sumar situaciones como: marcada calcificación aórtica, disfunción ventricular izquierda grave, hipertensión pulmonar, enfermedad renal o hepática, accidentes cerebrovasculares previos e incluso radioterapia torácica. En estos pacientes con alto riesgo quirúrgico, el implante valvular aórtico transcatéter (TAVI) se postula como un método alternativo para tratar a pacientes seleccionados2,3.
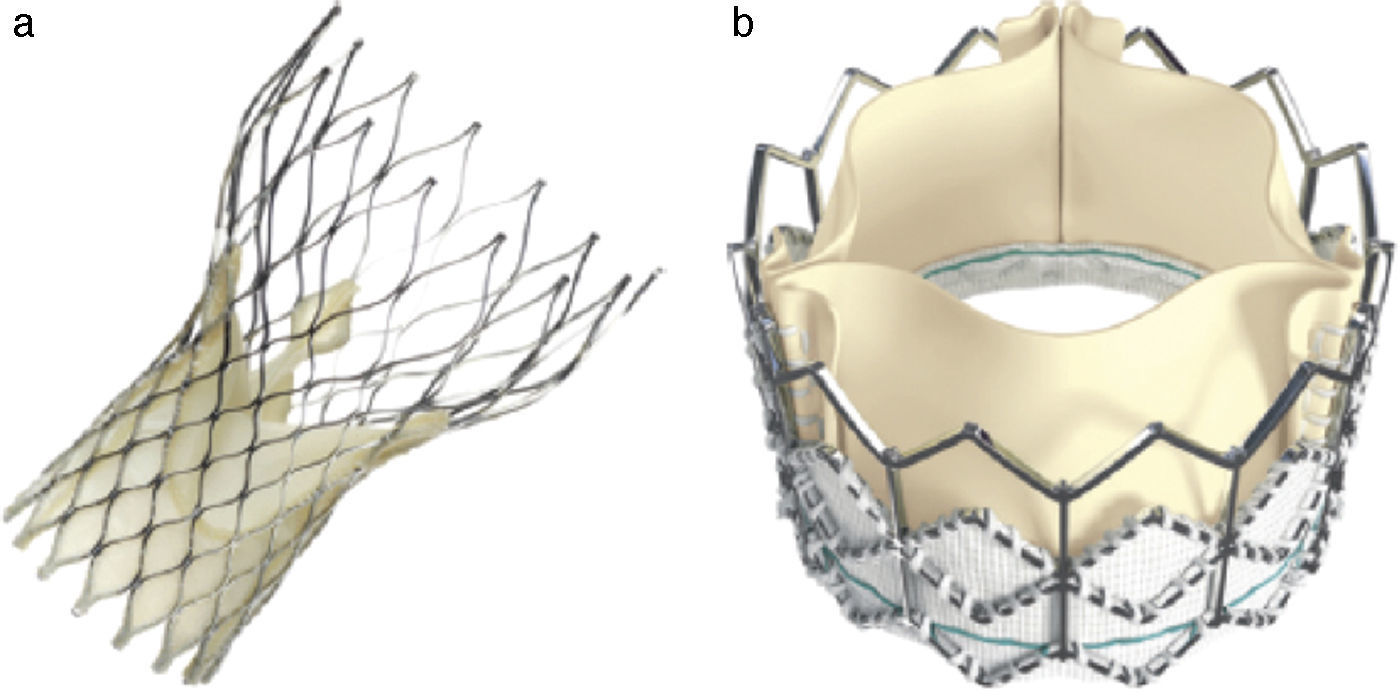
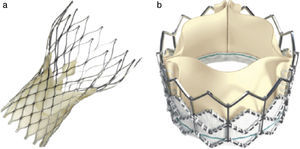
En este sentido en el ensayo PARTNER, que incluyó a 699 pacientes con estenosis aórtica grave, mostró que el TAVI tuvo mejores resultados que el tratamiento médico y no hubo diferencias al año de seguimiento entre el TAVI y la cirugía de sustitución valvular en pacientes con un alto riesgo quirúrgico en los resultados de mortalidad total (24,2% vs. 26,8%; p=0,44) o mortalidad cardiovascular (14,3% vs. 13%; p=0,63)4. Actualmente, tanto las guías americanas como europeas de valvulopatías recomiendan el TAVI a pacientes con indicación de recambio valvular aórtico que presentan un alto riesgo quirúrgico y una expectativa de supervivencia superior de 12 meses posterior al implante percutáneo, con una clase de recomendación i5,6. Disponemos de 2 tipos de prótesis TAVI que se utilizan en la práctica clínica: la válvula con sistema autoexpandible CoreValve ReValving (Medtronic, Minneapolis, EE. UU.) y la válvula de balón expandible Edwards Sapiens (Edwars Lifesciences, Irvine, EE. UU.) (fig. 1).
a) Válvula CoreValve (Medtronic) formado por un stent autoexpandible de nitinol que tiene en su interior 3 velos de pericardio porcino. b) Válvula de balón expandible Edwards Sapiens montada en el interior de un stent metálico de cobalto y constituida por 3 velos de pericardio bovino. A diferencia de la CoreValve, la válvula Edwars Sapiens se pliega sobre un balón y se implanta mediante un mecanismo de expansión por inflado de balón.
La tomografía computarizada multidetector (TCMD) se ha convertido en una herramienta indispensable en la valoración de pacientes candidatos a implante TAVI, especialmente utilizado para la valoración de la medida del anillo aórtico7-9, aunque también en la valoración del resto del trayecto aórtico y sobre todo del acceso vascular femoral.
El acceso transfemoral puede ser considerado el menos invasivo y el TCMD permite realizar una angiografía femoral no invasiva y una valoración tridimensional del sector ileofemoral. Su correcta valoración puede limitar las complicaciones vasculares, plantear vías de acceso alternativas como la transaxilar o transapical e incluso excluir a pacientes candidatos a esta técnica de recambio valvular percutáneo10.
Protocolo de adquisiciónLa realización de un TCMD en la evaluación para TAVI debe incluir la raíz aórtica, aorta, iliacas y arterias femorales comunes.
La adquisición de las imágenes para el análisis de la raíz aórtica debe realizarse de manera sincronizada con el electrocardiograma para evitar artefactos de movimiento, preferentemente de manera prospectiva para disminuir la dosis de radiación, pero optando por una sincronización retrospectiva en los casos de fibrilación auricular o frecuencias cardiacas elevadas11. En caso de pacientes con estenosis aórtica grave, es importante titular la dosis de betabloqueante por vía oral o calcioantagonista no dihidropiridínico hasta conseguir frecuencias cardiacas en torno a 60 latidos por minuto en reposo para disminuir los artefactos y mejorar la calidad de las imágenes.
El volumen de contraste yodado se adaptará al peso del paciente y el protocolo de adquisición empleado utilizando una concentración mínima de yodo de 350mg/ml.
Así mismo en función del protocolo y el tipo de escáner empleado se puede optar por hacer el estudio completo de la aorta y accesos femorales con los aparatos de TCMD más modernos o separar los estudios en 2 partes con los más antiguos, adquiriendo primero la aorta torácica con sincronismo cardiaco y en un segundo tiempo la aorta abdominal y las arterias iliacas y femorales sin necesidad de sincronización.
Valoración y medición del anillo aórticoEl anillo aórtico presenta un configuración oval7 (de trébol a nivel de los senos y circular a nivel de la unión sinotubular) y su evaluación por las técnicas de imagen bidimensional como son la ecocardiografía transtorácica y transesofágica es limitada, mostrando usualmente el diámetro más pequeño del tracto de salida del ventrículo izquierdo y el anillo aórtico. La posibilidad que ofrece la TCMD para la reconstrucción tridimensional del anillo hace que sus medidas sean consideradas hoy día el patrón oro de referencia por su reproducibilidad, fiabilidad y aplicabilidad12,13.
Un correcto estudio del anillo previo al implante TAVI evitará complicaciones como la regurgitación aórtica paravalvular (predictor de eventos en el seguimiento), embolización distal de la válvula, mismatch de la prótesis, oclusión de las arterias coronarias o incluso una rotura del anillo13.
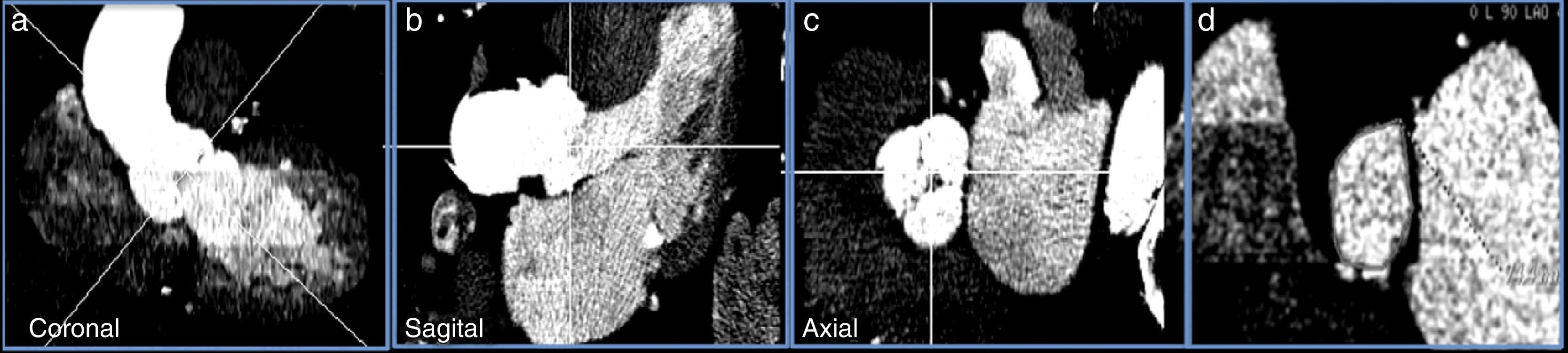
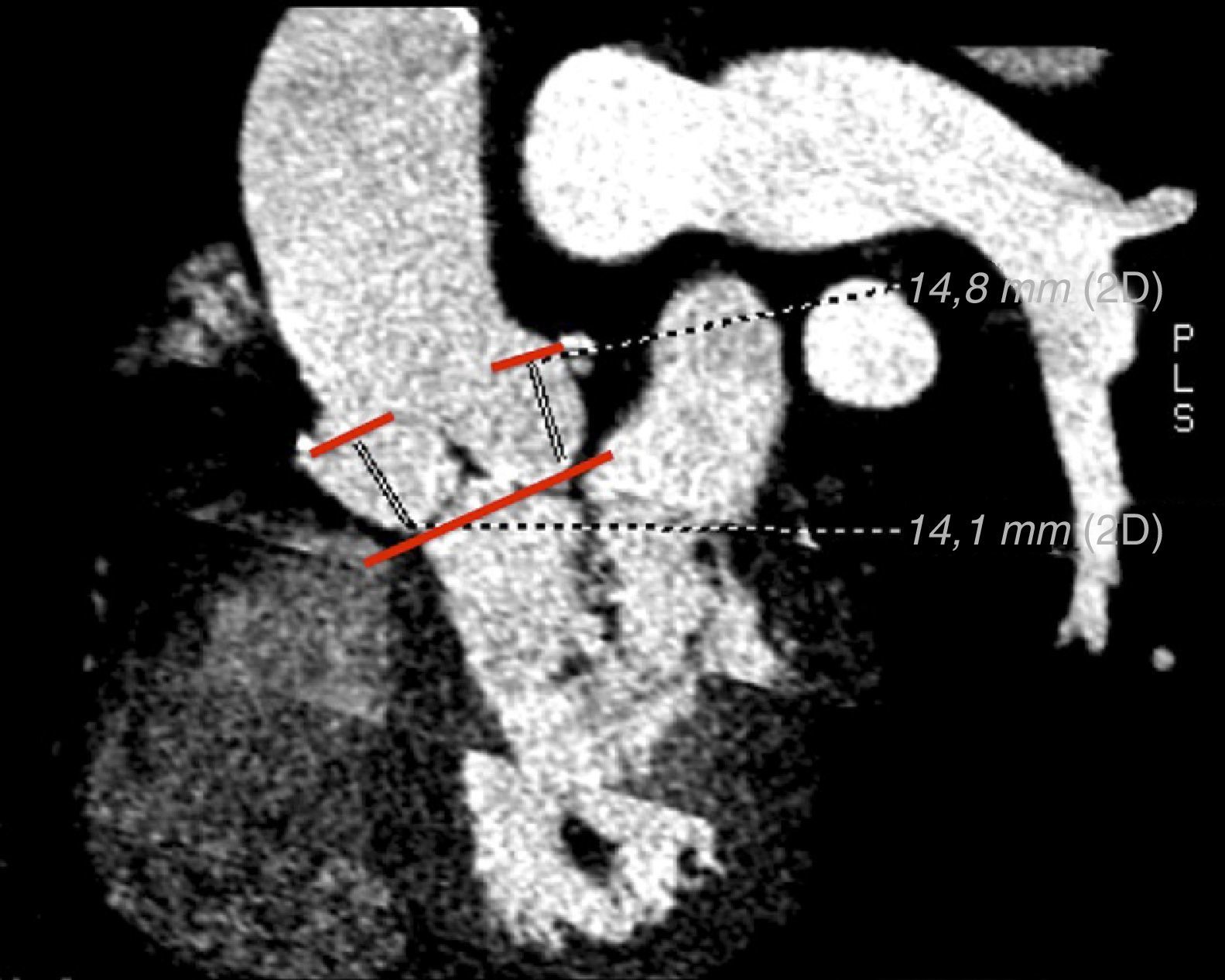
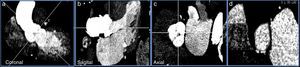
La medición del anillo aórtico por TCMD requiere la manipulación y el posprocesado de las imágenes hasta conseguir una imagen que se corresponda con el anillo basal de la válvula aórtica, que se define por el nivel situado inmediatamente por debajo de los 3 puntos de inserción más bajos de las cúspides aórticas (fig. 2).
Imagen con contraste de TCMD de paciente con estenosis aórtica grave. Planco coronal (a) y sagital (b) del tracto de salida de ventrículo izquierdo, porción sinusal y aorta ascendente. c) Imagen de la raíz aórtica a nivel de los senos de Valsalva. d) Anillo de la válvula aórtica donde se realizarán las medidas necesarias para la selección del tamaño de la prótesis percutánea aórtica.
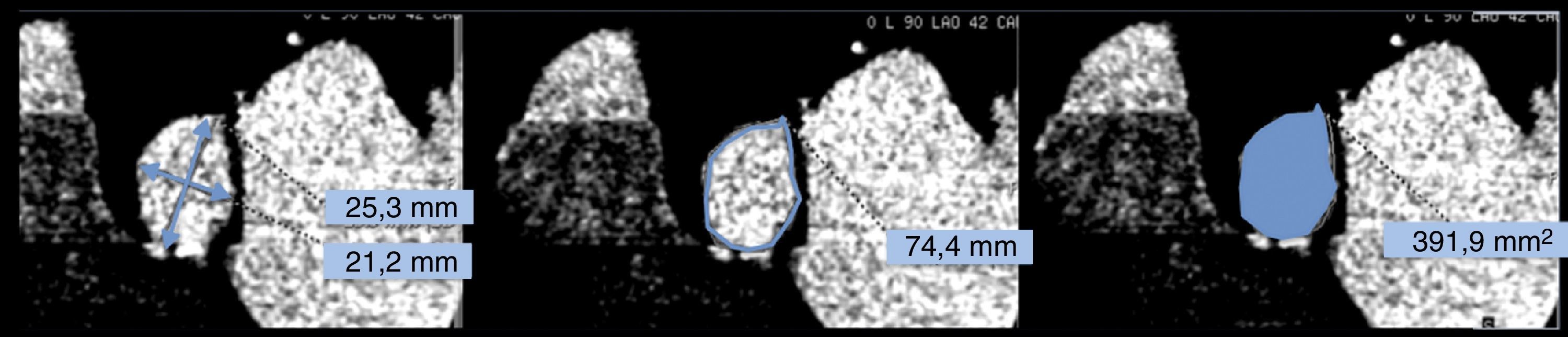
Estas medidas necesarias para la selección del tamaño adecuado de la prótesis, incluyen (fig. 3):
- –
Medición del diámetro mayor (Dmayor) y menor (Dmenor) del anillo aórtico para el cálculo del diámetro medio (D) que se obtiene promediando los 2 valores (D = [Dmayor+Dmenor]/2).
- –
Medición del perímetro del anillo aórtico.
- –
Planimetría del área anillo aórtico.
Para la válvula Edwards Sapien (Edwards Lifesciences), el anillo debe medir entre 18 -25mm, mientras que para la válvula CoreValve (Medtronic) el anillo debe medir entre 20-27mm11.
En la siguiente tabla 1 se muestran las recomendaciones del fabricante para la medición por TCMD de la Medtronic CoreValve autoexplandible.
Recomendaciones del fabricante del tipo de prótesis Medtronic CoreValve autoexplandible según las mediciones del anillo aórtico por TCMD
| Diámetro medio, mm | Perímetro, mm | Área, mm2 | |
|---|---|---|---|
| Medtronic CoreValve 23mm | 18-20 | 56,5-62,8 | 254-314 |
| Medtronic CoreValve 26mm | 20-23 | 62,8-72,3 | 314-415 |
| Medtronic CoreValve 29mm | 23-27 | 72,3-84,8 | 415-572 |
| Medtronic CoreValve 31mm | 26-29 | 81,7-91,1 | 530-660 |
La TCMD es la técnica de imagen de elección para la detección y la cuantificación de calcio. El grado de calcificación de los velos aórticos valorado en la TCMD previo al implante se correlaciona significativamente con el riesgo de complicaciones durante el TAVI. La fuga paravalvulvar se ve favorecida por el incorrecto despliegue de la prótesis contra la pared aórtica en presencia de calcio, incluso tras el inflado o balonización de la prótesis. Un estudio publicado por Leber et al.14 que evaluó la presencia de calcio valvular en 68 pacientes previo al implante de la prótesis CoreValve, demostró que los pacientes que presentaron un score>750 unidades de Agatston tuvieron una supervivencia al año significativamente menor que los pacientes con un score<750 unidades de Agatston (58% vs. 98%; p = 0,05), además de que la presencia de calcio aórtico se asoció a la mejoría de la clase funcional de la New York Heart Association después del implante del TAVI. Esto último se explicaría por una significativa mejoría en el gradiente transvalvular tras el implante de la prótesis en válvulas más estenóticas. En definitiva, los autores concluyeron que el grado de calcificación aórtica se asoció a la presencia de regurgitación aórtica, complicaciones durante el procedimiento, aumento de la mortalidad al año y mejoría de la clase funcional tras el TAVI.
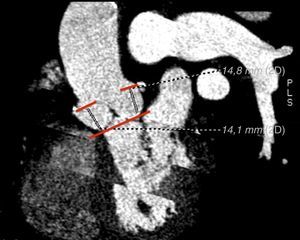
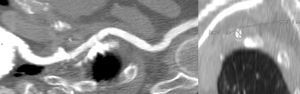
Valoración de las arterias coronariasLa distancia del plano aórtico origen de ambas arterias coronarias es una medida relevante en el estudio preimplantación de la prótesis percutánea aórtica. A diferencia de lo que ocurre durante el reemplazo quirúrgico valvular aórtico en el cual las valvas son reseccionadas, durante el TAVI las valvas nativas son desplazadas y aplastadas por la prótesis, pudiendo ocasionar complicaciones tan graves como una oclusión coronaria o lesión de la raíz aórtica12, así como el riesgo de obstrucción del flujo coronario por el propio stent de la válvula aórtica15.
Se indican valores de distancia mínimos de 10-14mm entre el origen de las arterias coronarias y la inserción de las valvas para evitar complicaciones en el implante de ambas prótesis15 (fig. 4). La prótesis CoreValve presenta menos complicaciones en este aspecto que la Edwars Sapien. Un estudio que evaluó el anillo aórtico y el origen de las arterias coronarias de 400 pacientes mediante TCMD observó que durante el TAVI, la intervención percutánea sobre las arterias coronarias ocurría con más frecuencia en los casos situados a una distancia<10mm del anillo, ocasionado por una obstrucción del flujo coronario que origina el stent de la prótesis TAVI16. La obstrucción de las arterias coronarias se puede evitar con el paso de una guía a través de las arterias coronarias previa al TAVI en pacientes con alto riesgo.
Valoración de la posición del plano de implantaciónDurante la implantación de la prótesis percutánea aórtica puede ser necesaria la realización de múltiples proyecciones angiográficas hasta encontrar un plano en el que todas las cúspides de los senos de Valsalva queden alineadas perpendicularmente en el mismo plano.
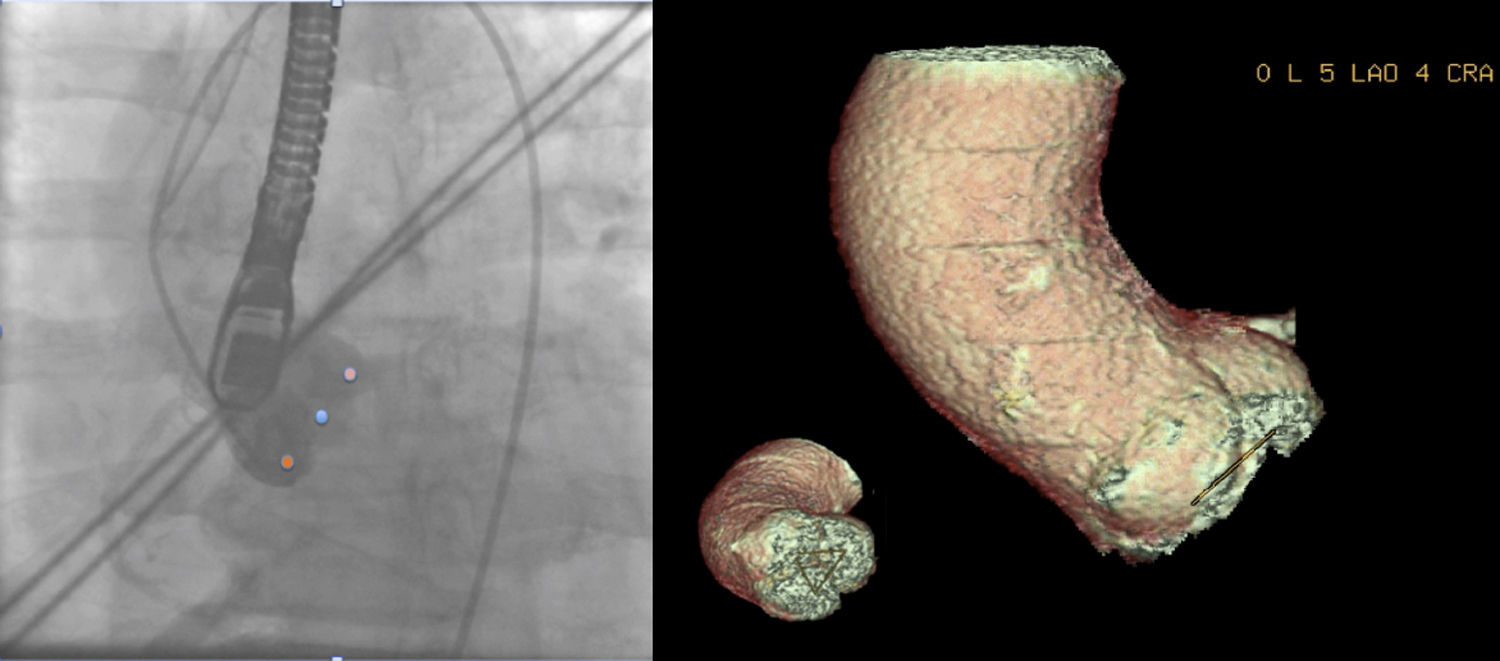
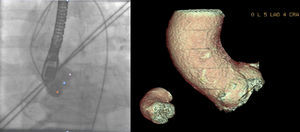
La mayoría de los operadores prefieren una proyección en la que la cúspide coronaria derecha es central, mientras que la no coronariana e izquierda están situadas simétricamente a cada lado12 (fig. 5).
Ejemplo de paciente varón de 83 años con estenosis aórtica grave en el que se muestra en el plano angiográfico (5 LAO 4 CRA) determinado por TCMD en el que los senos se encuentran alineados. Obsérvese que el triángulo que une los 3 senos se muestra en una única línea indicando que todos los senos se encuentran en el mismo plano. Se muestra también la proyección angiográfica en la que se muestran los 3 senos coronarios alineados. El punto central, el seno coronario derecho, el más a la izquierda de la imagen, el seno no coronariano y el punto más situado a la derecha de la imagen, el seno coronario izquierdo.
Diversos estudios han demostrado que el TCMD predice correctamente la proyección angiográfica perpendicular al plano valvular aórtico, que ayuda a guiar el proceso y correcto posicionamiento de la prótesis percutánea aórtica17-20, reduciendo así la dosis de contraste utilizado, la dosis de radiación y el tiempo de procedimiento (fig. 5).
Es importante conocer que si uno de los senos se encuentra incorrectamente alineado existe un alto riesgo de malposicionamiento, embolización y complicaciones periprocedimiento.
Debe tenerse en cuenta que si el paciente se coloca de manera diferente durante la adquisición de la TCMD y el procedimiento (p. ej., adquisición en decúbito supino, pero luego el paciente requiere estar girado hacia su derecha porque el acceso es transapical), se deben realizar correcciones, ya que habrá variaciones al cambiar la orientación del paciente.
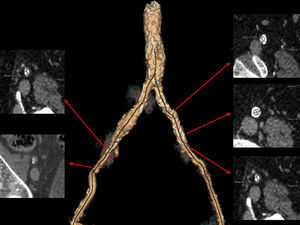
Valoración del acceso vascular transfemoralLas complicaciones vasculares son la mayor causa de mobilidad y mortalidad durante el implante TAVI21.
El acceso vascular transfemoral es considerado el acceso de elección por ser el menos invasivo y accesible, así como la vía de acceso más conocida y frecuentemente utilizada por los cardiólogos intervencionistas.
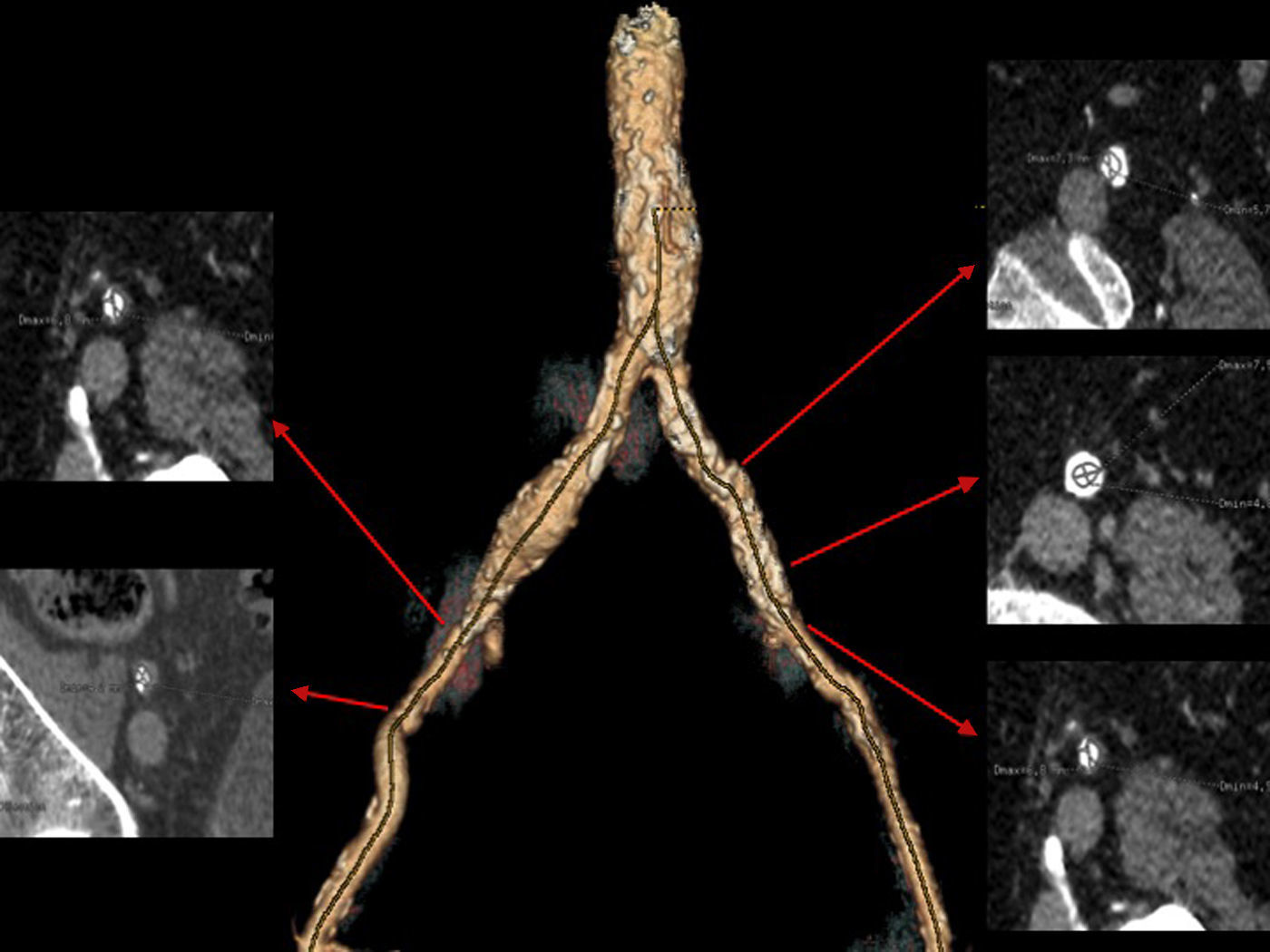
Las arterias ileofemorales son lo suficientemente grandes en la mayoría de los pacientes evaluados para TAVI y en ausencia de enfermedad arteroesclerosa la arteria es muy moldeable. Sin embargo, en presencia de arteriosclerosis moderada o grave, el tamaño de la vaina externa de los catéteres utilizados para el implante del TAVI no debe superar el diámetro mínimo de la arteria10. El TCMD es una herramienta que mediante la angiografía no invasiva permite valorar el acceso transfemoral utilizado en el TAVI evaluando el tamaño del vaso, la presencia de calcio, el diámetro luminal mínimo, la carga de placa e identifica tortuosidades y placas de ateromas complejas con alto riesgo de disección12.
Usualmente los catéteres empleados para el implante TAVI tiene un tamaño que fluctúa entre 6-8mm (18-24 F), dependiendo del tamaño de la prótesis. Actualmente, se disponen de catéteres de menor tamaño (14 F), que permiten tratar a pacientes con arterias femorales con diámetros menores de 6mm que hasta ahora no podían beneficiarse de este acceso vascular.
Las complicaciones vasculares ocurren con más frecuencia a nivel ileofemoral que en la propia aorta (1%)21 e incluyen: disección y/o rotura ileofemoral, infección en el punto de acceso, seudoaneurisma o sangrado en el zona de punción arterial, estenosis, trombosis o incluso fallo del dispositivo de cierre percutáneo utilizado durante el TAVI. La presencia de estas complicaciones vasculares se asocia a mayor morbimortalidad, mayor estancia hospitalaria y mayores costes, por tanto, es importante identificar e incluso excluir aquellos pacientes de mayor riesgo de presentarlas (fig. 6).
Otros accesos vascularesOtras opciones menos usadas con la transapical (actualmente utilizado principalmente con el Edwards Sapiens, Sapiens XT, y la próxima generación de válvulas) y la aórtica directa, transaxilar, o el acceso por arteria subclavia (principalmente para la Medtronic CoreValve)22.
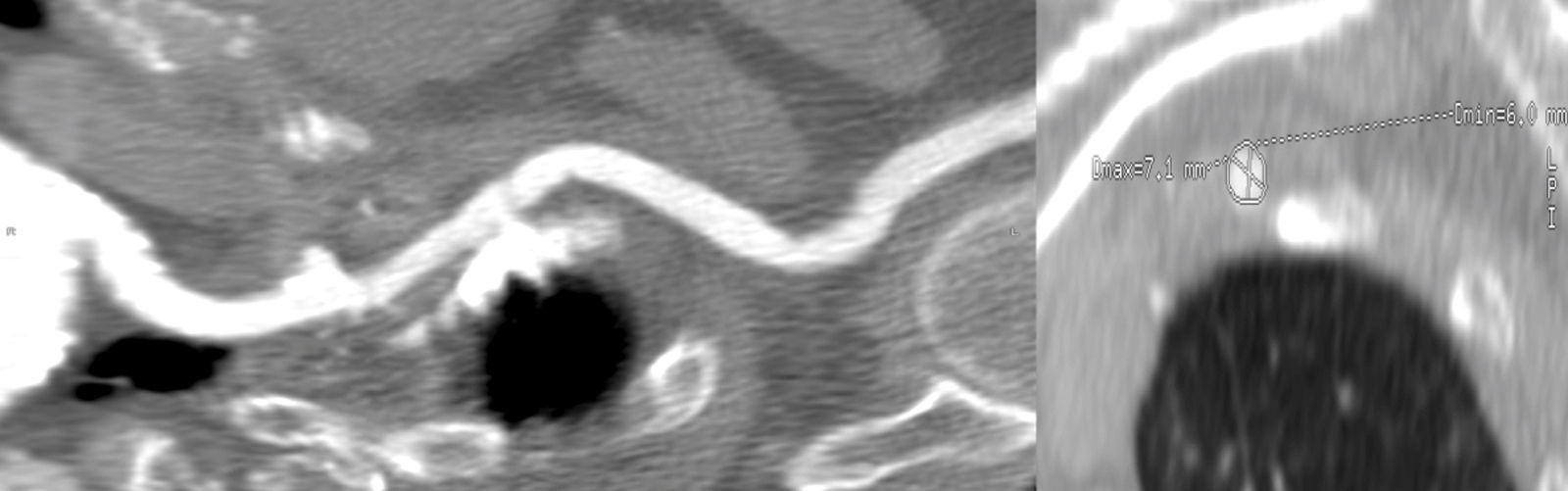
En el caso de que el acceso elegido sea el transaxilar o la arteria subclavia, en ausencia de calcio el diámetro mínimo de la arteria debe ser de al menos 6mm para catéteres de 18 F. En pacientes que además presenten un injerto de arteria mamaria, el diámetro mínimo de la arteria debe ser de 7,5mm para permitir el flujo durante la introducción del catéter (fig. 7).
Otro posible acceso vascular es el transcarotídeo. A pesar de que este acceso es muy accesible a través de una pequeña incisión en el cuello, actualmente su experiencia es muy limitada. En una serie de 12 casos se empleó la vía transcarotídea con éxito, no hubo ninguna muerte, pero un paciente presentó un accidente cerebrovascular23.
Resonancia magnéticaLa resonancia magnética (RM) es una técnica más compleja, requiere más tiempo y mayor colaboración del paciente, por lo que hasta el momento ha sido mucho menos usada que el TCMD para la valoración preimplantación de válvula TAVI. A diferencia del TCMD, la RM presenta la ventaja de no utilizar radiaciones ionizantes y de poder ser utilizada en pacientes con insuficiencia renal avanzada. Algunos estudios apuntan que la RM presenta, al igual que el TCMD, una buena reproducibilidad en la valoración del anillo aórtico24,25.
La angiografía con RM es una técnica sensible para detectar estenosis arteriales > 50% y podría surgir como una alternativa prometedora para el estudio del acceso vascular transfemoral en pacientes con insuficiencia renal, aunque esta técnica tiene la desventaja frente a la TCMD de presentar una menor resolución espacial y la imposibilidad de detectar calcio parietal a nivel de las arterias.
FinanciaciónNinguna.
Conflicto de interesesNinguno.