Evaluar nuestra experiencia quirúrgica y pronóstico postoperatorio en la cirugía de canal auriculoventricular en 10 años.
MétodosDesde mayo del 2003 hasta octubre del 2013 se recogieron retrospectivamente 91 pacientes consecutivos intervenidos de canal auriculoventricular. Diez pacientes con formas disbalanceadas se manejaron inicialmente con banding de arteria pulmonar y reparación biventricular en un segundo tiempo. Los objetivos primarios fueron mortalidad y reintervención hospitalaria y a largo plazo.
ResultadosLa mortalidad global fue del 3,30% (n=3). La mortalidad hospitalaria fue del 1,10% (n=1) y la mortalidad a largo plazo del 2,20% (n=2). La reintervención global fue del 11% (n=10). La causa más frecuente de reintervención fue la insuficiencia de la válvula auriculoventricular izquierda moderada-severa. La supervivencia global a 10 años fue del 96,70%. La supervivencia en el subgrupo de disbalanceados fue del 100%. La libertad de reintervención a largo plazo global a 10 años fue del 89%. Los pacientes con síndrome de Down tuvieron una tendencia a menor necesidad de reintervención a largo plazo.
ConclusionesLa reparación del canal auriculoventricular puede llevarse a cabo con buenos resultados a medio y largo plazo. El síndrome de Down podría actuar como factor protector en la reintervención por insuficiencia auriculoventricular izquierda. Las técnicas paliativas podrían tener cabida en ventrículos disbalanceados no extremos para redirigirlos a la vía biventricular.
The purpose of this study was to evaluate the surgical outcome of the atrioventricular septal defect in a single institution during the last 10 years (2003-2013) and to identify the risk factors associated with poor outcome.
MethodsData were retrospectively collected on 91 consecutive patients who underwent surgical correction for atrioventricular septal defect between May 2003 and October 2013 at our institution. There were 10 patients with borderline unbalanced forms of AVSD (0.19≤atrioventricular valve index≤0.39) that were repaired with a two-stage strategy.
ResultsThe overall mortality was 3.30% (n=3). In-hospital mortality was 1.10% (n=1), and late mortality was 2.20% (n=2). The overall re-intervention was 11% (n=10). Early reoperation was indicated in one patient. and late reoperation was required in 9 patients. Left atrioventricular valve regurgitation was the leading cause for re-intervention. The estimated overall survival at 10 years of follow-up for all patients was 96.70%. The estimated survival in the unbalanced group was 100%. The estimated freedom from late reoperation for all hospital survivors without an early reoperation was 89% at 10 years.
ConclusionsAtrioventricular septal defect is optimally carried out with good mid-term outcome. However postoperative left atrioventricular valve regurgitation remains a matter of concern during follow-up. Down's syndrome could be a protective factor against this complication. Palliatives techniques may be useful in borderline unbalanced forms of AVSD in order to achieve a biventricular repair.
El canal auriculoventricular (CAV) incluye defectos en la porción inferior del septum auricular, defectos del septo de entrada ventricular y diferentes grados de alteraciones en el tejido que forma las válvulas auriculoventriculares (AV) izquierda y derecha1. Hoy en día, los resultados a corto y medio plazo son excelentes. Sin embargo, la morbilidad y la necesidad de reintervención afectan a los resultados a largo plazo2. El síndrome Down se ha postulado como un posible factor protector frente a la insuficiencia mitral postoperatoria2. El objetivo de este estudio es evaluar nuestra experiencia en la cirugía de los CAV en un período de 10 años (2003-2013) e identificar factores de riesgo asociados a un peor pronóstico.
MétodosRecogida de datosEl estudio fue aprobado por el Comité Ético del Hospital Materno-Infantil Sant Joan de Déu y todos los procedimientos fueron llevados a cabo de acuerdo a las guías institucionales de protección de datos y la confidencialidad del paciente. Los datos se han obtenido de historias clínicas, incluyendo protocolos quirúrgicos, laboratorio de hemodinámica e informes de ecocardiografía.
Características de los pacientesSe recogieron retrospectivamente los datos de 91 pacientes diagnosticados de CAV sometidos a reparación biventricular entre mayo del 2003 y octubre del 2013. La mediana de edad según el tipo de CAV fue: completo, 6 meses (rango, 1-71); transicional, 14 meses (rango, 3-83) y parcial, 20 meses (rango, 5-168). Un 55% (n=50) eran mujeres. La mediana de peso en el momento de la cirugía fue 6,35kg (rango, 2,8-47). Respecto a las diferentes formas de CAV, un 64,80% (n=59) eran completos; 19,80% (n=18) eran parciales y un 15,40% (n=14) eran intermedios. Un 49,50% (n=45) fueron diagnosticados de trisomía del cromosoma 21. Tres pacientes presentaron además coartación de aorta y 2, atresia pulmonar. Los pacientes con transposición de grandes arterias fueron excluidos.
Técnica quirúrgicaTodos los procedimientos fueron llevados a cabo por el mismo cirujano y mediante técnica convencional de circulación extracorpórea (CEC) con canulación bicava e hipotermia moderada (25°C a 30°C). La cardioplejía hemática fría anterógrada se repitió cada 20 min tras el pinzamiento aórtico. El abordaje fue vía auriculotomía derecha de forma paralela al surco AV derecho, extendiendo la incisión hacia la orejuela derecha. Mediante inyección de suero salino para llenar ambos ventrículos se evaluaba la anatomía valvular y se establecían las líneas de coaptación de los velos. La distancia entre la válvula AV izquierda y la porción superior del septo interventricular fue identificada así como la hendidura de la válvula mitral en el caso que hubiese. La técnica de reparación de los CAV completos fue, en todos los casos, la de doble parche. Ocasionalmente, en los CAV transicionales con comunicación interventricular (CIV) restrictiva, el defecto fue cerrado mediante sutura directa usando Prolene 5-0® (Ethicon, New Brunswick, NJ, EE. UU.). La hendidura mitral fue cerrada sistemáticamente y testada su competencia. El seno coronario se dejó en todos los casos en el lado derecho del parche. Se realizó una ecocardiografía postoperatoria y antes del alta a todos los pacientes, objetivándose la competencia de las válvulas AV así como la presencia de defectos residuales. La insuficiencia de la válvula AV izquierda (IAVI) fue catalogada como leve (1), moderada (2) o severa (3).
Definiciones y objetivosNuestro objetivo fue el estudio de los pacientes diagnosticados de CAV sometidos a cirugía de reparación biventricular. Se usó el índice valvular AV (IVAV) (área valvular AV izquierda/área valvular AV derecha, cm2)3 para valorar la dominancia ventricular, definiéndose dominancia derecha cuando era ≤ 0, 4 y dominancia izquierda cuando era ≥ 0,6. Elegimos los valores entre 0, 4 y 0, 6 como la transición entre las formas balanceadas y disbalanceadas. Todos los pacientes con ventrículos claramente disbalanceados (IVAV < 0,19 o ≥ 0,6 (menos frecuente)) siguieron la vía univentricular y fueron excluidos. Un total de 10 pacientes con formas disbalanceadas no extremas (0,19 ≤ IVAV ≤ 0,39) se manejaron inicialmente con banding de arteria pulmonar (BAP) en los primeros días de vida para realizar la reparación biventricular definitiva en un segundo tiempo.
Los ecocardiogramas preoperatorios fueron realizados por cardiólogos especialistas en ecocardiografía pediátrica.
Los objetivos primarios fueron: a) mortalidad hospitalaria y a largo plazo, y b) reintervención hospitalaria y a largo plazo.
Los objetivos secundarios fueron:
- a)
Complicaciones postoperatorias mayores: insuficiencia auriculoventricular izquierda (IAVI), estenosis subaórtica, CIV residual, sustitución valvular mitral, implante de marcapasos definitivo e infección severa (neumonía y/o sepsis) antes del alta hospitalaria4,5. (Las tablas suplementarias S1 y S2 aportan los criterios utilizados para incluir esta última complicación [anexo 2]).
- b)
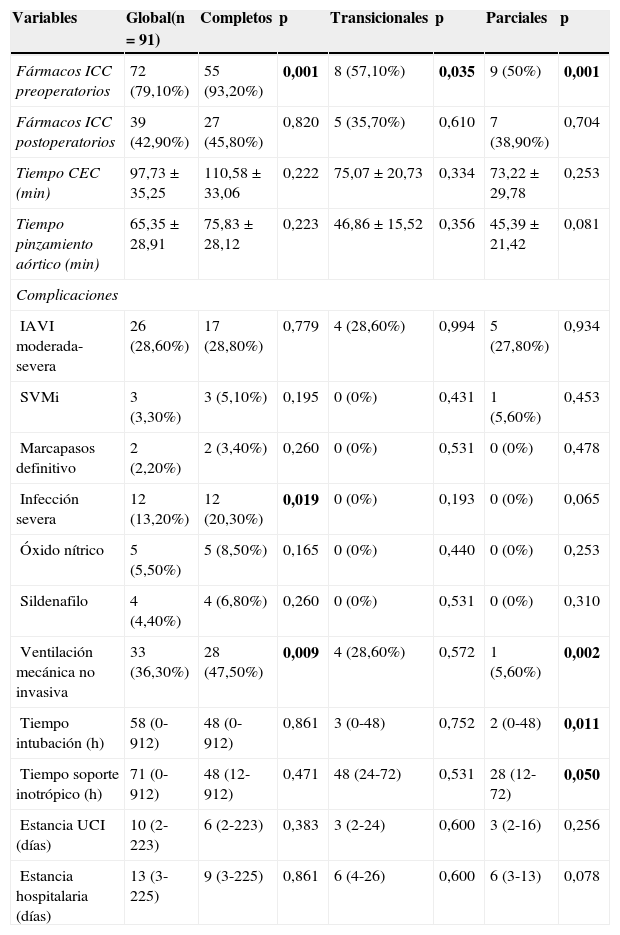
Tiempo de ventilación mecánica invasiva, necesidad de ventilación mecánica no invasiva (VMNI), tiempo de soporte inotrópico, tiempo de tiempo de circulación extracorpórea (CEC), tiempo de isquemia, uso de óxido nítrico y sildenafilo, fármacos anti insuficiencia cardíaca (digoxina, vasodilatadores, diuréticos y antiarrítmicos), estancia en unidad cuidados intensivos y hospitalaria. (Las tablas 1 y 2 ilustran los datos perioperatorios y análisis univariante por tipo de CAV y en los pacientes con ventrículos disbalanceados).
Tabla 1.Datos perioperatorios y análisis univariante por tipo de canal
Variables Global(n=91) Completos p Transicionales p Parciales p Fármacos ICC preoperatorios 72 (79,10%) 55 (93,20%) 0,001 8 (57,10%) 0,035 9 (50%) 0,001 Fármacos ICC postoperatorios 39 (42,90%) 27 (45,80%) 0,820 5 (35,70%) 0,610 7 (38,90%) 0,704 Tiempo CEC (min) 97,73±35,25 110,58±33,06 0,222 75,07±20,73 0,334 73,22±29,78 0,253 Tiempo pinzamiento aórtico (min) 65,35±28,91 75,83±28,12 0,223 46,86±15,52 0,356 45,39±21,42 0,081 Complicaciones IAVI moderada-severa 26 (28,60%) 17 (28,80%) 0,779 4 (28,60%) 0,994 5 (27,80%) 0,934 SVMi 3 (3,30%) 3 (5,10%) 0,195 0 (0%) 0,431 1 (5,60%) 0,453 Marcapasos definitivo 2 (2,20%) 2 (3,40%) 0,260 0 (0%) 0,531 0 (0%) 0,478 Infección severa 12 (13,20%) 12 (20,30%) 0,019 0 (0%) 0,193 0 (0%) 0,065 Óxido nítrico 5 (5,50%) 5 (8,50%) 0,165 0 (0%) 0,440 0 (0%) 0,253 Sildenafilo 4 (4,40%) 4 (6,80%) 0,260 0 (0%) 0,531 0 (0%) 0,310 Ventilación mecánica no invasiva 33 (36,30%) 28 (47,50%) 0,009 4 (28,60%) 0,572 1 (5,60%) 0,002 Tiempo intubación (h) 58 (0-912) 48 (0-912) 0,861 3 (0-48) 0,752 2 (0-48) 0,011 Tiempo soporte inotrópico (h) 71 (0-912) 48 (12-912) 0,471 48 (24-72) 0,531 28 (12-72) 0,050 Estancia UCI (días) 10 (2-223) 6 (2-223) 0,383 3 (2-24) 0,600 3 (2-16) 0,256 Estancia hospitalaria (días) 13 (3-225) 9 (3-225) 0,861 6 (4-26) 0,600 6 (3-13) 0,078 Variables categóricas expresadas como porcentajes (% respecto del grupo);variables continuas no normales expresadas como mediana (rango, mín-máx); variables continuas normales expresadas como media±desviación estándar. Se resaltan en negrita las variables estadísticamente significativas (p<0,05).
Fármacos ICC preoperatorios: fármacos antiinsuficiencia cardiaca congestiva preoperatorios; Tiempo CEC: tiempo circulación extracorpórea; IAVI moderada-severa: insuficiencia auriculoventricular izquierda moderada-severa; SVMi: sustitución valvular mitral; Estancia UCI: estancia unidad de cuidados intensivos.
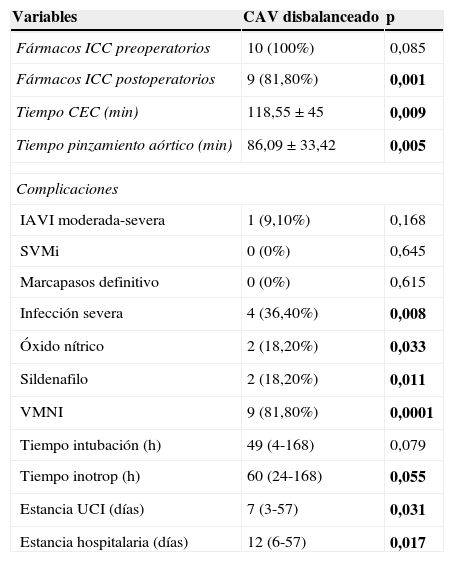
Tabla 2.Datos perioperatorios y análisis univariante en canales disbalanceados
Variables CAV disbalanceado p Fármacos ICC preoperatorios 10 (100%) 0,085 Fármacos ICC postoperatorios 9 (81,80%) 0,001 Tiempo CEC (min) 118,55±45 0,009 Tiempo pinzamiento aórtico (min) 86,09±33,42 0,005 Complicaciones IAVI moderada-severa 1 (9,10%) 0,168 SVMi 0 (0%) 0,645 Marcapasos definitivo 0 (0%) 0,615 Infección severa 4 (36,40%) 0,008 Óxido nítrico 2 (18,20%) 0,033 Sildenafilo 2 (18,20%) 0,011 VMNI 9 (81,80%) 0,0001 Tiempo intubación (h) 49 (4-168) 0,079 Tiempo inotrop (h) 60 (24-168) 0,055 Estancia UCI (días) 7 (3-57) 0,031 Estancia hospitalaria (días) 12 (6-57) 0,017 Variables categóricas expresadas como porcentajes (% respecto del grupo);variables continuas no normales expresadas como mediana (rango, mín-máx); variables continuas normales expresadas como media±desviación estándar. Se resaltan en negrita las variables estadísticamente significativas (p<0,05).
Fármacos ICC postoperatorio: fármacos antiinsuficiencia cardiaca congestiva postoperatorios; Tiempo CEC: tiempo circulación extracorpórea; IAVI moderada-severa: insuficiencia auriculoventricular izquierda moderada-severa; SVMi: sustitución valvular mitral; VMNI: ventilación mecánica no invasiva; Estancia UCI: estancia unidad de cuidados intensivos.
Para el análisis estadístico se usó el programa SPSS para Windows, versión 20.0 (SPSS, Chicago, IL). Las variables cuantitativas con una distribución no normal se expresaron como mediana con rangos y fueron comparadas mediante el test de la U de Mann-Whitney. Las variables cuantitativas con distribución normal se expresaron como media±desviación estándar y fueron comparadas mediante el test de la t de Student. Las variables categóricas fueron expresadas como porcentajes y comparadas con el test de la χ2. Se realizó un análisis univariante por subgrupos (tipos de canal y grupo disbalanceados) para objetivar qué variables guardaban relación con el pronóstico. Todas las variables que alcanzaron un resultado de p<0,05 fueron incluidas en el análisis multivariante (regresión logística modelo por pasos hacia adelante), que se realizó también por subgrupos. Se usó el método de Kaplan Meier para el análisis de supervivencia y libertad de reintervención. El test log-rank se usó para analizar diferencias en la supervivencia entre diferentes subgrupos.
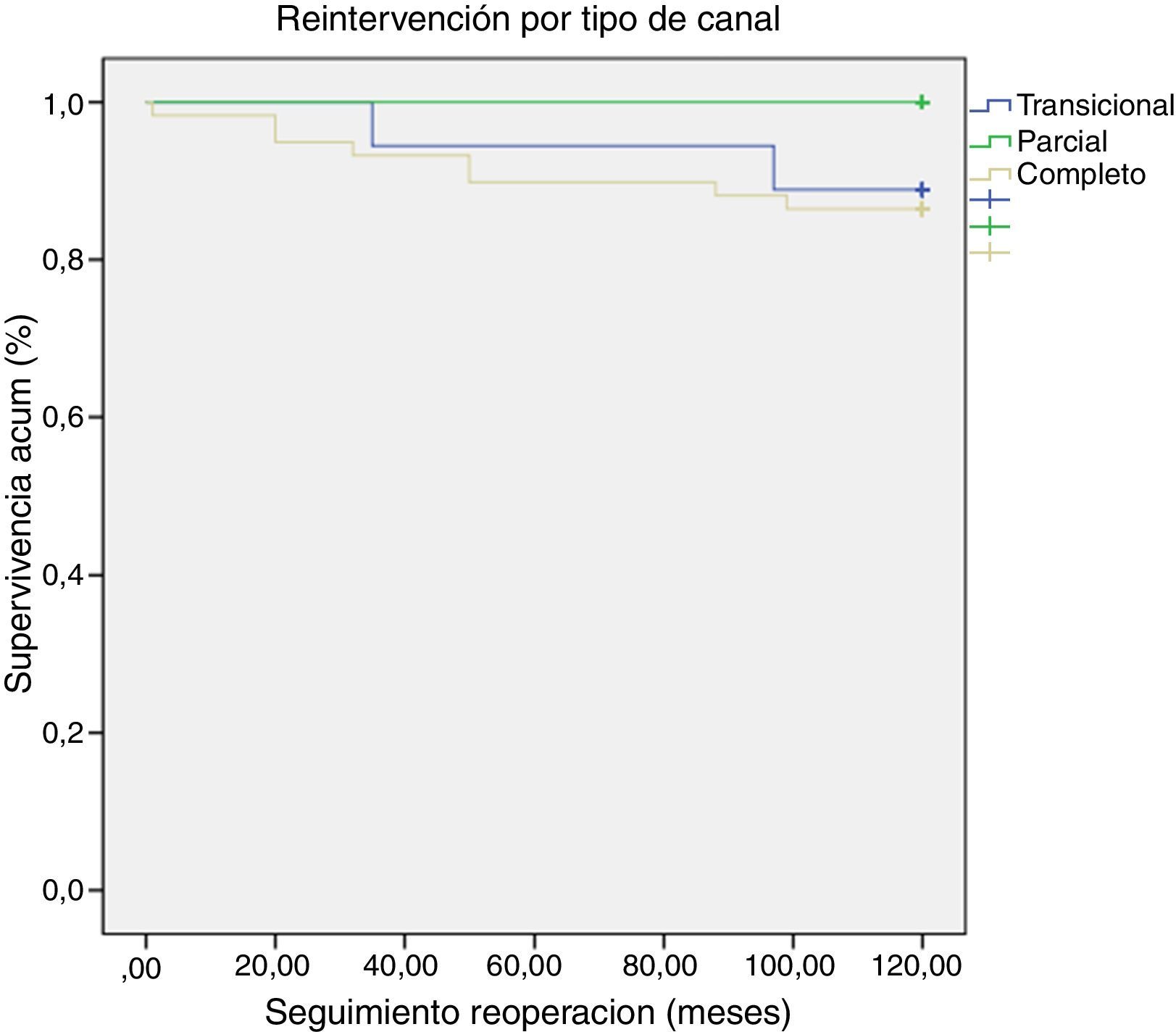
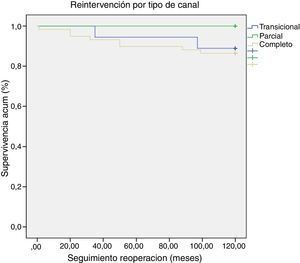
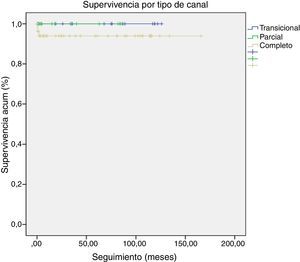
ResultadosLa mortalidad global fue del 3,30% (n=3). La mortalidad hospitalaria fue del 1,10% (n=1) y la mortalidad a largo plazo del 2,20% (n=2). La mortalidad en todos los casos fue debida a shock séptico. La mortalidad hospitalaria fue debida a un paciente con sepsis y hemocultivos positivos para Candida albicans y Klebsiella oxytoca. La mortalidad a largo plazo estuvo definida por sepsis en dos pacientes (uno con hemocultivos positivos para Pseudomonas aeruginosa y Haemophillus influenzae y otro por meningococcemia fulminante). La reintervención global fue del 11% (n=10), siendo todos los casos pacientes con CAV completo. Fue necesaria una reintervención hospitalaria en un paciente debido a una IAVI severa. Nueve pacientes (9,90%) requirieron una reintervención a largo plazo, con un intervalo medio desde la primera cirugía de 48,60±34,66 meses. La indicación para reintervención a largo plazo fue IAVI severa en 7 pacientes, realizándose sustitución valvular mitral en 3 pacientes y consiguiéndose reparación efectiva en 4. La indicación para reoperación en los otros 2 casos fue estenosis subaórtica y obstrucción del tracto de salida de ventrículo derecho+CIV residual. Ninguno de los pacientes que requirió una reintervención precoz o a largo plazo falleció durante el seguimiento ni precisó una segunda reintervención. La libertad de reintervención a largo plazo global fue del 89% a 10 años. La libertad de reintervención a largo plazo por tipo de canal fue: completo (86,40%), transicional (88,90%) y parcial (100%) (fig. 1).
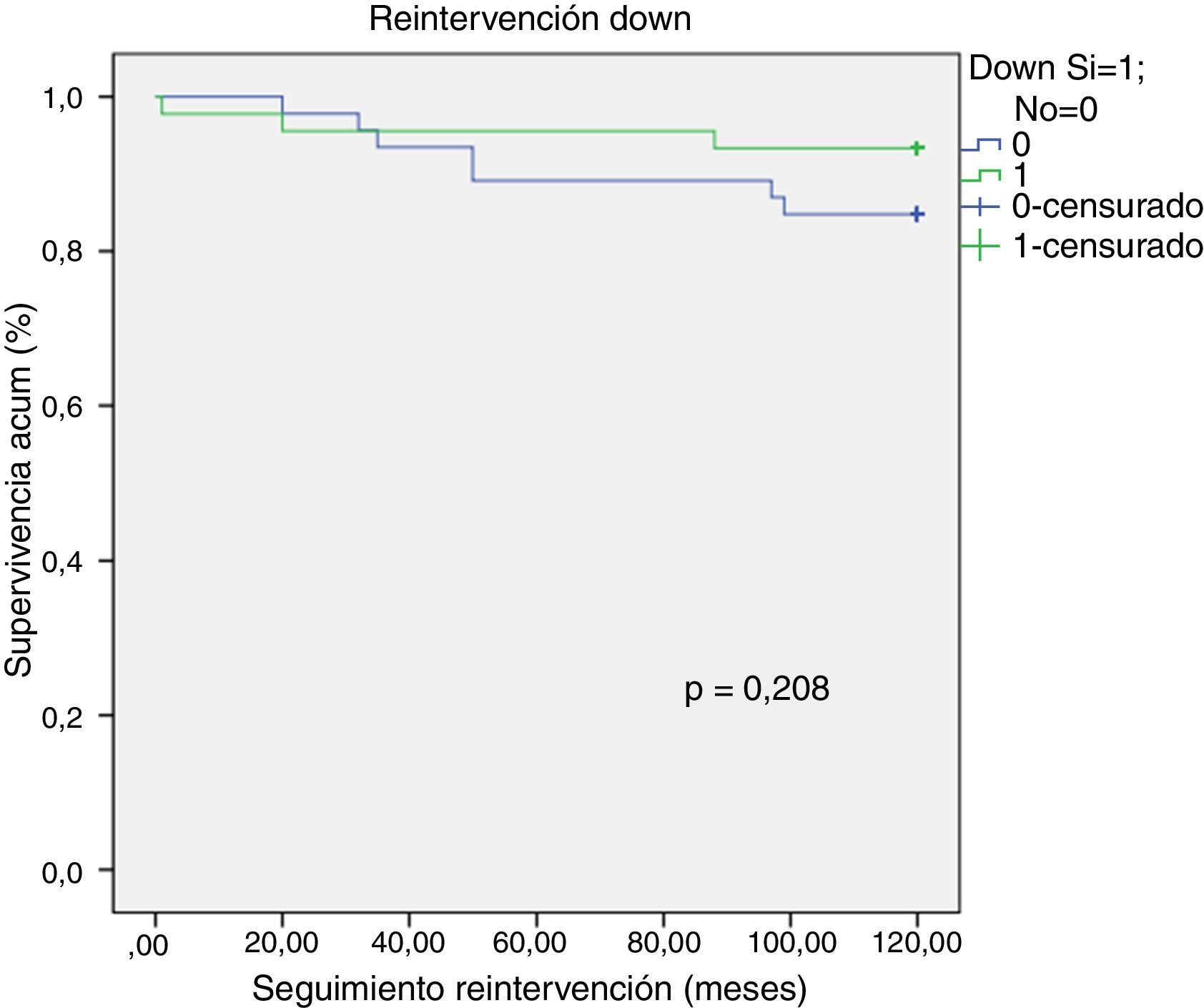
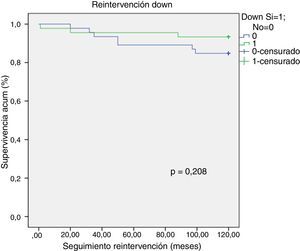
La incidencia de IAVI moderada-severa en el seguimiento fue del 28,60% (n=26), pudiendo actuar el síndrome de Down como factor protector frente a la IAVI moderada-severa (p = 0,029, OR 0,318, IC del 95%, 0, 114-0, 887). Se objetivó una tendencia a la menor necesidad de reintervención en los pacientes Down pero sin llegar a ser estadísticamente significativa (log- rank test, p = 0,208) (fig. 2).
Hubo un 13,20% (n=12) de pacientes que presentaron infección severa (neumonía y/o sepsis) antes del alta hospitalaria en el grupo de canales balanceados. El grupo de canales disbalanceados presentó una incidencia de esta complicación del 36,40% (n=4). La infección severa mantuvo una relación estadísticamente significativa con el tiempo de ventilación mecánica invasiva (p=0,0001, OR 1,020, IC del 95%, 1,010-1,031).
Al realizar el análisis por tipo de CAV, se objetivó que los pacientes con canal completo requerían más fármacos antiinsuficiencia cardíaca preoperatoriamente (p=0,014, OR 7,338, IC del 95%: 1,505-35,771) y tenían tiempos de CEC más prolongados (p=0,0001, OR 1,057, IC del 95%, 1,029-1,086). Frente a esto, los canales parciales podrían actuar de factor protector frente a la necesidad de VMNI (p = 0,050, OR 0,120, IC del 95%, 0,015-, .997) y el uso de fármacos antiinsuficiencia cardíaca preoperatoriamente (p = 0,013, OR 0,219, IC del 95%, 0,066-0,722).
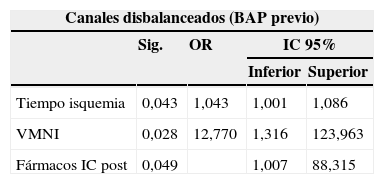
Un total de 10 pacientes con formas disbalanceadas no extremas (0,19 ≤ IVAV ≤ 0,39) se manejaron inicialmente con BAP en los primeros días de vida para realizar la reparación biventricular en un segundo tiempo. La media de tiempo desde el BAP hasta la reparación definitiva fue de 13±12,64 meses. En este subgrupo de pacientes se objetivaron mayores tiempos de isquemia (p=0,043, OR 1,043, IC del 95%, 1,001-1,086); más necesidad de VMNI (p=0,028, OR 12,770, IC del 95%, 1,316-123,963) y mayor uso de fármacos antiinsuficiencia cardíaca postoperatorios (p=0,049, OR 9,430, IC del 95%, 1,007-88,315). Ninguno de los 3 pacientes fallecidos pertenecía a este subgrupo.
La tabla 3 ilustra los factores estadísticamente significativos en el análisis multivariante en cada subgrupo de pacientes.
Análisis multivariante
| Canales disbalanceados (BAP previo) | ||||
|---|---|---|---|---|
| Sig. | OR | IC 95% | ||
| Inferior | Superior | |||
| Tiempo isquemia | 0,043 | 1,043 | 1,001 | 1,086 |
| VMNI | 0,028 | 12,770 | 1,316 | 123,963 |
| Fármacos IC post | 0,049 | 1,007 | 88,315 | |
| Canales completos balanceados | ||||
|---|---|---|---|---|
| Sig. | OR | IC 95% | ||
| Inferior | Superior | |||
| Fármacos IC preop | 0,014 | 7,338 | 1,505 | 35,771 |
| Tiempo CEC | 0,000 | 1,057 | 1,029 | 1,086 |
| Canales parciales (factor protector frente a VMNI y fármacos IC preop) | ||||
|---|---|---|---|---|
| Sig. | OR | IC 95% | ||
| Inferior | Superior | |||
| VMNI | 0,050 | 0,120 | 0,015 | 0,997 |
| Fármacos IC preop | 0,013 | 0,219 | 0,066 | 0,722 |
| Síndrome Down (factor protector frente IAVI moderada-severa) | ||||
|---|---|---|---|---|
| Sig. | OR | IC 95% | ||
| Inferior | Superior | |||
| Down | 0,029 | 0,318 | 0,114 | 0,887 |
| Infección | ||||
|---|---|---|---|---|
| Sig. | EXP (B) | IC del 95% para EXP (B) | ||
| Inferior | Superior | |||
| VM total | 0,000 | 1,020 | 1,010 | 1,031 |
BAP: banding arteria pulmonar; CEC: circulación extracorpórea; Fármacos IC post: fármacos antiinsuficiencia cardíaca congestiva postoperatorio; Fármacos IC preo: fármacos antiinsuficiencia cardíaca congestiva preoperatorio; IAVI: insuficiencia auriculoventricular izquierda; IC 95%: intervalo de confianza de 95%; OR: odds ratio; Sig: significación estadística (p < 0,05); VM total: tiempo total de ventilación mecánica no invasiva; VMNI: ventilación mecánica no invasiva.
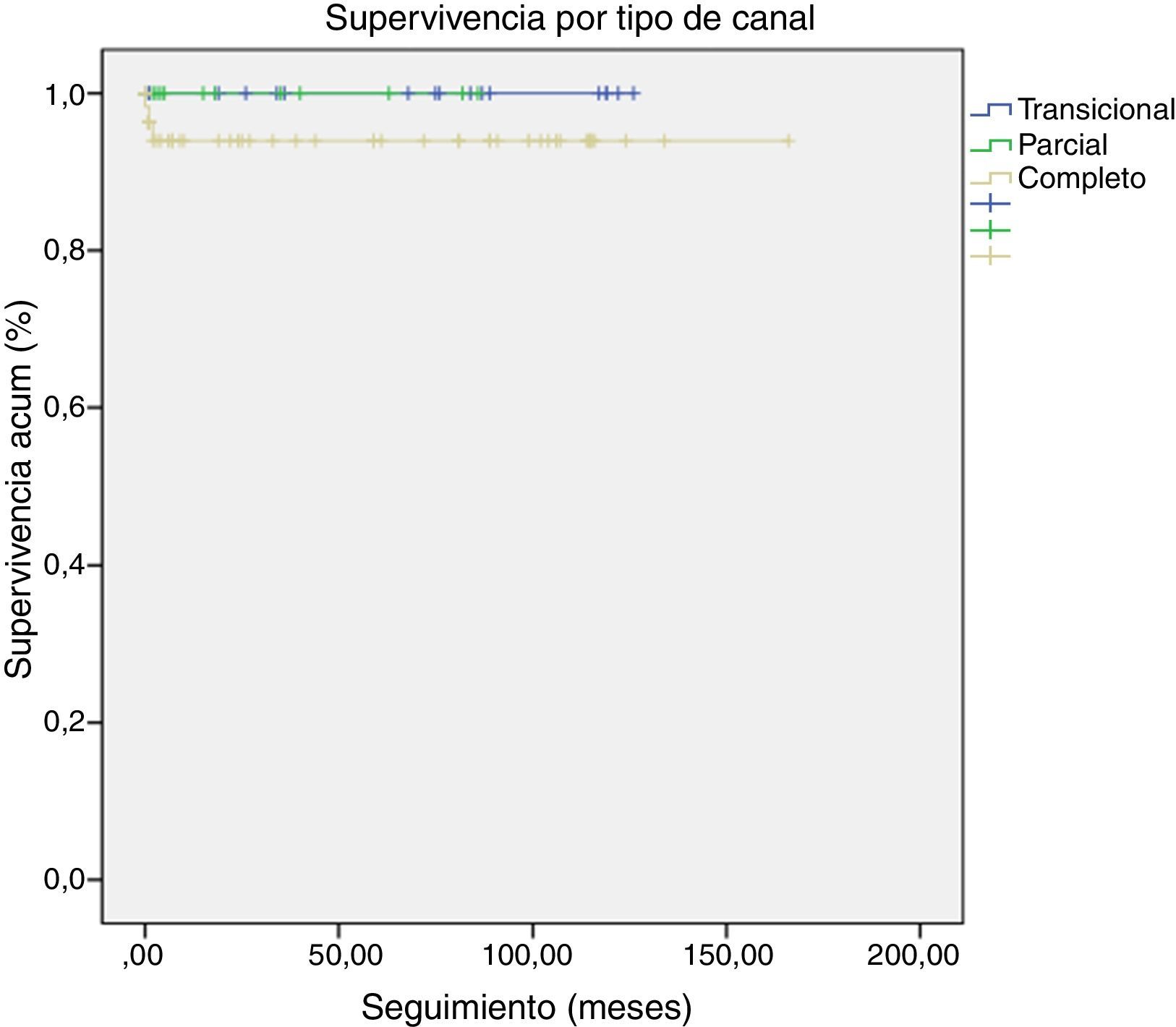
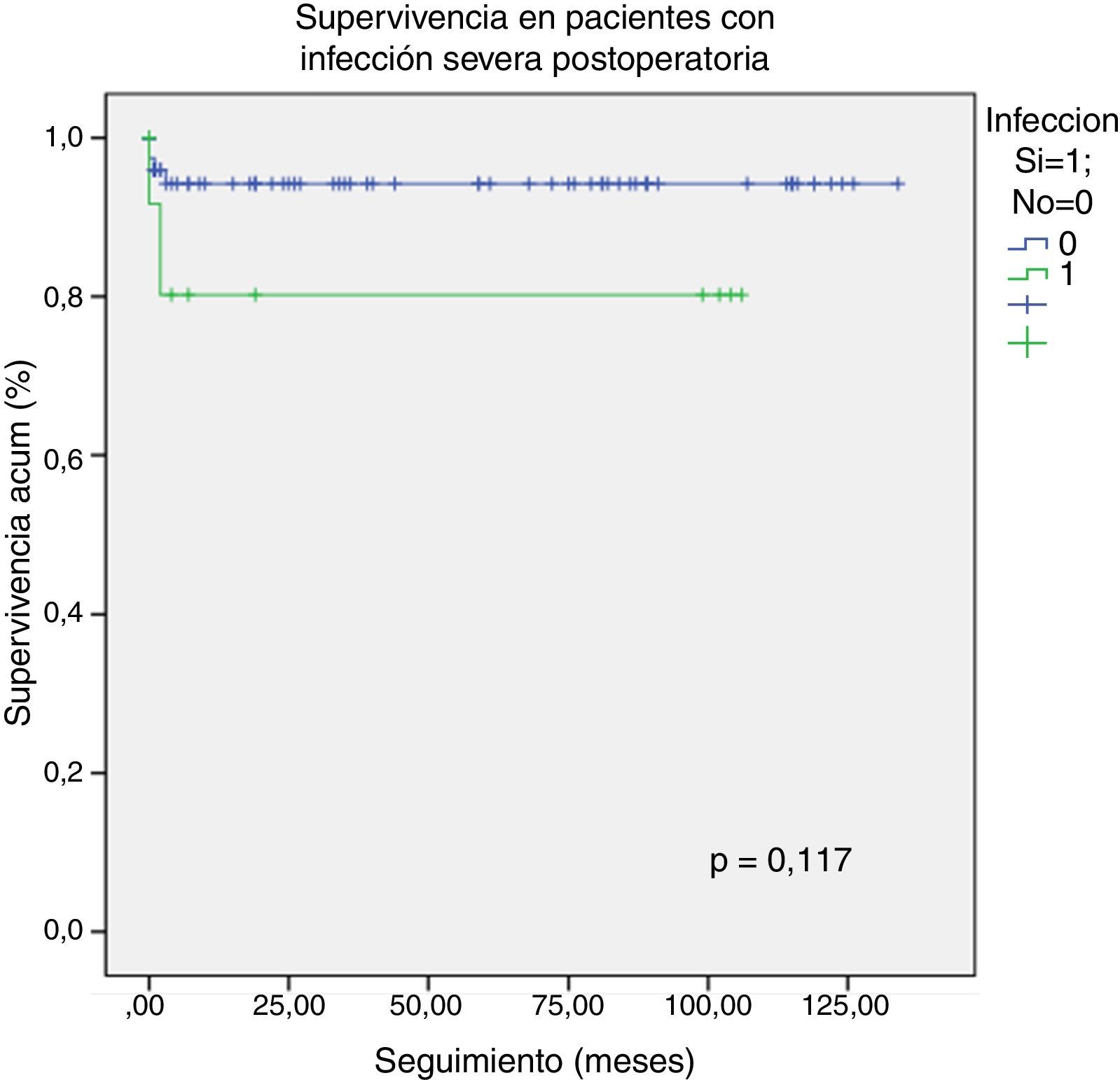
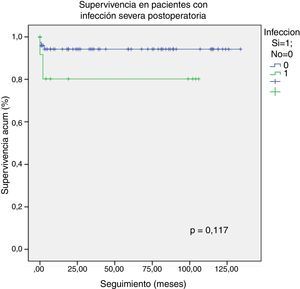
El seguimiento se realizó de forma rutinaria en el departamento de Cardiología Pediátrica de nuestro hospital. La mediana de seguimiento tras el alta hospitalaria fue de 60 meses (rango, 2-166). Hubo una pérdida de 2 pacientes en el seguimiento. La supervivencia global a 10 años fue del 96,70%, sin existir diferencias significativas entre los 3 tipos de CAV: completo (94,90%), parcial (100%) e intermedio (100%) (fig. 3). Los pacientes que presentaron infección severa tenían una menor supervivencia a largo plazo pero sin llegar a ser significativa (83,30%, log-rank test p=0,117) (fig. 4).
DiscusiónEl pronóstico tras la reparación biventricular de los CAV ha aumentado progresivamente gracias a un mejor conocimiento anatómico, técnica quirúrgica, protección miocárdica, cuidados perioperatorios y edad de reparación más precoz6-9. Algunos autores eligen el punto de corte de 3 meses de vida como la edad a partir de la cual las alteraciones en el lecho pulmonar empezarán a ser irreversibles y, por tanto, el momento óptimo para la reparación quirúrgica7,8. En nuestra serie, la mediana de edad de los pacientes con canal completo fue de 6 meses (rango, 1-71), con resultados postoperatorios satisfactorios. Coincidimos con la idea propuesta por Raisky et al.10 en que la calidad de tejido AV sería un factor más limitante en el pronóstico que la edad del paciente y del reto quirúrgico que supone intervenir a estos pacientes por debajo de los 3 meses de vida sin que esto implique claramente una mejoría en el pronóstico a largo plazo y una disminución de la tasa de reintervención.
El uso de técnicas paliativas en la cirugía del CAV no es una práctica recomendada, salvo que existan otras alteraciones asociadas que impliquen que la reparación primaria sea un procedimiento de muy alto riesgo9,10. Las principales indicaciones para el BAP serían ventrículos disbalanceados, ventrículo derecho de doble salida e infección severa11. Jegatheeswaran et al.3 definieron la transición entre ventrículos balanceados y disbalanceados mediante el IAVI (área valvular AV izquierda/área valvular AV derecha, cm2) con una clara indicación de cirugía univentricular en aquellos con un IAVI<0,19 o IAVI ≥ 0,6 (más infrecuente la dominancia izquierda) pero observando una gran heterogeneidad de estrategias quirúrgicas en aquellos con 0,19 ≤ IVAV ≤ 0,39 y un desproporcionado número de fallecimientos en este rango. En nuestra serie, hemos tratado a 10 pacientes con CAV tipo completo y ventrículos disbalanceados no extremos, realizando un BAP en los primeros días de vida y procediendo posteriormente a la reparación biventricular, con una media de tiempo desde el BAP hasta la reparación definitiva de 13±12,64 meses. A pesar de que este subgrupo tuvo una mayor morbilidad (tiempos de isquemia más largos, mayor necesidad de VMNI y de fármacos antiinsuficiencia cardíaca postoperatorios), la supervivencia fue del 100% correspondiendo los tres fallecimientos de nuestra serie a pacientes con CAV completos con ventrículos balanceados. Al igual que otros autores12,13, consideramos que realizar un BAP no es recomendable y que la reparación primaria es la técnica de elección en la cirugía del CAV. Sin embargo, en aquellos pacientes que, por su anatomía ventricular, se dirigirían inicialmente hacia una vía univentricular podría tener cabida como acondicionamiento previo y recuperarlos hacia la reparación biventricular.
La IAVI es la complicación más frecuente en el postoperatorio de los CAV, marcando el pronóstico a largo plazo14,15. Entre un 8 y un 19% de las reintervenciones a largo plazo son debidas a IAVI13. El cierre sistemático de la hendidura mitral no siempre previene la IAVI. Crawford et al.16 recomienda el refuerzo de este cierre mediante parches de teflón o de pericardio autólogo. En nuestra serie, un 28,60% de los pacientes desarrollaron IAVI moderada-severa, siendo la principal causa de reintervención a largo plazo. El síndrome Down podría desempeñar un papel protector frente a la IAVI debido a una mayor displasia tisular, que facilitaría una reparación más exitosa que en pacientes cromosómicamente normales3. En nuestra serie, también identificamos este efecto protector en los pacientes con trisomía 21 y una tendencia a la menor reintervención pero sin llegar a ser significativa.
ConclusionesLa cirugía de los CAV puede llevarse a cabo con óptimos resultados a corto-medio plazo. Los procedimientos paliativos no se recomiendan y únicamente podrían tener cabida en aquellos ventrículos disbalanceados no extremos para redirigirlos hacia la vía biventricular. La reintervención por IAVI sigue marcando el pronóstico a largo plazo siendo necesarias series con mayor número de pacientes y estudios prospectivos para mejorar los resultados de esta complicación.
Nuestro estudio presenta las siguientes limitaciones: es observacional y retrospectivo. El tamaño de muestra pequeño y heterogéneo, a pesar de que se realizaron análisis independientes por subgrupos, puede limitar los resultados a largo plazo. Además, las ecocardiografías postoperatorias no fueron realizadas siempre por el mismo cardiólogo pediátrico.
Rsponsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.