El implante de una prótesis pulmonar para recuperar la funcionalidad de la vía de salida derecha, operación frecuente en congénitos adultos, comienza a hacerse extensiva a la infancia para prevenir la disfunción ventricular.
ObjetivosComparar resultados de la bioprótesis pulmonar porcina en mayores/menores de 18 años, analizando factores de riesgo de mortalidad y disfunción protésica. Efectos de la válvula sobre el grado funcional y la funcionalidad del ventrículo derecho.
MétodosTodos los pacientes a los que se implantó una bioprótesis entre 1999-2015. Análisis estadístico SPSS20.0.
ResultadosCiento dos válvulas en 101 pacientes. Mortalidad hospitalaria 2,9% (3,7% adultos vs. 0% menores, p<0,001). Procedimientos quirúrgicos asociados en el 72,5%. Mortalidad 0% si la bioprótesis era único procedimiento. Factores de riesgo para mortalidad (p<0,05): tiempo de circulación extracorpórea, implante de bioprótesis en adulto.
Seguimiento completo, medio 4±3,7 años (4,4 adultos vs. 2,4 menores, p=0,017). Un fallecido tardío.
Disfunción protésica: 6,1% (1,3% adultos vs. 23,8% menores, p<0,001). Factores de riesgo de disfunción protésica en análisis univariante (p<0,05): conducto/prótesis previo en vía de salida, indicación implante estenosis pulmonar, implante bioprótesis en menores, peso bajo y menor superficie corporal. En multivariante permanecieron indicación implante estenosis y superficie corporal baja.
Tras la cirugía, mejoraron el grado funcional y los volúmenes del ventrículo (p<0,05), no la fracción de eyección.
ConclusionesEl implante de una bioprótesis pulmonar porcina conlleva baja mortalidad y recupera el volumen del ventrículo, pero no su función.
En los menores debería reservarse el procedimiento para cuando la función ventricular esté en riesgo, ya que degeneran más, y más precozmente.
The implant of a pulmonary prosthesis to regain functionality of the right ventricle outflow tract is a routine surgical procedure in adults with congenital heart disease, and is beginning to be extended in childhood to prevent ventricular dysfunction.
ObjectivesTo compare the outcomes of porcine pulmonary bioprosthesis in patients under and over 18 years old, and to analyse the risk factors of mortality and prosthetic valve dysfunction. Effects of the valve on the functional status and functionality of the right ventricle will also be analysed.
MethodsAll patients were implanted with a pulmonary bioprosthesis between 1999 and 2015. Statistical analysis was performed using SPSS20.0.
ResultsA total of 102 valves were implanted in 101 patients. The mean in-hospital mortality was 2.9% (3.7% adults versus 0% children, P<.001). Surgical procedures associated in 72.5%. Mortality was 0% when bioprosthesis is a single procedure. Risk factors for mortality (P<.05): cardiopulmonary by-pass time, bioprosthesis implant in adult group.
Mean follow-up was 4±3.7 years (4.4 adults versus 2.4 minors, P=.017). There was only one late death.
Prosthetic dysfunction was 6.1% (1.3% in adults vs 23.8% in children, P<.001). Risk factors for prosthetic valve dysfunction in the univariate analysis (P<.05) were previous conduit/prosthesis in right ventricle outflow tract, pulmonary stenosis surgical indication, bioprosthesis implant under 18 year-olds, low weight, and low body surface. In the multivariate analysis, stenosis implant indication stenosis and low body surface remained.
After surgery, the functional class and ventricular volumes improved (P<.05), but not the ejection fraction.
ConclusionsThe implant of a porcine pulmonary bioprosthesis leads to low mortality rate and recovery of right ventricle volume, but not its function.
In patients under 18, dysfunction is greater and earlier. Surgery should be reserved when ventricular function is at risk.
La cirugía cardíaca y la hemodinámica intervencionista resuelven las cardiopatías congénitas (CC) que cursan con obstrucción de la vía de salida derecha (situación Fallot, estenosis/atresia pulmonar con septo íntegro) y malformaciones que en su reparación primaria precisan conducto entre el ventrículo derecho (VD) y la arteria pulmonar (cirugía de Rastelli, truncus, cirugía de Ross).
La historia quirúrgica de dichas CC no está exenta de reintervenciones. La mejor estudiada es el Fallot, donde el 90% de niños operados a finales del siglo pasado han alcanzado la vida adulta1.
Estas CC reparadas presentan secuelas inherentes a la técnica utilizada (comisurotomía pulmonar, parche transanular, resección infundibular respetando anillo pulmonar, necesidad de conducto VD-arteria pulmonar) que condicionan estenosis pulmonar (EP), insuficiencia pulmonar (IP) o doble lesión pulmonar (DLP) en el evolutivo.
Existen diferentes opciones para reconstruir la vía de salida derecha disfuncionante: prótesis porcinas2 o de pericardio3, prótesis mecánicas4, conductos valvulados heterólogos5, homoinjertos, neoválvulas de politetrafluoroetileno expandido6…, todas con resultados dispares condicionados probablemente por el grupo de edad en el que se implanten o si el conducto/homoinjerto «respeta» la configuración anatómica del tracto de salida, como ocurre en la cirugía de Ross.
El objeto del presente trabajo es analizar los resultados de la solución elegida por nuestro grupo, las bioprótesis porcinas soportadas, realizando una comparativa entre las implantadas en edad adulta y las implantadas en menores de 18 años ante la tendencia generalizada a adelantar la prótesis pulmonar a edades más precoces, aportando datos para tratar de responder a una controversia actual: ¿cuándo es el momento idóneo para valvular el tracto de salida derecho disfuncionante?
MétodosEstudio retrospectivo de todos los portadores de CC intervenidos por nuestro servicio a los que se implantó una bioprótesis pulmonar porcina soportada entre el 1 de enero de 1999 y el 31 de mayo del 2015.
Se excluyeron las cirugías sin reparación biventricular.
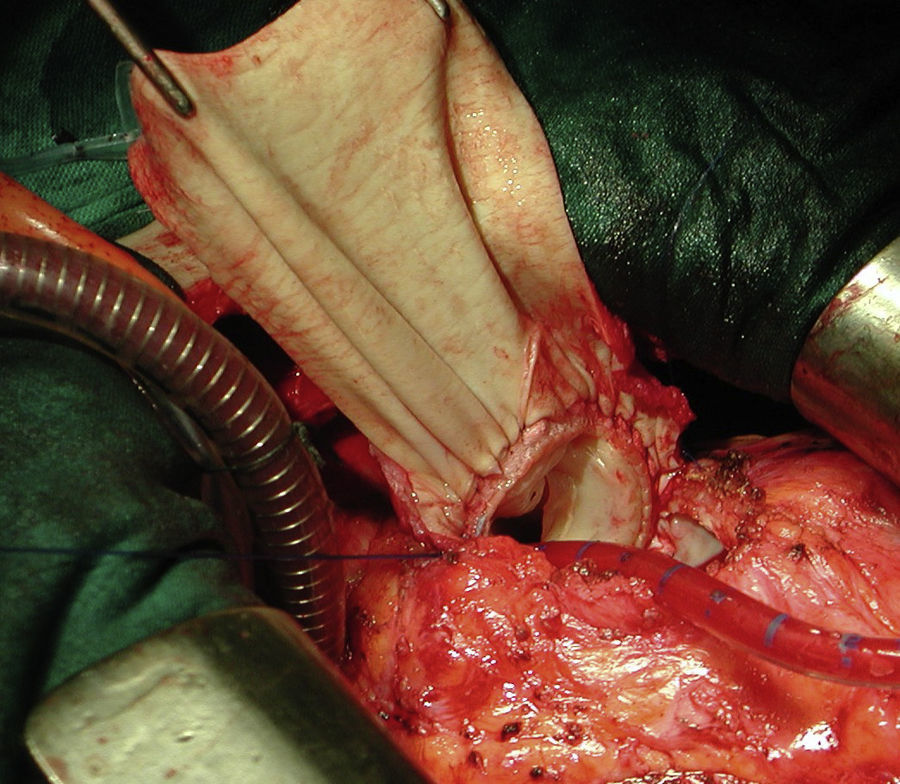
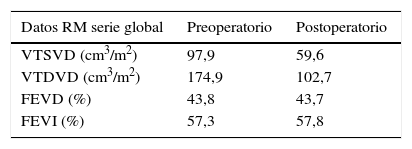
El implante de la bioprótesis se realizó mediante esternotomía media, circulación extracorpórea y, siempre que fue posible, sin isquemia miocárdica, empleando una variante técnica de la «peel operation» descrita por la Clínica Mayo para reintervención de conductos disfuncionantes7, que extendimos a la cirugía transanular, en la que la porción inferior de la prótesis se sutura al lecho abierto del infundíbulo del VD, y la porción superior a un parche de ampliación de yugular bovina (fig. 1).
Fotografía quirúrgica: implante de bioprótesis pulmonar porcina en paciente con cirugía transanular previa sobre Fallot. La porción inferior se ha suturado al suelo del infundíbulo y la superior a un parche de yugular bovina obtenido de un conducto Contegra® (Medtronic), que sirve para techar el infundíbulo del VD.
Se determinaron 31 variables preoperatorias, 22 perioperatorias y 20 postoperatorias.
Se describen los procedimientos quirúrgicos asociados al implante valvular pulmonar.
Mortalidad hospitalaria: la acontecida antes del alta o, si habiéndose producido esta, la ocurrida antes de los primeros 30 días postoperatorios. El resto se consideran fallecimientos en seguimiento.
Análisis de complicaciones acaecidas durante el ingreso hospitalario para el implante de la bioprótesis.
Definición de seguimiento completo: si durante el último año se había citado al paciente, o se le había telefoneado si era revisado fuera de nuestro hospital, o si había fallecido durante el seguimiento.
Se estudia la incidencia de endocarditis protésica.
Criterio de disfunción protésica: necesidad de sustitución de la prótesis mediante nuevo procedimiento quirúrgico/percutáneo, o presencia de un gradiente ecocardiográfico pico superior a 50mmHg, o existencia de insuficiencia protésica pulmonar severa.
Análisis de la recuperación del grado funcional de la New York Heart Association (NYHA) tras el implante valvular y la evolución de los volúmenes y la función del VD de aquellos pacientes de los que se disponía de resonancia magnética pre y postoperatoria.
Análisis estadístico con SPSS20.0 para Windows (SPSS inc. Chicago, Illinois, EE. UU.). Las variables cuantitativas se expresan como media±desviación estándar o como mediana y rango intercuartílico. Las variables cualitativas se expresan en valores absolutos y/o porcentaje en relación con el número total de pacientes o de procedimientos.
Para evaluar diferencias por grupo de edad, en variables cuantitativas se usó la t de Student. Si eran menores de 30 casos, la U de Mann-Whitney. En variables categóricas se usó la chi al cuadrado o la prueba exacta de Fisher.
Análisis estadístico univariante para identificar factores de riesgo de mortalidad hospitalaria y de disfunción protésica. Para variables cuantitativas, U de Mann-Whitney, y para categóricas, prueba exacta de Fisher. Para obtener odds ratio independientes de factores de riesgo de disfunción protésica (variable dependiente) se ajustó un modelo multivariante de regresión logística binaria, incluyendo como variables independientes las que mostraron asociación estadísticamente significativa (p<0,05) en análisis univariante.
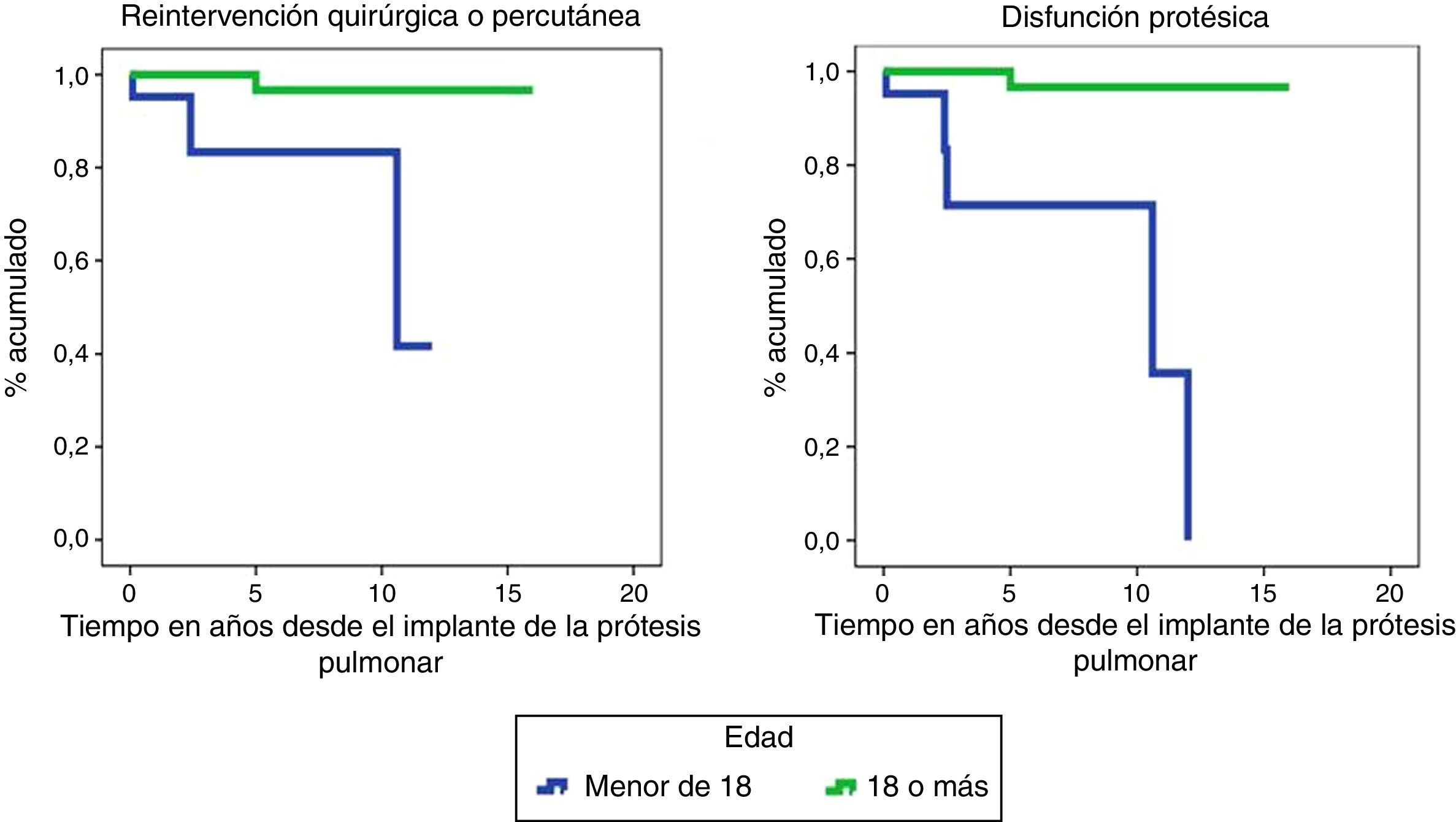
Curvas de supervivencia de ocurrencia de evento quirúrgico/percutáneo sobre la bioprótesis y de disfunción protésica. Prueba de Log-Rank para evaluar si existían diferencias entre mayores y menores de edad.
Comparación del grado funcional preoperatorio de los enfermos con el grado funcional postoperatorio y de las fracciones de eyección medias preoperatorias con las postoperatorias, cuantificadas mediante resonancia, utilizando la prueba de Mc Nemar para muestras relacionadas.
Comparación de volúmenes telesistólico y telediastólico medios del VD, cuantificados mediante resonancia magnética, utilizando la t de Student para muestras relacionadas.
ResultadosSe implantaron 102 bioprótesis pulmonares porcinas soportadas en 101 pacientes, 81 en adultos y 21 en menores.
Modelos de prótesis implantados: 22 Biocor® (St Jude) y 80 Mosaic® (Medtronic), sin diferencias estadísticamente significativas por ser mayor o menor de 18 años, ni en cuanto a disfunción protésica por emplear una u otra válvula.
Varones 57(55,9%). Diagnóstico de CC inicial más frecuente: situación Fallot, en 73,5% de los casos, sin diferencias entre mayores/menores de edad. El resto de los diagnósticos fueron: EP (9,8%), atresia pulmonar con comunicación interventricular (8,8%), atresia pulmonar con septo interventricular íntegro (2,9%), transposición de grandes arterias reparada mediante Rastelli (2,9%), truncus (1%) y secuelas derechas del procedimiento de Ross (1%).
La mediana de cirugías previas antes del implante de la bioprótesis fue 2 (rango 0-6). Solo 3 adultos no tenían cirugía previa. Sin diferencias entre las 2 poblaciones. La última actuación sobre la vía de salida derecha antes de la bioprótesis se realizó a edad más tardía en los adultos (p < 0,001).
Tipo de cirugía previa más frecuentemente realizada antes del implante de la bioprótesis: ampliación transanular (65,7%), sin diferencias entre adultos y menores.
Indicación quirúrgica más frecuente del implante valvular: IP, en 67 (65,7%), seguida de DLP, 27 (26,5%). La EP aislada fue infrecuente, 8 (7,8%). Se encontró diferencia por edad (p=0,036). Los menores, con mayor porcentaje de conductos VD-arteria pulmonar, tuvieron más indicación por EP o DLP que por IP aislada.
Otras variables preoperatorias con diferencias significativas entre ambas poblaciones: anchura del QRS (p=0,007), mayor en adultos; grado funcional NYHA (p=0,005), más avanzado en adultos.
Edad media del implante valvular: 31±13,5 años (rango 1-61). En adultos es 36 vs. 12 años en menores. Peso 60±19 kg (rango 9-115). Talla 161±17cm (rango 74-186). Superficie corporal 1,6±0,3 m2 (rango 0,4-2,2).
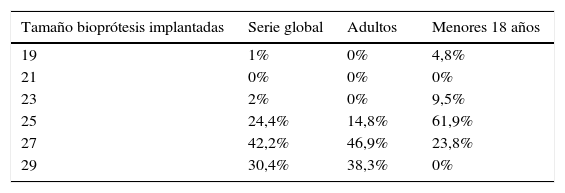
Los tamaños de las válvulas empleadas no mostraron diferencias por grupo de edad (tabla 1).
Se realizó algún otro procedimiento quirúrgico, además del implante pulmonar en 74 (72,5%) casos (tabla 2). Fueron más numerosos en adultos (p=0,02).
Procedimientos quirúrgicos asociados al implante de la bioprótesis pulmonara
| Procedimiento | n |
|---|---|
| Cierre cortocircuito residual | 36 |
| Plastia válvula tricúspide | 27 |
| Implante prótesis tricúspide | 6 |
| Implante prótesis aórtica | 12 |
| Plastia arterias pulmonares principales | 7 |
| Cirugía de arritmias | 4 |
| Recambio aorta ascendente | 3 |
| Resección membrana subaórtica | 2 |
| Implante prótesis mitral | 2 |
| Explante stent dislocado | 2 |
| Reparación drenaje venoso pulmonar anómalo parcial | 2 |
| Explante bioprótesis disfuncionante | 1 |
| By-pass mamario-coronario | 1 |
| Reparación perforación seno de Valsalva a VD | 1 |
| Implante marcapasos | 1 |
La mortalidad hospitalaria global ha sido del 2,9%. La diferencia entre adultos y menores resultó significativa (p<0,001). Fallecieron solo 3 adultos (3,7%).
En los 28 casos de implante pulmonar aislado no hubo mortalidad. Tampoco en las 48 cirugías de bioprótesis y otro/s procedimiento/s derecho/s que se operaron sin isquemia miocárdica.
Otras variables perioperatorias con diferencias significativas: necesidad de acceso periférico para circulación extracorpórea (p<0,001), implante asociado de prótesis aórtica (p<0,001), cierre de cortocircuito residual asociado (p=0,024), tiempo de circulación extracorpórea (p=0,010), necesidad de pinzado aórtico (p=0,043) y tiempo mediano de intubación (p<0,001), todas mayores en adultos.
Análisis de 32 posibles factores de riesgo de mortalidad hospitalaria. En el análisis univariante, solo relación con tiempo de extracorpórea (p=0,036) y con el hecho de que la válvula se implantase en mayores de edad (p<0,001).
Complicaciones perioperatorias en el 32%, sin diferencias por edad. Lo más frecuente, una arritmia supraventricular paroxística/definitiva. El resto de ellas se recogen en la tabla 3.
Complicaciones durante el implante de la prótesis pulmonara
| Tipo de complicación | n |
|---|---|
| Reintervención mayor durante el ingreso por lesión residual | 1 |
| Arritmia paroxística/definitiva supraventricular | 6 |
| Infección hospitalariab | 5 |
| Neumotórax | 3 |
| Traqueostomía | 4 |
| Reintervención por sangrado | 5 |
| Accidente cerebrovascular con/sin secuelas | 3 |
| Linfedema inguinal | 2 |
| Bajo gasto perioperatorio | 3 |
| Infarto cardíaco agudo perioperatorio | 2 |
| Insuficiencia renal transitoria con necesidad de hemodiafiltración | 3 |
| Insuficiencia hepática | 1 |
| Pericarditis | 1 |
| ECMO | 1 |
Seguimiento completo en el 99% (98,7% en adultos, 100% en menores). Seguimiento medio: 4±3,7 años (rango 0,1-16). Las diferencias entre adultos (4,4) y menores (2,4) fueron significativas (p=0,017).
Solo se ha producido un fallecimiento tardío entre los 99 supervivientes al implante. Era un adulto, portador también de prótesis mecánicas aórtica y mitral, al que se trataba médicamente una endocarditis protésica pulmonar. Falleció por hemorragia cerebral.
Disfunción protésica se ha producido en 6 (6,1%) de los 99 supervivientes (tabla 4). Predomina en menores (p=0,001). Son 4 pacientes los que han necesitado reintervención quirúrgica/percutánea sobre la bioprótesis, además de otros 2 que presentan gradiente ecocardiográfico superior a 50mmHg en el último control. Ninguno tiene insuficiencia intra/periprotésica pulmonar severa.
Pacientes con disfunción protésica. Modelo de prótesis, momento y motivo de la disfunción
| Fallot.<18 años. Mosaic®. 2.° año. Endocarditis protésica bacteriana | Reintervención quirúrgica |
|---|---|
| TGACIVEP.<18 años. Biocor®. Un mes. Endocarditis protésica fúngica. | Reintervención quirúrgica |
| APCIV.<18 años. Biocor®. 10.° año. DLP intraprotésica | Reintervención percutánea |
| EP.>18 años. Mosaic®. 5.° año. IP intraprotésica | Reintervención percutánea |
| Fallot.<18 años. Biocor®. 12.° año | Gradiente 53mmHg |
| Fallot.<18 años. Mosaic®. 2.° año | Gradiente 55mmHg |
APCIV: atresia pulmonar con comunicación interventricular; DLP: doble lesión pulmonar; EP: estenosis pulmonar; IP: insuficiencia pulmonar; TGACIVEP: transposición grandes arterias con comunicación interventricular y estenosis pulmonar.
Endocarditis protésica se registró en 5 (5,1%) de los 99 supervivientes, 3 en adultos y 2 en menores. Fueron un episodio de endocarditis protésica precoz (Aspergillus) y 4 episodios de endocarditis protésica tardía (una Candida, 3 bacterianos). Dos casos precisaron recambio quirúrgico de la prótesis.
Otras variables en seguimiento con diferencias significativas: necesidad de tratamiento médico postoperatorio (p=0,042) y volúmenes postoperatorios telesistólico y telediastólico del VD (p<0,001), mayores en adultos. La necesidad de reintervención quirúrgica/percutánea sobre la bioprótesis pulmonar (p=0,029) fue mayor en menores.
Análisis univariante de 22 posibles factores de riesgo de disfunción protésica, encontrándose asociación significativa (p<0,05) en 5: si en el tipo de cirugía previa sobre el tracto de salida derecho había algún tipo de prótesis previa con respecto a las que no lo tenían; indicación de implante de bioprótesis EP respecto a IP; implante realizado en menores de edad; peso bajo, y superficie corporal baja.
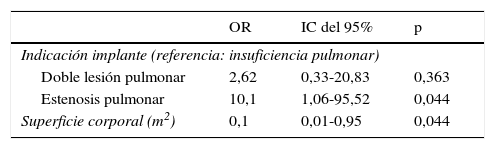
La escasa disfunción protésica hizo difícil ajustar modelos multivariantes. En uno cuyas variables independientes fueron la indicación de implante de prótesis (EP, DLP, IP) y la superficie corporal se mantuvieron los efectos hallados en el univariante (tabla 5).
Modelo multivariante para la asociación de la disfunción protésica con factores de riesgo quirúrgicos
| OR | IC del 95% | p | |
|---|---|---|---|
| Indicación implante (referencia: insuficiencia pulmonar) | |||
| Doble lesión pulmonar | 2,62 | 0,33-20,83 | 0,363 |
| Estenosis pulmonar | 10,1 | 1,06-95,52 | 0,044 |
| Superficie corporal (m2) | 0,1 | 0,01-0,95 | 0,044 |
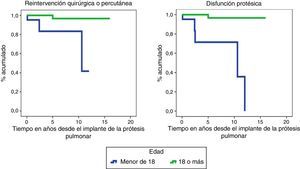
Las funciones de supervivencia de necesidad de reintervención quirúrgica/percutánea (p=0,002) y de disfunción protésica (p<0,001), corroboran el mejor funcionamiento de la válvula en los adultos a lo largo del tiempo (fig. 2).
El grado funcional mejora. Se pasa del 8,1% de pacientes con grado funcional i preoperatorio hasta el 64,1% tras la intervención (p<0,001), sin diferencias por grupo etario.
Los volúmenes telesistólico y telediastólico medios del VD postoperatorios se redujeron con respecto a los preoperatorios (p<0,001 para ambos) tras el implante valvular, siendo también significativas las diferencias (p<0,001) por grupos de edad (mayor reducción volumétrica en menores).
No mejoró la fracción de eyección del VD tras la intervención.
Los datos de resonancia se recogen en la tabla 6.
| Datos RM serie global | Preoperatorio | Postoperatorio |
|---|---|---|
| VTSVD (cm3/m2) | 97,9 | 59,6 |
| VTDVD (cm3/m2) | 174,9 | 102,7 |
| FEVD (%) | 43,8 | 43,7 |
| FEVI (%) | 57,3 | 57,8 |
| Datos RM 15 pacientes IP exclusiva | Preoperatorio | Postoperatorio | Valor p |
|---|---|---|---|
| VTSVD (cm3/m2) | 124,8±41,1 | 62±33,3 | < 0,001 |
| VTDVD (cm3/m2) | 214,1±56,6 | 108,3±45,7 | < 0,001 |
| FEVD (%) | 42,5±9,8 | 44,4±11,6 | 0,51 |
| FEVI (%) | 60±7,3 | 58,7±8 | 0,52 |
FEVD: fracción de eyección del ventrículo derecho; FEVI: fracción de eyección del ventrículo izquierdo; VTDVD: volumen telediastólico del ventrículo derecho; VTSVD: volumen telesistólico del ventrículo derecho.
Son 2 las principales controversias relacionadas con la recuperación de la función valvular pulmonar en CC: el momento de llevarla a cabo y el material protésico a emplear. En cuanto a la primera, parece demostrado que a mayor precocidad, menor dilatación y disfunción del VD, pero también menor durabilidad de la prótesis implantada y mayor posibilidad de reintervenciones, siendo el número creciente de las mismas un factor de riego para mortalidad en cirugía de congénitas8.
Las ventajas y los inconvenientes de las distintas prótesis disponibles no son objeto del presente trabajo. A modo de resumen, citaremos que las neoválvulas de politetrafluoroetileno son defendidas por pocos grupos9, que el empleo de las prótesis mecánicas experimenta un reciente repunte, al menos en pacientes seleccionados10, y que respecto a las distintas prótesis biológicas la opción elegida por nuestro grupo encaja con la conclusión que Abbas y Hoschtitzky formulan en su revisión de la literatura: en estudios con seguimientos medios que apenas alcanzan 5 años, las prótesis porcinas parecen funcionar mejor que las de pericardio, pero está por demostrar que estos resultados perduren en seguimientos más prolongados11. En cuanto a la prótesis percutánea Melody® (Medtronic), solo la consideramos alternativa válida respetando su indicación original para implantes dentro de conductos disfuncionantes y en pacientes de riesgo quirúrgico elevado por comorbilidad. En estudios con seguimientos medios similares a los de las prótesis quirúrgicas12, la reintervención quirúrgica/percutánea es del 30%, criterio menos exigente que el de disfunción protésica, que incluye los reintervenidos y los aún no reoperados pero con la Melody® disfuncionante. Además, no permite tratar lesiones asociadas, situación concurrente en 3 de cada 4 pacientes nuestros, y no es necesariamente más barato, como demuestra el estudio multicéntrico de O’Byrne et al.13.
Cuando se implanta una prótesis pulmonar para recuperar la función valvular, los objetivos son mejorar la calidad de vida de los pacientes y, si es posible, su supervivencia. Si como, ocurre en la mayoría de los casos, se opta por un material biológico, es importante definir en qué momento de la historia quirúrgica la relación riesgo-beneficio del implante se inclina hacia este último, y aquí es donde nuestro trabajo puede contribuir a clarificar la toma de decisiones.
Ciertamente, existen diferencias estadísticamente significativas (obviamente además de en la edad) entre las variables preoperatorias de las poblaciones de adultos y de menores de 18 años, pero respecto al análisis de la disfunción protésica, la única de las estudiadas que en algunos trabajos muestra asociación es la indicación quirúrgica del implante protésico (EP, Zubairi et al.14). Este hecho puede suponer una limitación de nuestro trabajo. El resto de las variables preoperatorias con diferencias pueden influir en otros aspectos, pero no en cuanto a disfunción protésica. Con la prudencia impuesta por las diferencias en la indicación (p=0,036), más EP en los menores, consideramos las poblaciones comparables en cuanto al objetivo de disfunción protésica.
El grado funcional NYHA mejora en todos los estudios, desde los iniciales15 hasta los recientes, como el metaanálisis de Ferraz Cavalcanti et al.16. Nuestros resultados son concordantes, sin diferencias entre adultos y menores. Ahora bien, empleando criterios más objetivos, como el test de consumo de oxígeno, Rotes et al.17, con datos de la Clínica Mayo, se demuestra que solo se produce una pequeña mejoría en el consumo pico de oxígeno tras valvular el tracto de salida del VD. Por contra, en el posterior metaanálisis de la literatura, no se demuestran diferencias en la capacidad funcional antes y después de la prótesis.
En cuanto a la supervivencia, es exigible una mortalidad hospitalaria muy baja. Lo publicado oscila entre el 03 y el 4,8%5, dependiendo fundamentalmente de la edad media de la serie y del número de procedimientos quirúrgicos asociados al implante protésico pulmonar. Nosotros hemos encontrado diferencias al comparar ambas poblaciones (solo fallecen adultos). El resultado es concordante con la serie de reintervenidos de Fallot de la Clínica Mayo18, donde también el implantar la válvula en adultos fue factor de riesgo de mortalidad hospitalaria. Nuestra serie es compleja, con edad media de implante muy avanzada y elevado número de cirugía asociada. La principal evolución técnica ha sido la drástica reducción de acceso periférico para extracorpórea en los últimos años (el 74% hasta 2009, el 29% después al aumentar la experiencia).
Durante el seguimiento, la muerte súbita por arritmia es la forma más frecuente de fallecimiento, al menos en el Fallot. Nollert et al.19 determinan que tras los primeros 25 años posreparación la mortalidad es del 0,24% anual, pero alrededor de la tercera década se eleva al 0,94%. Serán necesarios estudios prospectivos con importante casuística y análisis multivariante para demostrar que la supervivencia mejore. Y si es así, qué parte se debe a la prevención que puedan realizar los desfibriladores, o qué parte a que la mejora funcional del VD al valvularlo disminuya las muertes debidas a insuficiencia cardíaca y quizás la probabilidad de desarrollo de arritmias y su mortalidad inherente… En cualquier caso, la supervivencia de nuestra serie es excelente, con solo un adulto fallecido en seguimiento, sin diferencias entre las poblaciones infantil y de mayores de edad.
Numerosos trabajos recogen puntos de corte en cuanto a volúmenes del VD, superados los cuales no se regresa a las medidas que Holmes20 propone como normales (47ml/m2 para el telesistólico y 108ml/m2 para el telediastólico). En nuestra serie, los volúmenes telesistólico y telediastólico del VD se recuperaron: hasta con telediastólicos de 214ml/m2 (15 pacientes seleccionados «única lesión preoperatoria IP») el VD regresó al límite alto de la normalidad. En cuanto a los telesistólicos, el corte se encuentra en algún lugar del intervalo entre los 98ml/m2 de la cohorte global, donde el VD no regresa a la normalidad, y los 86ml/m2 de la cohorte de menores, donde sí lo hace.
En la mayoría de los trabajos, la fracción de eyección del VD no se recupera si estaba previamente deteriorada. En nuestra serie tampoco lo hace. Ferraz Cavalcanti et al.16 han sugerido la importancia de definir la verdadera fracción de eyección del VD ajustándola a la presencia de la sobrecarga volumétrica debida a la posible presencia de cortocircuitos residuales, insuficiencia tricúspide asociada y a la propia IP, que aumentan el gasto cardíaco para tratar de mantener un flujo pulmonar adecuado y que magnificarían la fracción de eyección preoperatoria. Según dicho estudio, si no se tienen esos ajustes en cuenta, la función ventricular tras implantar la prótesis apenas mejora, pero porque en realidad se había supravalorado la preoperatoria.
Nuestro grupo no dispone de tecnología ni de formación para realizar los cálculos para obtener la fracción de eyección de VD preoperatoria ajustada. A pesar de ello, se seleccionó a un grupo de 15 enfermos con resonancia pre y postimplante de la bioprótesis, excluyendo los que tenían insuficiencia tricúspide preoperatoria mayor que leve y/o cortocircuitos residuales, en un intento de que fuesen pacientes con única lesión residual IP. A pesar de encontrarse en este grupo una ligera mejoría en la función, tampoco resultó significativa.
La disfunción protésica puede hacer fracasar los posibles efectos beneficiosos de valvular a estos pacientes, años después de realizada la intervención, como sugieren Hallbergson et al.21.
Los criterios de disfunción protésica varían en la literatura. Hemos adoptado los descritos en la metodología, que son los más repetidos en diferentes trabajos, pero esto puede suponer otra limitación de nuestro estudio. Aplicándolos a nuestra población, los resultados son consistentes: las bioprótesis porcinas disfuncionan más y antes en menores de 18 años, manteniéndose las diferencias en el modelo multivariante.
Entonces, si la mejoría tras valvular el tracto de salida es objetivamente cuestionable, no está demostrado que mejore la supervivencia y existe evidencia de que cuanto menor es el paciente en el que se implanta la bioprótesis, menor es su durabilidad (Rotes et al.18, Batlivala et al.22 y Oliver et al.23, menor edad a la hora del implante es factor de riesgo de disfunción protésica en análisis uni y multivariante), parece juicioso reservar la indicación en menores para cuando exista deterioro objetivo de la capacidad funcional del enfermo, insuficiencia tricúspide progresiva asociada a la IP, los volúmenes telediastólicos del VD sean todavía inferiores a 214ml/m2 o cuando la función del VD en estudios seriados de resonancia magnética baje del 45-50%.
ConclusionesLa bioprótesis porcina soportada soluciona, al menos a medio plazo, la disfunción del tracto de salida del VD por secuela de una CC reparada previamente. La mortalidad hospitalaria es mayor cuando se implanta en adultos y es del 0% en ambas poblaciones cuando se realiza sin isquemia miocárdica, asociada o no a algún otro procedimiento sobre el corazón derecho, la protagonizan cirujanos con experiencia en CC y se utiliza la variante técnica de la «peel operation».
La bioprótesis consigue que el VD regrese a tamaño normal, aun partiendo de severos grados de dilatación en prácticamente todos los enfermos. La función del VD experimenta leve mejoría sin alcanzar significación, aunque probablemente se había sobreestimado la preoperatoria.
El grado funcional NYHA de adultos y niños mejora tras el implante valvular.
Recomendamos prudencia a la hora de implantar bioprótesis pulmonares porcinas en edad pediátrica. Su durabilidad es menor que en adultos. Nuestro criterio: indicarlas cuando exista deterioro funcional objetivo, insuficiencia tricúspide progresiva asociada a la IP, no superar volúmenes telediastólicos del VD de 214ml/m2 ni telesistólicos de 86ml/m2, o cuando su fracción de eyección esté en el límite bajo de la normalidad.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.