La miocardiopatía dilatada (MCD) se caracteriza por la dilatación ventricular y la reducción del grosor miocárdico. Es una patología multifactorial con varios mecanismos biológicos que pueden explicar su fisiopatología. Entre estos mecanismos, es relevante el componente inmunitario humoral y celular con una serie de autoanticuerpos (AA) descritos, principalmente los anti-β1 adrenérgicos y los anti-m2 de la acetilcolina. Estos anticuerpos reconocen a un grupo de proteínas presentes en el tejido cardíaco, y desempeñan un papel esencial en la patogénesis de la miocardiopatía, contribuyendo a la disfunción ventricular. La eliminación de estos anticuerpos mediante la inmunoadsorción (IA) implica un beneficio hemodinámico en estos pacientes. Las experiencias piloto más recientes han demostrado que la eliminación de los anticuerpos circulantes mediante la IA mejora la función cardíaca de los pacientes con MCD y reduce la inflamación. Estos anticuerpos son mayoritariamente inmunoglobulinas G de clase 3 (IgG3). La IA mediada por los adsorbentes anti-Ig es eficaz para la eliminación, entre otras, de la IgG3, y es un método seguro y generalmente bien tolerado por los pacientes con MCD.
Dilated cardiomyopathy is characterized by ventricular dilatation and progressive depression of myocardial contractile function. It is a multifactorial disease, on which several mechanisms may contribute to the pathophysiology of this process. Disturbances in both humoral and cellular immunity have been described among these patients. A number of antibodies against various cardiac cell proteins, mainly anti-β1-adrenergic and anti-m2 against acetylcholine, have been identified. Recent data indicate that these cardiac antibodies play an active role in the pathogenesis and may contribute to ventricular dysfunction of these patients. Therefore, removal of cardiac autoantibodies by immunoadsorption may induce hemodynamic improvement in dilated cardiomyopathy patients. Recent open pilot trials have consequently shown that removal of circulating antibodies by immunoadsorption induces improvement of cardiac function and decreases myocardial inflammation. These autoantibodies mainly belong to immunoglobulin G subclass 3 (IgG3). The performance achieved by the use of anti-Ig immunoadsorbents is efficacious enough to remove IgG3 and the rest of the immunoglobulin subtypes. IA is a safe and well tolerated therapeutic option for dilated cardiomyopathy patients.
La MCD es un síndrome clínico caracterizado por la dilatación progresiva ventricular y la alteración de la función miocárdica que exhibe atrofia e hipertrofia1. Según la Organización Mundial de la Salud (OMS), se incluye el requerimiento de ser de etiología desconocida2. Sin embargo, son frecuentes los cuadros de etiología diversa, pero conocida y con una evolución fisiopatológica muy similar, que se manifiestan por una insuficiencia cardíaca crónica con fases de reagudización. Así, el término MCD debería excluir el compromiso miocárdico difuso secundario a isquemia o a la fase final de una sobrecarga crónica, como es la hipertensión arterial o la estenosis aórtica.
El diagnóstico de MCD idiopática (MCDi) o primaria se reserva a los casos de etiología no identificable3. A este grupo pertenecen más de dos tercios de los pacientes, mientras que en el otro grupo, denominado enfermedad específica del músculo cardíaco, se incluyen los casos de MCD secundarios a causas no cardiovasculares: miocardiopatía viral, chagásica, genética, tóxica, familiar, inflamatoria, alcohólica, hipertensiva e isquémica3.
La incidencia de nuevos casos de MCD en Europa es de 7/100.000, aunque esta ratio no es más que una estimación, con la evidencia de un periodo asintomático cada vez mayor4,5. Del 20-45% de los nuevos casos se recuperan con tratamiento médico, aunque el pronóstico es sombrío, con una mortalidad a los 5 años del 20%6. El trasplante cardíaco es la mejor opción terapéutica para los pacientes con insuficiencia cardíaca grado D7,8. El limitado número de donantes, la presencia de comorbilidades o la edad avanzada hacen que tan sólo un pequeño porcentaje de pacientes se beneficie del trasplante cardíaco. La dimensión sociosanitaria de este problema clínico ha estimulado una profunda reflexión para conocer la fisiopatología de la MCD, a la vez que ha generado la inversión de numerosos recursos económicos destinados a la investigación e implementación de nuevas terapias para el manejo del paciente con MCD.
Hay un grupo de enfermedades cardiológicas como las miocarditis y la MCD que, sin estar catalogadas como enfermedades autoinmunes, tienen respuestas inmunopatológicas claras. En la MCD hay una batería de anticuerpos frente a antígenos cardíacos que, como agentes patógenos, o como epifenómenos secundarios a la agresión cardíaca, están implicados en la evolución de la enfermedad. La presencia de estos anticuerpos en las muestras biológicas de los pacientes es un marcador diagnóstico de la MCD. La eliminación de estos anticuerpos del plasma circulante, mediante técnicas de aféresis o depuración extracorpórea, como es el caso de la IA, contribuye positivamente en la mejoría clínica y hemodinámica de estos pacientes.
Fisiopatología de la miocardiopatía dilatada: bases celulares y humoralesLas alternativas al tratamiento convencional de la MCD se han diseñado de acuerdo con las hipótesis que relacionan la etiología y la evolución fisiopatológica: reacción autoinmunitaria - hiperactividad del sistema nervioso simpático (SNS), y disfunción sistólica - remodelado del ventrículo izquierdo9. La MCD se asocia a la activación neurohormonal –SNS y sistema renina/angiotensina–, que es mayor en las fases avanzadas. Ambos sistemas se relacionan entre sí: la liberación de la renina por el riñón está mediada por los receptores β-adrenérgicos, mientras que la angiotensina II estimula la liberación de norepinefrina presináptica10. Todo ello contribuye a la consecución de cuatro mecanismos de adaptación que se dirigen a mejorar el rendimiento cardíaco: aumento de la frecuencia y de la contractilidad (activación del SNS), de la precarga (aumento de la volemia y de la resistencia periférica) y de los elementos contráctiles.
La etiología viral y la autoinmunidad representan otra vía alternativa para explicar la patogénesis de la enfermedad: la infección viral provoca la lesión miocárdica; se activa la respuesta autoinmune con un daño progresivo miocárdico, dilatación ventricular, y, final-mente, se desarrolla la insuficiencia cardíaca11. La hipótesis de que un enterovirus sea la causa inicial de la enfermedad ha sido demostrada por la presencia del ARN viral, detectado en biopsias endocárdicas de pacientes con MCD, asociándose la persistencia del virus con progresión de la disfunción cardíaca12–14.
Hay un subgrupo de pacientes con alteraciones en la inmunidad celular y humoral. La insuficiencia cardíaca crónica se asocia con la activación celular crónica. En las biopsias endocárdicas se observa infiltración de linfocitos activados, o de células mononucleares, junto con una expresión excesiva de las moléculas de adhesión circulantes, o la hiperactividad de los antígenos humanos leucocitarios (HLA) de las células intersticiales o del endotelio vascular15–17. También la liberación de citocinas proinflamatorias (interleucina 1β [IL-1β], interleucina 6 [IL-6], factor de necrosis tumoral α [TNF-β]) son indicadores de mal pronóstico y ayudan a modular la disfunción miocárdica a través de la inducción in vitro de un efecto inotrópico negativo sobre los miocitos aislados18, o la regulación de la apoptosis19. Estos hallazgos apoyan que el término «cardiomiopatía inflamatoria» es válido para definir la patogénesis de la MCD.
En pacientes con miocarditis o con MCD, se ha demostrado un daño humoral mediado por la presencia de los AA dirigidos frente a antígenos cardíacos, que pueden estar presentes en la membrana plasmática –AA antirreceptor β1-adrenérgico20, o antirreceptor muscarínico21–; en el citoesqueleto22 –AA antiproteínas intracelulares como miosina, actina, troponina, o tropomiosina–; y en las estructuras intracelulares –AA anti-Na-K-adenosina trifosfatasa (ATPasa) del retículo sarcoplásmico23, o anticeto α ácido deshidrogenasa24, o antiproteínas de choque térmico25.
Autoinmunidad en la miocardiopatía dilatadaEl papel de estos anticuerpos en la MCD es objeto de debate. Pueden ser reflejo de una respuesta inflamatoria a la necrosis de los miocitos, siendo meros marcadores del daño del miocardio, o desempeñar por sí mismos un activo papel durante la enfermedad. Así, por ejemplo, en la miocarditis crónica y en la cardiomiopatía, la prevalencia de anticuerpos frente a la miosina del citoesqueleto se asocia con un deterioro de la función cardíaca26.
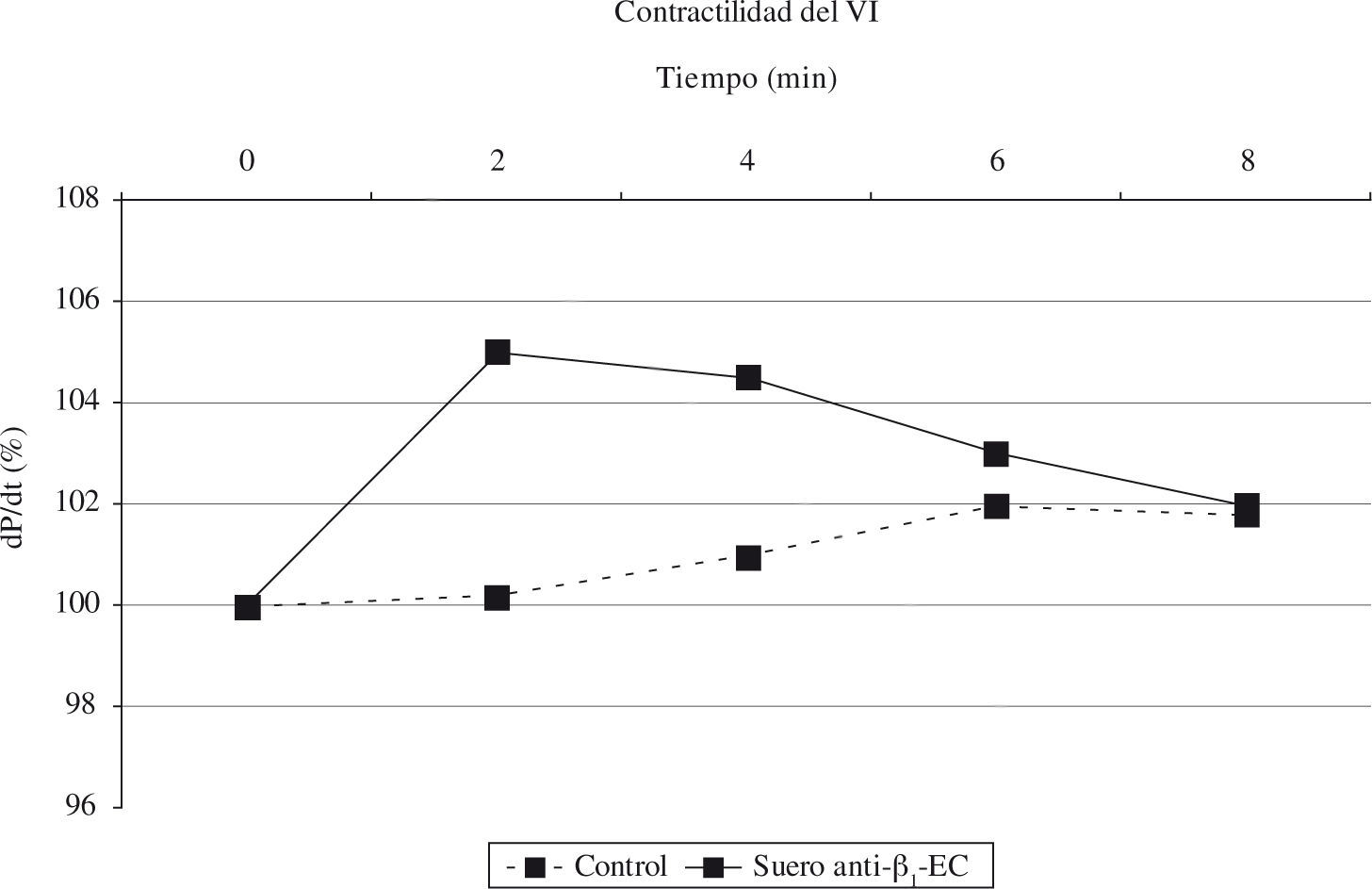
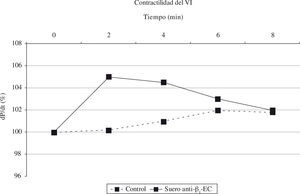
La inmunización activa llevada a cabo en conejos, mediante la inyección de un péptido sintético correspondiente al segundo loop extracelular del receptor humano M2 de acetilcolina –un AA presente en el suero de los pacientes con MCDi–, demostró la inducción de un cambio en la morfología cardíaca similar a la observada en los pacientes con MCD27. Igualmente, ratas inmunizadas, en este caso con el loop del receptor β1, desarrollan dilatación progresiva del ventrículo izquierdo y disfunción28. Y lo más importante, al inyectar el suero de estos animales en otros aparentemente sanos, se induce un fenotipo cardiomiopático similar al anterior (Fig. 1), lo que demuestra el potencial patogénico de los anticuerpos anti-β1-adrenérgicos en la MCD. Otros estudios in vitro han corroborado la activación de un mecanismo de señalización en cascada de la respuesta a la adrenalina29,30, mientras que in vivo se asocian a un empeoramiento de la función ventricular izquierda y a la mayor prevalencia de arritmias31,32.
Cambios en la contractilidad del ventrículo izquierdo (VI) de las ratas naive Lewis/CrIBR tras la inmunización con un suero control (NaCl 0,9%), o con un suero de ratas previamente inmunizadas con anticuerpos β1-ECII (50 µl).
Estos resultados sugieren un papel muy activo de estos AA. Wallukat33 demostró que los AA antirreceptor β1-adrenérgicos poseen un efecto agonista sobre el receptor, con la particularidad de que no lo desensibilizan. La desensibilización es un mecanismo de feedback negativo, que protege al miocardio de una exposición prolongada a la estimulación β-adrenérgica, reduciendo el número de receptores de membrana. Ello explicaría por qué los β-bloqueadores son sólo eficaces en la fase aguda de la insuficiencia cardíaca, manifestando el efecto contrario –incremento del número de receptores β– en las fases más estables o avanzadas de la enfermedad.
La prevalencia de estos AA en los pacientes con MCDi varía del 40–90%, algo más bajos en miocardiopatías de otra etiología, y prácticamente nulos en sujetos sanos34. No obstante, la evolución del título de los anticuerpos de membrana no se conoce muy bien. Caforio, et al. han visto que normalmente la concentración más alta de estos AA se observa al diagnóstico, para luego disminuir con la progresión de la enfermedad, siendo apenas detectables en las fases más avanzadas35.
En el caso de los anticuerpos del citoesquleto, se demostró que la concentración de los AA contra miosina y actina mantienen una relación directamente proporcional al daño miocárdico –medido como la troponina I, un antígeno específico de la superficie de los cardiomiocitos–, de manera que los pacientes que habían sufrido un infarto de miocardio presentaban una concentración elevada de troponina I y eran positivos para los tests de detección de estos AA36. En los pacientes con miocarditis, se ha observado una prevalencia del 52% de los AA antimiosina37, y su persistencia se asocia con el empeoramiento de la fracción de eyección y una mayor rigidez diastólica. En pacientes jóvenes con MCD, sobre todo en la forma idiopática, se han detectado AA contra la cadena pesada α y β de la miosina –específicos del tejido auricular, y de ventrículo y músculo esquelético, respectivamente.
Factores como la necrosis de los miocitos, secundaria a una infección viral o a cualquier otra lesión cardíaca, facilitan la exposición de estas proteínas intracelulares, favoreciendo la autoinmunidad asociada a la MCD38. Otro de los mecanismos autoinmunes es el mimetismo molecular, es decir, dada la similitud entre un antígeno exógeno y otro endógeno (proteínas del citoesqueleto), podrían lesionarse también los antígenos del huésped39. Los estudios experimentales sobre mimetismo demuestran la reactividad cruzada, de modo que algunos anti-cuerpos monoclonales específicos de la miosina cardíaca pueden reaccionar frente al receptor β1-adrenérgico. Ambos mecanismos de interrupción de la tolerancia a los autoantígenos intracelulares pueden explicar la asociación de la infección viral con la miocarditis y con la MCD.
Hay un grupo de componentes intracelulares que también han demostrado capacidad antigénica. Los AA dirigidos frente a los antígenos mitocondriales actúan sobre la base energética de la célula, y dañan algunas de las proteínas de la mitocondria. Sin llegar a ser específicos de cada órgano, se han detectado AA frente a una flavoproteína mitocondrial en el 36% de los pacientes con diagnóstico de MCDi40. Los AA que actúan frente a la proteína translocadora de nucleótidos de adenina (ANT) inhiben el transporte adenosina difosfato (ADP)/ adenosina trifosfato (ATP) transmembrana, y son responsables de un deterioro de la función cardíaca en los pacientes con MCDi41. Experimentalmente, estos anti-cuerpos han demostrado su reactividad a las proteínas dependientes de los canales de Ca2+ presentes en la membrana de los miocitos de rata, induciendo la lisis de estas células, incluso en ausencia de la activación del complemento42. Una reciente revisión de Caforio, et al.43 propone que pudiera ocurrir que los diversos AA que inducen al mecanismo humoral de la MCD, aun en ausencia de la inflamación del miocardio, afectan directamente a las bases reguladoras de la corriente de Ca2+.
Baba, et al.23, utilizando como antígeno la enzima Na-K-ATPasa, previamente aislada del retículo sarcoplásmico de la corteza cerebral porcina, observaron un grupo de AA con posible actividad biológica en la MCD. Igualmente, el transporte de calcio mediado por otra ATPasa reticular del miocito está disminuido en un tercio de los pacientes con MCD44, aunque también se ha observado entre los pacientes con MCDi o con cardiopatía isquémica45.
Las proteínas de choque térmico (heat shock proteins [HSP]) son protectoras de la célula frente al daño molecular que se produce en una amplia variedad de enfermedades. Se convierten, así, en un objetivo de la respuesta inmunitaria, y se ha demostrado que la concentración de AA puede llegar al doble en los pacientes con MCD frente a la de los sujetos sanos46.
La inmunoadsorción en los pacientes con miocardiopatía dilatadaParalelamente al desarrollo de la hipótesis etiopatológica de la autoinmunidad en la MCD, se han ido publicando los resultados de la eficacia de la terapia farmacológica. A pesar de los avances en el tratamiento de la MCD con los inmunosupresores –corticoides, ciclosporina, azatioprina–, o los inmunomoduladores –pentoxifilina, etanercept, o Ig endovenosa–, el pronóstico es de poco favorable.
A la vista de los resultados experimentales y clínicos sobre el componente mayoritario de autoinmunidad en la base de la patogénesis de esta enfermedad, eliminar los anticuerpos desencadenantes del proceso parece una opción, cuando menos, razonable. La demostración en pacientes con MCDi de la presencia de AA frente a varios epítopos del receptor β1-adrenérgico, y la hipótesis de que pueda tener un papel determinante en la fisiopatología de la enfermedad28–35, ha puesto en marcha una línea de investigación en la que, mediante la eliminación del agente causal, se conseguiría una mejoría sustancial de la enfermedad. La supresión farmacológica de los AA, o su extracción extracorpórea a partir del plasma del paciente, va a repercutir directa y positivamente sobre la función contráctil del miocardio y la clínica general de estos pacientes.
Los anticuerpos circulantes del paciente con MCD pueden ser eliminados mediante IA. Esta técnica consiste en separar inicialmente el plasma del paciente, haciéndolo luego circular a través de unas columnas específicas que, por diferentes mecanismos –p. ej. la unión a un anticuerpo policlonal anti-Ig humana–, fijan y eliminan específicamente estos AA, devolviendo finalmente al paciente el plasma ya tratado mediante un circuito de retorno venoso.
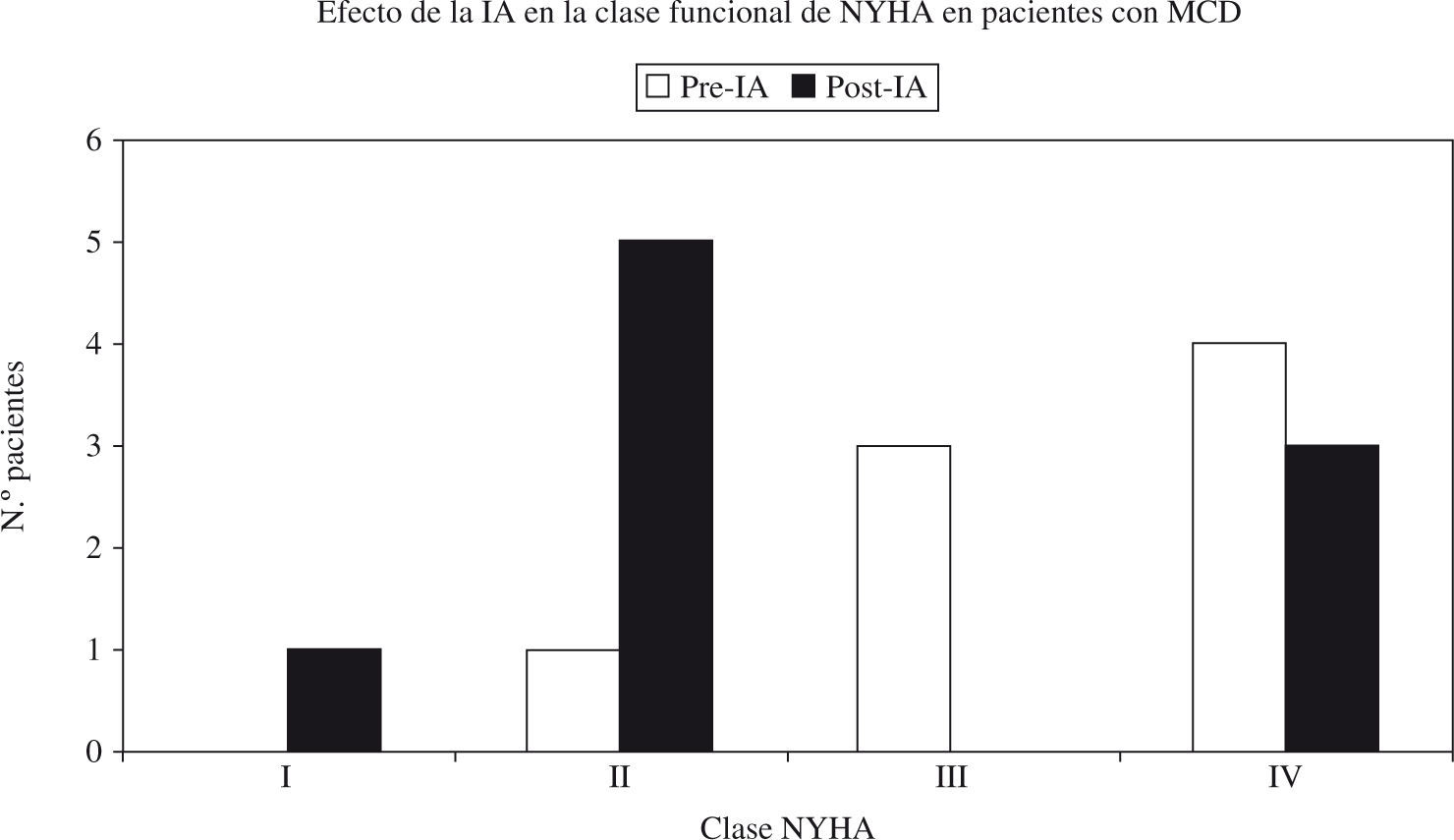
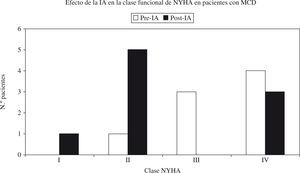
Desde finales de la década de 1990, se han publicado numerosos estudios analizando los resultados de la IA en pacientes con MCDi. El primero de estos artículos, publicado por Dörffel en 1997, recoge los resultados de un estudio piloto no controlado, que incluye a nueve pacientes diagnosticados de MCDi e insuficiencia cardíaca grave con fracción de eyección de ventrículo izquierdo (FEVI) inferior a 30%, y con una concentración excesiva de anticuerpos antirreceptor β1-adrenérgico47. Tras la extracción de las Ig circulantes del plasma, a partir de cinco a siete sesiones consecutivas de IA, se observó una mejoría significativa en todos los parámetros hemodinámicos estudiados –índice y gasto cardíaco, presión capilar pulmonar, y resistencia vascular sistémica y pulmonar–, que fue paralela a la reducción de la cantidad de los AA. A pesar de que en este primer estudio no se analiza la función ventricular, un estudio posterior de este grupo confirma la mejoría en el grado funcional de la New York Heart Association (NYHA) a corto plazo48 (Fig. 2). Los autores concluyeron que el efecto de la IA, eliminando los AA de tipo β, quizá fuera similar al de los fármacos β-bloqueadores en el tratamiento de la insuficiencia cardíaca crónica. Además, en esta serie, el índice del volumen sistólico pasó de 24,0±7,4 a 35,9±10,3ml/m2, tras cinco sesiones de IA (p<0,01)48.
Descripción de los síntomas según la NYHA en pacientes de MCD antes (pre) y después de la IA (post-IA).
Unos años después, en un estudio prospectivo y aleatorizado en pacientes con MCD (n=9; NYHA III-IV; FEVI < 30%), y en el que se incluyó un grupo control (n = 9), se analizaron los parámetros hemodinámicos agudos, como la FEVI y la clase funcional de la NYHA49. Los pacientes se sometieron a un primer ciclo de tres sesiones de IA, seguido de la infusión endovenosa de IgG –dosis de 0,5g/kg peso corporal– que pretendía evitar, por un lado, el rebote inmunológico de la producción de nuevos anticuerpos, y por otro, reducir el riesgo de infección por la depleción de Ig. La IA se repitió durante otros tres cursos sucesivos con dos sesiones consecutivas, hasta el tercer mes de haber comenzado el tratamiento. En el grupo de control no se llevó a cabo la IA. La mejoría observada en los valores del índice cardíaco, o del índice de volumen sistólico –con incrementos del 30%–, y de la resistencia sistémica vascular –disminución del 30%– de los pacientes tratados con IA frente a los controles (p<0,01) persistió después de 3 meses de seguimiento. La FEVI aumentó significativamente en el grupo de tratamiento, lo que indica que la IA activa la función cardiovascular en el enfermo con MCD. Por el contrario, la hemodinámica de los enfermos del grupo de control no tuvo ningún cambio con respecto al momento basal del ensayo49.
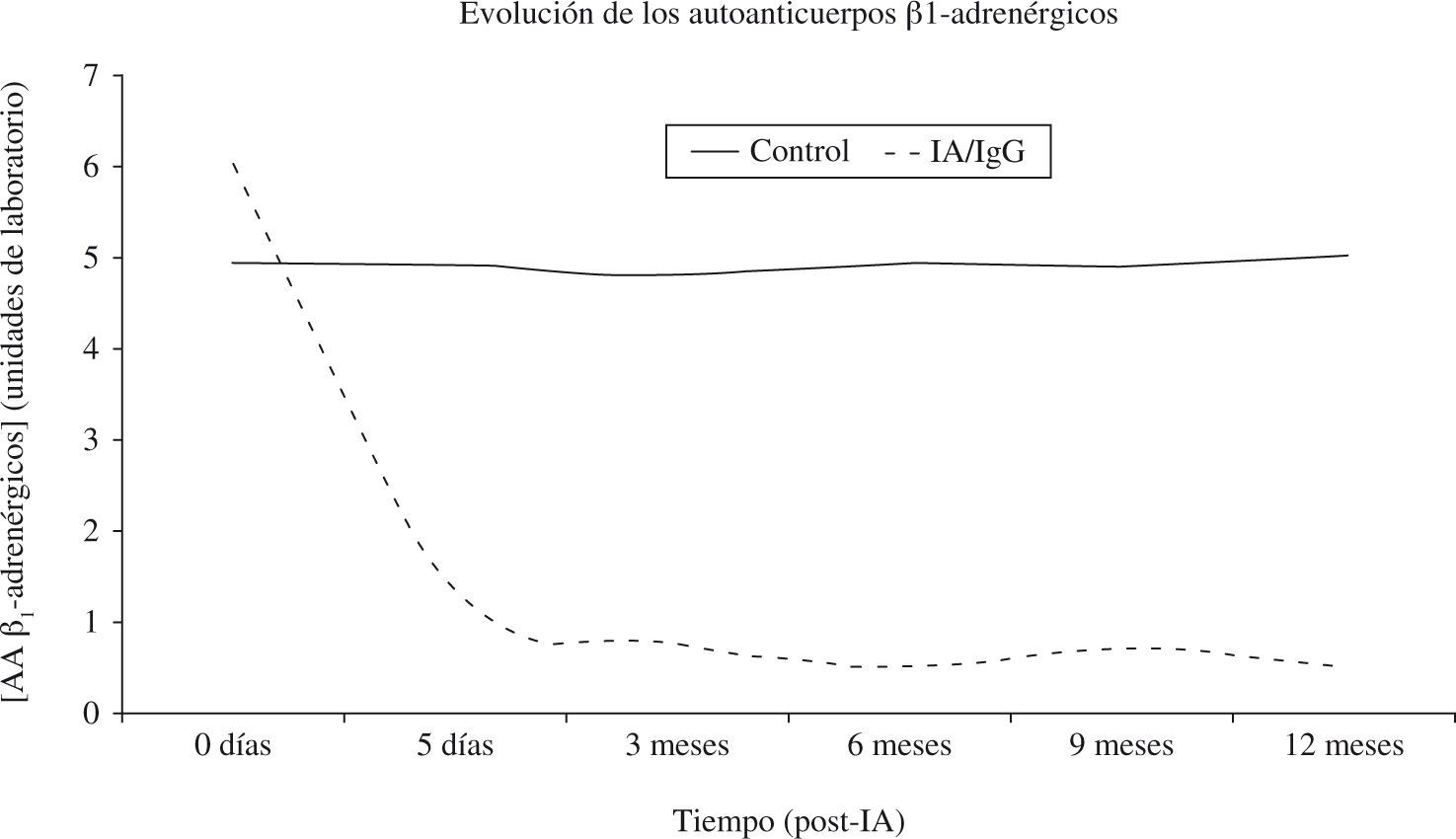
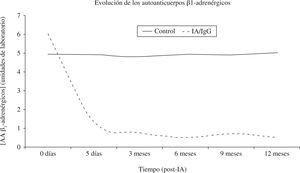
Müller50 publicó un estudio prospectivo, controlado, en 34 pacientes con MCDi. La gravedad de la enfermedad se contrastó por la presencia de AA dirigidos frente al receptor β1-adrenérgico. La muestra se dividió en dos subgrupos del mismo tamaño, de modo que la mitad de los pacientes –grupo de control– recibió la terapia farmacológica convencional, con la dosis máxima tolerada de inhibidores de la enzima convertidora de angiotensina, digitálicos, diuréticos, anticoagulantes orales y β-bloqueadores (bisprolol); el grupo de estudio fue además tratado con IA. El efecto de la IA se evaluó a largo plazo, de modo que después de 1 año se observó que el diámetro telediastólico de ventrículo izquierdo disminuyó el 14,5% en el grupo de tratamiento (p=0,0001), y el 3,8% en el grupo de control (p=0,2342). En cuanto a la FEVI, no se detectó ningún cambio en los controles, aunque sí en el grupo de tratamiento. La IA produjo un incremento relativo de casi el 70% (FEVIpre-IA = 22,3 plusmn;3,3%; FEVIpost-IA = 37,9±7,9%; p=0,0001). El mantenimiento de la respuesta a largo plazo –cinco sesiones de IA fueron suficientes para 1 año de seguimiento– se acompañó de una mejoría significativa (p=0,0001) de la función cardíaca, encontrándose todos los pacientes con NYHA I-II al finalizar el estudio. Sin embargo, los pacientes con MCDi tratados únicamente con fármacos experimentaron una recuperación de la función cardíaca hasta el sexto mes, que posteriormente retornó a los valores de inicio del estudio50. Esta diferencia con respecto al control pudiera deberse al efecto depresor de la IA sobre la concentración total de IgG, y especialmente sobre la concentración de los AA anti-β1-adrenérgicos, que tuvo lugar al finalizar el ciclo de las cinco sesiones de aféresis (Fig. 3).
Evaluación a 1 año de seguimiento de la concentración de los AA β1-adrenérgicos (unidades de laboratorio) obtenida a partir de un grupo de pacientes de MCD (n=17) tratados con IA y restitución de la IgG (IA/IgG) y de controles (n=15 pacientes de MCD no tratados con IA).
La vida media de las IgG es de 21 días, y de 5 días para las inmunoglobulinas M (IgM), con un importante depósito extravascular, en tejido, del 60% para IgG, y del 20% para IgM, y un equilibrio del espacio extra al intravascular de 1-3h. Resulta, entonces, esperable que una terapia exclusiva con fármacos inmunosupresores, que actúan sólo a nivel de la síntesis de estos anticuerpos, no tenga un efecto significativo en la reducción de la concentración de Ig hasta transcurridas al menos varias semanas desde su inicio. En cambio, la lenta eliminación de la fracción extravascular hace que, tras una sesión de IA, la concentración de Ig se recupere tras 24-48h, aunque no por completo. Después de una sesión de IA en la que la eliminación de Ig se hace mediante la retención selectiva a través de un anticuerpo policlonal anti-Ig, se consigue una retención del 85% de IgG y de un 60% de la IgM total51, aunque después de tres sesiones este porcentaje sube al 80% para las IgM52.
Los AA β1-adrenérgicos pueden causar una estimulación adrenérgica crónica. De este modo, la IA podría no sólo actuar a nivel hemodinámico, sino también sobre la inflamación del miocardio. El estudio de Staudt53 ha tratado de demostrar este efecto, analizando los cambios inmunohistológicos inducidos por la IA (cuatro cursos repartidos en 3 meses), y la posterior sustitución de IgG (una dosis de 0,5g/kg peso corporal, a intervalos mensuales durante 3 meses), en pacientes con MCD (n=12), en comparación con sus correspondientes controles (n=13), con los que no se utilizó la IA como terapia inmunomoduladora. En el grupo control, el número de linfocitos CD3, CD4 y CD8, y el de antígenos leucocitarios comunes del miocardio, permaneció estable durante los 3 meses de seguimiento del estudio. Esto permitió excluir la posibilidad de que en el curso natural de la enfermedad se asocie a una caída en el número de células inflamatorias. Tampoco cambió la expresión del antígeno HLA de clase II (alelos DP, DQ, DR). Por el contrario, con el tratamiento IA/IgG a los pacientes con MCD crónica, se observó un descenso significativo de las tres poblaciones linfocitarias, así como de los antígenos leucocitarios comunes del miocardio, y en la expresión del antígeno HLA de clase II53.
Ello revela que la infiltración de linfocitos tiene un papel clave en la patogénesis de la MCD. Un número elevado de leucocitos en el miocardio se asocia a una activación excesiva de las células T en este tejido, y el daño mediado por estos linfocitos T es estrictamente dependiente de los antígenos de clase II del complejo mayor de histocompatibilidad. De hecho, la susceptibilidad de un individuo a desarrollar MCD se asocia a la expresión de diversos alelos del gen HLA de clase II, de modo que la eficacia de la terapia elegida depende de la capacidad de eliminación de la infiltración de linfocitos y de la reducción de la expresión de este antígeno en el miocardio54. Recientemente, se ha publicado que también las células T reguladoras (CD4+CD25+CD127low) aparecen como mediadoras del efecto de la IA55, de modo que esta terapia será capaz de aumentar el nivel de estas células en pacientes con MCDi. Además, este efecto, asociado a una disminución en la población de linfocitos T activados (la ratio de T efectoras CD4+/CD69+, de T citotóxicas CD8+/CD69+, y de T colaboradoras CD4+/CD28+), se corresponde con una reducción de los AA cardiotóxicos, y con ello, una mejoría en los parámetros ecocardiográficos.
Estos estudios demuestran que la terapia IA/IgG genera cambios en la inmunidad celular y humoral del proceso inflamatorio del miocardio de los pacientes con MCD. La IA no ha demostrado ningún efecto sobre la concentración de TNF-α, una citocina proinflamatoria, con efectos inotrópicos negativos, y la apoptosis del miocardio sí puede contribuir a regular la concentración de citocinas en el tejido cardíaco56.
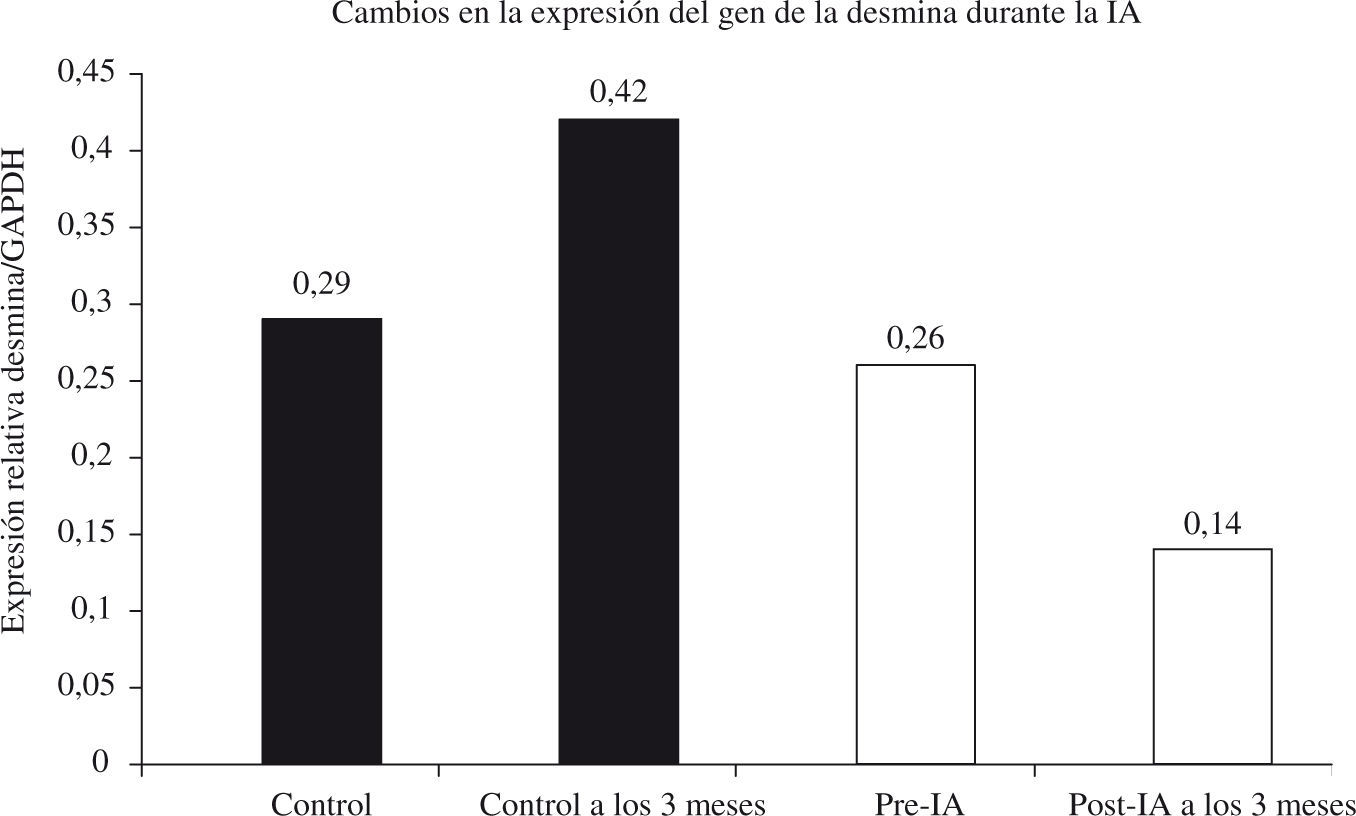
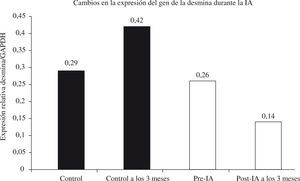
La eliminación de anticuerpos por la IA puede influir en la expresión de algunos genes del miocardio asociados a la MCD o la insuficiencia cardíaca. Hay una correlación inversa entre el nivel de expresión de la desmina, una proteína de los filamentos intermedios del citoesqueleto de los miocitos, y la FEVI en los pacientes con MCD57. En los pacientes tratados con IA/IgG, la expresión de la desmina disminuyó significativamente (p<0,05) frente a la de los controles tratados farmacológicamente (Fig. 4), y esta reducción fue paralela al incremento en el valor de FEVI58.
Cambios en la expresión del gen de la desmina durante la IA. Al inicio del estudio y a los 3 meses, se aísla el contenido en ARN de las biopsias endomiocárdicas de pacientes con MCD tratados sin IA (grupo de control, n=6), o con IA (IA, n=6). La expresión del gen de la desmina se cuantificó mediante reacción en cadena de la polimerasa con transcripción reversa (RT-PCR), utilizando la expresión de gliceraldehído fosfato deshidrogenasa (GAPDH) como patrón interno (p<0,05 vs momento basal; p<0,05 vs controles).
Wallukat59 fue el primer investigador que publicó el beneficio de eliminar los anticuerpos cardíacos mediante la IA en los pacientes con cardiopatía no isquémica, demostrando una mejoría de los síntomas y de la función cardíaca. Desde entonces, varios estudios abiertos y controlados han descrito el beneficio de la IA en la hemodinámica del miocardio y su relación con la concentración del péptido natriurético cerebral (nt-BNP), y sobre la calidad de vida del paciente con MCD crónica60. Sin embargo, no en todos los estudios hubo uniformidad en los resultados. Cooper, et al.61 observaron que, incluso sin la restitución de la IgG, la respuesta hemodinámica al tratamiento con IA no es uniforme, aunque se confirma que la calidad de vida de los pacientes con MCD crónica e insuficiencia cardíaca congestiva (ICC) (clase funcional III-IV de la NYHA) mejoró significativamente, manteniéndose 6 meses después del tratamiento.
En un ensayo clínico en 22 pacientes con MCD y NYHA III-IV, el resultado de la IA no se asoció con la eliminación de los AA del receptor β-adrenérgico62. El contenido de estos anticuerpos fue positivo en el 73% de los casos (16 de 22), pero, independientemente del resultado, ambos grupos mostraron una respuesta hemodinámica semejante (ΔFEVI ~ 50%) después de nueve sesiones de IA repartidas en 3 meses (1 ciclo/mes), junto con una infusión endovenosa mensual de 0,5 g IgG/kg después de cada ciclo. Además, al recuperar los anticuerpos del eluato de los adsorbentes utilizados durante la IA y añadirlos a los miocitos de rata en cultivo, se observó un efecto cronotrópico, triplicándose la actividad celular hasta alcanzar los 450 latidos/min62. Este fenómeno puede ser explicado porque los anticuerpos responsables del efecto inotrópico y cronotrópico negativo sobre los cardiomiocitos son diferentes en los distintos tipos de MCD. Una ruta común a los anticuerpos cardiotrópicos es la representada por la unión del receptor Fcγ-II a (CD32), recientemente aislado de la membrana del retículo endoplásmico del cardiomiocito63. Los anticuerpos cardiodepresores de la MCD se unen vía Fab al antígeno cardíaco, de modo que el fragmento Fc de la IgG se podría unir al receptor Fcγ-IIa del cardiomiocito, ejerciendo un efecto inotrópico negativo. Distintos tipos de AA cardíacos de la MCD pueden inducir una respuesta inotrópica negativa por la vía de su unión al receptor Fcγ-IIa. Es decir, el modelo Fcγ puede explicar por qué distintos anticuerpos dirigidos frente a distintos antígenos cardíacos generan la misma respuesta de deterioro hemodinámico63. La IA es una opción óptima para eliminar como las Ig que reconocen distintos epítopos cardíacos, pero que comparten una misma vía de reconocimiento a partir del dominio Fcγ.
Felix64, además de analizar el efecto cronotrópico, midió la fluorescencia emitida por la liberación del ión Ca2+. Los anticuerpos aislados en un grupo de individuos sanos no produjeron ningún efecto ni sobre el transporte de Ca2+, ni sobre la función contráctil. Sin embargo, los anticuerpos purificados del suero de pacientes con MCDi redujeron el transporte de Ca2+ y el acortamiento de las células cardíacas. La evolución hemodinámica favorable de los enfermos tratados con IA se correlacionó con la respuesta cardiodepresora de los AA sobre los miocitos aislados de los modelos animales de experimentación64.
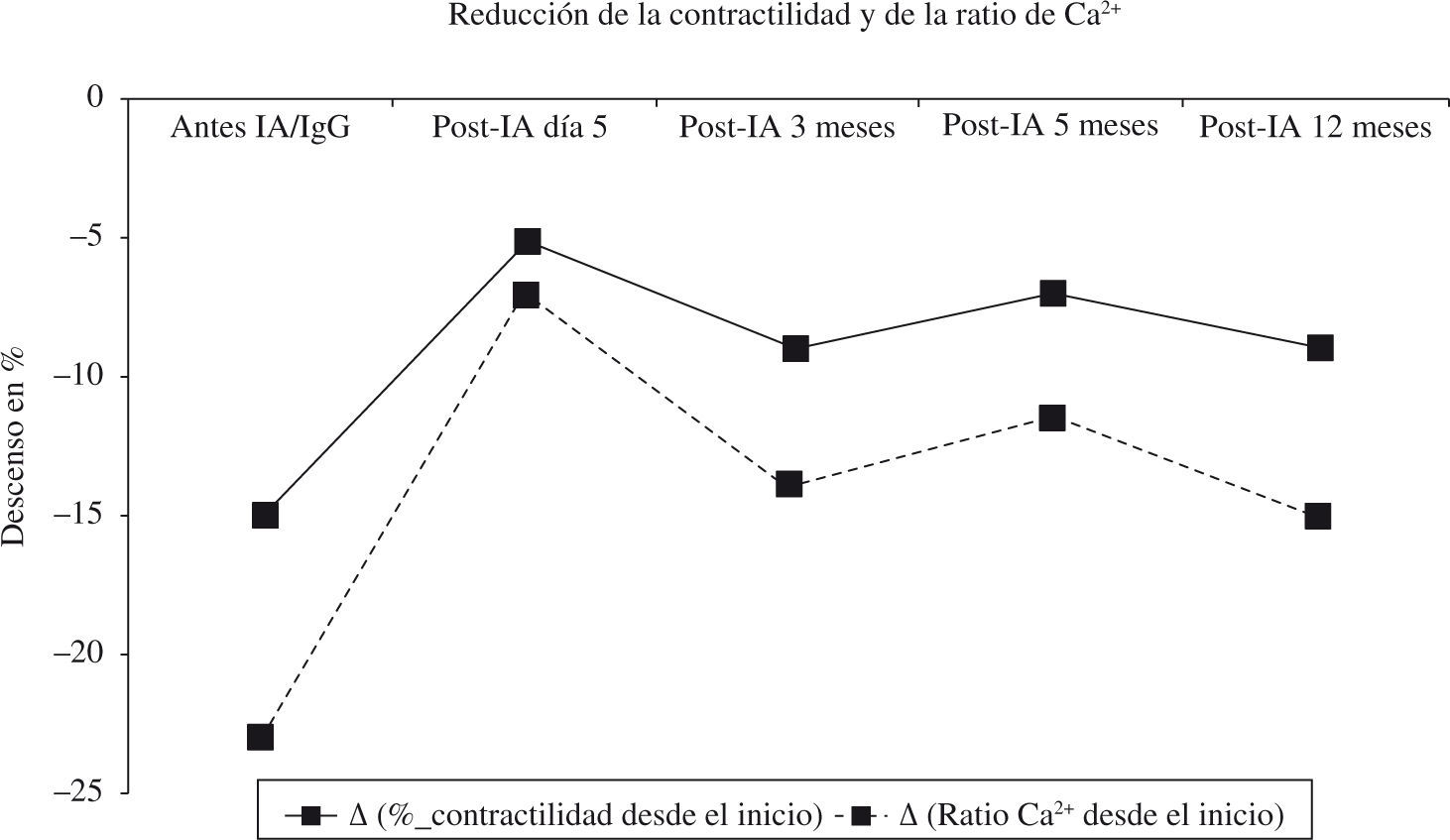
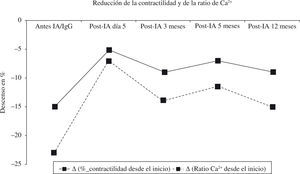
La detección de estos AA cardiodepresores tiene relevancia terapéutica esencial porque la contribución de la actividad humoral al pronóstico de la MCD difiere de unos pacientes a otros. En los pacientes con insuficiencia cardíaca grave secundaria a MCD, es muy importante saber de antemano qué pacientes son susceptibles de mejorar con IA. Trimpert, et al.65 han demostrado que no se produjo ningún efecto con la IA en los pacientes sin anticuerpos cardiodepresores (n=6), mientras que aquellos con anticuerpos inotrópicos negativos (n=11) presentaron una activación de la FEVI, que pasó del 33,8±1,7% al 44,5±2,3%, o al 51,8±1,7% a los 3, 6 o 12 meses del tratamiento con IA (5 sesiones) e Ig endovenosa (0,5g/kg), respectivamente (p<0,05 vs el grupo de los pacientes sin AA). La definición del grupo de pacientes con anticuerpos cardiodepresores se hizo a partir de la mediana del porcentaje de reducción de la función contráctil de los cardiomiocitos (–14,0±1,3%) y del balance de Ca2+ (–7,6±0,4%). La IgG aislada y purificada del plasma de los pacientes de los dos grupos redujo la contractilidad in vitro de los miocitos de rata (–11,5±1,3%) y la ratio de Ca2+ (–6,5±0,5%). Sin embargo, esta actividad cardiodepresora del contenido en IgG de los pacientes con MCD fue disminuyendo con el tiempo transcurrido desde la IA/IgG (Fig. 5), hasta alcanzar los 12 meses, en que hay un pequeño rebote inmunológico65.
Mediana de la reducción de la contractilidad y de la ratio de Ca2+ en cardiomiocitos de rata adulta tras la incubación con el plasma obtenido de pacientes con MCD (n=11) en el momento indicado. Todos los valores fueron estadísticamente significativos de acuerdo con el método de Holm-Sidak (p<0,05).
Baba66 detectó la presencia de AA cardiodepresores en el 63% de 104 pacientes con MCDi, sin relación con otros parámetros clínicos salvo la presencia de anticuerpos contra el receptor β1-adrenérgico (81 vs 52%; p<0,01), o el receptor muscarínico M2 de la acetilcolina (83 vs 42%; p < 0,01). La inyección de estos AA cardiodepresores en embriones de pollo ha provocado un descenso significativo de la FEVI, aunque esta respuesta fue reversible tras la IA llevada a cabo in vitro del suero del paciente.
En ocasiones, la mejora hemodinámica de la IA en la MCD es similar en los pacientes positivos y negativos para los AA anti-β1-adrenérgicos, lo que pone de manifiesto que no siempre podemos basar la eficacia de la IA en la eliminación de estos anticuerpos67. Staudt68 fue el primero en describir este efecto, demostrando el efecto depresor de la IA sobre la concentración plasmática de la forma inactiva del nt-BNP y del péptido natriurético auricular (nt-ANP). Estos péptidos se sintetizan como proteínas precursoras para luego transformarse en prohormonas –BNP y ANP–. Una vez liberadas por la célula, se produce una división equimolar entre la forma biológicamente activa de la hormona, que es rápidamente aclarada del plasma, y la forma inactiva (nt-ANP/nt-BNP), que permanece estable en el plasma. Una concentración elevada de la forma inactiva se ha asociado a la disfunción ventricular y a la gravedad de la insuficiencia cardíaca69, y se puede considerar un marcador de riesgo independiente de morbilidad y mortalidad en la ICC por MCD70. Tras 12 sesiones de IA repartidas a intervalos de 1 mes durante 4 meses, en pacientes con diagnóstico de MCD (n=15), hay una reducción significativa (> 50%) y prolongada durante 1 año de seguimiento en la concentración plasmática de nt-ANP (de 4.439±1.271fmol/ml al inicio, a 2.227±427fmol/ml al final de los 3 ciclos de IA; p<0,01), y de nt-BNP (de 1.501±328fmol/ml al inicio, a 714±119 fmol/ml al final de los 3 ciclos de IA; p<0,01)68. Paralelamente a esta inactivación neurohormonal, y en comparación con lo obtenido para el grupo de control, se registró un incremento en el valor de FEVI (del 29,7±1,0% al 39±2,0%; p<0,001) en el grupo tratado con IA. Puesto que los pacientes incluidos en este estudio recibían una medicación estable, el efecto sobre el nivel plasmático de estos péptidos, así como la mejoría observada en la condición hemodinámica, son, por tanto, el resultado de la IA. Puede ocurrir que la IA actúe directamente, activando la contractilidad del miocardio, y/o produciendo vasodilatación68. Otros autores, incluso, han asociado la respuesta hemodinámica a la IA con la reducción del estrés oxidativo en los pacientes con MCDi71, y con una mejor capacidad para la práctica del ejercicio cardiopulomar72.
El papel de la inmunoglobulina G de tipo 3 en la miocardiopatía dilatada: implicaciones terapéuticas de la inmunoadsorciónEl beneficio terapéutico de la IA también sucede, por actuar directamente sobre el sistema inmunitario, mitigando el proceso inflamatorio en el que la prevalencia de un determinado subtipo de Ig pudiera tener un significado crucial en la fisiopatología de la MCDi.
Los anticuerpos de naturaleza IgG3 son las Ig más activas en la fijación del complemento, y son los mediadores más eficaces de la citotoxicidad celular dependiente de anticuerpos73. Recientemente, se descubrió el papel de los anticuerpos IgG3 de la cadena pesada de la miosina cardíaca –formas α y β–, como la Ig predominante en los pacientes con MCDi, y su relación directa con la gravedad de la enfermedad, sobre todo en presencia de niveles elevados de interferón-γ (IFN-γ)73. Los AA de este subtipo contribuyen a la patogenicidad inmunitaria de la MCD. De este modo, el beneficio hemodinámico momentáneo o sostenido de la IA depende también de la eficacia de esta técnica en la retención de los anticuerpos IgG3 de los enfermos de MCD51,74.
Por lo tanto, resulta esencial un sistema de IA que elimine con la misma selectividad y eficacia todas las subclases de IgG (IgG1, 2, 3 y 4). Se ha publicado que algunos adsorbentes –proteína A– tienen baja afinidad por la IgG375 y son ineficaces para mejorar la función cardíaca y los síntomas de los pacientes con MCD76. Además, al comparar este sistema con un adsorbente anti-IgG, los resultados de afinidad obtenidos para la retención de IgG3 fueron estadísticamente significativos (Δconcentración (%): –37,4±4,0% tras la primera sesión de IA con proteína A, n=9; Δconcentración (%): –89,0±3,0% tras la primera sesión de IA con anti-IgG, n=9; p<0,001)74; algo semejante ocurrió al comparar el porcentaje de eliminación de los anticuerpos anti-α1-adrenérgicos.
Estos resultados destacan nuevamente la importancia de los anticuerpos IgG3 en la MCD, siendo esperable una relación positiva entre la reducción de IgG3 y los resultados clínicos. En un estudio de cohorte de 51 pacientes con MCD no familiar y en avanzado estado de cronicidad (la mayoría en lista de espera para trasplante cardíaco), Doesch76 demostró que con una tasa de reducción del 90% en el total de las IgG (acumulada tras 5 sesiones de IA), pero del 67% en el caso de la IgG3 –la máxima conseguida hasta la fecha para la IA con proteína A–, el incremento en la FEVI, aunque significativo, fue más bajo (del 26,3±9,4% al 28,7±11,4%; p<0,016) que el observado en otros estudios a los que ya hemos hecho referencia48–50,53,58,65,68. No obstante, sí se observó una respuesta al tratamiento –cinco sesiones de IA–, con respecto al resto de los marcadores humorales de la gravedad del daño cardíaco (nt-BNP, proteína C reactiva)77. Resultados semejantes fueron los obtenidos por el grupo de Yoshikawa78, tratando a los pacientes con MCD con un sistema de IA basado en adsorbentes de triptófano, con los que la retención de IgG3 fue incluso inferior al 60%. Por todo ello, es muy importante que la depleción de estas Ig se mantenga a largo plazo, lo que va a repercutir directamente sobre la salud del ventrículo y eventos como el de la muerte súbita.
La inmunoadsorción es un método seguro como terapia de la miocardiopatía dilatadaCon la excepción del trasplante cardíaco, ningún procedimiento terapéutico ensayado hasta ahora en la MCDi ha mejorado tanto la función del ventrículo izquierdo. Además, la IA es un método seguro y con una tolerabilidad excelente. Las complicaciones del uso terapéutico de la IA en la MCD son muy poco frecuentes, y la tasa de mortalidad asociada a la intervención de 3/10.000 procedimientos78. Nosotros podemos asegurar que en la literatura con la que hemos preparado esta revisión, y en la que se utiliza la IA en pacientes con ICC y MCD, no hemos encontrado referencia a efectos adversos específicos, o a complicaciones graves, y tampoco a la mortalidad en el curso del tratamiento.
ConclusiónLa activación del sistema inmune, con la formación de los AA cardíacos, tiene un papel transcendente en el inicio y la progresión de la MCD, y mayoritariamente en la forma idiopática de la enfermedad. La IA elimina selectivamente estos anticuerpos y contribuye a mejorar la función ventricular y la sintomatología de los pacientes con MCD. La IA es una opción terapéutica real para aquellos casos, incluso en las fases más avanzadas de la enfermedad, en que la única alternativa es el trasplante cardíaco. No obstante, la mayoría de los estudios se han llevado a cabo en un número reducido de pacientes y con un seguimiento máximo de 1 año. Los buenos resultados obtenidos merecen el diseño de ensayos multicéntricos más amplios, controlados por placebo, y con seguimientos más prolongados.