La endocarditis sobre válvula pulmonar aislada es extremadamente infrecuente. Presentamos el caso un adolescente de 15 años, portador de una comunicación interventricular y endocarditis infecciosa sobre válvula pulmonar, en que luego de 8 semanas de tratamiento médico fue necesario intervenir quirúrgicamente por presentar grandes vegetaciones en los velos pulmonares, algunas pediculadas, e insuficiencia pulmonar severa. En nuestro país, en ese momento no teníamos válvulas biológicas, por lo que decidimos reconstruir la válvula pulmonar con pericardio autólogo fresco. Ocho meses después, el paciente mantiene una evolución clínica, hemodinámica y ecocardiográfica satisfactoria.
Isolated pulmonary valve endocarditis is very rare. The case is presented of a 15 year-old child, who after eight weeks medical treatment required surgical intervention. This patient had large vegetations in all pulmonary cusps. At that time, there were no biological valves in our country, so it was decided to reconstruct the pulmonary valve with fresh autologous pericardium. The clinical and hemodynamic outcomes were good eight months later.
La endocarditis infecciosa (EI) derecha representa aproximadamente el 6% de los casos de endocarditis y afecta de manera habitual a la válvula tricúspide o a las 2 válvulas derechas. La EI pulmonar (EIP) aislada representa menos del 1,5% del total de las EI1. La EIP se ha descrito fundamentalmente en pacientes usuarios de drogas por vía parenteral y asociada a la presencia de catéteres venosos centrales o cables de marcapasos, a la valvuloplastia pulmonar, a infecciones sistémicas y a enfermedades cardiacas congénitas intervenidas o no2. La incidencia conocida de la EI en cardiopatías congénitas (CC) es 15-140 veces más elevada que en la población general. La incidencia de la EI es considerablemente más alta en pacientes con un defecto de septación interventricular. El tratamiento de la EI en CC sigue los principios generales de tratamiento. La cirugía cardiaca es apropiada cuando falla la terapia médica, surgen complicaciones hemodinámicas severas o hay un alto riesgo de embolia séptica devastadora3.
Caso clínicoNiño de 15 años, con antecedentes de ser portador de una comunicación interventricular (CIV), que ingresa por cuadro febril de una semana de evolución en el Hospital Pediátrico Provincial. En el examen físico, se constatan frémito precordial, soplo sistólico en el borde esternal izquierdo en barra y escape pulmonar, manifestaciones respiratorias y celulitis a nivel del maléolo tibial derecho. Se realiza un ecocardiograma donde se evidencia la presencia de grandes vegetaciones en la válvula pulmonar e insuficiencia pulmonar severa. Se realiza el diagnóstico de EI y se inicia tratamiento antibiótico durante 8 semanas, con mejoría clínica evidente. Todos los hemocultivos fueron negativos. Se traslada a nuestro centro de cirugía cardiovascular para valorar el tratamiento quirúrgico por la presencia de grandes vegetaciones en los velos pulmonares. Reaparece el cuadro febril y se retoma el tratamiento médico. Luego de mejoría clínica y desaparición del síndrome febril, y ante la presencia de grandes vegetaciones en los velos pulmonares con peligro de embolización pulmonar, se decide la intervención quirúrgica.
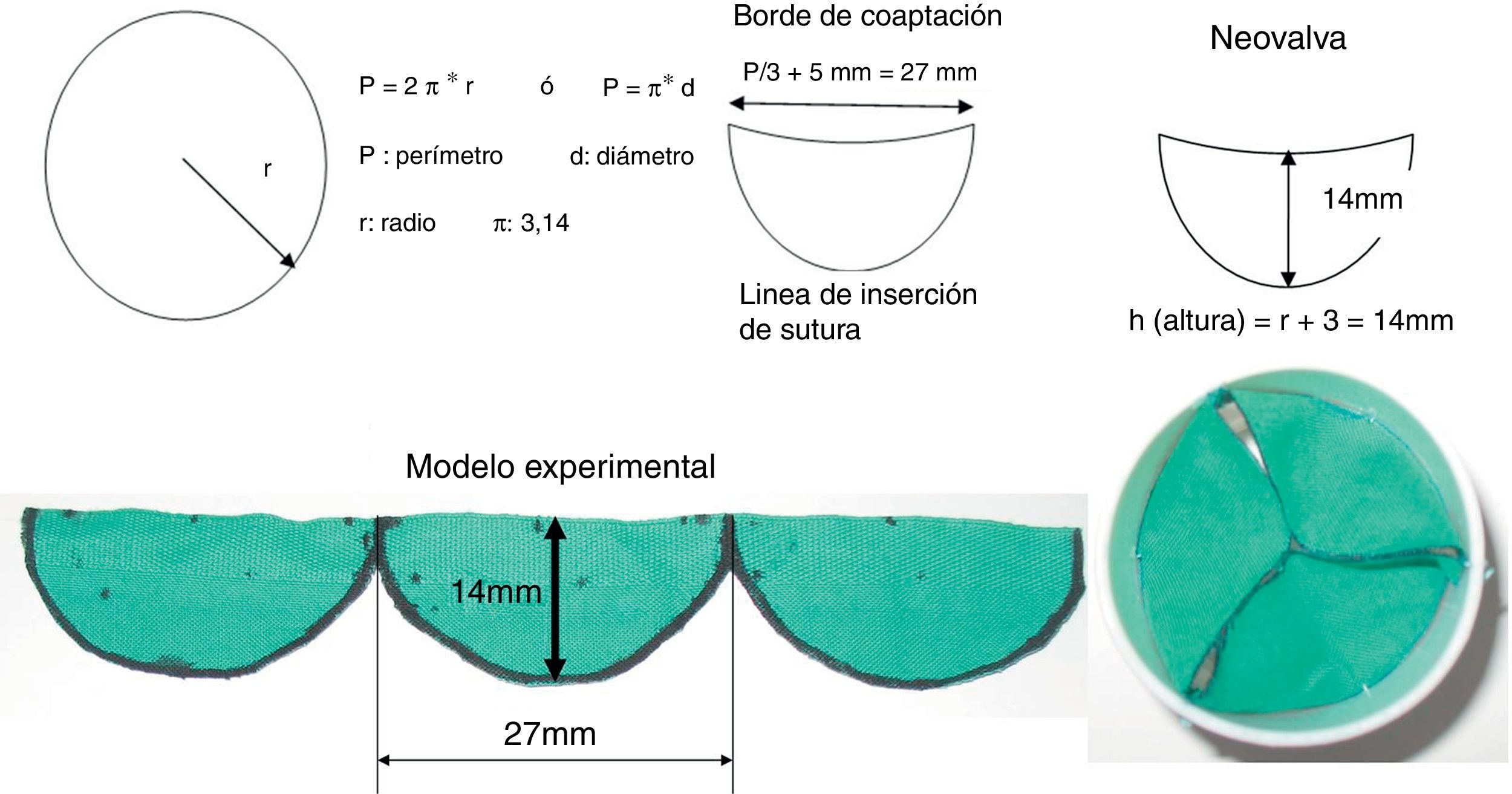
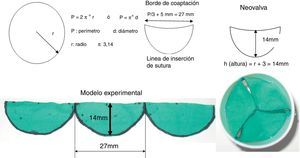
Ante la imposibilidad de contar con válvulas biológicas, nos propusimos reconstruir la válvula pulmonar con pericardio autólogo fresco, teniendo en cuenta la resistencia a la infección que muestra cuando es empleado en las reparaciones mitrales por EI3. A continuación, describimos cómo efectuamos el diseño de esta técnica, sobre la base de cálculos matemáticos lógicos que luego fueron comprobados y corregidos con el diseño de un modelo experimental confeccionado por nuestro equipo de trabajo (fig. 1).
Cálculos preoperatorios para la construcción de los 3 neovelos pulmonaresSegún tabla estimada de anillo valvular por superficie corporal (SC)4:
– SC = 1,21.
– Anillo valvular estimado: 18,2mm (+3)=21mm.
Según ecocardiograma:
– Anillo valvular pulmonar (medido vista eje corto grandes vasos) = 21mm.
En ambas variantes, el diámetro (d) valvular es de aproximadamente 21mm, d=21mm, radio (r) =d/2= 10,5mm.
Perímetro (P) = π * d=(3,14 * 21mm)=65,94mm, aproximado: 66mm.
Si consideramos que las diferencias en las dimensiones anatómicas de las 3 valvas (cúspides/velos) pulmonares son similares, entonces dividir el valor del perímetro valvular de aproximadamente 66mm por 3 (número de valvas a reconstruir) resultaría en las dimensiones de cada una de las neovalvas en su margen libre o de coaptación, es decir, P/3= 66mm/3=22mm. A este valor se consideró adicionarle 2,5mm a cada lado, para la sutura de fijación a cada comisura, para contribuir a cerrar el espacio intercomisural y además lograr el efecto seno de Valsalva, a lo que también se suma la elasticidad natural del pericardio, quedando en aproximadamente 27mm cada neovalva. Al considerar la altura (h) de cada valva, tuvimos en cuenta que las 3 cúspides se unen en el punto medio de la luz de la arteria pulmonar, por lo que se tomó la medida del radio de la circunferencia, sobredimensionando este valor en 3mm para suplir lo que restaría la confección in situ de las líneas de suturas al anillo. La altura máxima se situó a nivel del punto medio de los neovelos (h =11+3=14). Las dimensiones de cada neovalva pulmonar son como se puede observar en la figura 1, donde mostramos el modelo experimental en 2 vistas. En la primera (a la izquierda) se ven las dimensiones (longitud y altura) de cada neovalva y en la segunda (a la derecha) vemos el modelo en sus 3 dimensiones, donde constatamos una buena coaptación central de las neovalvas.
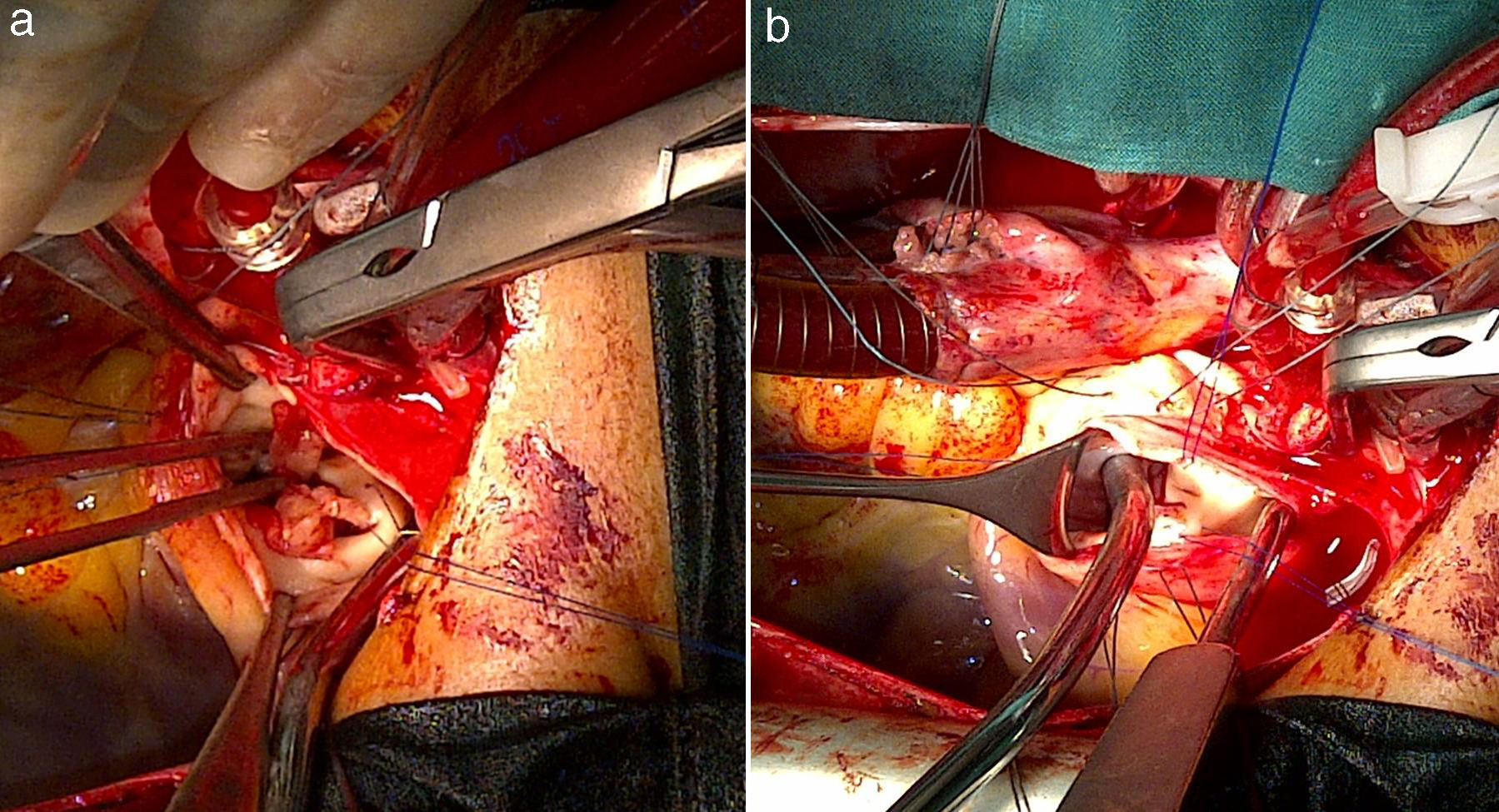
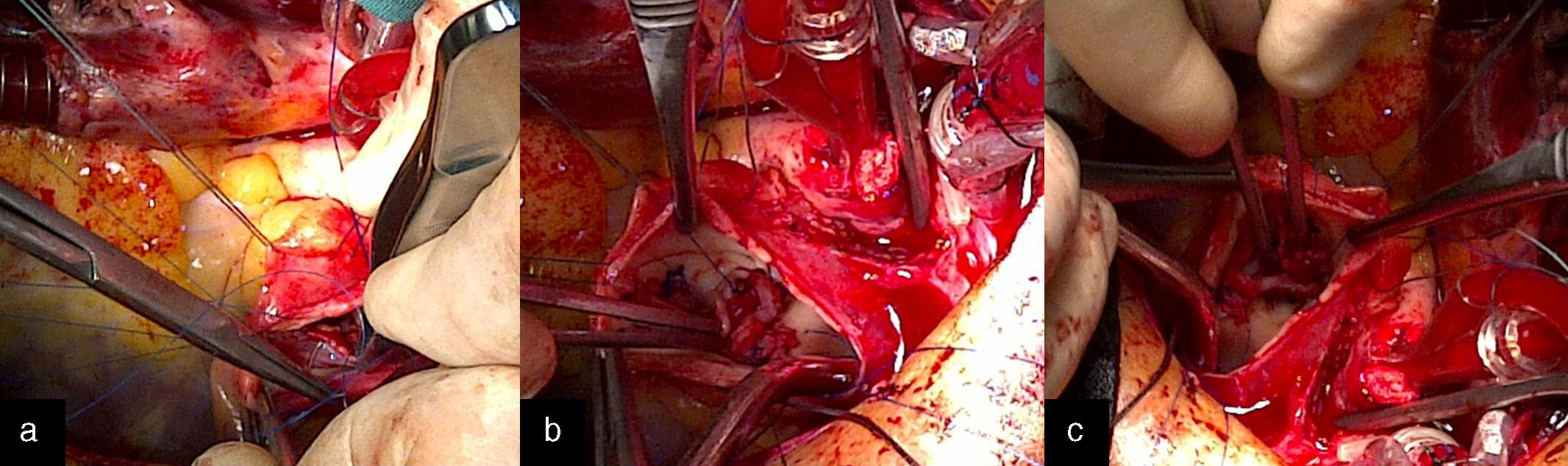
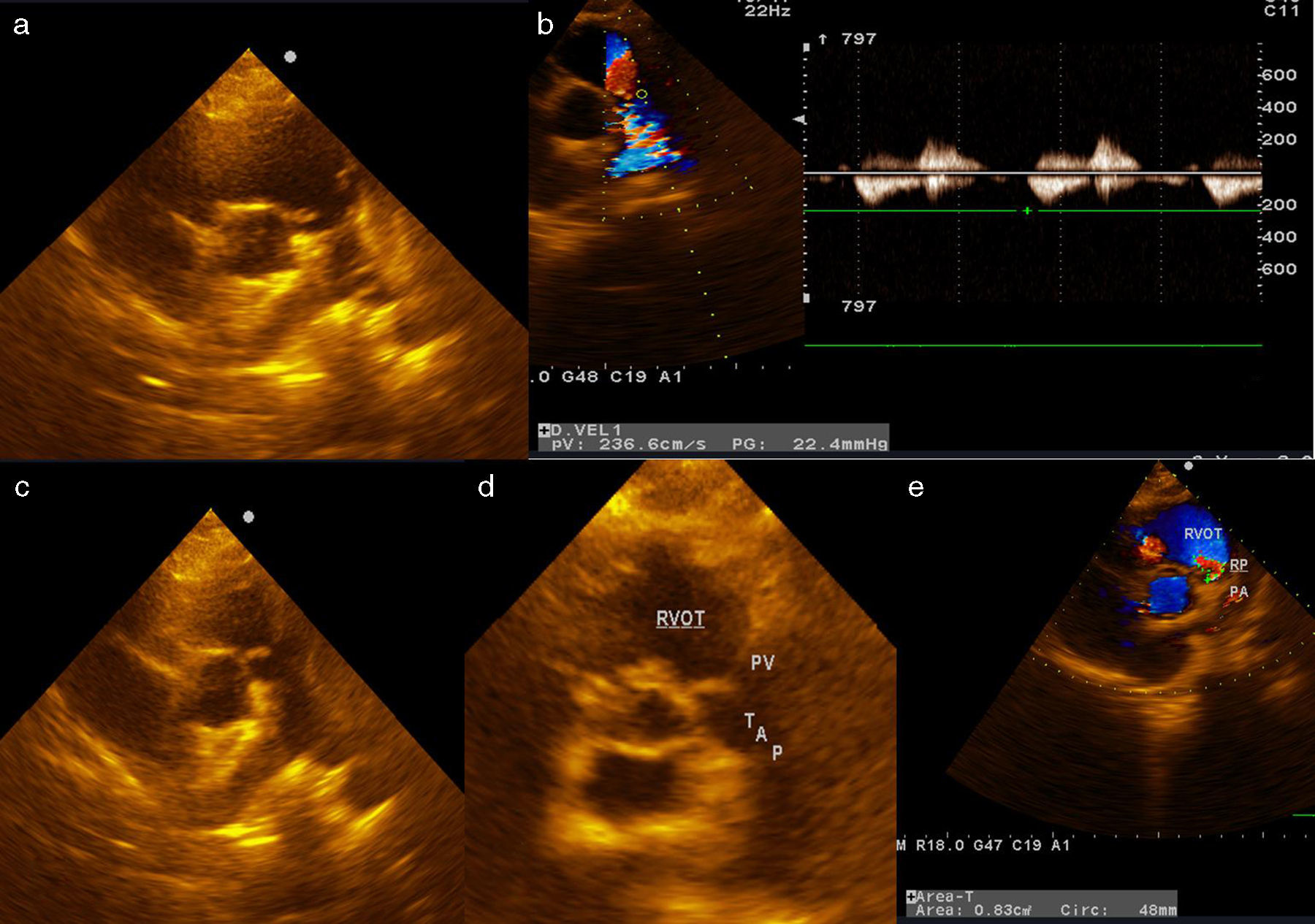
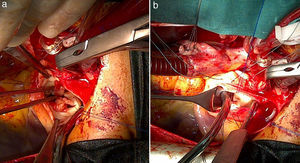
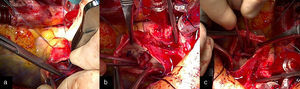
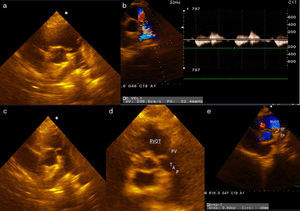
Intervención quirúrgicaSe empleó circulación extracorpórea e hipotermia moderada y parada cardiaca cardiopléjica; se procedió al cierre de la CIV perimembranoso de 5mm a través de la aurícula derecha con 2 puntos en U y soporte de pericardio. A continuación, se procedió a la apertura de la arteria pulmonar y a la exposición de las 3 comisuras pulmonares con 3 puntos de anclaje de Prolene 4/0. Se observaron múltiples vegetaciones grandes en los velos pulmonares (fig. 2a), que obligaron a la resección total de los 3 velos. El anillo pulmonar estaba indemne (fig. 2b). Se realizó la medición del anillo con los dilatadores de Hegar hasta el número 21, realizándose la comprobación transoperatoria del diámetro del añillo estimado en el preoperatorio. Se confeccionaron los 3 velos con pericardio autólogo, siguiendo la forma de medialuna de los velos pulmonares (fig. 1). La reconstrucción de la válvula pulmonar se inició por el velo anterior, considerando disponer la superficie serosa (mesotelial) del pericardio de cada cúspide hacia los respectivos senos. Primero se fijaron los neovelos a ambas comisuras con Prolene 4/0 y luego su implantación al anillo pulmonar con una línea sutura continua (fig. 3a). Esta técnica se reprodujo de la misma forma para la inserción de los velos de pericardio en el anillo correspondiente a los velos izquierdo y derecho (fig. 3b y c). El tiempo de parada cardiaca fue de 104 min y el de circulación extracorpórea de 139 min. La salida de la circulación extracorpórea y el postoperatorio inmediato transcurrieron sin problemas; el paciente fue extubado en las primeras horas y el ecocardiograma transtorácico realizado reportó buena función sistodiastólica de ambos ventrículos, la ausencia de cortocircuito residual y la presencia de insuficiencia pulmonar ligera. Dos semanas después, el paciente recibió el alta hospitalaria, con evidente mejoría clínica y hemodinámica. Ocho meses después de la cirugía, el paciente estaba asintomático (clase funcional 1 de la New York Heart Association Class) y en el ecocardiograma de control se informó de buena función de ambos ventrículos, cámaras cardiacas balanceadas, sin cortocircuito residual. En la figura 4 se muestra la apertura de la neoválvula (fig. 4a) con un gradiente sistólico pico transvalvular pulmonar de 22,4 mmHg (fig. 4b) y su cierre (fig. 4c y d), dejando ver una insuficiencia pulmonar ligera (área de jet regurgitante de 0,83 cm2) (fig. 4e).
a) Implantación de las neovalvas de pericardio autólogo al anillo pulmonar con una línea sutura continua. b) Muestra los puntos de fijación de los neovelos en las comisuras y los neosenos de Valsalva. c) Reconstrucción valvular pulmonar, con las 3 neovalvas de pericardio autólogo implantadas en sus posiciones anatómicas.
Resultados del ecocardiograma transtorácico postoperatorio realizado 6 meses después de efectuada la reconstrucción de la válvula pulmonar. a) Muestra la apertura de la neoválvula. b) Gradiente sistólico pico transvalvular pulmonar de 22,4 mmHg. c y d) Muestra el cierre de la neoválvula. e) Insuficiencia pulmonar ligera (área de jet regurgitante de 0,83 cm2).
La endocarditis sobre válvula pulmonar es poco frecuente y entre los factores predisponentes están las CC5. El paciente en estudio era portador de una CIV y se constató una celulitis a nivel del maléolo tibial derecho, que pudo haber hecho episodios de bacteriemia, que unidos a la turbulencia a través de la CIV, favorecieron la colonización de los gérmenes en la válvula pulmonar. Para la indicación quirúrgica en nuestro paciente tuvimos en cuenta el reinicio del proceso febril y la presencia de grandes vegetaciones en los velos pulmonares. El tratamiento quirúrgico indicado es el reemplazo valvular con válvulas biológicas. Las prótesis mecánicas son susceptibles a trombosis protésicas y otras variantes de disfunción, a lo que se suma la necesidad de anticoagulación de por vida. Los adolescentes también son más propensos a no cumplir el régimen de anticoagulación. Otras alternativas son los homoinjertos de válvula aórtica y pulmonar, con los inconvenientes de difícil obtención y ser propensos a la degeneración. La resección de los velos pulmonares enfermos, dejando transitoriamente al paciente sin válvula pulmonar para luego realizar la implantación transcatéter de una prótesis biológica, es otra alternativa posible6,7, con la que nosotros no contamos. Dejar a un paciente sin válvula pulmonar provoca una insuficiencia pulmonar severa con sobrecarga diastólica del ventrículo derecho, que a corto o mediano plazo producirá un deterioro de la función del ventricular derecho. Pero más grave aún son las conocidas repercusiones sobre el árbol vascular pulmonar, sobre todo las dilataciones del tronco de la arteria pulmonar y de sus ramas de primer y segundo orden, que comprimen y obstruyen el árbol traqueobronquial, lo que conduce al desarrollo de procesos sépticos respiratorios a repetición y al desarrollo de traqueomalacia y broncomalacia, que agravan el cuadro respiratorio de estos pacientes8,9. Por lo tanto, esta alternativa fue descartada por nuestro equipo de trabajo.
Son conocidas las reconstrucciones de la válvula aórtica con pericardio autólogo. Recientemente, fue publicado un artículo que reporta un total de 404 pacientes en los que fue posible la reconstrucción de la válvula aórtica, independientemente del tipo de valvulopatía aórtica, con buenos resultados a corto y mediano plazo10.
Nuestro equipo de trabajo ideó y realizó una creativa técnica quirúrgica, con la cual reconstruimos la válvula pulmonar con pericardio autólogo fresco, con buenos resultados postoperatorios. Para su uso tuvimos en cuenta que el paciente era portador de una EI activa, a la cual el pericardio es resistente, y además asumimos que los velos de pericardio pueden soportar las bajas presiones que se generan en las cavidades derechas. Se obtuvieron gradientes pulmonares ligeramente elevados, lo que se debe al mayor grosor de los neovalvas del pericardio y a las diferencias en la textura entre las valvas nativas y el pericardio autólogo. La regurgitación pulmonar ligera se atribuye a posibles defectos en la coaptación de las neovalvas pulmonares.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
ConclusiónLa reconstrucción de la válvula pulmonar con pericardio autólogo constituye una alternativa más para el reemplazo valvular pulmonar en pacientes con endocarditis activa cuando el reemplazo con válvulas biológicas no es posible.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.