El secuestro pulmonar es una malformación congénita poco frecuente, caracterizada por un segmento anormal de tejido broncopulmonar irrigado por una arteria aberrante de origen sistémico, proveniente en la mayoría de los casos de la aorta descendente y menos comúnmente del tronco celíaco. Queremos mostrar nuestra experiencia en el manejo quirúrgico de un paciente con secuestro pulmonar intralobar con suplencia arterial proveniente del tronco celíaco, junto a una revisión narrativa de la literatura.
ResultadoPresentamos un paciente de 24 años, sin antecedentes de importancia, con cuadro de una semana de evolución de síntomas respiratorios bajos, dolor pleurítico en el hemitórax izquierdo y fiebre subjetiva. Se inicia tratamiento antibiótico empírico por sospecha de neumonía por hallazgos en la radiografía de tórax, sin embargo, por un empeoramiento del cuadro clínico se realiza TAC de tórax contrastada que muestra neumonía necrosante de lóbulo inferior izquierdo. La reconstrucción tridimensional evidencia vasculatura supernumeraria proveniente del tronco celíaco que confluye a lóbulo inferior izquierdo. Cirugía de Tórax realiza toracotomía posterolateral izquierda con hallazgos que se correlacionan con imágenes diagnósticas. El procedimiento no presentó complicaciones y el seguimiento de 3 meses postoperatorio evidencia función pulmonar normal sin complicaciones.
ConclusionesEl secuestro pulmonar es una malformación congénita poco frecuente, con una clínica inespecífica, que debe sospecharse ante la presencia de neumonías recurrentes que no responden al manejo antibiótico habitual. La conducta quirúrgica es la más utilizada, sin embargo, se debe individualizar el caso para favorecer los resultados.
Pulmonary sequestration is a rare congenital malformation, characterised by an abnormal segment of bronchopulmonary tissue irrigated by an aberrant artery of systemic origin. In most cases it originates from the descending aorta and less commonly, from the coeliac trunk. A presentation is made of personal experience in the surgical management of a patient with intralobar pulmonary sequestration with arterial supply from the coeliac trunk, including a narrative review of the literature.
ResultsThe case is presented on a 24-year-old patient, with no relevant clinical history, with a history of low respiratory symptoms, pleuritic pain in left hemithorax and subjective fever of one week onset. Empirical antibiotic treatment is initiated due to suspicion of pneumonia and due to chest radiography findings. Owing to a worsening of the clinical state, it was decided to perform a chest CT scan with contrast, which showed necrotising pneumonia of the left lower lobe. Three-dimensional reconstruction shows supernumerary vasculature coming from the coeliac trunk that converges to the lower left lobe. The Thoracic Surgery Department performed a left posterolateral thoracotomy, with findings that correlate with diagnostic images. The procedure had no complications. The follow-up 3 months after surgery showed evidence of normal lung function without complications.
ConclusionsPulmonary sequestration is a rare congenital malformation, with a non-specific clinical symptoms, and should be suspected in the presence of recurrent pneumonia that does not respond to usual antibiotic management. The surgical approach is the most used, however, the patient must be selected in order to have a favourable outcome.
El secuestro pulmonar (SP) es una malformación congénita poco frecuente, caracterizada por un segmento anormal de tejido broncopulmonar irrigado por una arteria aberrante de origen sistémico, proveniente en la mayoría de los casos de la aorta descendente y, menos comúnmente, del tronco celíaco.
A pesar de ser una dolencia infrecuente con una clínica inespecífica, el cirujano debe sospecharla ante la presencia de neumonías recurrentes, dado que a pesar de ser inocua en algunos casos, en el momento del diagnóstico puede estar comprometida seriamente la vida del paciente.
Queremos mostrar nuestra experiencia en el manejo quirúrgico de un paciente con SP intralobar con suplencia arterial proveniente del tronco celíaco, junto a una revisión narrativa de la literatura.
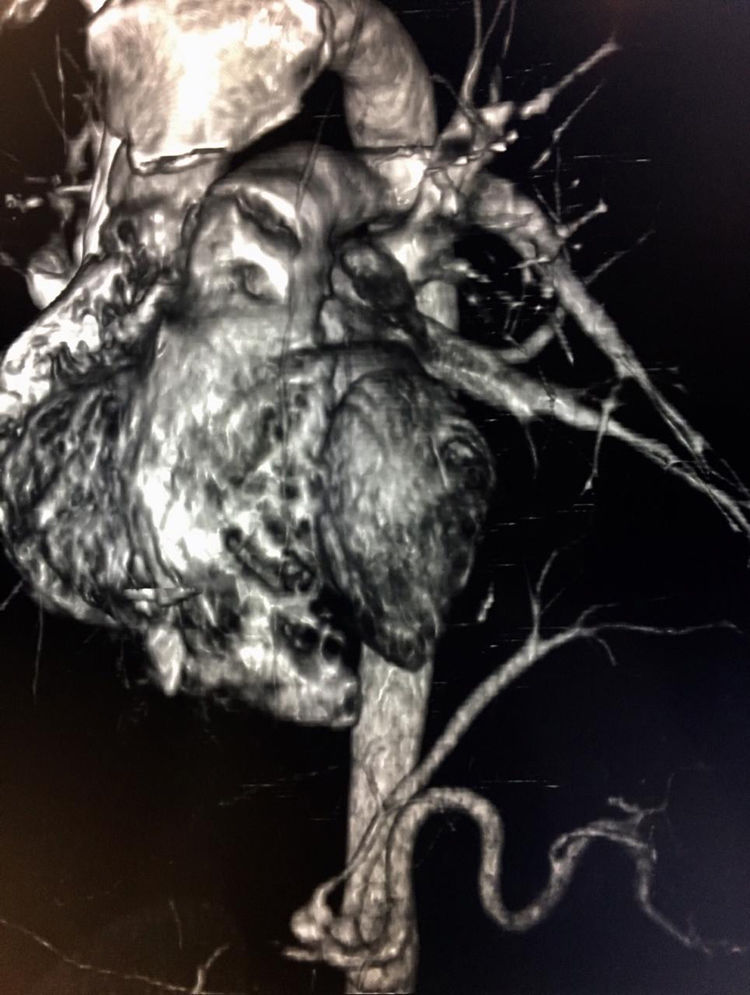
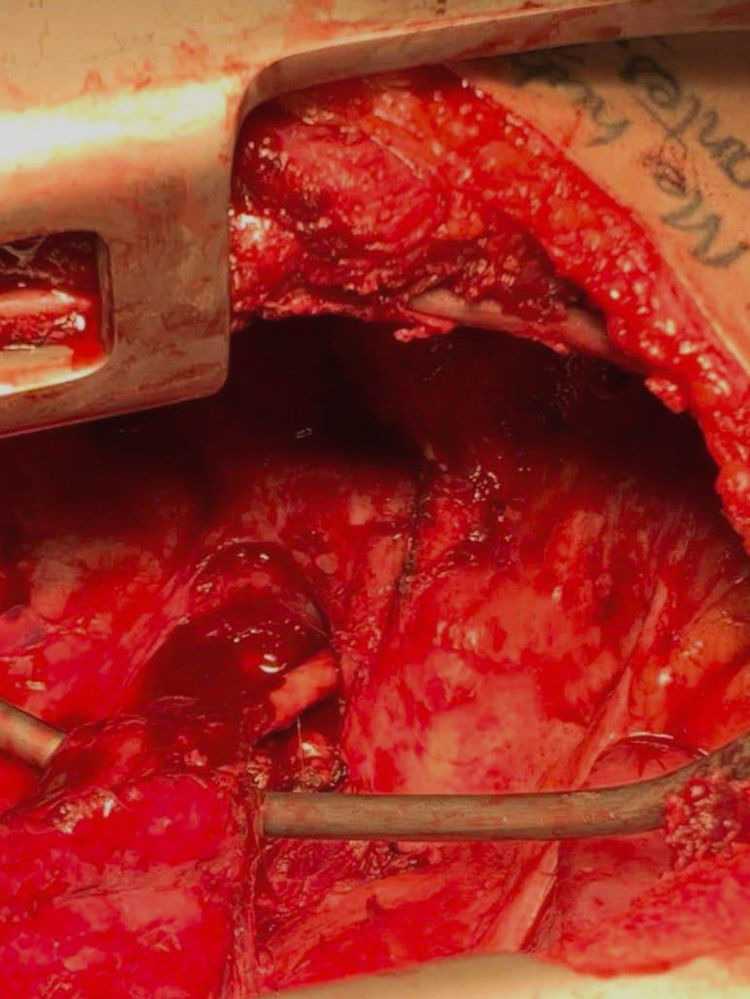
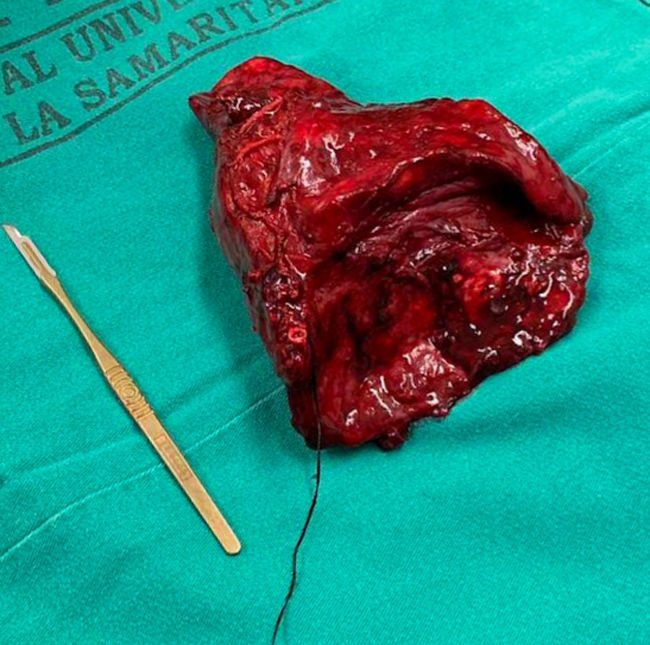
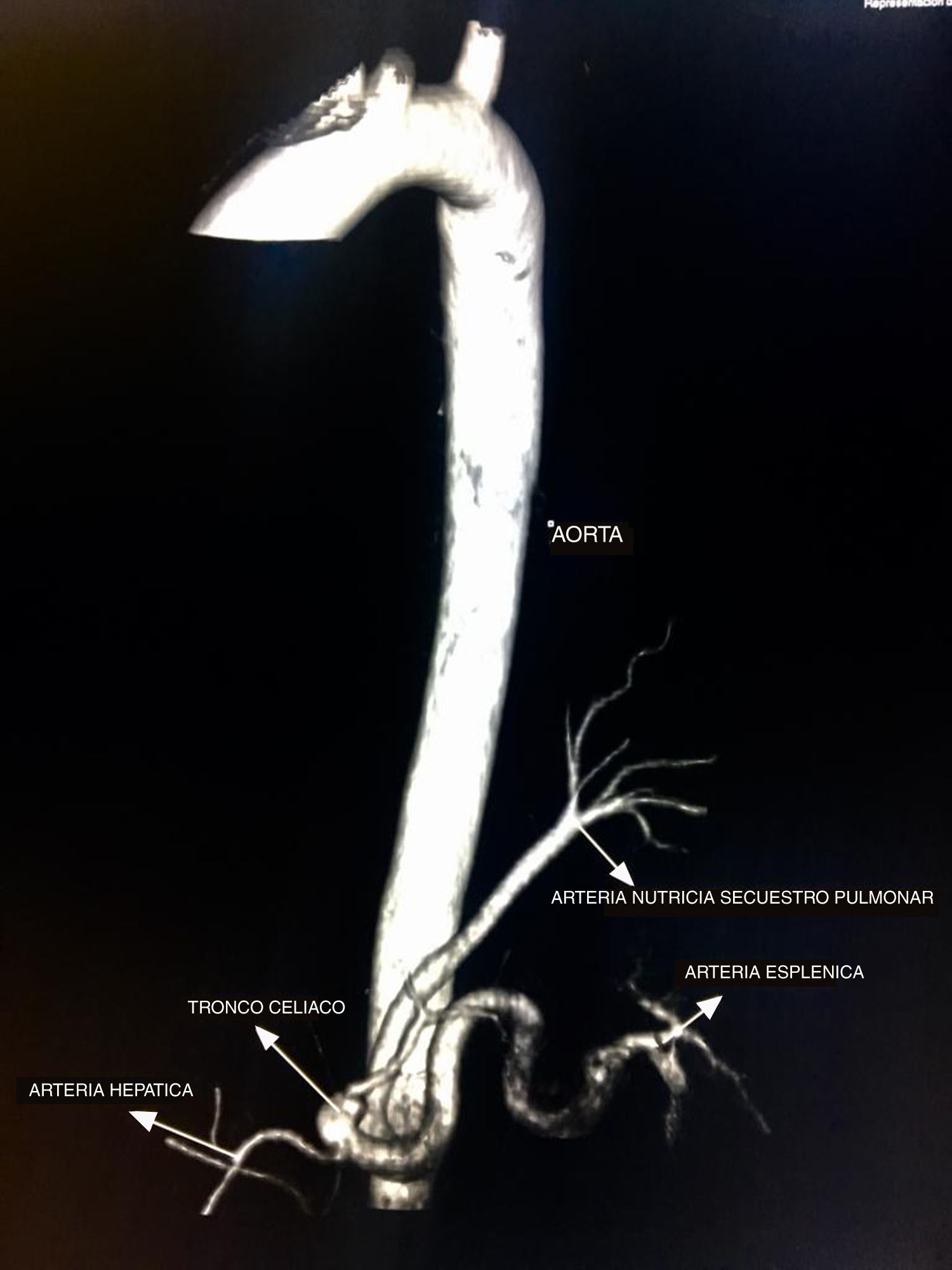
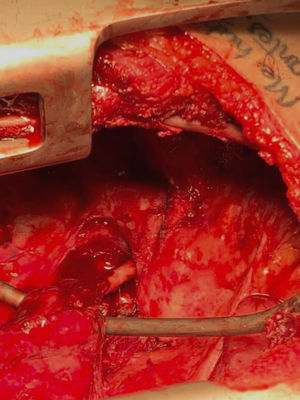
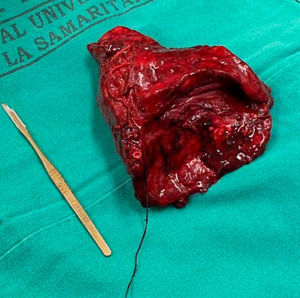
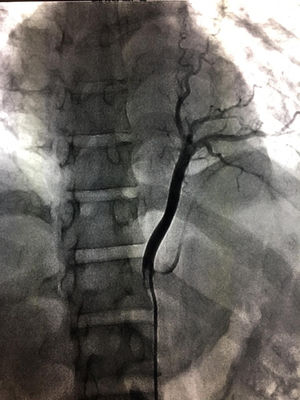
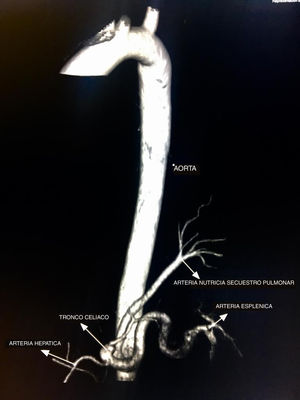
Caso clínicoPresentamos el caso de un paciente de 24 años de edad, sin antecedentes de importancia, quien ingresa a urgencias por cuadro de una semana de evolución de síntomas respiratorios bajos, dolor pleurítico en el hemitórax izquierdo y fiebre subjetiva. Se inicia tratamiento antibiótico empírico por sospecha de neumonía debido a los hallazgos en la radiografía de tórax; sin embargo, por un empeoramiento del cuadro clínico, se realiza tomografía axial computarizada (TAC) de tórax contrastada que muestra una neumonía necrosante del lóbulo inferior izquierdo. Se realizó reconstrucción tridimensional, evidenciándose vasculatura supernumeraria proveniente del tronco celíaco que confluye a lóbulo inferior izquierdo, como se observa en la imagen 1. Cirugía de Tórax realiza toracotomía posterolateral izquierda con hallazgos que se correlacionan con imágenes diagnósticas (imagen 2), resultando en lobectomía (imagen 3), procedimiento sin complicaciones, con un seguimiento de 4 meses postoperatorio con evidencia de función pulmonar normal, sin complicaciones.
El SP o broncopulmonar es una malformación congénita rara, que corresponde aproximadamente a entre un 1 y un 6% de las anormalidades congénitas y puede llegar a ser indetectable en el periodo prenatal, incluso en la niñez1,2. La SP no tiene un sexo predilecto de aparición, aunque algunos estudios han mostrado una relación hombre:mujer de 1,5:12,3.
El término SP fue utilizado por primera vez en el argot médico por Pryce en 19641. El SP resulta de un tejido pulmonar anormal, no funcionante, sin conexión con el árbol traqueobronquial, asociado a irrigación arterial anómala proveniente de la circulación sistémica que suele ser largo, irregular, con aterosclerosis prematura y suele provenir de la aorta torácica descendente, atravesando el ligamento pulmonar inferior ipsilateral1,2.
Existen 2 tipos: secuestro intralobar (SIL), el cual es el más común, con aproximadamente el 75% de los casos, como lo evidenciamos en nuestro paciente, donde la lesión nace de la capa de la pleura que rodea la porción del pulmón, y el secuestro extrapulmonar (SEL), que tiene su propio recubrimiento pleural y mantiene una anatomía completamente separada del tronco broncopulmonar1,2.
En los SIL el defecto es debido a una yema pulmonar que tiene vasculatura aberrante que inicia su desarrollo antes de la formación pleural, por eso el pulmón normal y el secuestrado están cubiertos por la misma pleura. En las SEL el desarrollo de la yema es posterior al desarrollo de la pleura, por lo que tiene distinto recubrimiento pleural2.
El diagnóstico del SP suele ser un reto debido a la heterogeneidad de los síntomas, razón por la cual la edad de diagnóstico de esta enfermedad puede ser tan variada como muestran Wey Y junto a Li F, quienes encontraron un rango de edad de diagnóstico entre un mes y 77 años4; sin embargo, más de la mitad de los casos de SIL son diagnosticados después de los 20 años. En el presente caso, nuestro paciente tenía 24 años en el momento del ingreso; así mismo, el diagnóstico después de los 40 años es raro y se ha identificado un máximo de 7 años entre la instauración de los síntomas y el diagnóstico3,5. En el caso de nuestro paciente la instauración rápida de complicaciones permitió una alta sospecha.
El SIL se caracteriza por neumonías bacterianas recurrentes del lóbulo comprometido durante la adolescencia y la adultez, aunque el síntoma principal es la tos o la expectoración (76%), la fiebre (38%), la hemoptisis (27%) y el dolor en el pecho (11%), entre otros1,3, clínica evidenciada por nuestro paciente. Por otra parte, pueden presentar hemotórax y falla cardiaca debida al shunt que genera la lesión. Solo el 15% de los pacientes con SIL viven asintomáticos y son diagnosticados incidentalmente2.
Pacientes con SEL pueden estar asintomáticos durante toda la vida y ser diagnosticados incidentalmente debido a la ausencia de cuadros infecciosos, pues no existe ninguna conexión con el árbol traqueobronquial1,2. Sin embargo, este tipo de secuestro es más fácil de diagnosticar por ultrasonido o resonancia magnética (RM) en periodo prenatal o neonatal. La aparición en este tipo de SP se da de 4:1 o 3:1 en series de reportes antenatales, así como se ha evidenciado su aparición en el hemitórax izquierdo en dos tercios de los casos reportados2. El SEL, además, puede ser difícil de diferenciar de tumores retroperitoneales, por lo cual requiere más pruebas como catecolaminas, cortisol, aldosterona y marcadores tumorales4.
La ultrasonografía es un método no invasivo, seguro y útil en la edad prenatal y posnatal, pero es muy inespecífico en la etapa antenatal y neonatal; además, tiene un valor limitado en los adultos, por lo cual se suele usar TAC o RM. En el caso de nuestro paciente, ante la ausencia de sospecha no se realizó ningún estudio perinatal3.
Los hallazgos imagenológicos asociados al cuadro clínico del paciente son claves para el diagnóstico del SP, sin embargo, varían entre el SIL y el SEL. La radiografía de tórax tiene 3 hallazgos típicos: 1) nódulo solitario o masa; 2) lesión quística o multiquística, y 3) consolidación, como en este caso, aunque también puede pasar que la única manifestación radiológica sea una figura tubular opaca que muestra una arteria aberrante. Aproximadamente en el 26% de los casos de SIL se observan niveles hidroaéreos causados por la fístula bronquial. El nivel hidroaéreo muestra inflamación crónica, pero no necesariamente infección activa2.
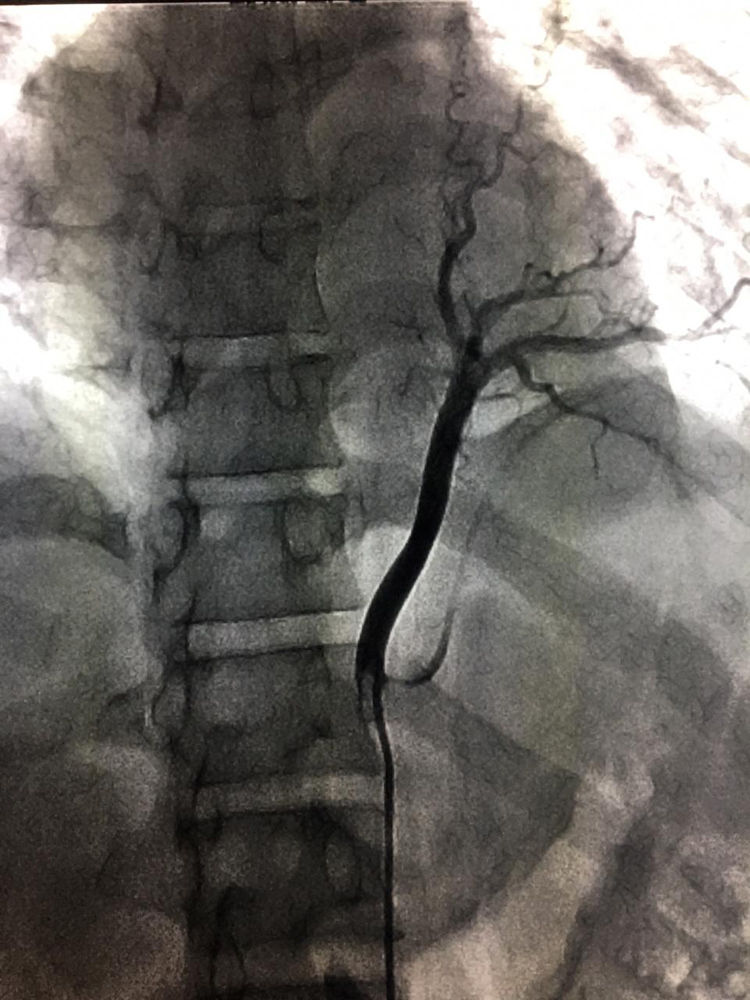
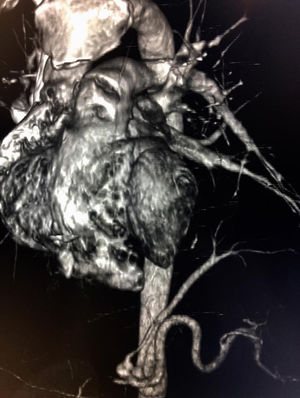
En la TAC el SIL se caracteriza por masas en espacio pulmonar (49%), consolidación con o sin quiste (28%), bronquiectasias y lesiones cavitarias (11%) o lesiones neumónicas, lo cual dificulta el diagnóstico, requiriendo en estos casos, como en nuestro paciente, apoyo de otro métodos imagenológicos3. La hiperlucidez puede ser observada en el secuestro intralobar debido a la entrada de aire proveniente del pulmón normal, quedando atrapada allí1. La masa observada es bien definida de forma piramidal, oval o redondeada en el espacio pleural cerca del espacio posteromedial del diafragma ipsilateral. No tan frecuentemente puede estar fuera del espacio pleural, en el mediastino incrustado en el diafragma o en el abdomen superior o el retroperitoneo2. En general, la TAC y la RM suelen ser suficientes para demostrar la existencia de una suplencia arterial externa, por lo cual no es necesario realizar una angiografía2. A pesar de esto, se recomienda estudio que evidencie claramente la topografía, para lo cual la sustracción por angiografía digital puede resultar muy útil o, como en el caso de nuestro paciente, reconstrucciones 3D que permiten evidenciar adecuadamente la anatomía, como se ve en las figuras 1 y 4; así como en el aortograma realizado que se ve en la imagen 5. Así mismo, el Doppler color puede evidenciar la suplencia arterial del SP que se encuentre cerca del diafragma o el hígado3,5.
La localización del SP puede variar entre el lóbulo inferior izquierdo (71%), el lóbulo inferior derecho (25%), el lóbulo superior izquierdo (1%) y por debajo del 1% podemos encontrar casos en la língula y el lóbulo medio derecho3,6.
La suplencia arterial en el SP proviene en el 74% de los casos de una única arteria supernumeraria proveniente de la aorta torácica, con un diámetro aproximado de 6,3mm1,2, aunque en la SIL se han encontrado múltiples arterias suplementarias2. En el estudio realizado por Wei y Li se encontró que de los 2.625 pacientes reportados, la suplencia arterial del SP provenía principalmente de la arteria torácica con un 76,55% de prevalencia, seguida por la aorta abdominal, con un 18%, la arteria intercostal, con un 1,99%, la diafragmática, con un 1,55%, y del arco aórtico, con un 0,44%. En un volumen menor encontraron reportes de casos provenientes de la arteria subclavia (solo 6 casos), de la pulmonar (5 casos), así como de la arteria gástrica izquierda (4 casos), con 2 casos de la coronaria y tan solo uno con suplencia proveniente del tronco celíaco, lo cual hace extremadamente raros los hallazgos en nuestro paciente3.
Los drenajes venosos del SP en el 90% de los casos van al sistema venoso pulmonar, especialmente los SIL, drenaje a la vena ácigos en el 4%, a la vena hemiácigos en el 3% o a la vena cava inferior3.
El SP está frecuentemente asociado a otras enfermedades que incluyen defectos cardiacos, hipoplasia pulmonar, duplicaciones císticas del intestino anterior, anomalías vertebrales o diafragmáticas como hernia diafragmática congénita, eventración o parálisis2,7. En estudios de extensión de nuestro paciente no se identificó ninguna otra anormalidad asociada.
A pesar de encontrarse múltiples LIS por ecografía prenatal, hay quienes afirman que esta entidad puede no ser congénita, sino adquirida tras múltiples cuadros de neumonía, en especial las infecciones lobares bajas o la inflamación crónica (típicamente bronquiectasias), que pueden resultar en una enfermedad quística del pulmón acompañada de una proliferación de arterias sistémicas (neovascularización) que entran al pulmón a través del ligamento pulmonar o a través de la pleura8. Estas anastomosis arteriales sistémico-pulmonares transpleurales se han visto en pacientes con fibrosis quística, neumonía crónica o tuberculosis, y están asociadas a fibrosis pleural y disminución del flujo arterial sanguíneo; sin embargo, las adquiridas presentan una conexión intacta con el árbol bronquial, así como una neovasculatura delgada, irregular y marcadamente diferente a la encontrada en las congénitas, estos son los llamados pseudosecuestros. Debido a la existencia de múltiples enfermedades que mimetizan el SP, la claridad de los hallazgos imagenológicos pueden diferenciarlo de dolencias con características similares, como se puede ver en la tabla 12.
Diagnósticos diferenciales según hallazgos imagenológicos
| Sin suplencia arterial sistémica | Con suplencia arterial sistémica | |
|---|---|---|
| Adquiridos | Congénitos | |
| Tumores primariosTumores metastásicosLesiones congénitasInfecciones | Hipertrofia de arterias sistémicas (arterias bronquiales) en respuesta a inflamación crónica:InfecciónObstrucción de arteria pulmonarTromboembolismo pulmonar crónicoArteritis de Takayasu | Arterias anómalas aberrantes secuestrantesSíndrome de pulmón hipogénicoSuplencia aislada de tejido pulmonar normal |
El tratamiento predilecto del SP es quirúrgico: lobectomía (imagen 2) por toracotomía abierta o toracoscópica videoasistida cuando el paciente es asintomático4,5, aunque en estos pacientes continúa debatiéndose el manejo, sobre todo en SEL asintomáticos donde los hallazgos son incidentales, poniendo en debate el requerimiento de un procedimiento quirúrgico debido a que es probable que el paciente continúe asintomático por el resto de su vida. En estos pacientes se recomienda monitorizar por TAC o RM cada 5 o 10 años. En pacientes con SIL sintomáticos se prefiere el manejo quirúrgico; en un estudio realizado por Alsumrain y Ryu se demostró una disminución en la sintomatología. Así mismo el SIL asintomático suele tratarse con una lobectomía parcial o completa para evitar el alto riesgo de infecciones o hemoptisis1,2, sin embargo, la decisión de un manejo quirúrgico debe incluir la valoración de las manifestaciones clínicas del SP, el riesgo de complicaciones posquirúrgicas, las comorbilidades y las preferencias individuales del paciente1,9.
Los métodos menos invasivos han ido disminuyendo las complicaciones quirúrgicas que se presentan en el 28% de los pacientes, entre las cuales encontramos fístula broncopulmonar con escape de aire, hemoptisis, empiema y arritmia; así mismo, la embolización percutánea de la suplencia arterial del secuestro ha sido realizada para prevenir el desarrollo de complicaciones hemorrágicas y para tratamiento definitivo, con diferentes tasas de resultado según el autor4,5,10. Sin embargo, por ahora son tecnologías con las que no contamos en nuestro centro de atención.
Alsumrain y Ryu identificaron que la principal causa de manejo quirúrgico fueron las infecciones respiratorias, como en el caso de nuestro paciente, en quien se encontraba comprometido su estado de salud, logrando disminuir las infecciones y la hemoptisis media posquirúrgica1,7.
ConclusionesEl SP es una malformación congénita poco frecuente, con una clínica inespecífica, que debe sospecharse ante la presencia de neumonías recurrentes que no responden al tratamiento antibiótico habitual. La conducta quirúrgica es la más utilizada, sin embargo, se debe individualizar para favorecer un óptimo resultado.
Consentimiento informadoLos autores declaran que disponen del consentimiento informado del paciente para la publicación de las imágenes clínicas en este artículo y que han preservado sus datos personales, siguiendo los protocolos de la institución.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.