Varón de 34 años con Síndrome de Marfan y Pectus Excavatum intervenido de aneurisma de aorta ascendente e insuficiencia aórtica mediante técnica de David I en 2007 que acude con insuficiencia mitral severa por rotura de cuerdas de velo anterior. Nuestro objetivo persigue demostrar que la toracotomía posterolateral izquierda es una alternativa factible en determinados casos seleccionados para el tratamiento de la patología de la válvula mitral.
MétodosDadas las características anatómicas del paciente y la cirugía cardíaca previa nos planteamos cual sería la mejor vía de abordaje para este caso. Tras revisiones bibliográficas y consultas a expertos nos inclinamos por la sustitución valvular mitral vía toracotomía posterolateral izquierda. Para ello tras toracotomía posterolateral izquierda y canulación a nivel de aorta torácica descendente y vena femoral común izquierda (Seldinger) se procede a entrada en circulación extracorpórea. Ante la imposibilidad de clampaje aórtico, se decide practicar la sustitución valvular mitral a corazón latiendo y con ambiente de CO2, para ello se practica atriotomía izquierda y utilizando varios aspiradores de recuperación se consigue una visión aceptable de la válvula mitral, decidiéndose sustitución de la misma ante las dificultades técnicas que conllevaría una reparación valvular.
ResultadosSe consiguió llevar a cabo el recambio mitral con buen resultado, comprobado por ecocardiografía transesofágica tras la cirugía.
ConclusionesLa toracotomía posterolateral izquierda puede ser una alternativa ante pacientes con patologías concomitantes que provoquen desplazamiento del corazón hacia el hemitórax izquierdo.
The case concerns a 34-year-old man with Marfan syndrome and Pectus Excavatum that has been previously operated on for an ascending aortic aneurysm and aortic regurgitation using the David I technique in 2007. The patient currently has severe mitral regurgitation due to rupture of the anterior chordae leaflet. The objective is to demonstrate that left posterolateral thoracotomy is a feasible alternative in certain selected cases for the treatment of mitral valve pathology.
MethodsGiven the anatomical characteristics of the patient, and previous cardiac surgery, posed the question of what would be the best approach for this case. After a review of the literature and expert consultations, it was decided to perform a mitral valve replacement via left posterolateral thoracotomy. To do this, after left posterolateral thoracotomy and cannulation at the level of the descending thoracic aorta and left common femoral vein (Seldinger), extracorporeal circulation was started. Given the impossibility of aortic clamping, it was decided to perform beating heart mitral valve replacement in a CO2 environment. To do this, a left atriotomy was performed and, using various recovery aspirators, an acceptable view of the mitral valve was achieved. I was decided to replace it, due to the technical difficulties that a valve repair would entail.
ResultsThe mitral replacement was successfully performed by transoesophageal echocardiography.
ConclusionsLeft posterolateral thoracotomy may be an alternative for patients with concomitant pathologies that cause displacement of the heart towards the left hemithorax.
El síndrome de Marfan se debe a una mutación de un gen del brazo largo del cromosoma 15 que codifica una glucoproteína compuesta por 2.871 aminoácidos, principal componente de las microfibrillas extracelulares llamada fibrilina-11. Se trata de uno de los trastornos hereditarios, con herencia generalmente autosómica dominante, más frecuentes2. Alrededor de 1/3.000-5.000 personas se verán afectos por esta enfermedad caracterizada fundamentalmente por una tríada de manifestaciones1,2: por un lado, se presentan cambios esqueléticos que pueden incluir entre otros, extremidades largas y delgadas con articulaciones laxas, pectus excavatum. Por otro lado, podemos tener una reducción visual a consecuencia de una subluxación del cristalino (ectopia lenticular). Por último, estos pacientes suelen presentar aneurismas aórticos de diversos grados1,2. Además, hasta un 25% presentaran una insuficiencia mitral severa a consecuencia de un prolapso valvular1,2.
Queremos presentar nuestra experiencia en el uso de la toracotomía posterolateral izquierda, una vía útil como alternativa en pacientes con patología valvular mitral, deformaciones de la caja torácica y para reintervenciones.
Material y métodosPresentamos el caso de un paciente de 34 años sin factores de riesgo cardiovascular con síndrome de Marfan ya intervenido en nuestro servicio 11 años antes debido a patología aneurismática de raíz aórtica que ocasionaba insuficiencia aórtica severa. En aquel momento ante los hallazgos en ecocardiografía transesofágica: DTDVI 60̊mm, aurícula izquierda normal, anillo aórtico 28̊mm, raíz aórtica con diámetro máximo de 72̊mm y borramiento de la unión sinotubular, déficit de coaptación central de los 3 velos aórticos y fracción de eyección del 50% se decidió entonces por una cirugía de preservación de válvula aórtica mediante reimplantación de raíz aórtica (David tipo I) para evitar recurrencia de la insuficiencia aórtica3,4. En el postoperatorio inmediato el paciente precisó implante de marcapasos definitivo DDD.
Siete años más tarde de la cirugía, se diagnostica de insuficiencia mitral, al menos moderada, por prolapso de velo anterior debido a rotura de cuerdas tendinosas. En ese momento, debido a la complejidad técnica que supondría la cirugía y el estado asintomático del paciente se decidió optar por una actitud conservadora.
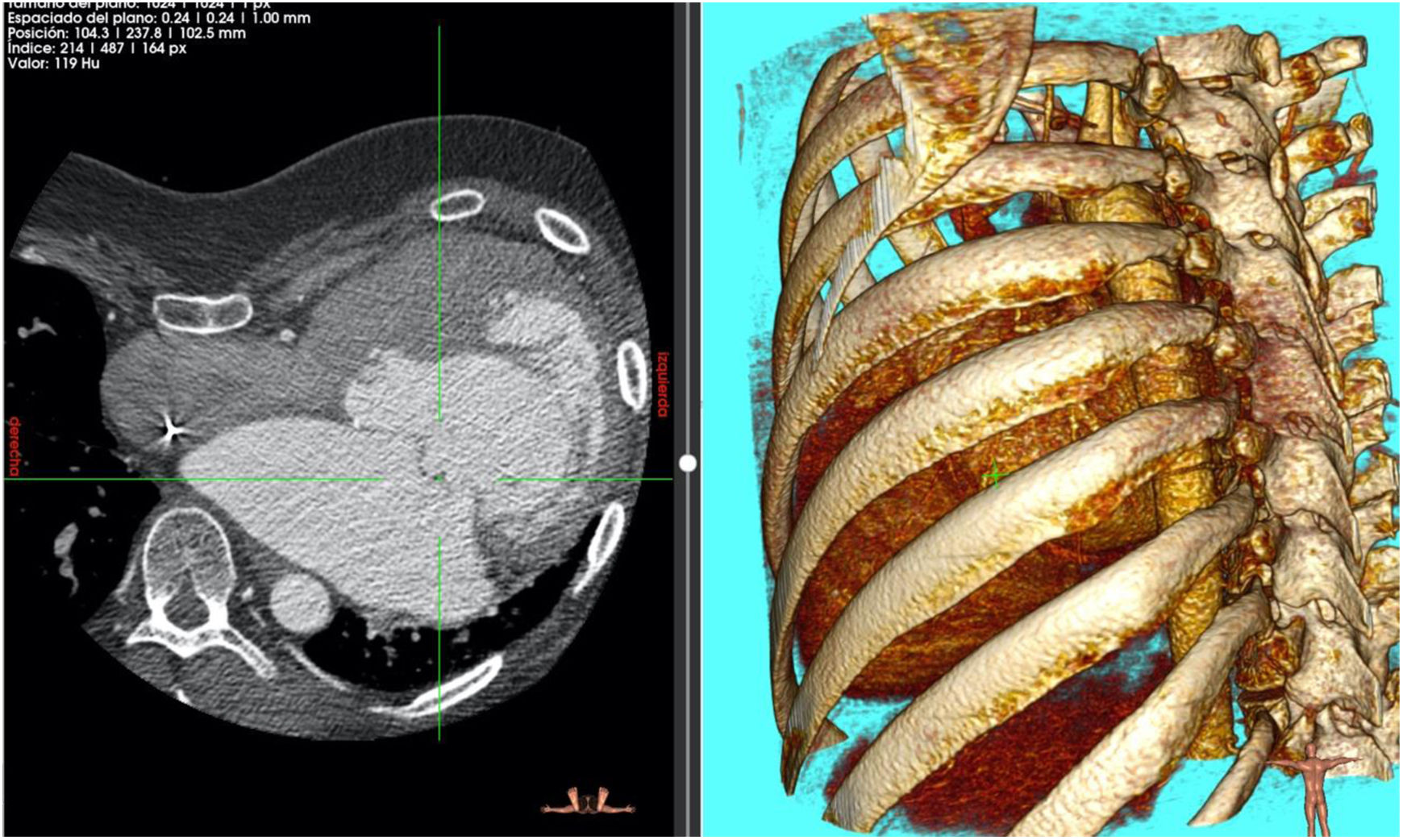
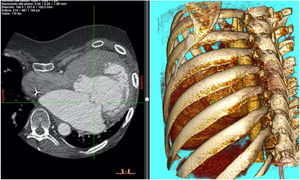
Pasados cuatro años del diagnóstico de insuficiencia mitral, el paciente ingresa en el hospital en insuficiencia cardíaca NYHA III-IV. Una nueva ecocardiografía transesofágica objetivó una insuficiencia mitral severa por prolapso de velo anterior (festón A1) con vena contracta de 7̊mm, PISA 11̊mm con velocidad de 55̊cm/s. Anillo mitral de 45̊×̊55̊mm. La válvula aórtica reparada presentó una regurgitación trivial, anillo aórtico de 24̊mm, senos de Valsalva de 29̊mm y fracción de eyección del 45%. En angioTAC se apreció un marcado pectus excavatum con desviación de todas las estructuras cardíacas hacia el hemitórax izquierdo, ocupando la aurícula izquierda gran parte de dicho hemitórax (fig. 1). Por todo ello y debido a las dificultades que presentaba el paciente se barajaron varias posibilidades quirúrgicas: cirugía mitral por toracotomía derecha, cirugía mitral por reesternotomía media y resolución en mismo tiempo del pectus excavatum y cirugía mitral por toracotomía posterolateral izquierda. Decidiéndonos por esta última tras una exhausta revisión de la bibliografía recogida hasta el momento.
Del mismo modo, ante la dificultad para el clampaje, decidimos realizar la cirugía a corazón latiendo. Para ello tuvimos que decidir entre varias opciones para prevenir embolismos aéreos. Barajamos varias posibilidades como el uso de endoclamp, uso de un fibrilador, o el mantenimiento durante la cirugía de una presión de perfusión lo suficientemente elevada como para mantener la válvula aórtica cerrada. Finalmente nos decantamos por esta última opción, al considerarla en nuestra experiencia el método más seguro.
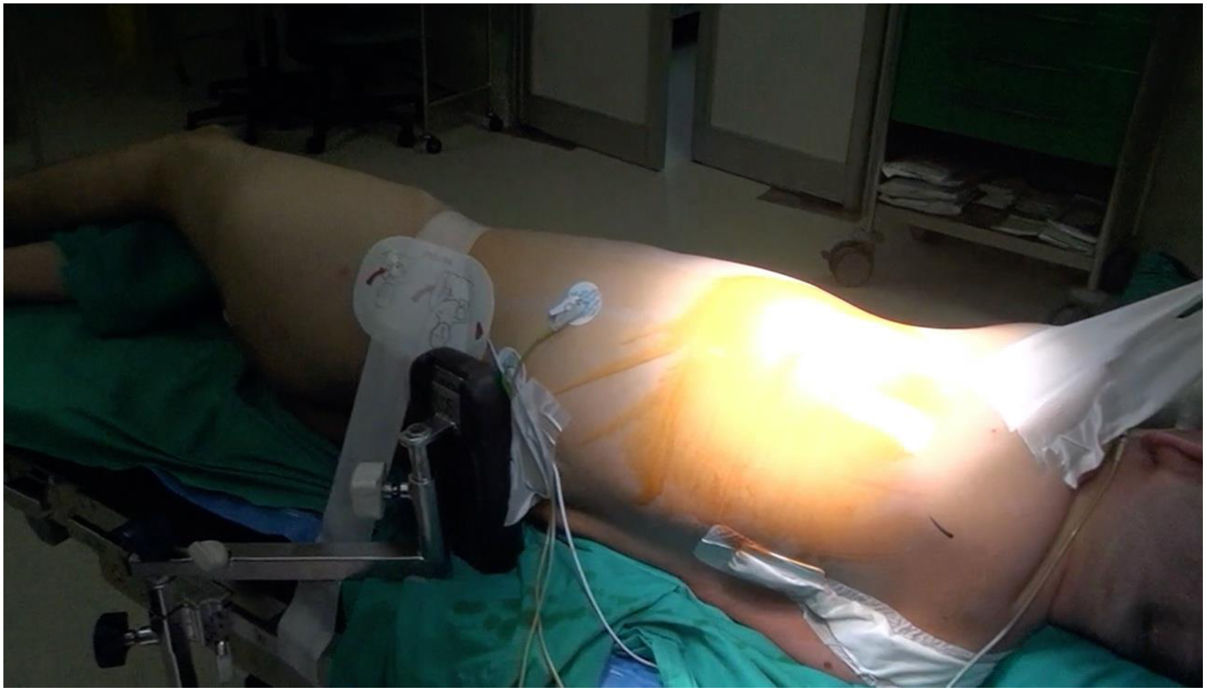
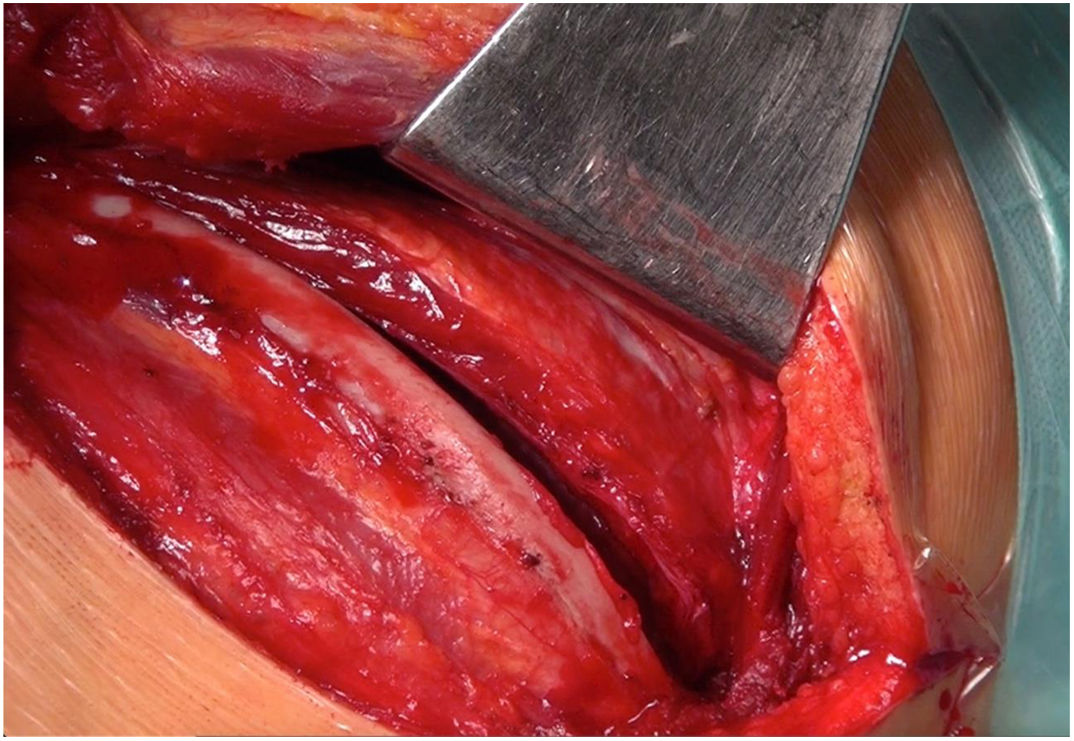
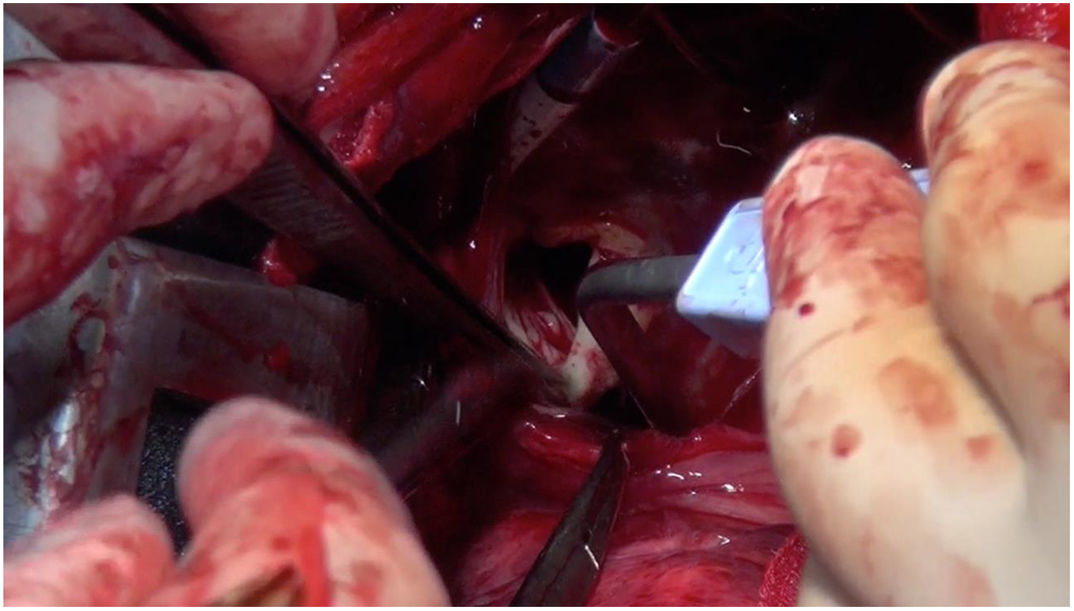
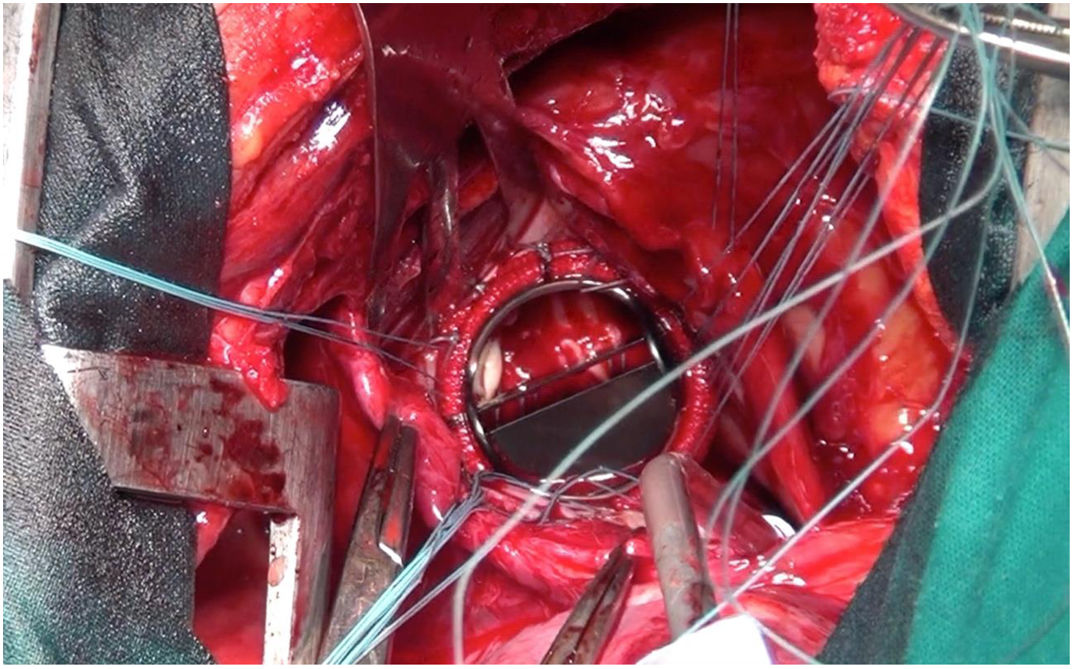
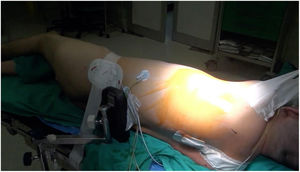
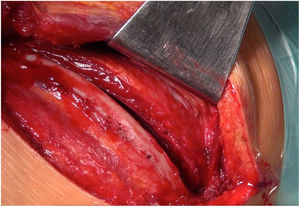
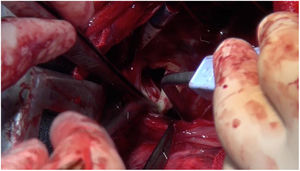
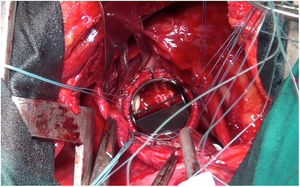
Técnica quirúrgicaCon el paciente en decúbito lateral derecho con la pelvis discretamente rotada hacia la izquierda (fig. 2), bajo anestesia general y epidural se procedió a toracotomía posterolateral izquierda a nivel del quinto espacio intercostal (fig. 3). Se practicó una apertura pericárdica anterior al nervio frénico y posteriormente, tras heparinización del paciente e instauración de circulación extracorpórea con canulación arterial a nivel de aorta torácica descendente y venosa a nivel de vena femoral común izquierda (mediante técnica de Seldinger) y a corazón latiendo, bajo ambiente de CO2, por imposibilidad de clampaje aórtico se procedió a atriotomía izquierda longitudinal para correcta exposición de la válvula mitral (fig. 4). Para evitar el paso de aire a través de la válvula aórtica, se mantuvo una presión de perfusión lo suficientemente alta durante la cirugía como para mantener la válvula cerrada. Debido a las dificultades técnicas del procedimiento, se precisó de varios aspiradores de recuperación para una correcta visualización, y no pudiendo asegurar una reparación 100% eficaz se optó directamente por el reemplazo valvular mitral por prótesis mecánica Master de SJM N°31 (fig. 5). Cierre de aurícula izquierda (durante el mismo, es recomendable la colocación de una sonda de Foley a través de los discos de la válvula, para así mantenerla abierta procurando que el contenido ventricular en cada latido pasa a la aurícula izquierda y no a la aorta, evitando así embolismos aéreos. Una vez cerrada la aurícula y tras eliminación del aire, se desinfla la sonda y se procede a su retirada y salida de circulación extracorpórea según protocolo habitual.
ResultadosLa sustitución valvular mitral se pudo llevar a cabo en un tiempo de circulación extracorpórea de 90 minutos, sin necesidad de parar el corazón y con muy buen resultado medido con ecocardiográfia tranesofágica en el quirófano. El paciente fue extubado en el quirófano y trasladado a la Unidad de Cuidados Intensivos donde tuvo un postoperatorio inmediato sin incidencias, siendo dado de alta del hospital a los 10 días de la intervención.
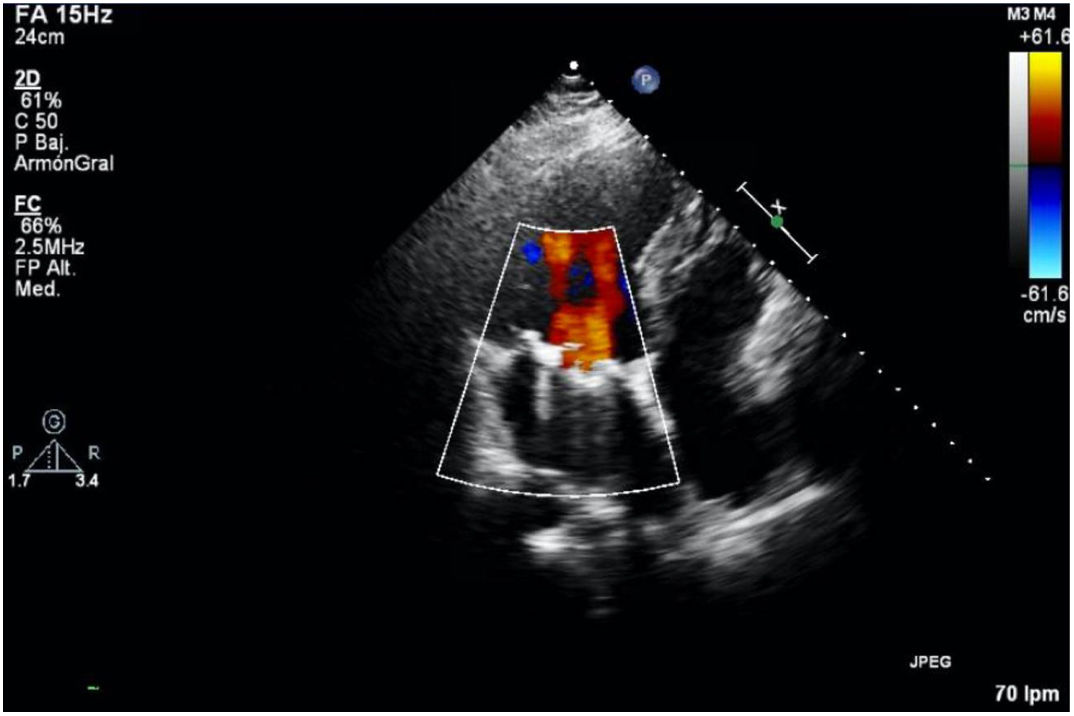
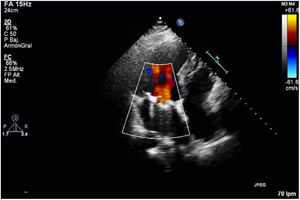
Actualmente, 20 meses tras la cirugía, el paciente se encuentra en perfecto estado, en clase funcional I de la NYHA con una última ecocardiografía en la que destaca un ventrículo izquierdo remodelado no dilatado con función sistólica deprimida, en grado ligero, por asincronía contráctil debido a estimulación continua del marcapasos. Aurícula izquierda moderadamente dilatada y ventrículo derecho no dilatado con función conservada. La prótesis mitral se encontraba normofuncionante (fig. 6), al igual que la válvula aórtica reimplantada, que presentaba insuficiencia trivial.
DiscusiónEl acceso por toracotomía posterolateral izquierda no es un acceso frecuente en cirugía cardiovascular, sobre todo a la hora de realizar cirugía valvular5 en el momento actual, ya que en los inicios de la cirugía cardíaca era la vía utilizada para realizar comisurotomías transventriculares. Sin embargo, puede ser una alternativa para pacientes con determinadas características especiales, como los pacientes con síndrome de Marfan y pectus excavatum e intervenciones cardíacas previas con cambios en la localización y orientación habitual de las estructuras cardíacas.
Según nuestra experiencia con este caso y en la línea de varios autores que han utilizado tanto la toracotomía anterior izquierda como la toracotomía posterolateral izquierda5-7 con buenos resultados, sabiendo que es poca la literatura, podríamos decir que nos encontramos ante una muy buena alternativa para casos concretos en los que no sería posible otra vía de abordaje más tradicional.
Una de las mayores series recogidas hasta la fecha, con 16 pacientes entre 2002 y 2007 sobre esta vía de abordaje a corazón latiendo, es la recogida por Suzuki et al.8. Consiguieron unos tiempos de cirugía de 221̊±̊51 minutos con unos tiempos de circulación extracorpórea de 71̊±̊27 minutos, con una extubación a las 10̊±̊7,7 horas y una estancia en Cuidados Intensivos y hospitalaria de 2,9̊±̊1,9 y 6,2 ̊±̊2,4 días, respectivamente.
Por todo ello y en la línea de los distintos casos publicados hasta la fecha, consideramos que tanto la vía de abordaje posterolateral izquierda como la realización de la cirugía a corazón latiendo es reproducible por cirujanos con amplio desarrollo en la cirugía cardiovascular, pudiendo garantizar más que buenos resultados. La individualización del acceso quirúrgico en cada caso, y sobre todo ante deformidades torácicas donde una angioTC preoperatoria es obligatoria, es imprescindible para obtener un buen resultado final.
ConclusionesLa toracotomía posterolateral izquierda puede ser una alternativa ante pacientes con patologías concomitantes que provoquen desplazamiento del corazón hacia el hemitórax izquierdo.
Consentimiento informadoLos autores declaran que obtuvieron el consentimiento informado del paciente para la publicación de este artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.