La realización del trasplante cardíaco en pacientes portadores de dispositivos de asistencia ventricular izquierda (DAVI) de larga duración presenta un desafío tanto a nivel quirúrgico como de manejo médico. Ante la falta de donantes, es cada vez mayor la realización de trasplantes en estas condiciones, por lo que es necesaria una planificación de todo el proceso comenzando desde el implante del dispositivo, lo que permitirá prever las posibles complicaciones y sus respectivas soluciones, obteniendo así los mejores resultados.
Describimos las pautas a tener en cuenta en la implantación del DAVI (accesos, localización y trayecto de injerto de salida y cable de alimentación, cierre), así como en la planificación y realización del trasplante, haciendo un breve comentario sobre 2 aspectos importantes desde el punto de vista de manejo hemodinámico frecuentes en estos casos.
Performing heart transplantation in patients with long-term ventricular assist devices (LVADs) is both a surgical and medical management challenge. Given the lack of donors, heart transplants under these conditions are increasing, so it is necessary to plan the entire process starting from the implantation of the device, which will allow to foresee possible complications and their respective solutions, thus obtaining best results.
We describe the guidelines to be taken into account in LVAD implantation (access, location and route of the outflow graft, driveline, closure), as well as in the planning and performance of the transplant, making a brief comment on two important aspects about the usual hemodynamic management in these cases.
Los dispositivos de asistencia ventricular izquierda (DAVI) de larga duración han evolucionado rápidamente en los últimos años. Diversos estudios han demostrado que gracias a ellos se ha logrado mejorar la calidad de vida y la supervivencia de los pacientes con insuficiencia cardíaca avanzada en lista de espera para trasplante1–3, lo que conlleva a un incremento notable en su utilización como puente a trasplante o como puente a candidatura4.
Esto supone el aumento de procedimientos de trasplante en pacientes portadores de DAVI.
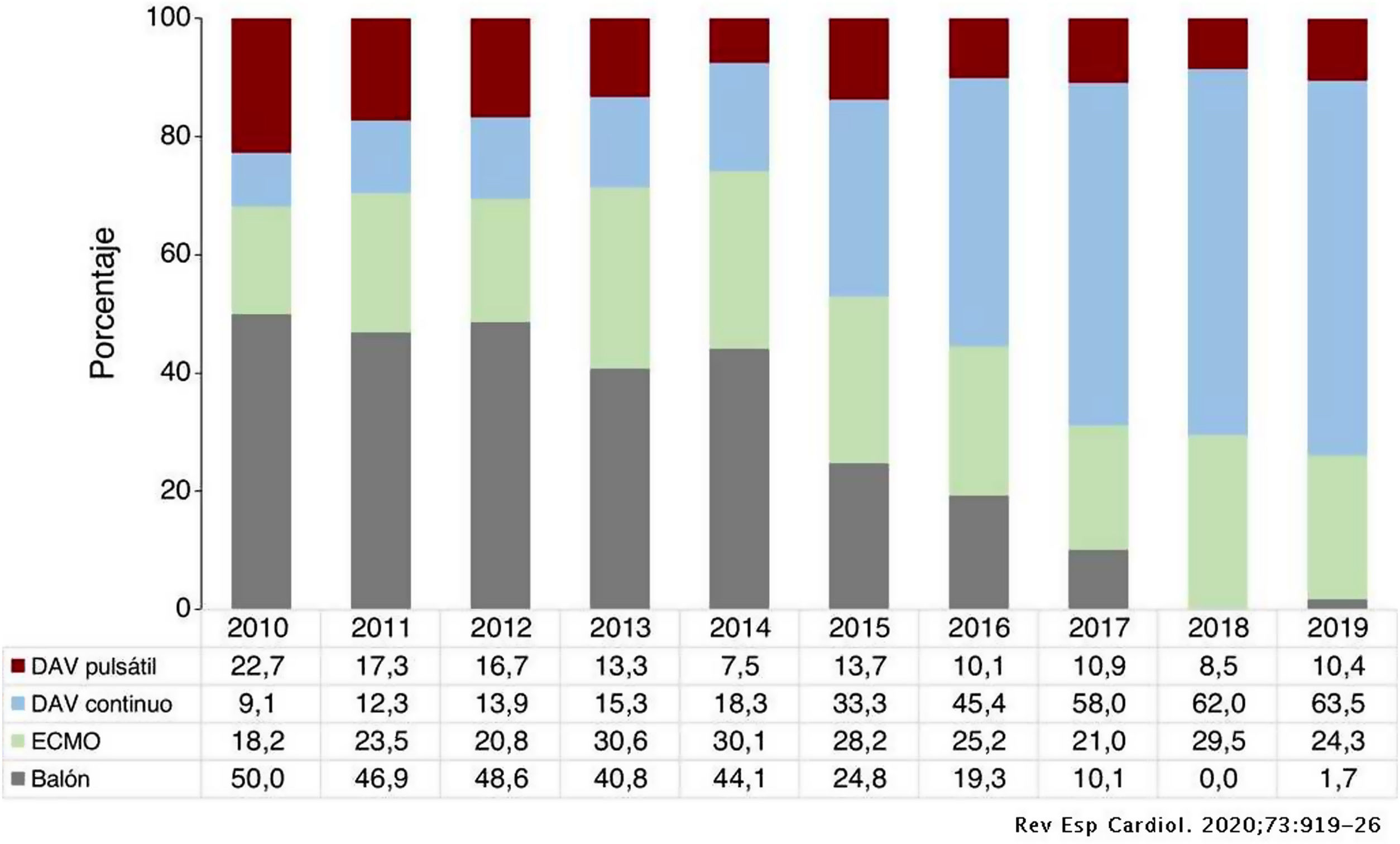
En España, es cada vez mayor el porcentaje de pacientes que llegan al trasplante asistidos mecánicamente con DAVI (fig. 1).
Distribución del tipo de asistencia circulatoria previa al trasplante por años (2010-2019). DAV: dispositivo de asistencia ventricular; ECMO: oxigenador extracorpóreo de membrana.
Fuente: Tomado del Registro Español de Trasplante Cardiaco. XXXI Informe Oficial de la Asociación de Insuficiencia Cardiaca de la Sociedad Española de Cardiología. Rev Esp Cardiol. 2020;73:919-926.
En el Hospital Universitario de Bellvitge, por ejemplo, entre 2015 y 2019 se realizaron un total de 110 cirugías de trasplante cardíaco, de las cuales 15 casos (13,6%) fue en pacientes portadores de DAVI, con una supervivencia del 100% al alta hospitalaria. Durante el seguimiento posterior solo hubo un fallecimiento en contexto neumonía bilateral por COVID-19, haciendo en total una supervivencia bruta del 94% con un seguimiento medio algo superior a 3 años, lo que muestra unos resultados muy equiparables e incluso algo superiores al trasplante convencional5.
El trasplante en este tipo de pacientes presenta ciertas condiciones que lo colocan en un nivel de dificultad quirúrgica y anestésica no rutinarias. Se describen tiempos quirúrgicos y tiempos de isquemia cardíaca más largos, mayor requerimiento transfusional, tiempos de intubación más prolongados y mayor estancia en unidad de críticos6–8. Sin embargo, no parece haber repercusión en la supervivencia post trasplante a corto y mediano plazo7,8, en parte debido a su realización en centros de alto volumen en este tipo de procedimientos complejos9.
A continuación recogeremos varios aspectos que consideramos importantes para minimizar las complicaciones y desarrollar este procedimiento con los mejores resultados posibles.
Estos consejos comienzan en el momento del implante del DAVI hasta la reanimación postquirúrgica del trasplante, por ello lo dividiremos en las siguientes fases:
- –
Implante DAVI
- –
Preparación pre trasplante
- –
Trasplante con DAVI
- –
Manejo hemodinámico
En el implante de DAVI a un paciente cuya indicación es el puente al trasplante o el puente a la candidatura debe tenerse muy presente que esta no será la cirugía definitiva, y que debemos preparar la futura reintervención de cara a minimizar el riesgo de daño del injerto de salida y del cable de alimentación. Para ello consideramos que es importante valorar los siguientes aspectos:
Canulación para circulación extracorpóreaSe ha de intentar realizar la canulación arterial en la aorta ascendente distal, lo suficientemente separado del lugar de la anastomosis del injerto de salida, pero sin disecar demasiado el arco aórtico pensando en la futura canulación en el momento del trasplante.
La canulación venosa es preferentemente única en aurícula derecha, salvo en pacientes en los que deban asociarse otros procedimientos que impliquen apertura de cavidades derechas (foramen oval permeable, comunicación interauricular o interventricular, anuloplastia tricuspídea), en los que se deberá realizar canulación bicava.
Cabe destacar que es posible realizar el procedimiento sin canulación para circulación extracorpórea (CEC), siendo incluso de elección en centros de gran volumen10, sin embargo, nosotros no lo recomendamos ya que requiere de gran experiencia por dificultar el manejo hemodinámico y hemorrágico, en un paciente lábil por definición.
Recorrido y anastomosis del injerto de salidaLa medición de la longitud del injerto de dacron de salida es importante porque determina la posición de éste durante el proceso de cicatrización. Un injerto demasiado corto conlleva a que cruce la línea media longitudinalmente durante gran parte de su recorrido, lo que lo hace más susceptible de ser dañado con el paso de la sierra durante la reintervención. Un injerto demasiado largo puede alejarse del esternón hacia cavidades derechas, alejándose de la línea media, pero pudiendo provocar problemas de acodamientos o rotaciones que comprometerían el flujo. La longitud ideal del injerto es aquella en que su trayecto vertical descansa sobre cavidades derechas a la derecha del esternón.
Se ha descrito un recorrido del injerto por el lado derecho del corazón, pasando por detrás de la vena cava superior (entre cava superior y arteria pulmonar derecha) hasta su anastomosis en la zona lateral de la aorta ascendente11. Nosotros discrepamos de los beneficios de esta localización, aunque sí creemos que realizar la anastomosis ligeramente sobre la zona lateral de la aorta puede disminuir el riesgo de lesión durante la reintervención12. Dicha anastomosis recomendamos hacerla en la porción inicial de la aorta ascendente, ya que ello facilitará explantarlo por completo en la cardiectomía en el momento del trasplante.
Recorrido del cable de alimentaciónExiste bibliografía que recomienda que el cable de alimentación, en su salida de la centrífuga, gire alrededor de ella para favorecer su salida de la cavidad pericárdica por el ángulo costofrénico izquierdo, pudiendo luego ser tunelizado hasta la locación deseada, alejándolo así del trayecto retroesternal12. En nuestro caso, hemos utilizado tanto este recorrido como también la salida a través del pericardio por el ángulo derecho, con la salvedad de dejar el cable lo suficientemente largo para que permanezca hacia la cara diafragmática, alejado del esternón.
Para disminuir la probabilidad de complicaciones por tracción involuntaria del cable en el postoperatorio, se recomienda su disposición abdominal en 2 tramos, uno inicial desde el pericardio hasta la zona subcostal derecha, y un segundo recorrido subcutáneo desde allí hasta el lado izquierdo (aproximadamente en la línea medioclavicular izquierda y algo por arriba de la línea umbilical).
Utilización de membranas de politetrafluoroetilenoLa utilización de este tipo de membranas para el cierre de pericardio ha sido ampliamente descrita para prevenir el daño de estructuras mediastínicas durante las reintervenciones en cirugía cardíaca13,14. En los casos de pacientes con DAVI, se menciona su utilización para recubrir tanto el injerto de salida como la bomba centrífuga, así como para el cierre de pericardio. Aunque la utilización de estas membranas no es una práctica generalizada a todos los equipos quirúrgicos, está descrito que podría facilitar los planos de disección entre las estructuras mediastínicas, el esternón y las diferentes partes del dispositivo, en una futura reintervención15,16.
En nuestro caso, solemos utilizar una membrana de politetrafluoroetileno (PTFE) para el cierre de pericardio anterior, fijada con puntos sueltos no reabsorbibles a ambos bordes laterales y hacia la cara diafragmática, recubriendo a la vez el injerto de salida y la cara anterior del corazón, lo que nos permite una protección de las estructuras durante la reintervención. Asimismo, en varias ocasiones también hemos recubierto la bomba centrífuga con una membrana de PTFE fijada con puntos sueltos no reabsorbibles al pericardio lateral, aislando el propio dispositivo de las diferentes estructuras adyacentes (membrana pleuropericárdica, nervio frénico, pulmón, pared costal).
Acceso mínimamente invasivoSe ha descrito el implante de DAVI mediante toracotomía lateral izquierda para la centrífuga, la tunelización intrapericárdica del injerto de salida hasta la zona de anastomosis en aorta ascendente, la cual puede realizarse por toracotomía anterolateral derecha o por miniesternotomía17–20, pudiendo realizarse sin CEC o con CEC por acceso femoral.
Se ha relacionado este acceso con disminución del tiempo de CEC, menor sangrado con la consecuente menor necesidad de transfusión (menos anticuerpos de cara al trasplante), disminución del tiempo de hospitalización total y en unidad de críticos, así como menos disfunción del ventrículo derecho18,20–22. Como puente al trasplante plantea un beneficio adicional al facilitar la reintervención por menor cantidad de adherencias hacia el esternón.
También es una opción en los casos de pacientes previamente operados portadores de injertos coronarios, ya que no sería necesaria la disección de los mismos, pudiendo pasar el injerto de salida a través de la cavidad pleural izquierda hasta la aorta ascendente (miniesternotomía).
Nuestra experiencia con este acceso es limitada pero positiva hasta el momento.
Preparación pretrasplantePrevio a su inclusión en lista de espera para trasplante, el portador de DAVI debe ser sometido a pruebas que ayuden a la planificación del mismo.
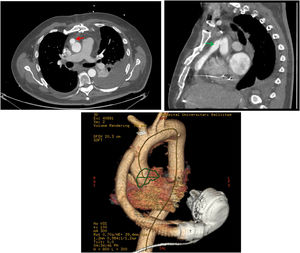
De cara a la cirugía, la realización de una tomografía tóraco-abdominal con contraste resulta indispensable, tanto para saber la localización y trayecto del cable de alimentación y del injerto de salida y su zona de anastomosis en aorta ascendente (fig. 2), así como la distancia y relación que guardan con las estructuras adyacentes: esternón, pulmones, tronco venoso innominado, etc.12.
Tomografía torácica con contraste en paciente portador de DAVI. A la izquierda en un corte axial, la flecha roja muestra el injerto de salida en la zona de anastomosis en la aorta ascendente. A la derecha en un corte sagital, la flecha verde muestra el recorrido longitudinal del injerto de salida en relación con el esternón. Debajo se muestra la reconstrucción en 3D del mismo paciente.
También nos sirve para el estudio de los posibles accesos vasculares en caso de necesitar una canulación periférica: vasos femorales y axilares.
Es importante anotar que es posible que algunos de estos pacientes hayan sido portadores previamente de otro tipo de asistencia de corta duración como una ECMO, por lo que la valoración de los vasos femorales es mandatoria.
Trasplante con dispositivo de asistencia ventricular izquierdaLas pautas para la realización de una cirugía de trasplante cardíaco en un paciente portador de DAVI serían inicialmente las habituales a cualquier trasplante en una reintervención: revertir anticoagulación oral, colocación de palas externas de desfibrilación, marcar localización de vasos femorales, desactivación del desfibrilador interno (DAI), utilización de sierra oscilante, etc.
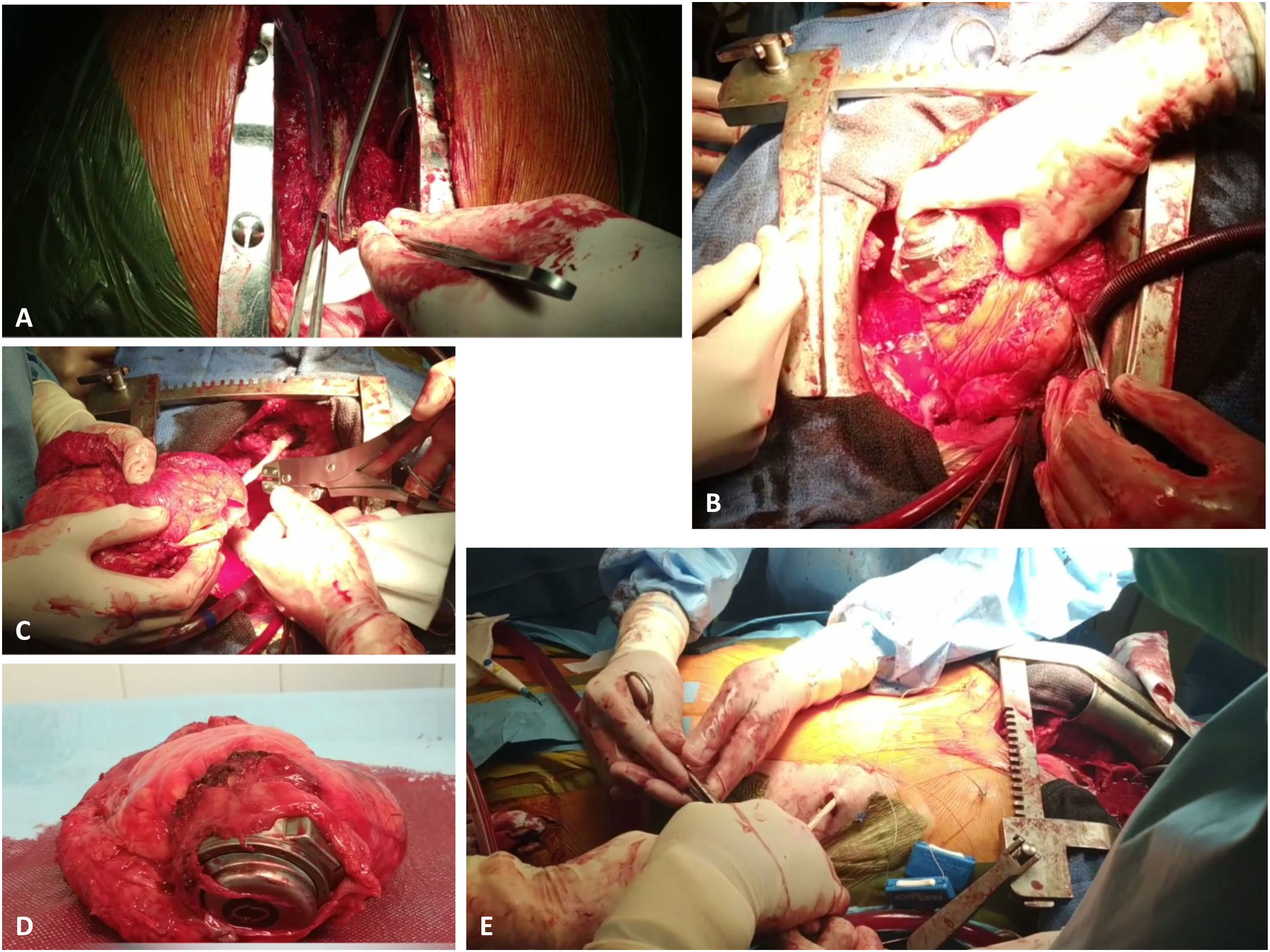
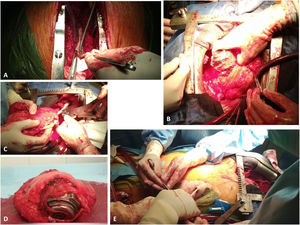
En el caso de portadores de DAVI se plantean algunas particularidades que se mencionarán a continuación. El cálculo del tiempo de preparación y disección para el explante del DAVI no debe subestimarse, ya que presenta desafíos respecto a un trasplante convencional (fig. 3):
- -
Es importante preparar la zona abdominal que permita la retirada del cable de alimentación una vez finalizado el implante del órgano y revertida la heparina.
- -
Una vez abierta la cavidad pericárdica es imprescindible la localización del injerto de salida para seguir su trayectoria hasta su inserción en la aorta, liberando las adherencias tanto de la aorta como de las cavidades derechas para realizar la canulación. Existe bibliografía que recomienda tener la ingle abierta con los vasos femorales expuestos antes de realizar esta maniobra12, sin embargo, nosotros solo la recomendamos en caso de ser la primera vez que se realiza este procedimiento o al prever complicaciones por los hallazgos de las pruebas preoperatorias.
- -
Es posible, en caso de necesidad, canular la aorta provisionalmente a través del injerto de salida utilizando una cánula arterial de 24 Fr. Para esto es imprescindible recordar parar el funcionamiento del DAVI y clampar el injerto de salida proximalmente al punto escogido para la canulación12.
- -
La liberación de la bomba y del lado izquierdo del corazón de recomienda realizarla una vez iniciada la CEC: primero se detiene el DAVI, luego se clampa y secciona el injerto de salida, y finalmente se libera la centrífuga de la cápsula que lo rodea preferiblemente utilizando el bisturí eléctrico. Durante este paso es importante no lesionar el nervio frénico izquierdo.
- -
Es mejor realizar el clampaje aórtico en el receptor solo cuando el órgano donante se encuentre ya en las instalaciones del hospital.
- -
La cardiectomía no difiere de la convencional salvo en lo que se refiere a la aortotomía, la cual debe realizarse preferiblemente por encima de la anastomosis del injerto de salida. En ocasiones la aorta ascendente no es lo suficientemente larga para permitirlo, por lo que la alternativa es dejar la zona de la anastomosis con el injerto de salida ligado en el receptor.
- -
El cable de alimentación se secciona durante la cardiectomía. Una vez liberadas todas las estructuras, se procede a traccionarlo todo lo posible dentro de la cavidad pericárdica y cortarlo, dejando el remanente abandonado en el abdomen hasta el final del trasplante.
- -
La porción abdominal del cable de alimentación se realiza por tracción en tramos rectos, ya sea uno solo si sale directamente por la pared abdominal, o haciendo una pequeña incisión en la zona donde realiza la angulación a nivel subcostal derecho si es que su recorrido es en 2 tramos. Algunos autores describen la realización de este paso con el tórax cerrado12, sin embargo, nosotros recomendamos hacerlo con la heparina revertida pero antes de cerrar el tórax, porque permite la revisión de la hemostasia en la totalidad de su trayecto (incluyendo la entrada en cavidad pericárdica).
Trasplante con DAVI. A) La imagen muestra la apertura de la membrana de PTFE tras realizar la esternotomía y su apertura siguiendo la trayectoria del injerto de salida. B) La imagen muestra la liberación de la bomba una vez en circulación extracorpórea. C) La imagen muestra la tracción y sección del cable de alimentación una vez realizada la cardiectomía. D) La imagen muestra el corazón extraído con la bomba en ápex de ventrículo izquierdo parcialmente liberada de su cápsula. La figura E muestra la extracción del cable de alimentación por tracción en tramos rectos, una vez revertida la heparina, pero con el tórax aún abierto para permitir revisión de la hemostasia.
En este aspecto, la experiencia y manejo del anestesista, así como su pericia con la ecocardiografía transesofágica, son cruciales para un buen desenlace. Sin embargo, no hay que infravalorar el aporte desde el punto de vista del cirujano.
Existen 2 aspectos diferenciales en este tipo de cirugía:
El sangrado intra y postoperatorioPor tratarse de reintervenciones durante el primer año y de pacientes anticoagulados hasta el momento de la cirugía los problemas hemorrágicos pueden ser de gran severidad. Los dispositivos de flujo continuo se han asociado además con disfunción plaquetaria y con déficit de factor de von Willebrand23–26. Se recomienda ser muy activo en la reposición de factores de coagulación, plaquetas y concentrados de hematíes. No es infrecuente la necesidad de revisión quirúrgica en estos casos.
VasodilataciónVarios estudios han asociado el uso de dispositivos de flujo continuo como predictor independiente de vasoplejía postrasplante27–30. Se han planteado diversas causas de esta vasoplejía en este tipo de pacientes, entre ellas la disminución del tono vasomotor por ausencia de pulsatilidad31, posible liberación de antígenos bacterianos en el momento del explante en pacientes con historia de infecciones recurrentes del cable de alimentación32, respuesta inflamatoria provocada por la cirugía y circulación extracorpórea prolongadas33, traduciéndose todo ello en una situación de vasodilatación en ocasiones refractaria a altas dosis de vasoconstrictor. Ello puede implicar la imposibilidad de mantener presión arterial media necesaria para una perfusión adecuada del injerto y del resto de órganos, necesitando incrementar dosis de inotropo. Si para mantener una situación hemodinámica adecuada se requieren dosis elevadas de vasoconstrictor e inotropos es preferible el soporte mecánico circulatorio con ECMO precoz, lo que permitirá reducir las dosis de fármacos dejando «reposar» el injerto. La recuperación del tono vasomotor y de la contractilidad se suele recuperar durante la primera semana32.
ComentariosEl uso de DAVI como puente a trasplante o candidatura se presenta como una alternativa segura ante la falta de donantes, permitiendo la mejoría clínica y funcional del paciente mientras se encuentra en lista de espera y llegando en mejores condiciones al trasplante2,3. La realización del trasplante en este tipo de pacientes representa un reto de manejo quirúrgico y hemodinámico en el pre, intra y postoperatorio, destacando los mejores resultados cuando se realiza en centros de mayor volumen9. En España, el gran número de centros donde se realiza el trasplante cardíaco (19 en total), dificulta ganar experiencia en estos procedimientos de mayor complejidad.
Consideraciones éticasEl Comité de Ética del Hospital Universitario de Bellvitge ha acordado otorgar la aprobación para la publicación del presente manuscrito y ha evaluado y aceptado los motivos para la exención del consentimiento informado en el marco del presente proyecto.
Comité de éticaEl presente manuscrito ha sido revisado por el Comité de Ética de la Investigación del Hospital Universitari de Bellvitge, mediante el procedimiento rápido de evaluación de la documentación contemplado en sus Procedimientos Normalizados de Trabajo (esta aprobación constará en el Acta 20/21 de fecha 18/11/2021), tras examinar toda la documentación presentada sobre el manuscrito con nuestra Ref. PR405/21, titulado: Trasplante cardíaco en pacientes portadores de asistencia ventricular de larga duración: «tips and tricks»
Presentado por la Dra. Karina Osorio Higa, del Servicio de Cirugía Cardíaca del Hospital Universitari de Bellvitge, el comité ha acordado otorgar la aprobación para su publicación.
Conflicto de interesesKarina Osorio-Higa. No tiene conflicto de intereses.
Daniel Ortiz-Berbel. No tiene conflicto de intereses.
Albert Miralles-Cassina. Consultor para Abbott.