La vía clínica de recuperación intensificada en cirugía cardiaca (RICC) pretende identificar, difundir y favorecer la implementación de las mejores actuaciones basadas en la evidencia científica para disminuir la variabilidad en la práctica clínica. La puesta en marcha de estas prácticas en el proceso clínico global favorecerá la obtención de mejores resultados, acortamiento de estancias hospitalarias y en la Unidad de Cuidados Críticos, lo que permitirá una reducción de costes y una mayor eficiencia. Tras realizar una revisión sistemática en cada uno de los puntos del proceso perioperatorio en cirugía cardiaca, se han redactado recomendaciones basadas en la mejor evidencia científica disponible en la actualidad con el consenso de las sociedades científicas implicadas.
The ERAS guidelines are intended to identify, disseminate and promote the implementation of the best, scientific evidence-based actions to decrease variability in clinical practice. The implementation of these practices in the global clinical process will promote better outcomes and the shortening of hospital and critical care unit stays, thereby resulting in a reduction in costs and in greater efficiency. After completing a systematic review at each of the points of the perioperative process in cardiac surgery, recommendations have been developed based on the best scientific evidence currently available with the consensus of the scientific societies involved.
En los últimos años, la aplicación de los programas de recuperación intensificada en las áreas quirúrgicas, también denominada en inglés fast-track surgery o enhanced recovery after surgery (ERAS), han sido los protagonistas de cambios radicales en el manejo de los pacientes. Estos programas sistematizan la aplicación de un paquete de medidas y estrategias perioperatorias destinadas a aquellos pacientes que van a ser sometidos a un procedimiento quirúrgico. Su objetivo es disminuir el estrés secundario originado por la intervención quirúrgica, propiciando una mejor recuperación del paciente, disminuyendo significativamente las complicaciones y la mortalidad. Se realiza un cambio drástico en el planteamiento del circuito asistencial, pasando a ser el paciente y la familia los protagonistas del proceso quirúrgico.
El concepto de fast-track comenzó con la cirugía cardiaca a través de varios trabajos de cirujanos como Engelman1, Krohn2 o Westaby3 en los años ochenta y noventa, pero se limitaba a intentar acortar tiempos de estancia en Unidad Críticos (UC) y hospitalaria. Kehlet4 en 1997, basándose en los conceptos de fast-track, introduce conceptos multidisciplinares y de una asistencia más integral para los pacientes en el área de la cirugía coloproctológica. Desde ese momento es cuando se produce el gran cambio a nivel global, con una expansión exponencial de centros que ponen en práctica este tipo de principios y programas.
En el campo de la coloproctología, este tipo de programa está demostrando excelentes resultados5 y el resto de las especialidades quirúrgicas han ido incorporándose a esta nueva dinámica de forma constante y progresiva.
La población de pacientes de cirugía cardiaca presenta peculiaridades únicas que hacen complicada su aplicación y que no se pueden desarrollar como una simple copia de los existentes para otras especialidades quirúrgicas. La población de pacientes de cirugía cardiaca ha evolucionado en los últimos años hacia el aumento de las comorbilidades médicas y un aumento de los procedimientos realizables. A esto se ha de añadir consideraciones específicas del perioperatorio, como son la necesidad de realización de la circulación extracorpórea (CEC), la frecuencia elevada de arritmias, la alta necesidad de transfusión de productos sanguíneos y la imprescindible participación de la UC.
El presente proyecto ha surgido como una colaboración entre las diversas sociedades científicas implicadas en el proceso asistencial del paciente, mediante un enfoque multimodal, multidisciplinar, apoyado en la evidencia científica, y con el objetivo de realizar recomendaciones de optimización de la asistencia, que en su conjunto lleven al desarrollo de una vía clínica de recuperación intensificada en cirugía cardiaca (RICC).
El proyecto se inició a finales de 2018 y debido a su complejidad, se ha extendido en el tiempo hasta principios de 2020, cuando nos encontrábamos en el proceso final de compilación y revisión global del documento. Ante la irrupción de la pandemia por SARS-CoV-2 no consideramos que se tengan que realizar modificaciones sustanciales en nuestras recomendaciones. Si bien, en el momento actual, ante la perspectiva de una «normalidad COVID», quizás sea de mayor importancia el desarrollo de este tipo de programas con el fin de alcanzar la máxima eficiencia y poder contribuir al ahorro de estancias en UC y hospitalaria.
ObjetivosRealizar recomendaciones basadas en la evidencia científica y el consenso de las sociedades científicas involucradas para impulsar el desarrollo de programas RICC.
Intentar homogenizar los cuidados perioperatorios de los pacientes adaptados a las pautas de la vía clínica RICC.
MetodologíaSe consensuaron los diferentes puntos del cuidado perioperatorio del paciente a incluir en la presente vía clínica entre todos los componentes del grupo de trabajo.
Se dividió el trabajo en grupos de 2/3 investigadores. Para cada punto se realizó una revisión sistemática de la literatura científica mediante Pubmed, Embase y Cochrane Library, apoyándose en las diferentes Guías de Práctica Clínicas publicadas.
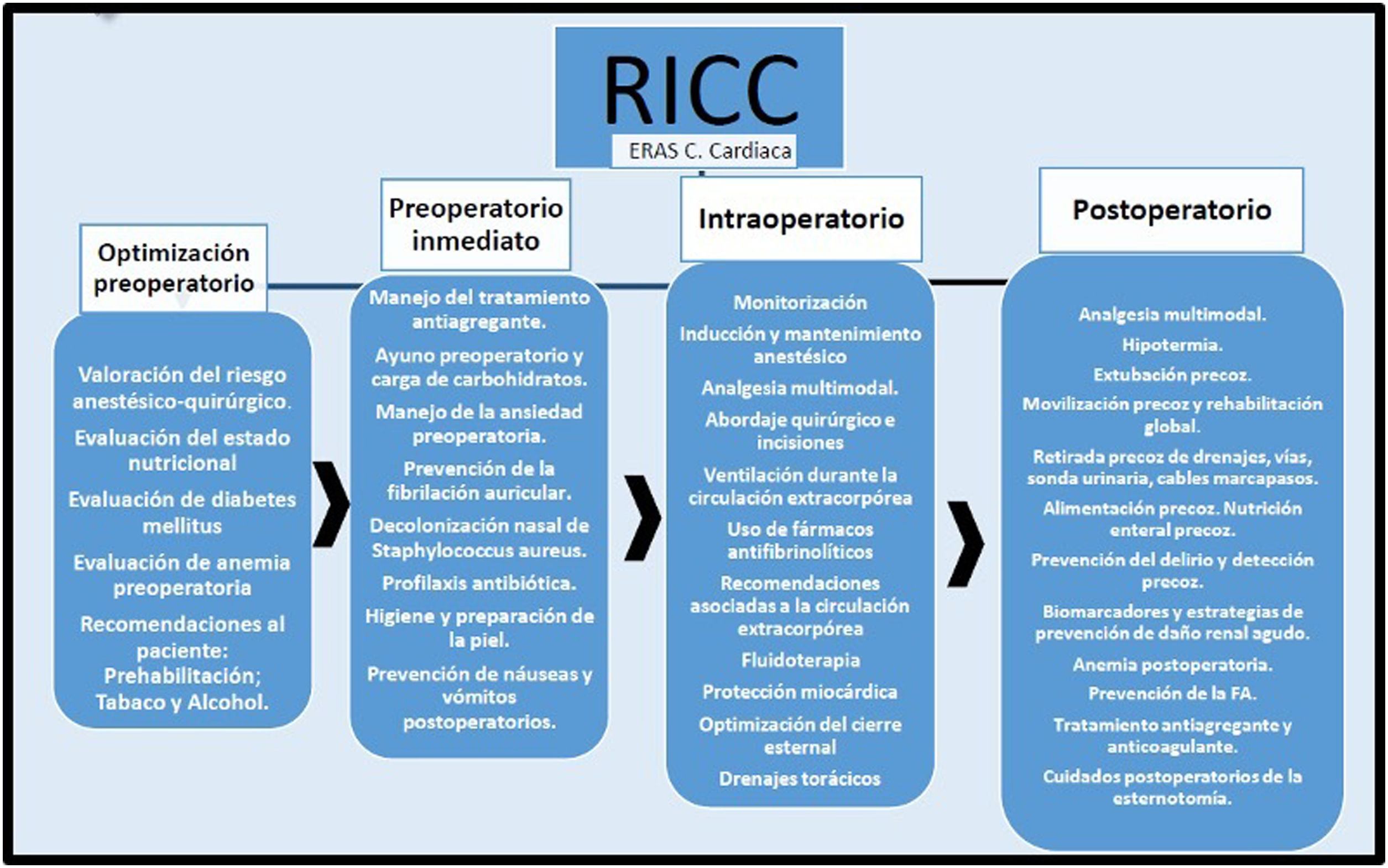
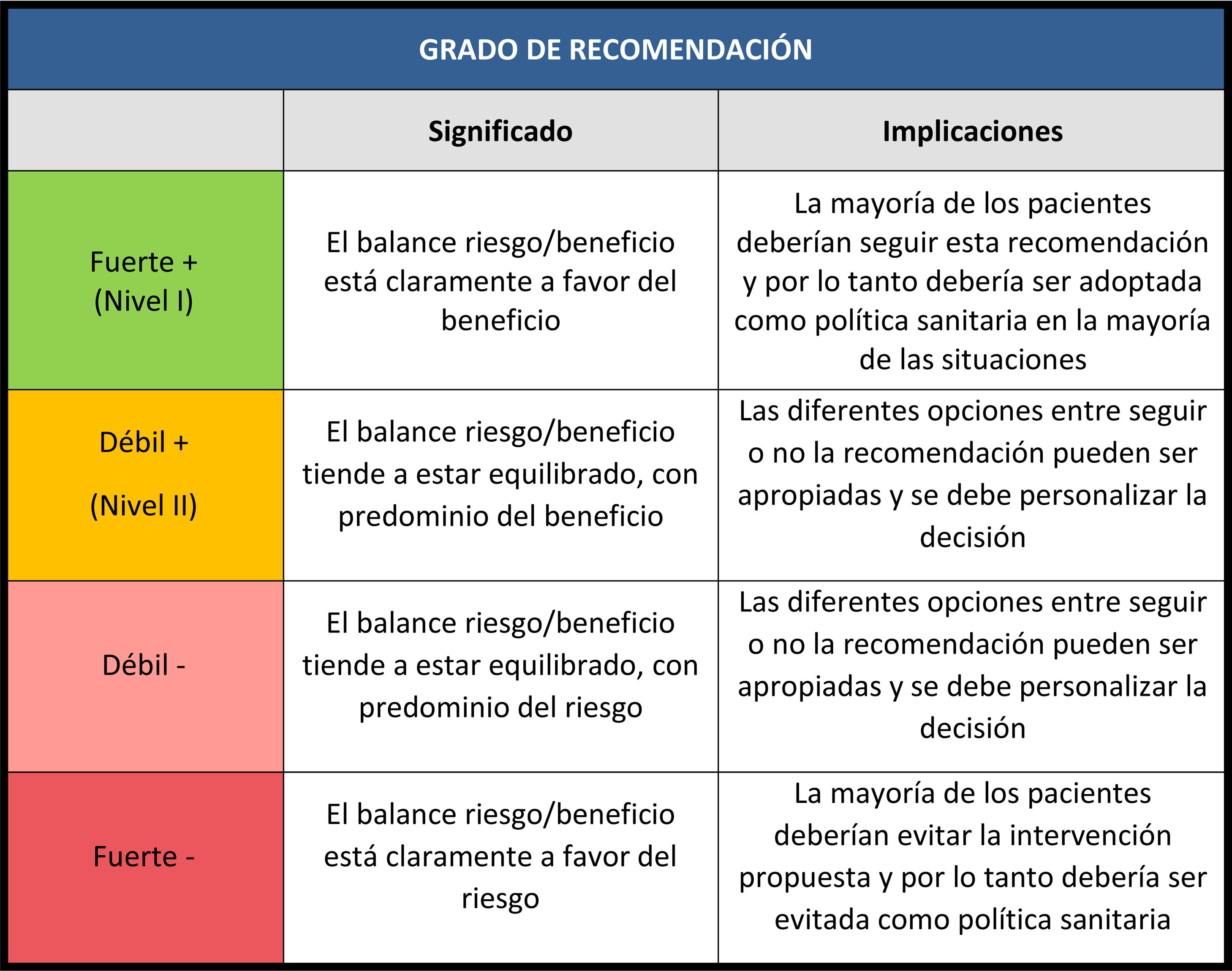
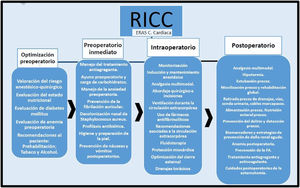
Cada grupo de autores realizó el análisis según la metodología PRISMA6, y posteriormente redactaron las recomendaciones según la escala GRADE7 (tablas 1 y 2). Se realizó una revisión posterior de todas las recomendaciones por los coordinadores de las diferentes sociedades científicas, concluyendo con la selección de un paquete de medidas (fig. 1).
Pacientes que vayan a ser intervenidos de cirugía cardiovascular, mayores de 18 años, con un adecuado nivel cognitivo para poder comprender y colaborar en el proceso.
Se excluye a las cirugías urgentes.
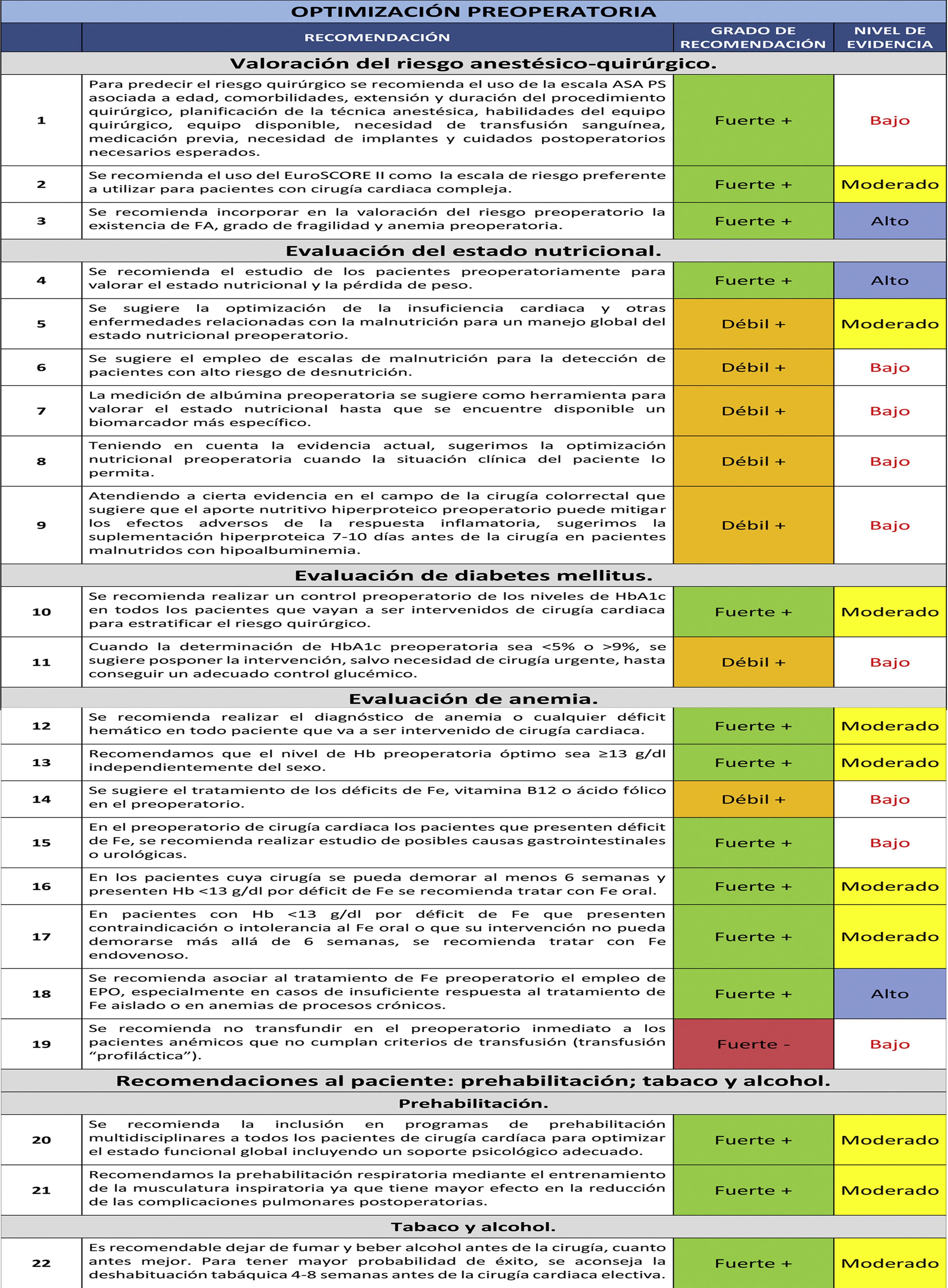
Etapa de optimización preoperatoriaValoración del riesgo anestésico-quirúrgicoLa valoración de riesgo anestésico-quirúrgico en la cirugía cardiaca es importante para establecer las medidas preventivas que mejoren los resultados de morbimortalidad durante el proceso anestésico-quirúrgico. La escala ASA PS (American Society of Anesthesiologists Physical Status Classification System) de valoración de riesgo perioperatorio se establece en la visita preanestésica y se utiliza como sistema de clasificación del estado fisiológico del paciente, siendo útil para predecir el riesgo quirúrgico8,9. Además de esta escala, la ASA (American Society of Anesthesiologists) recomienda incluir en la valoración de riesgo los siguientes factores: edad, comorbilidades, extensión y duración del procedimiento quirúrgico, planificación de la técnica anestésica, habilidades del equipo quirúrgico, equipo disponible, necesidad de transfusión sanguínea, medicación previa, necesidad de implantes y cuidados postoperatorios necesarios esperados9.
En el área de la cirugía cardiaca, la escala de riesgo más extensamente utilizada es el EuroSCORE II10. Comparada con otras escalas de riesgo como el STS (Society of Thoracic Surgeons) Risk Score y el ACEF Score (Age, Creatinine, Ejection Fraction Score) proporciona más flexibilidad para procedimientos complejos. Por ello, el EuroSCORE II, debe ser considerado como la escala de riesgo que mejor predice la mortalidad operatoria, sobre todo en pacientes con cirugía cardiaca compleja11.
1. Para predecir el riesgo quirúrgico se recomienda el uso de la escala ASA PS asociada a edad, comorbilidades, extensión y duración del procedimiento quirúrgico, planificación de la técnica anestésica, habilidades del equipo quirúrgico, equipo disponible, necesidad de transfusión sanguínea, medicación previa, necesidad de implantes y cuidados postoperatorios necesarios esperados.
Recomendación fuerte +. Nivel de evidencia bajo.
2. Se recomienda el uso del EuroSCORE II como la escala de riesgo preferente a utilizar para pacientes con cirugía cardiaca compleja.
Recomendación fuerte +. Nivel de evidencia moderado.
Existen otros factores de riesgo perioperatorio que se han relacionado con la cirugía cardiaca y que no se consideran en las escalas de riesgo anteriores como son la existencia de fibrilación auricular (FA)12, fragilidad13 y anemia preoperatoria14. De hecho, debería considerarse su incorporación a las escalas de riesgo existentes.
También, sería útil incluir en la rutina de la valoración preoperatoria anestésico-quirúrgica el riesgo de sangrado o de transfusión sanguínea. Así, el ACTA-PORT Score es una herramienta fiable y validada para predecir el riesgo de transfusión de pacientes sometidos a cirugía cardiaca y podría ser incorporado en los programas de ahorro de sangre en este área15.
3. Se recomienda incorporar en la valoración del riesgo preoperatorio la existencia de FA, grado de fragilidad y anemia preoperatoria.
Recomendación fuerte +. Nivel de evidencia alto.
Evaluación del estado nutricionalLos pacientes intervenidos de cirugía cardiaca experimentan una compleja respuesta inflamatoria desencadenada por estímulos como la propia lesión quirúrgica, el contacto de la sangre con la superficie del sistema de CEC, los fenómenos de isquemia-reperfusión, la hipoperfusión enteral o la transfusión de hemoderivados que desencadenan una repercusión intestinal. Diversos estudios han demostrado que el estado de malnutrición en pacientes que van a ser intervenidos de cirugía cardiaca se asocia a un mayor tiempo de estancia en UC, de ventilación mecánica y mayores tasas de complicaciones infecciosas16. La malnutrición preexistente se agrava por el ayuno preoperatorio. Un soporte nutricional adecuado mejorará la recuperación del paciente actuando a distintos niveles: mantenimiento del metabolismo, atenuación del catabolismo, preservación de la integridad de la mucosa gastrointestinal, mejoría de la cicatrización de la herida y optimización de una adecuada hidratación y control glucémico16-18.
4. Se recomienda el estudio de los pacientes preoperatoriamente para valorar el estado nutricional y la pérdida de peso.
Recomendación fuerte +. Nivel de evidencia alto.
5. Se sugiere la optimización de la insuficiencia cardiaca y otras enfermedades relacionadas con la malnutrición para un manejo global del estado nutricional preoperatorio.
Recomendación débil +. Nivel de evidencia moderado.
El empleo de escalas de malnutrición es esencial para una terapia correcta y personalizada. Aunque los scores de riesgo de desnutrición empleados en la actualidad (MUST, SNAQ, MST, NRS-2002) no se encuentran validados en pacientes intervenidos de cirugía cardiaca, en estudios realizados con los mismos se describen unos porcentajes de malnutrición que varían entre el 4,6-19,1%19. La malnutrición identificada por la escala MUST (Malnutritional Universal Screening Tool), así como el Euroscore y el tiempo de CEC, son factores de riesgo independientes para el desarrollo de complicaciones postoperatorias. Sin embargo, la mayoría de los investigadores concluye que en el campo de la cirugía cardiaca las herramientas actuales presentan una sensibilidad insuficiente para predecir complicaciones postquirúrgicas sin sugerir el empleo de una escala de malnutrición específica19,20.
6. Se sugiere el empleo de escalas de malnutrición para la detección de pacientes con alto riesgo de desnutrición.
Recomendación débil +. Nivel de evidencia bajo.
Los biomarcadores nutricionales se han analizado en numerosos estudios pronósticos en pacientes intervenidos de cirugía cardiaca. En ellos, las cifras bajas de albúmina, prealbúmina y el índice de masa corporal (IMC) se consideran factores de riesgo independientes de morbilidad y mortalidad21,22.
Las guías ESPEN23 han definido a los pacientes con riesgo severo de desnutrición con: IMC < 18,5 kg/m2, pérdida de peso > 10-15% en los últimos seis meses, albúmina sérica < 3 g/dL, valoración global subjetiva (SGA) grado C o valoración de riesgo nutricional (NRS) > 5. Ya que, parámetros como la hipoalbuminemia preoperatoria, se relaciona en particular con tiempos de ventilación mecánica prolongados, infección, fracaso renal agudo y aumento de la estancia en UC y hospitalaria21,22,24. Numerosos estudios han validado valores de albúmina de 3,5 gr/dL como punto de corte de malnutrición y de impacto en los resultados a corto y medio plazo en poblaciones específicamente cardioquirúrgicas, tanto de sustitución valvular aórtica abierta como transcatéter25.
7. La medición de albúmina preoperatoria se sugiere como herramienta para valorar el estado nutricional hasta que se encuentre disponible un biomarcador más específico.
Recomendación débil +. Nivel de evidencia bajo.
La detección de pacientes en riesgo de malnutrición y su optimización preoperatoria se complica en cirugía cardiaca por cuestiones logísticas, derivadas del ingreso en las 12-24 h antes de la intervención quirúrgica. La optimización del estado nutricional extrahospitalariamente, podría ser necesaria para lograr los objetivos preoperatorios.
8. Teniendo en cuenta la evidencia actual, sugerimos la optimización nutricional preoperatoria cuando la situación clínica del paciente lo permita.
Recomendación débil +. Nivel de evidencia bajo.
Para el tratamiento de la malnutrición se han postulado diversos esquemas de suplementación nutritiva preoperatoria. Sin embargo, en la actualidad no existen ensayos clínicos con suficiente poder para recomendar su implantación o estrategias para postergar la intervención en vistas a optimizar la situación nutricional20,26-29.
9. Atendiendo a cierta evidencia en el campo de la cirugía colorrectal que sugiere que el aporte nutritivo hiperproteico preoperatorio puede mitigar los efectos adversos de la respuesta inflamatoria, sugerimos la suplementación hiperproteica 7-10 días antes de la cirugía en pacientes malnutridos con hipoalbuminemia.
Recomendación débil +. Nivel de evidencia bajo.
Evaluación de diabetes mellitusEl control estricto de la glucemia es necesario debido a que la hiperglucemia elimina el preacondicionamiento isquémico y da como resultado una disfunción endotelial y una disminución de la actividad fagocítica de los neutrófilos polimorfonucleares, al tiempo que aumenta la formación de lesiones en un modelo murino de barrera hematoencefálica de isquemia cerebral. Estos efectos nocivos de la hiperglucemia son causados por anormalidades mitocondriales en células no insulinodependientes, donde los transportadores de glucosa se sobreexpresan durante el estrés30.
La Sociedad Europea de Anestesiología (ESA) recomienda que el paciente con alto riesgo de presentar alteraciones en el metabolismo hidrocarbonado debe ser identificado (síndrome metabólico, historia familiar de diabetes, historia personal de problemas cardiovasculares, diabetes gestacional o hiperglucemia transitoria), se debe mantener una especial atención sobre él y controlar sus niveles de glucemia perioperatoria31,32.
La hiperglucemia en pacientes quirúrgicos hospitalizados se asocia a un aumento de la morbilidad y mortalidad, por lo que ha de ser evitada30.
Los niveles elevados de hemoglobina A1c (HbA1c) se correlacionan con mal control glucémico y por tanto aumentan el riesgo de que el paciente presente hiperglucemias en su ingreso. En un documento de consenso de las asociaciones americanas y europeas de diabetes (ADA y EASD) se definió en < 7% los niveles óptimos de HbA1c33. Se ha demostrado que a mayor nivel de HbA1c, existe mayor incidencia de infección profunda de herida esternal, problemas isquémicos y otras complicaciones34,35.
También se ha demostrado que los pacientes no diabéticos conocidos que presentan niveles elevados de HbA1c tienen mayor riesgo de mortalidad postoperatoria36.
Por todo ello, es conveniente realizar un control de los niveles de HbA1c en todos los pacientes que vayan a ser intervenidos de cirugía cardiaca.
Salvo en cirugía urgente, con valores > 9% (que indica haber presentado recurrencia de hiperglucemias severas) o < 5% (indicativo de haber presentado hipoglucemias graves recurrentes) se debe retrasar la intervención31.
10. Se recomienda realizar un control preoperatorio de los niveles de HbA1c en todos los pacientes que vayan a ser intervenidos de cirugía cardiaca para estratificar el riesgo quirúrgico.
Recomendación fuerte +. Nivel de evidencia moderado.
11. Cuando la determinación de HbA1c preoperatoria sea < 5% o > 9% se sugiere posponer la intervención, salvo necesidad de cirugía urgente, hasta conseguir un adecuado control glucémico.
Recomendación débil +. Nivel de evidencia bajo.
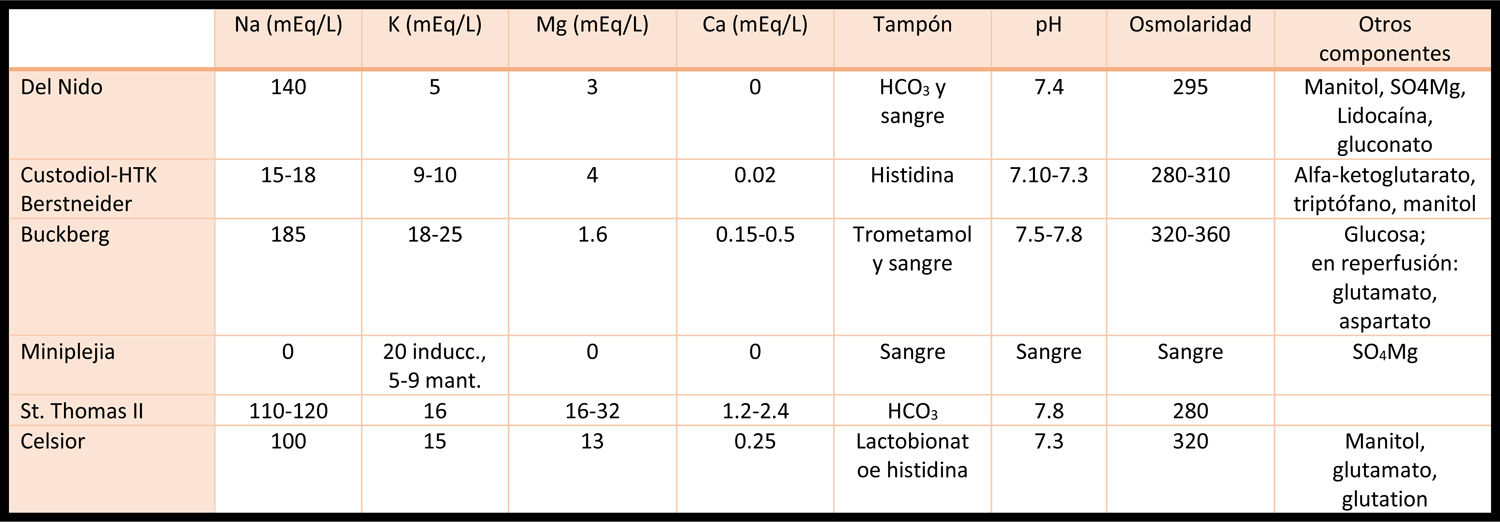
Evaluación de anemia preoperatoriaLos niveles bajos de hemoglobina (Hb) en pacientes que van a someterse a cirugía cardiovascular se han asociado a aumento de la morbilidad y mortalidad37,38, y también a un incremento en las necesidades transfusionales, relacionadas con peores resultados39,40. Por ello, se recomienda detectar la presencia de niveles bajos de Hb en el preoperatorio de cirugía cardiovascular e identificar el tipo de anemia para su correcto manejo. La analítica deberá incluir al menos un recuento hemático completo, ferritina, índice de saturación de la transferrina, vitamina B12, ácido fólico, proteína C reactiva y creatinina (Cr)41.
12. Se recomienda realizar el diagnóstico de anemia o cualquier déficit hemático en todo paciente que va a ser intervenido de cirugía cardiaca.
Recomendación fuerte +. Nivel de evidencia moderado.
Existe evidencia de que niveles preoperatorios de Hb < 13 g/dL se asocian a mayor riesgo de transfusión, por lo que el nivel objetivo de Hb, independientemente del sexo, ha de ser ≥ 13 g/dL41,42.
13. Recomendamos que el nivel de Hb preoperatoria óptimo sea ≥ 13 g/dL independientemente del sexo.
Recomendación fuerte +. Nivel de evidencia moderado.
Aún en ausencia de anemia, el déficit de hierro (Fe), ácido fólico o de vitamina B12 se deben tratar en el preoperatorio. Además, si existe déficit de Fe se debe investigar si existe una causa gastrointestinal o urológica41.
14. Se sugiere el tratamiento de los déficits de Fe, vitamina B12 o ácido fólico en el preoperatorio.
Recomendación débil +. Nivel de evidencia bajo.
15. En el preoperatorio de cirugía cardiaca, en los pacientes que presenten déficit de Fe, se recomienda realizar estudio de posibles causas gastrointestinales o urológicas.
Recomendación fuerte +. Nivel de evidencia bajo.
El tratamiento con Fe oral se puede realizar en casos en que la cirugía se pueda demorar al menos seis semanas. Se deberá administrar Fe intravenoso en aquellos pacientes que no respondan al Fe oral, o que presenten intolerancia o contraindicación, en los casos en que la intervención se deba realizar en menos de seis semanas o en anemias muy severas41,43.
En caso de poder iniciar el tratamiento al menos dos semanas antes de la cirugía, se puede recomendar el tratamiento con eritropoyetina (EPO) asociada al Fe intravenoso, tal y como reflejan varios estudios aleatorizados y metaanálisis44-47 y especialmente en caso de anemia por procesos crónicos41.
16. En los pacientes cuya cirugía se pueda demorar al menos seis semanas y presenten Hb < 13 g/dL por déficit de Fe se recomienda tratar con Fe oral.
Recomendación fuerte +. Nivel de evidencia moderado.
17. En pacientes con Hb < 13 g/dL por déficit de Fe que presenten contraindicación o intolerancia al Fe oral o que su intervención no pueda demorarse más allá de seis semanas, se recomienda tratar con Fe endovenoso.
Recomendación fuerte +. Nivel de evidencia moderado.
18. Se recomienda asociar al tratamiento de Fe preoperatorio el empleo de EPO, especialmente en casos de insuficiente respuesta al tratamiento de Fe aislado o en anemias de procesos crónicos.
Recomendación fuerte +. Nivel de evidencia alto.
No se recomienda realizar transfusión «profiláctica» en el preoperatorio inmediato (pacientes anémicos que no cumplan criterios de transfusión), dado que no se asocia a mejores resultados ni a ahorro de transfusiones globales48.
19. Se recomienda no transfundir en el preoperatorio inmediato a los pacientes anémicos que no cumplan con criterios de transfusión (transfusión «profiláctica»).
Recomendación fuerte -. Nivel de evidencia bajo.
Recomendaciones al paciente: prehabilitación, tabaco y alcoholPrehabilitaciónEl aumento de la esperanza de vida en la población general ha derivado en que la edad de los pacientes candidatos a cirugía cardiaca aumente. Existe evidencia suficiente a favor de que la edad cronológica no es un factor limitante para contraindicar una intervención quirúrgica, pues a pesar de que se aumenta el riesgo de complicaciones, se obtiene un claro beneficio49,50.
Por otro lado, debemos conocer en este grupo poblacional el grado de vulnerabilidad a estímulos estresores (proceso quirúrgico), es decir de fragilidad, para poder establecer los riesgos reales de la cirugía.
La tradicional valoración preoperatoria y las escalas de riesgo no nos aportan información específica sobre la fragilidad y el sedentarismo (nivel de actividad física nulo o muy bajo) de nuestros pacientes añosos, siendo ambos factores determinantes de su evolución postoperatoria. El grado de fragilidad se asocia de manera repetida en diferentes estudios con aumento de la morbilidad postoperatoria, mayor tiempo de estancia hospitalaria, necesidad de traslado a instituciones para continuar la recuperación, mayor gasto sanitario y mayor mortalidad51-54. La intervención y todo el proceso perioperatorio suponen un estrés fisiológico que afecta de manera significativa la capacidad funcional y fisiológica de los pacientes con caídas de hasta el 40% sobre su capacidad basal25,55-60. Incluso en algunos pacientes, la recuperación de su estado funcional basal puede ser muy prolongada.
Los programas de prehabilitación cardiaca se han implantado para mejorar los resultados postoperatorios. Aunque la evidencia actual es limitada, son una estrategia preventiva multidisciplinar muy prometedora61,62. Al realizar un programa de entrenamiento prequirúrgico se mejora la capacidad aeróbica del paciente y aumenta así su capacidad funcional, mitigando las consecuencias del estrés quirúrgico y consiguiendo disminuir la incidencia y severidad de las complicaciones postoperatorias.
La prehabilitación, como parte integrante de los protocolos ERAS en cirugía cardiaca, es la herramienta que necesitamos para optimizar el estado funcional de los pacientes frágiles y añosos programados para cirugía cardiaca. El tiempo de espera hasta la cirugía es nuestra oportunidad para poner en marcha un programa de prehabilitación.
Los cinco componentes básicos de la prehabilitación cardiaca son: evaluación del estado funcional basal, entrenamiento físico, nutrición/asesoramiento dietético, control de los factores de riesgo cardiovascular y soporte psicológico (reducción de la ansiedad). La combinación del entrenamiento físico de pocas semanas de duración (capaz de mejorar la reserva funcional), la mejora de la nutrición y el soporte psicológico se consideran los tres pilares básicos recomendables en todo programa de prehabilitación25,55-60.
En el momento actual no existe nivel de evidencia científica suficiente para recomendar un determinado programa de prehabilitación en pacientes programados para cirugía cardiaca, en espera de los resultados de dos estudios multicéntricos: PREHAB Study (Pre-Operative Rehabilitation for Reduction of Hospitalization After Coronary Bypass and Valvular Surgery, NCT02219815) y PERFORM TAVR (Protein and Exercise to Reverse Frailty in Older Men and Women Undergoing Transcatheter Aortic Valve Replacement, NCT03522454).
Sin embargo, podemos afirmar con base en la bibliografía reciente que la prehabilitación en los pacientes programados para cirugía cardiaca (especialmente la respiratoria) se asocia con un descenso del tiempo de estancia hospitalario, mejoría objetiva del estado físico funcional y mejoría subjetiva en la calidad de vida (física y de salud mental)63,64, así como a una reducción de las complicaciones pulmonares postoperatorias y del tiempo de estancia. No se recoge ningún efecto perjudicial en ninguno de los programas de prehabilitación estudiados hasta el momento65.
20. Se recomienda la inclusión en programas de prehabilitación multidisciplinares a todos los pacientes de cirugía cardiaca para optimizar el estado funcional global, incluyendo un soporte psicológico adecuado.
Recomendación fuerte +. Nivel de evidencia moderado.
21. Recomendamos la prehabilitación respiratoria mediante el entrenamiento de la musculatura inspiratoria, ya que tiene mayor efecto en la reducción de las complicaciones pulmonares postoperatorias.
Recomendación fuerte +. Nivel de evidencia moderado.
Tabaco y alcoholLa detección del consumo de alcohol y tabaco debe realizarse antes de la intervención quirúrgica utilizando herramientas de detección validadas para poder establecer medidas de control, ya que son factores de riesgo para el desarrollo de complicaciones postoperatorias66,67.
Ser fumador activo aumenta el riesgo de padecer complicaciones en el periodo perioperatorio de todas las cirugías, particularmente complicaciones respiratorias, cardiacas, infecciosas y relacionadas con la herida quirúrgica68.
Se ha demostrado que dejar de fumar y/o beber alcohol reduce las complicaciones postoperatorias. Por otra parte, cuanto más largo es el periodo preoperatorio libre de tabaco, menor es el riesgo de padecer complicaciones postoperatorias69,70.
No está clara cuál debe ser la duración del tiempo de abandono del tabaco y el alcohol previo a la cirugía, pero probablemente se obtenga el máximo beneficio a partir de un año71, lo cual supone un tiempo no asumible para la mayoría de las indicaciones de cirugía cardiaca. Una revisión de la colaboración Cochrane de 2014 para comenzar las intervenciones de abandono del tabaco recomienda que estas empiecen en torno a 4-8 semanas antes de la cirugía, para que hayan sido efectivas durante y después de la cirugía72. Otros autores concluyen que estas intervenciones deben hacerse a través de un programa intensivo de abandono del tabaco para tener efecto en las tasas de complicaciones posoperatorias.
22. Es recomendable dejar de fumar y beber alcohol antes de la cirugía, cuanto antes mejor. Para tener mayor probabilidad de éxito, se aconseja la deshabituación tabáquica 4-8 semanas antes de la cirugía cardiaca electiva.
Recomendación fuerte +. Nivel de evidencia moderado.
Etapa preoperatorio inmediatoManejo del tratamiento antiagregante y anticoagulanteAntiagregación simpleTodo paciente diagnosticado con cardiopatía isquémica debe iniciar tratamiento con ácido acetil salicílico (AAS), excepto si existe contraindicación73. Si se indica revascularización quirúrgica, se debe introducir igualmente lo antes posible salvo que la intervención se vaya a realizar en menos de cinco días.
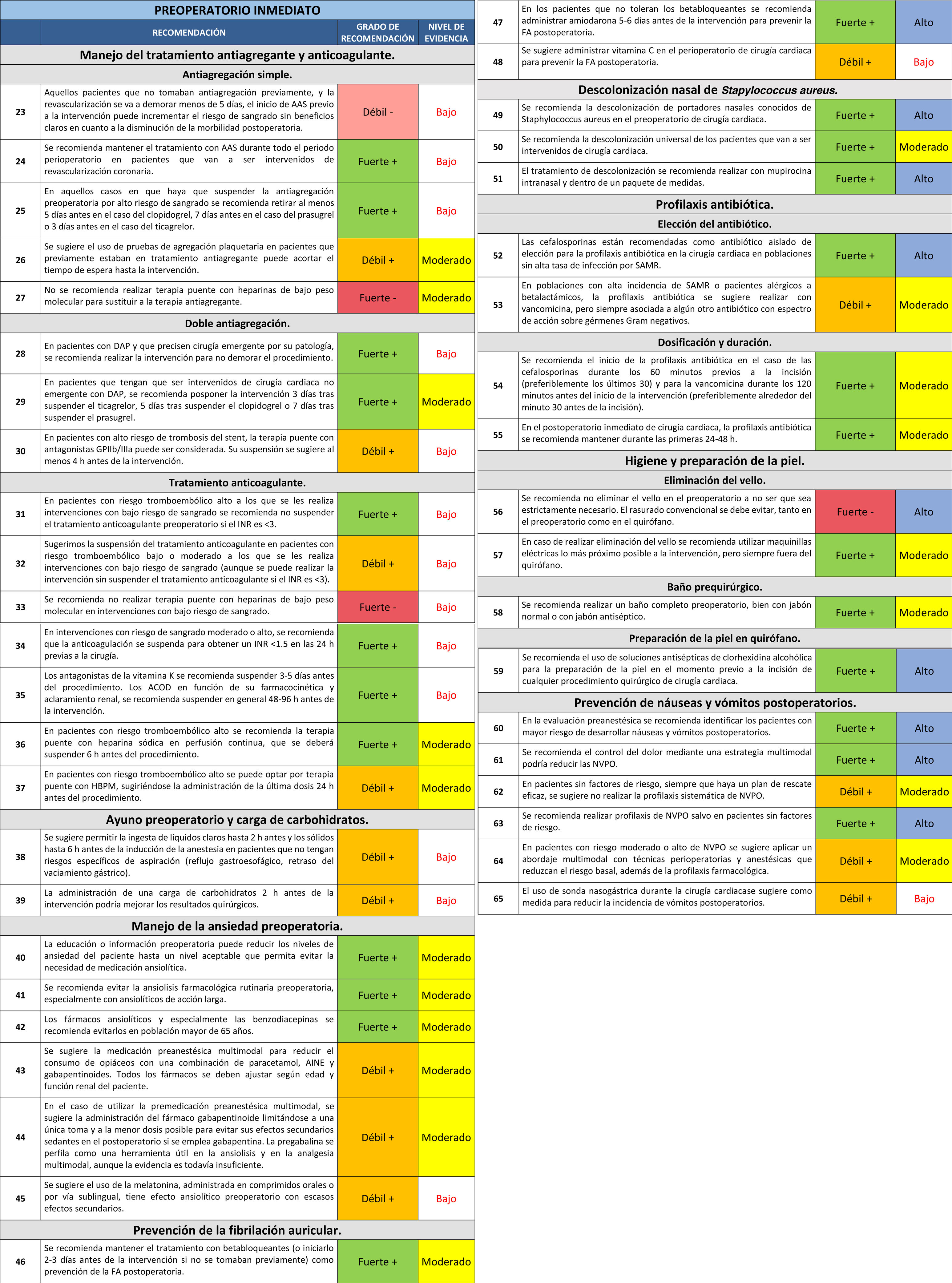
23. En aquellos pacientes que no tomaban antiagregación previamente, y la revascularización se va a demorar menos de cinco días, el inicio de AAS previo a la intervención puede incrementar el riesgo de sangrado sin beneficios claros en cuanto a la disminución de la morbilidad postoperatoria.
Recomendación débil -. Nivel de evidencia bajo.
Los pacientes con antiagregación simple con AAS que van a ser intervenidos de revascularización coronaria quirúrgica no deben suspender el tratamiento74-76 porque a pesar de que incrementa el riesgo de sangrado postoperatorio y las necesidades transfusionales77, no aumenta la mortalidad ni las reexploraciones por hemorragia y se ha asociado con una reducción de la tasa de infartos tardíos o de revascularización repetida78. Solo determinados casos podrían requerir su interrupción, como aquellos pacientes que rechazan la transfusión, cirugías de alto riesgo de sangrado o reintervenciones, insuficiencia renal severa, enfermedades hematológicas o déficits congénitos de función plaquetaria. En caso de necesidad de suspenderlo, se debe suspender al menos cinco días antes de la intervención74. También se debe suspender en cirugías cardiacas que no sean de revascularización coronaria.
24. Se recomienda mantener el tratamiento con AAS durante todo el periodo perioperatorio en pacientes que van a ser intervenidos de revascularización coronaria.
Recomendación fuerte +. Nivel de evidencia bajo.
En cuanto a la antiagregación simple preoperatoria con fármacos distintos del AAS, algunos estudios han demostrado un aumento del débito hemático postoperatorio por los tubos de drenaje, una mayor transfusión de productos sanguíneos, mayor tasa de reintervención, ingresos más prolongados y una mayor mortalidad79,80. Por tanto, se recomienda la suspensión al menos cinco días antes de la intervención para el clopidogrel, siete días antes el prasugrel y tres días antes el ticagrelor81,82.
25. En aquellos casos en que haya que suspender la antiagregación preoperatoria por alto riesgo de sangrado, se recomienda retirar al menos cino días antes en el caso del clopidogrel, siete días antes en el caso del prasugrel o tres días antes en el caso del ticagrelor.
Recomendación fuerte +. Nivel de evidencia bajo.
Las pruebas de función plaquetaria pueden ayudar a reducir el tiempo de espera hasta la cirugía en pacientes tratados con fármaco inhibidor del P2Y12 en un 50%74.
26. Se sugiere el uso de pruebas de agregación plaquetaria en pacientes que previamente estaban en tratamiento antiagregante para acortar el tiempo de espera hasta la intervención.
Recomendación débil +. Nivel de evidencia moderado.
Por otro lado, está contraindicada la terapia puente con heparinas de bajo peso molecular para retirar la terapia antiagregante previamente a la intervención quirúrgica.
27. Se recomienda no realizar terapia puente con heparinas de bajo peso molecular para sustituir a la terapia antiagregante.
Recomendación fuerte -. Nivel de evidencia moderado.
Doble antiagregaciónLa principal problemática con el tratamiento antiagregante se encuentra en el paciente bajo tratamiento con doble antiagregación plaquetaria (DAP) que ha de ser intervenido, debido al mayor riesgo hemorrágico que presentan. La problemática se puede dar fundamentalmente en dos situaciones:
- 1.
Paciente que tiene que ser intervenido de manera urgente, en tratamiento con DAP que puede ser retirada, en que la demora de la intervención hay que ajustarla en función de la retirada de la DAP.
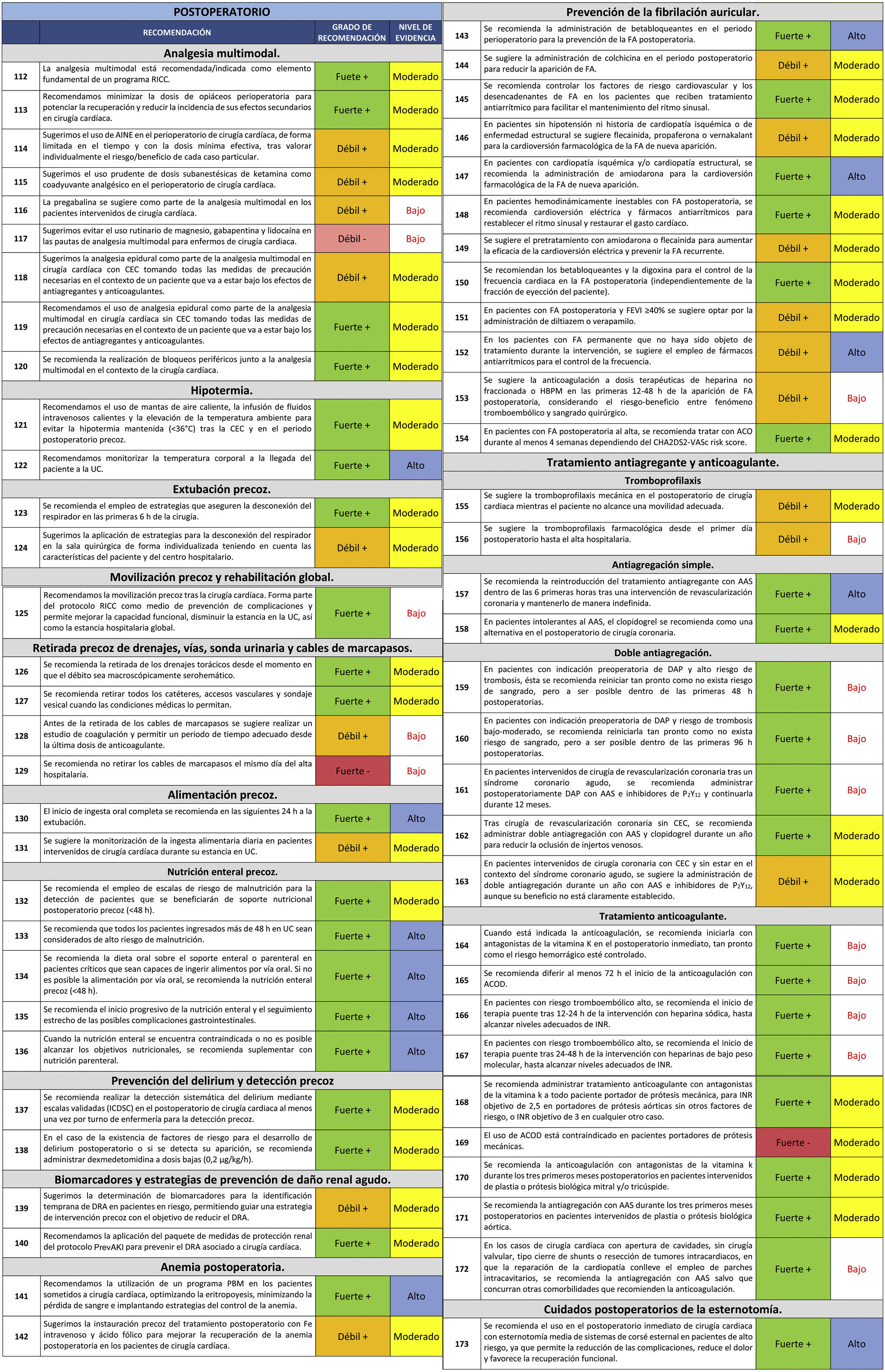
- 2.
Paciente cuya intervención puede ser demorada sin problema, pero por determinadas características de su patología no es recomendable retirar la DAP.
Lamentablemente, a pesar de la elevada frecuencia de los casos en que hay que plantearse la retirada o no de la DAP, actualmente no existen estudios aleatorizados sobre este punto. La evidencia disponible se basa en estudios observacionales y en consenso de expertos.
En primer lugar, hay que tener en cuenta que no es infrecuente en el contexto de la cirugía de la cardiopatía isquémica la situación de indicación de cirugía emergente (sobre todo de revascularización coronaria) en un paciente que se encuentra con DAP y en el que la intervención no se puede demorar. En estos casos, se considera que ninguna cirugía emergente debe posponerse pese al hecho de encontrarse el paciente con DAP. En estos casos, el paciente ha de ser intervenido haciendo una hemostasia quirúrgica minuciosa para minimizar el sangrado, pudiendo utilizarse trasfusión de productos plaquetarios83. En casos urgentes, que no requieren intervención de emergencia, el clopidogrel se puede suspender 48 h antes de la cirugía, disminuyendo el riesgo de sangrado a partir de este momento, pero incrementado con respecto a la suspensión cinco días previos.
28. En pacientes con DAP y que precisen cirugía emergente por su patología, se recomienda realizar la intervención para no demorar el procedimiento.
Recomendación fuerte +. Nivel de evidencia bajo.
Por otro lado, en el caso de cirugía no urgente, la decisión de suspender o mantener el tratamiento con DAP, así como la demora entre la suspensión y la intervención, han de ser valorados de manera individualizada caso a caso. Debido a la falta de ensayos clínicos para dilucidar riesgos, se recurre a estudios observacionales. Los puntos fundamentales que hay que valorar en el momento de la suspensión del tratamiento antiagregante son tanto el riesgo hemorrágico del procedimiento como el riesgo trombótico (fundamentalmente de stents coronarios). Una idea fundamental a tener en cuenta, es que al igual que en la monoterapia, el AAS puede mantenerse durante todo el periodo perioperatorio sin que suponga un aumento significativo del riesgo de sangrado, mientras que se recomienda la interrupción del otro agente, con un margen de seguridad adecuado para evitar las complicaciones ya mencionadas84. Sin embargo, suspender la DAP tras el implante de un stent puede derivar en fatales consecuencias. El riesgo se derivará de implante del stent (síndrome coronario agudo, enfermedad coronaria estable), la anatomía de las lesiones (bifurcación, lesión en el tronco coronario izquierdo), el tipo de stent implantado (los liberadores de fármacos de las primeras generaciones tienen un perfil mucho más trombogénico) y el tiempo transcurrido desde el implante.
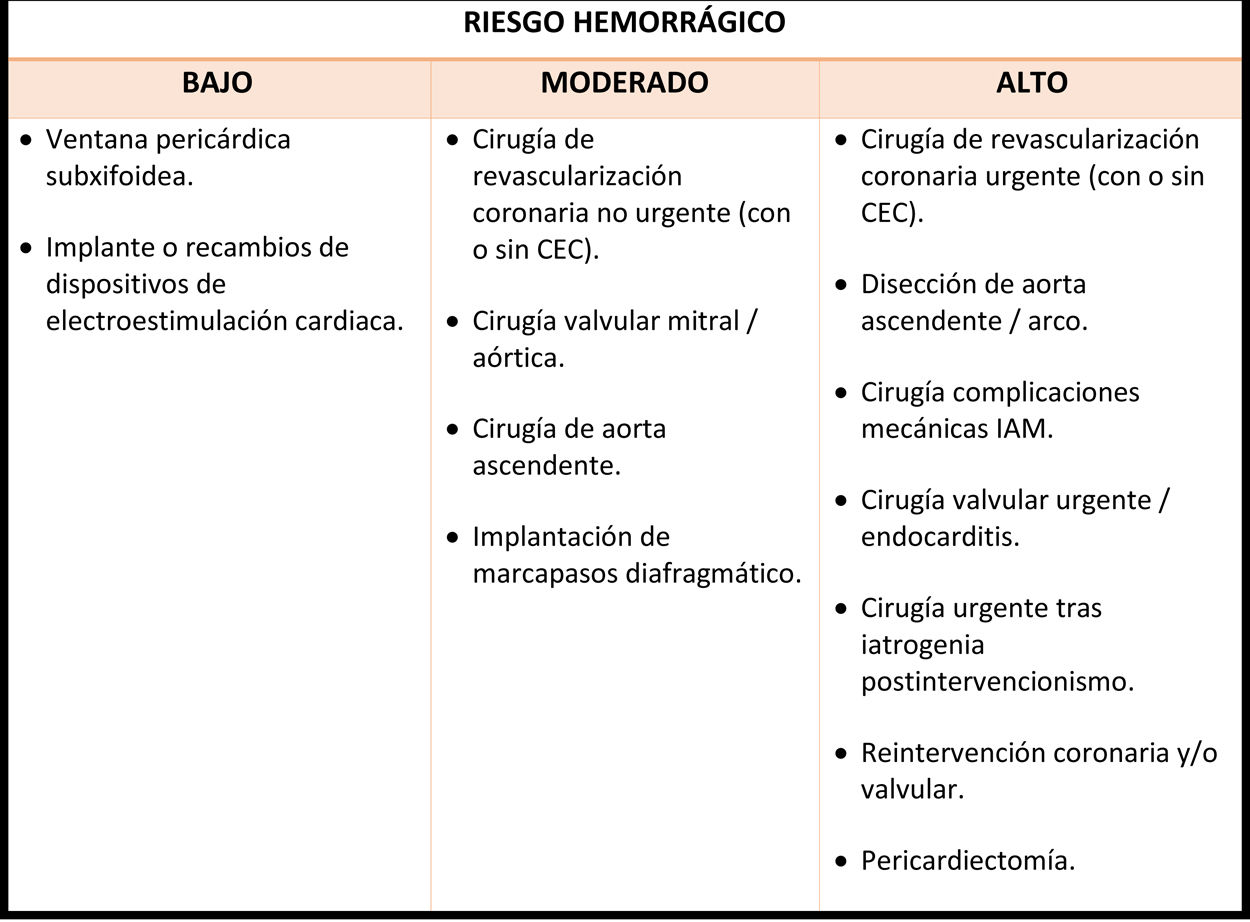
La tabla 4 estratifica los procedimientos de cirugía cardiovascular encuadrados en función del riesgo de sangrado. El riesgo de trombosis del stent por la retirada de tratamiento antiagregante se clasifica en riesgo en bajo, moderado y alto en función de varios factores82:
- •
Tiempo de evolución del síndrome coronario agudo hasta la intervención.
- •
Características clínicas del paciente.
- •
Tipo de stent implantado.
Estratificación del riesgo hemorrágico según el tipo de cirugía/procedimiento
Adaptado del Documento de Consenso acerca del manejo perioperatorio y periprocedimiento del tratamiento antitrombótico, de Vivas D. et al.82.
CEC: circulación extracorpórea. IAM: infarto agudo de miocardio.
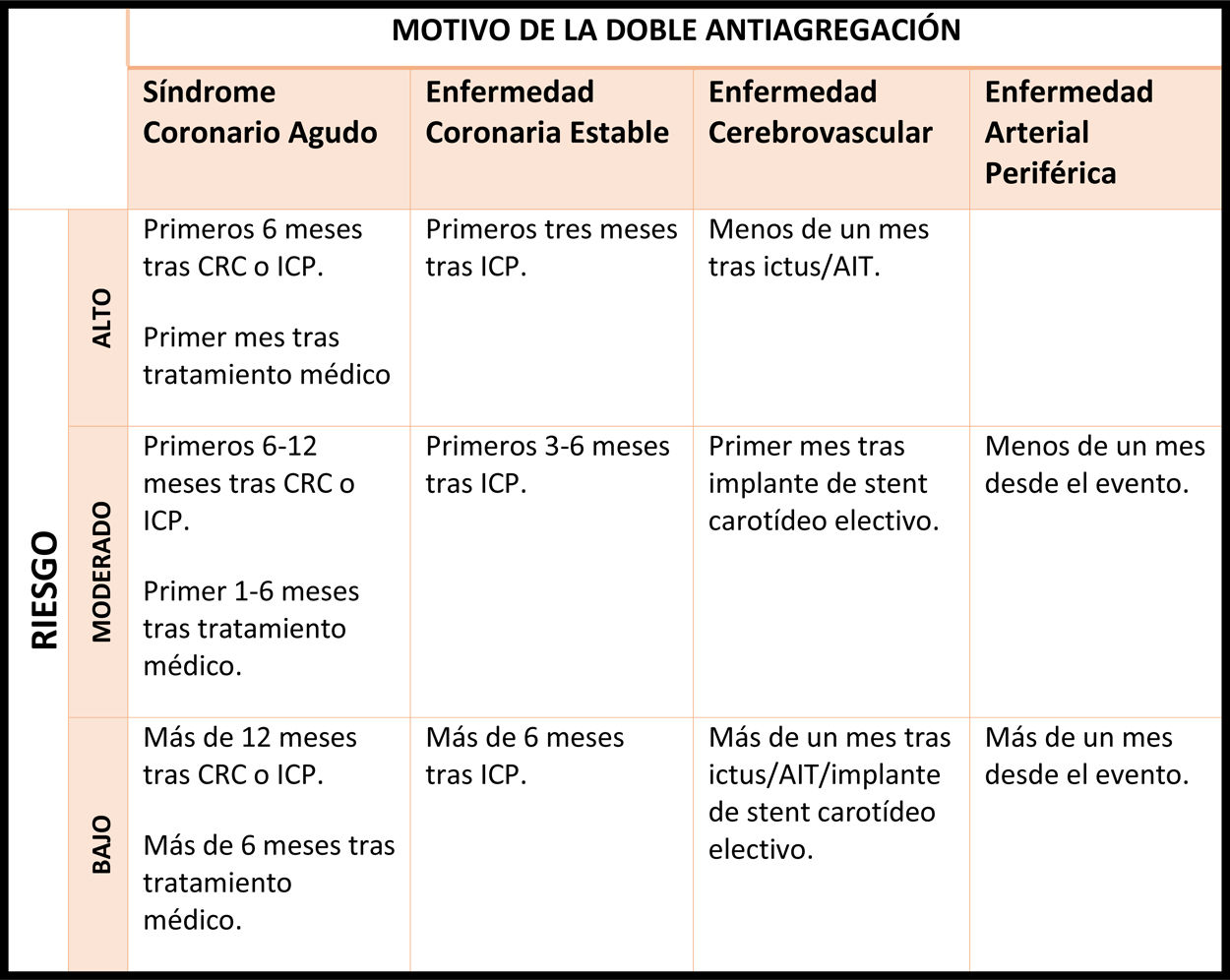
La tabla 5, tomada del documento de la Sociedad Española de Cardiología82, orienta para la estimación del riesgo trombótico en función de estos factores y de la causa por la que el paciente está recibiendo el tratamiento antiagregante. En general, aquellos pacientes con mayor perfil trombogénico son:
- •
Aquellos a los que se les ha implantado un stent liberador de fármacos de primera generación o un stent con armazón vascular bioabsorbible.
- •
Tras angioplastias percutáneas complejas (implante de stent largos o múltiples, o angioplastias en bifurcaciones, en el tronco coronario izquierdo, en vasos de escaso calibre o en injertos de vena safena).
- •
Aquellos con antecedentes de diabetes mellitus o insuficiencia renal crónica.
- •
Pacientes que reciben antiagregación tras un síndrome coronario agudo. En este grupo de pacientes, la antiagregación se recomienda mantenerla al menos seis meses tras el procedimiento percutáneo.
Estratificación del riesgo trombótico del paciente con tratamiento antiagregante
*En caso de stents liberadores de fármaco de primera generación (rapamicina, paclitaxel) y stents con armazón vascular bioabsorbible, se ha de considerar riesgo trombótico elevado durante los primeros 12 meses tras ICP y moderado si > 12 meses tras ICP.
**El riesgo trombótico aumenta de moderado a alto y de bajo a moderado si asocia más de uno de los siguientes factores de riesgo: ictus/AIT previo, diabetes mellitus, insuficiencia renal crónica, ICP complejo (stent largos, múltiples, bifurcaciones, tronco coronario izquierdo, vasos únicos, solapamiento, vasos < 2,5 mm o injertos de vena safena).
AIT: accidente isquémico transitorio. CRC: cirugía de revascularización coronaria. ICP: intervencionismo coronario percutáneo.
Adaptado del Documento de Consenso acerca del manejo perioperatorio y periprocedimiento del tratamiento antitrombótico de Vivas D. et al82.
En líneas generales se recomienda retrasar la cirugía electiva hasta al menos un mes tras el implante de stent, siempre y cuando se pueda mantener el AAS, y suspendiendo el otro fármaco al menos cinco días antes de la intervención83,85. No obstante, cada caso debe ser individualizado, analizando el riesgo-beneficio de la suspensión de la DAP, teniendo en cuenta los factores que pueden favorecer un mayor riesgo de sangrado, así como posibles causas y consecuencias de la trombosis del stent. Aquellos pacientes diabéticos, por ejemplo, o a los sometidos a una angioplastia compleja, tienen un mayor perfil trombogénico, debiendo posponerse la cirugía electiva hasta al menos seis meses tras el implante del stent.
29. En pacientes que tengan que ser intervenidos de cirugía cardiaca no emergente con DAP, se recomienda posponer la intervención tres días tras suspender el ticagrelor, cinco días tras suspender el clopidogrel o siete días tras suspender el prasugrel.
Recomendación fuerte +. Nivel de evidencia moderado.
Por otro lado, en aquellos pacientes en los cuales el riesgo trombótico de la suspensión de la DAP es prohibitivo86, existe la posibilidad de realizar terapia puente con el uso de antagonistas de GPIIb/IIIa (como el eptifibatide o el tirofibán), aunque existe poca evidencia al respecto. Solo se recomiendan en casos muy determinados, suspendiendo el segundo antiagregante y sustituyéndolo por estos fármacos de corta duración de efecto. Tras la suspensión del segundo antiagregante, el paciente es mantenido el tiempo necesario para que cese su efecto con DAP con AAS + antagonista GPIIb/IIIa. La realización de este puente permite que el antagonista GPIIB/IIIA puede ser suspendido al menos cuatro horas antes de la intervención, minimizando el periodo de riesgo de trombosis de stents. Más recientemente se ha demostrado la eficacia y seguridad del tratamiento puente con el cangrelor, que presenta una vida media ultracorta y que ha demostrado no aumentar las complicaciones hemorrágicas perioperatorias74.
30. En pacientes con alto riesgo de trombosis delstent, la terapia puente con antagonistas GPIIb/IIIa puede ser considerada. Su suspensión se sugiere al menos cuatro horas antes de la intervención.
Recomendación débil +. Nivel de evidencia bajo.
Tratamiento anticoagulanteLas indicaciones para la anticoagulación pueden ser la FA (causa más frecuente), prótesis valvulares mecánicas, estenosis mitral, gran tamaño auricular o mala función ventricular.
La gran mayoría reciben anticoagulación oral (ACO), bien sea por antagonistas de la vitamina K (acenocumarol en nuestro medio) con INR (Razón Normalizada Internacional) objetivo entre dos y tres, o bien con anticoagulantes de acción directa (ACOD) como el dabigatrán, apixabán, rivaroxabán y edoxabán.
Según el riesgo tromboembólico y el riesgo hemorrágico (tabla 4) se puede establecer una pauta de la necesidad o no de suspender el tratamiento y cuándo suspenderlo, así como la necesidad o no de terapia puente.
Intervenciones con bajo riesgo de sangradoEstas intervenciones son cirugías menores, que en algunos casos se pueden realizar con anestesia local. La más frecuente es la asociada a dispositivos de electroestimulación.
Está demostrado que en estos pacientes se puede realizar la intervención de forma segura sin interrumpir la anticoagulación87, por lo que si el paciente se encuentra con INR dentro del rango terapéutico, se puede realizar el procedimiento sin suspender la anticoagulación88, si bien en pacientes con riesgo tromboembólico bajo o moderado se puede optar por la suspensión de la anticoagulación.
31. En pacientes con riesgo tromboembólico alto a los que se les realiza intervenciones con bajo riesgo de sangrado se recomienda no suspender el tratamiento anticoagulante preoperatorio si el INR es < 3.
Recomendación fuerte +. Nivel de evidencia bajo.
32. Sugerimos la suspensión del tratamiento anticoagulante en pacientes con riesgo tromboembólico bajo o moderado a los que se les realiza intervenciones con bajo riesgo de sangrado (aunque se puede realizar la intervención sin suspender el tratamiento anticoagulante si el INR es < 3).
Recomendación débil +. Nivel de evidencia bajo.
La terapia puente con heparinas de bajo peso molecular (HBPM) no se debe realizar porque se aumenta el riesgo de formación de hematomas.
33. Se recomienda no realizar terapia puente con heparinas de bajo peso molecular en intervenciones con bajo riesgo de sangrado.
Recomendación fuerte -. Nivel de evidencia bajo.
Intervenciones con riesgo de sangrado moderado o altoRequieren siempre la suspensión de la anticoagulación.
El tratamiento con antagonistas de la vitamina K se ha de suspender entre tres y cinco días antes de la intervención, siempre y cuando el INR previo estuviera en rango terapéutico89,90. Se ha de realizar una determinación de INR como máximo 24 h antes de la intervención para comprobar que el INR sea < 1,5.
En el caso de tratamiento con ACOD, la suspensión dependerá de la función renal del paciente y del riesgo hemorrágico de la intervención91, aunque en líneas generales se recomienda suspenderlos al menos 48-96 h antes del procedimiento.
34. En intervenciones con riesgo de sangrado moderado o alto, se recomienda que la anticoagulación se suspenda para obtener un INR < 1,5 en las 24 h previas a la cirugía.
Recomendación fuerte +. Nivel de evidencia bajo.
35. Se recomienda suspender los antagonistas de la vitamina K entre 3-5 días antes del procedimiento. Los ACOD en función de su farmacocinética y aclaramiento renal, se recomienda suspenderlos en general 48-96 h antes de la intervención.
Recomendación fuerte +. Nivel de evidencia bajo.
La administración de terapia puente con heparinas se recomienda exclusivamente en pacientes con alto riesgo tromboembólico92,93. Actualmente, las guías únicamente aprueban el uso de heparina no fraccionada. El uso de HBPM se relaciona con una mayor tasa de reintervenciones por sangrado en el postoperatorio, pero su uso no requiere ingreso hospitalario para su administración, por lo que se utiliza como alternativa en la mayoría de casos programados94.
La terapia puente se ha de iniciar cuando el INR sea < 2 o, si se desconoce el INR, tras haber omitido dos o tres dosis de anticoagulante oral.
Se deberá detener la perfusión de heparina no fraccionada al menos 6 h antes de la cirugía. En el caso de HBPM, la última dosis se administrará al menos 24 h antes de la intervención.
36. En pacientes con riesgo tromboembólico alto se recomienda la terapia puente con heparina sódica en perfusión continúa, que se deberá suspender 6 h antes del procedimiento.
Recomendación fuerte +. Nivel de evidencia moderado.
37. En pacientes con riesgo tromboembólico alto se puede optar por terapia puente con HBPM, sugiriéndose la administración de la última dosis 24 h antes del procedimiento.
Recomendación débil +. Nivel de evidencia moderado.
Anticoagulación y cirugía urgenteEn ocasiones es necesario intervenir a un paciente de manera urgente o emergente sin disponer del tiempo adecuado para poder suspender con seguridad el tratamiento anticoagulante. En estos casos una determinación del INR (antagonistas de vitamina K), o pruebas cualitativas, como el tiempo de tromboplastina parcial activado o el tiempo de protrombina (ACOD), deben realizarse obligatoriamente antes del procedimiento95.
En caso de no poder diferir la cirugía, se puede contemplar la posibilidad de la reversión con vitamina K, complejo protrombínico o el agente hemostático adecuado96. Siempre se ha de individualizar el riesgo-beneficio por aplicar esta medida, especialmente en pacientes con alto riesgo tromboembólico.
Ayuno preoperatorio y carga de carbohidratosUn aspecto importante para mejorar los resultados de la cirugía cardiaca y la satisfacción del paciente es la disminución del tiempo de ayuno preoperatorio. El ayuno es un requisito para la prevención de la broncoaspiración, pero contribuye al estado catabólico que se produce en respuesta al estrés quirúrgico17,97-99. Desde el trabajo de Maltby et al. en 1986100, se han realizado varios ensayos clínicos aleatorizados en cirugía no cardiaca que han demostrado que la ingesta de líquidos claros no alcohólicos hasta 2 h antes de la inducción de la anestesia y la ingesta sólida ligera hasta 6 h antes de la anestesia general, son prácticas seguras101-103.
En el ámbito de cirugía cardiaca no existen ensayos clínicos amplios sobre este aspecto. En cualquier caso, deberá prestarse especial atención a la población de riesgo, en especial a diabéticos con riesgo de retraso del vaciamiento gástrico. Otros aspectos, como una vía aérea potencialmente difícil, el reflujo gastroesofágico, los síntomas de disfagia y los trastornos de la motilidad y metabólicos también deben tenerse en cuenta103.
38. Se sugiere permitir la ingesta de líquidos claros hasta 2 h antes y los sólidos hasta 6 h antes de la inducción de la anestesia en pacientes que no tengan riesgos específicos de aspiración (reflujo gastroesofágico, retraso del vaciamiento gástrico).
Recomendación débil +. Nivel de evidencia bajo.
La administración de hidratos de carbono dos horas antes de la intervención quirúrgica puede disminuir la resistencia insulínica, mejorar el control glucémico postoperatorio, y favorecer la recuperación del tránsito intestinal. También puede disminuir la incidencia de infecciones quirúrgicas, el número total de complicaciones, la estancia hospitalaria y reducir la sensación de sequedad y hambre23,98,101,102,104-106.
En pacientes con diabetes mellitus sometidos a intervención mayor (incluida cirugía cardiaca), se ha demostrado la no inferioridad de la ingesta preoperatoria de carbohidratos107.
Algunos estudios en cirugía cardiaca han permitido demostrar que la administración de la carga de hidratos de carbono es una práctica segura, sin asociar fenómenos de broncoaspiración, y con algunos resultados beneficiosos en términos de comportamiento hemodinámico y reducción de la incidencia de FA y complicaciones infecciosas108-110.
39. La administración de una carga de hidratos de carbono 2 h antes de la intervención se sugiere como medida para mejorar los resultados quirúrgicos.
Recomendación débil +. Nivel de evidencia bajo.
Manejo de la ansiedad preoperatoriaEn los pacientes que van a intervenirse de cirugía cardiaca, el miedo a lo desconocido y la falta de información actúan como factores determinantes de ansiedad preoperatoria61, lo cual se puede asociar con aumento del requerimiento de analgésicos y de las complicaciones111,112. La ansiedad se manifiesta ya varios días antes del ingreso, por lo que la administración de fármacos ansiolíticos tras el ingreso como única actuación es claramente insuficiente.
La educación preoperatoria puede reducir la ansiedad de los pacientes candidatos a cirugía cardiaca hasta niveles que permiten evitar medicación ansiolítica61,112-115. Si bien el formato elegido para la información (oral, escrito o multimedia) no influye en los niveles de ansiedad, la información adquirida por los pacientes es mayor en formato multimedia que escrita, y la escrita mayor que la oral115.
40. Se recomienda la educación o información preoperatoria como medida para reducir los niveles de ansiedad del paciente hasta un nivel aceptable que permita evitar la necesidad de medicación ansiolítica.
Recomendación fuerte +. Nivel de evidencia moderado.
Tradicionalmente las benzodiacepinas han sido el fármaco más empleado, sin embargo, estudios más recientes sugieren que el uso de agentes no benzodiacepínicos se asocian a menor tiempo de ventilación mecánica y menor estancia en UC61,111,112,114. Además, las benzodiacepinas deben ser evitadas en pacientes mayores de 65 años, dada su mayor sensibilidad y posible retraso en su metabolización, que pueden llevar a deterioro cognitivo, delirium, trastornos psicomotores o aumento del riesgo de caídas116-118.
41. Se recomienda evitar la ansiolisis farmacológica rutinaria preoperatoria, especialmente con ansiolíticos de acción larga.
Recomendación fuerte +. Nivel de evidencia moderado.
42. Los fármacos ansiolíticos y especialmente las benzodiacepinas se recomienda evitarlos en población mayor de 65 años.
Recomendación fuerte +. Nivel de evidencia moderado.
La premedicación multimodal debería incluir una combinación de paracetamol, antiinflamatorios no esteroideos (AINE) y gabapentinoide oral, ajustados por edad y función renal, de tal manera que los niveles plasmáticos óptimos coincidan con el inicio de la cirugía para asegurar al máximo el ahorro de opiáceos.
Respecto a los gabapentinoides como parte de la ansiolisis preoperatoria, conviene distinguir entre gabapentina y pregabalina (fármacos más empleados). La gabapentina ha demostrado efectos adversos indeseables provocando excesiva somnolencia y retrasos en la extubación119,120. En cuanto a la pregabalina, se le atribuyen varios efectos beneficiosos: reducción de los scores de dolor en reposo y en movimiento, reducción del consumo de opioides en las primeras 24 h postcirugía y disminución de la incidencia de náuseas, vómitos y prurito. Aunque la literatura no es extensa, los resultados con el empleo de pregabalina en pacientes de cirugía cardiaca parecen ofrecer ventajas más allá del control del dolor, aportando estabilidad emocional en el postoperatorio. Estudios más extensos son necesarios para poder hacer una recomendación de uso más firme121.
43. Se sugiere la medicación preanestésica multimodal para reducir el consumo de opiáceos con una combinación de paracetamol, AINE y gabapentinoides. Todos los fármacos se deben ajustar según edad y función renal del paciente.
Recomendación débil +. Nivel de evidencia moderado.
44. En el caso de utilizar la premedicación preanestésica multimodal, se sugiere la administración del fármaco gabapentinoide limitandose a una única toma y a la menor dosis posible para evitar sus efectos secundarios sedantes en el postoperatorio si se emplea gabapentina. La pregabalina se perfila como una herramienta útil en la ansiolisis y en la analgesia multimodal, aunque la evidencia es todavía insuficiente.
Recomendación débil +. Nivel de evidencia moderado.
La melatonina podría tener utilidad como alternativa ansiolítica pre y postoperatoria122, pero no se han encontrado estudios en anestesia cardiaca.
Se han propuesto técnicas de meditación especialmente en cirugía de revascularización coronaria no urgente123,124.
45. Se sugiere el uso de la melatonina, administrada en comprimidos orales o por vía sublingual, por su efecto ansiolítico preoperatorio con escasos efectos secundarios.
Recomendación débil +. Nivel de evidencia bajo.
Prevención de la fibrilación auricularLos betabloqueadores han demostrado reducir el riesgo de aparición de FA postoperatoria, por lo que se recomienda mantener el tratamiento en los pacientes que los tomaban previamente. En aquellos pacientes que no tomaban tratamiento betabloqueador previamente, se recomienda iniciar tratamiento oral 2-3 días antes de la cirugía, dosificando la pauta cuidadosamente según la presión arterial y el ritmo cardiaco125,126.
46. Se recomienda mantener el tratamiento con betabloqueadores (o iniciarlo 2-3 días antes de la intervención si no se tomaban previamente) como prevención de la FA postoperatoria.
Recomendación fuerte +. Nivel de evidencia moderado.
En aquellos pacientes que no toleran los betabloqueadores, debe considerarse la amiodarona administrada 5-6 días antes de la cirugía cardiaca como tratamiento profiláctico de la FA. A pesar de haber demostrado ser más eficaz en la prevención de la FA postoperatoria que los betabloqueadores, no se recomienda de primera línea debido a su mayor riesgo de complicaciones125,127-129.
47. En los pacientes que no toleran los betabloqueadores se recomienda administrar amiodarona 5-6 días antes de la intervención para prevenir la FA postoperatoria.
Recomendación fuerte +. Nivel de evidencia alto.
Atendiendo a que una posible fisiopatología de la aparición de la FA postoperatoria se deba a un estrés oxidativo, se ha abogado por el uso de la vitamina C como una terapia coste-efectiva, lo cual viene apoyado en un metaanálisis130, tanto como terapia aislada como asociado a otras actuaciones profilácticas.
48. Se sugiere la administración de vitamina C en el perioperatorio de cirugía cardiaca para prevenir la FA postoperatoria.
Recomendación débil +. Nivel de evidencia bajo.
Descolonización nasal de Staphylococcus aureusEl Staphylococcus aureus es el germen responsable de la mayoría de complicaciones infecciosas de sitio quirúrgico y protésicas tras cirugía cardiaca. Entre el 18 y el 30% de los pacientes que se van a operar presentan colonización nasal, lo cual les supone un riesgo hasta tres veces mayor de presentar bacteriemia o infecciones de herida quirúrgica por S. aureus.
Está ampliamente establecido que se ha de realizar una descolonización de los portadores74,131. Existe la posibilidad de realizar un screening de los mismos mediante cultivo o técnicas de PCR y posteriormente realizar un tratamiento selectivo de los pacientes con resultados positivos132, sin embargo la actual evidencia apunta a realizar una descolonización universal por motivos prácticos, logísticos o de coste-efectividad, aunque advierten de que puede conllevar la aparición de resistencias antibióticas133,134.
El tratamiento descolonizador debe incluir como antibiótico tópico la mupirocina intranasal135,136, pero siempre dentro de un paquete de actuaciones que incluyan educación sobre higiene y duchas diarias con antisépticos como la clorhexidina. Se deberá realizar durante cinco días antes de la intervención.
49. Se recomienda la descolonización de portadores nasales conocidos deStaphylococcus aureusen el preoperatorio de cirugía cardiaca.
Recomendación fuerte +. Nivel de evidencia alto.
50. Se recomienda la descolonización universal de los pacientes que van a ser intervenidos de cirugía cardiaca.
Recomendación fuerte +. Nivel de evidencia moderado.
51. El tratamiento de descolonización se recomienda realizar con mupirocina intranasal y dentro de un paquete de medidas.
Recomendación fuerte +. Nivel de evidencia alto.
Profilaxis antibióticaLos beneficios de la profilaxis antibiótica en cirugía cardiaca son tan evidentes que los estudios frente a placebo serían inadmisibles. Para que sea óptima, se ha de elegir el antibiótico adecuado, con la dosificación y duración correcta.
Elección del antibióticoComo norma general, el antibiótico de elección debe ser una cefalosporina de forma aislada siempre que la tasa de infecciones por Staphylococcus aureus meticilin resistentes (SAMR) no sea alta137.
Dentro de las cefalosporinas se ha de recordar que cuanto mayor sea la generación, menor la actividad frente a grampositivos y mayor frente a gramnegativos. Por tanto, dado que el germen que con mayor frecuencia produce infecciones en nuestros pacientes son los Staphylococcus, se debería tender a usar las de primera o segunda generación (cefazolina o cefuroxima)137-139.
52. Las cefalosporinas están recomendadas como antibiótico aislado de elección para la profilaxis antibiótica en la cirugía cardiaca en poblaciones sin alta tasa de infección por SAMR.
Recomendación fuerte +. Nivel de evidencia alto.
En pacientes alérgicos a los betalactámicos, o en caso de alto riesgo de infección por SAMR, se administrará vancomicina. Dado que el espectro de la vancomicina no permite actuar sobre gramnegativos, se debe asociar otro antibiótico que puede ser la gentamicina (alérgicos a betalactámicos) o la cefazolina (alto riesgo de SAMR)137.
53. En poblaciones con alta incidencia de SAMR o pacientes alérgicos a betalactámicos, la profilaxis antibiótica se sugiere realizar con vancomicina, pero siempre asociada a algún otro antibiótico con espectro de acción sobre gérmenes gramnegativos.
Recomendación débil +. Nivel de evidencia moderado.
Dosificación y duraciónLa primera dosis de cefalosporina debe administrarse dentro de los 60 minutos previos a la intervención137, existiendo evidencias recientes de que el mejor momento es dentro de los 30 min previos140. La dosis inicial de cefazolina será de 1 g o 2 g en pacientes de > 60kg. En caso de que la intervención se prolongue, se debe repetir dosis de 1 g cada 3-4 h137.
La vancomicina se administra con una dosis inicial de 1-1,5 g, o ajustada a peso a razón de 15 mg/kg. Se debe iniciar dentro de los 120 minutos previos a la intervención137, con evidencia de que el mejor momento es cerca de los 30 minutos antes de la incisión140. Se deberá repetir dosis de 7,5 mg/kg durante la CEC137.
La gentamicina se administra con dosis de 4 mg/kg durante los 60 minutos previos a la incisión, sin repetir dosis durante al intervención137.
54. Se recomienda el inicio de la profilaxis antibiótica en el caso de las cefalosporinas durante los 60 minutos previos a la incisión (preferiblemente los últimos 30) y para la vancomicina durante los 120 minutos antes del inicio de la intervención (preferiblemente alrededor del minuto 30 antes de la incisión).
Recomendación fuerte +. Nivel de evidencia moderado.
Tras la intervención, la profilaxis antibiótica se administrará durante las primeras 24-48 h postoperatorias. No se debe prolongar más de 48 h para evitar el riesgo de aparición de resistencias antibióticas o provocar infección por Clostridium difficile138,139,141,142. En ningún caso está justificado ligar la duración de la profilaxis a la permanencia de catéteres, sondas o drenajes torácicos141.
55. En el postoperatorio inmediato de cirugía cardiaca, la profilaxis antibiótica se recomienda mantener durante las primeras 24-48 h.
Recomendación fuerte +. Nivel de evidencia moderado.
Higiene y preparación de la pielEliminación del velloTradicionalmente, se ha asociado el vello a una falta de limpieza y aumento de infección de herida quirúrgica, además de que su eliminación permite una mejor exposición de la zona de incisión y facilita la sutura y colocación de apósitos.
El afeitado tradicional puede producir microtraumas en la piel, habiendo estudios que han asociado este hecho con un aumento de la infección de herida. Por ello, se han propuesto técnicas de recorte del vello con máquinas eléctricas. Existe un tercer método que sería la aplicación de cremas depilatorias, aunque tienen el inconveniente de poder producir reacciones alérgicas y además el tiempo de espera para su actuación es de unos 15-20 min.
Tanto en una revisión de la Cochrane, como en metaanálisis tanto previos como más recientes, no se aprecian diferencias significativas en la aparición de infección de herida entre los pacientes a los que se les elimina el vello y aquellos a los que no se les elimina143-147. Además, en la mayoría de estos metaanálisis y revisiones se apunta a que el método de eliminación de vello que se asocia a mayor tasa de infecciones es el rasurado convencional frente al corte con maquinilla eléctrica. Si bien, se ha de tener en cuenta que estos estudios y metaanálisis no son específicos de cirugía cardiaca, habiendo mucha menor evidencia en nuestra especialidad a este respecto148.
En cuanto al momento en que se realice la eliminación del vello, no hay evidencia de que la eliminación cercana al momento de la intervención reduzca las infecciones, pero las recomendaciones actuales149,150 apuntan a que lo más adecuado, en caso de decidirse eliminar el vello, sería realizarlo lo más cerca de la intervención, pero siempre fuera del quirófano.
56. Se recomienda no eliminar el vello en el preoperatorio a no ser que sea estrictamente necesario. El rasurado convencional se debe evitar, tanto en el preoperatorio como en el quirófano.
Recomendación fuerte -. Nivel de evidencia alto.
57. En caso de realizar eliminación del vello se recomienda utilizar maquinillas eléctricas lo más próximo posible a la intervención, pero siempre fuera del quirófano.
Recomendación fuerte +. Nivel de evidencia moderado.
Baño prequirúrgicoEl objetivo del baño prequirúrgico es conseguir que la piel esté lo más limpia posible y reducir al máximo la carga bacteriana, especialmente en el lugar de la incisión. Esta práctica está recomendada en múltiples guías de práctica clínica151-153.
En cuanto a si el baño se ha de realizar con jabón antiséptico de clorhexidina o con jabones convencionales, en una revisión de la Cochrane154 no se encuentran diferencias significativas, y en las guías actuales no realizan distinción al respecto.
58. Se recomienda realizar un baño completo preoperatorio, bien con jabón normal o con jabón antiséptico.
Recomendación fuerte +. Nivel de evidencia moderado.
Preparación de la piel en el quirófanoSe ha demostrado la superioridad de la clorhexidina sobre la povidona yodada como antiséptico en las cirugía limpia-contaminada155, especialmente la de base alcohólica153, y también específicamente en cirugía cardiaca156.
Por tanto, actualmente se recomienda el uso de clorhexidina al 2% en isopropanolol al 70%, gracias a su efecto inmediato, prolongado en el tiempo y bajo coste152. Es importante tener en cuenta que se debe secar por evaporación antes de la incisión, y tener cuidado con acumulaciones que puedan provocar quemaduras por el bisturí eléctrico. Habitualmente se usan colorantes para permitir identificar el área tratada, sin que existan recomendaciones sobre el colorante óptimo.
59. Se recomienda el uso de soluciones antisépticas de clorhexidina alcohólica para la preparación de la piel en el momento previo a la incisión de cualquier procedimiento quirúrgico de cirugía cardiaca.
Recomendación fuerte +. Nivel de evidencia alto.
Prevención de náuseas y vómitos postoperatoriosLa presencia de náuseas y vómitos postoperatorios (NVPO) suponen una disminución en el bienestar del paciente y un riesgo de complicaciones graves (hemorragia, dehiscencia de suturas quirúrgicas, alteraciones hidroelectrolíticas, aumento del consumo metabólico de oxígeno, etc.) limitan la movilización precoz y la ingesta oral, suponiendo un aumento de los costes del proceso quirúrgico y un impacto negativo en la calidad percibida por el paciente.
La etiología de las NVPO es multifactorial y se han desarrollado distintas escalas que permiten estratificar a los pacientes según sus factores de riesgo. La más empleada para los pacientes quirúrgicos en general, es la escala de Apfel et al.157, en la que los cuatro factores de riesgo que se contemplan son: sexo femenino, antecedentes de cinetosis o NVPO previos, no fumador y el uso de opiáceos postoperatorios. La probabilidad estimada de NVPO es 10, 21, 39, 61 y 78% si ninguno, uno, dos, tres o cuatro de los factores de riesgo están presentes.
Sin embargo, en el ámbito de la cirugía cardiaca, no está tan clara la aplicación de estas escalas y se han identificado además otros factores como: edad menor de 60 años, uso de esteroides intraoperatorios y la extubación al ingreso en la UC. Sin embargo, no se ha establecido correlación con la duración de la CEC.
La identificación del riesgo basal de los pacientes permite adoptar medidas de reducción de riesgo y aplicar la profilaxis farmacológica158-160.
60. En la evaluación preanestésica se recomienda identificar los pacientes con mayor riesgo de desarrollar náuseas y vómitos postoperatorios.
Recomendación fuerte +. Nivel de evidencia alto.
La ansiedad y el control del dolor con opiáceos se asocian con un aumento de NVPO a menudo de difícil control. Una analgesia adecuada puede reducir el estrés y mejorar el confort y recuperación del paciente. Cada vez se impone con más fuerza la necesidad de una analgesia balanceada, combinándose diferentes vías de administración y diferentes fármacos analgésicos o anestésicos para que, de esta forma, sea posible emplear dosis más pequeñas y minimizar los efectos colaterales, entre ellos las NVPO161,162.
61. Se recomienda el control del dolor mediante una estrategia multimodal para reducir las NVPO.
Recomendación fuerte +. Nivel de evidencia alto.
Las NVPO afectan entre un 20% y un 67% de los pacientes intervenidos de cirugía cardiaca. Sin embargo, estudios más recientes en pacientes incluidos en programas de fast-track revelan una incidencia de náuseas del 19,7% y vómitos del 4,3%.
Según estos estudios, la incidencia se considera baja y no prolonga la estancia en la UC, por lo que no se considera necesario la administración de fármacos antieméticos como profilaxis en pacientes sin factores de riesgo163-165.
62. En pacientes sin factores de riesgo, siempre que haya un plan de rescate eficaz, se sugiere no realizar profilaxis sistemática de NVPO.
Recomendación débil +. Nivel de evidencia moderado.
A pesar de que se trata de uno de los mayores objetivos del programa ERAS, sigue existiendo un debate abierto sobre la mejor pauta de profilaxis antiemética para pacientes con factores de riesgo.
Varios grupos pioneros en el desarrollo de fast-track y ERAS en cirugía cardiaca han incluido la administración de ondasetrón en la prevención de NVPO, obteniendo una reducción en la incidencia de NVPO sin encontrar efectos adversos.
En otros grupos, la administración de bajas dosis de dexametasona al inicio de la anestesia también redujo la incidencia de NVPO.
La profilaxis puede realizarse con monoterapia o mediante la asociación de varios fármacos. La monoterapia puede ser adecuada para pacientes con riesgo bajo (Apfel 1 punto) o moderado (Apfel 2 puntos). La combinación de fármacos que bloquean diferentes receptores es aditiva y está indicada en algunos pacientes con riesgo moderado y en todos los pacientes con riesgo alto (Apfel 3-4 puntos). Las combinaciones más utilizadas han sido el droperidol a bajas dosis (0,625 mg-1,25 mg) y/o la dexametasona (4-8 mg) con un antagonista de la serotonina y han demostrado una eficacia similar pero superior a un fármaco único166-174.
63. Se recomienda realizar profilaxis de NVPO, salvo en pacientes sin factores de riesgo.
Recomendación fuerte +. Nivel de evidencia alto.
Las medidas generales incluyen el uso de propofol en la inducción, evitar el óxido nitroso, evitar dosis altas de neostigmina, disminuir los opiáceos perioperatorios, la hidratación adecuada, evitar la hipoxia, la hipoglucemia y el dolor175-177.
64. En pacientes con riesgo moderado o alto de NVPO se sugiere la aplicación de un abordaje multimodal con técnicas perioperatorias y anestésicas que reduzcan el riesgo basal, además de la profilaxis farmacológica.
Recomendación débil +. Nivel de evidencia moderado.
La distensión gástrica aumenta la presión intragástrica y predispone al paciente a sufrir NVPO, especialmente si se ha realizado ventilación manual. La inserción de una sonda nasogástrica durante el procedimiento y hasta la extubación del paciente podría reducir la incidencia de vómitos postoperatorios. Estos resultados concuerdan con los encontrados en cirugía abdominal, aunque se debería tener en cuenta también el impacto sobre la aparición de atelectasias y, probablemente, de neumonía. Sin embargo, se ha de tener en cuenta la posible interferencia de la sonda con la monitorización de ecocardiografía transesofágica (ETE)178,179.
65. El uso de sonda nasogástrica durante la cirugía cardiaca se sugiere como medida para reducir la incidencia de vómitos postoperatorios.
Recomendación débil +. Nivel de evidencia bajo.
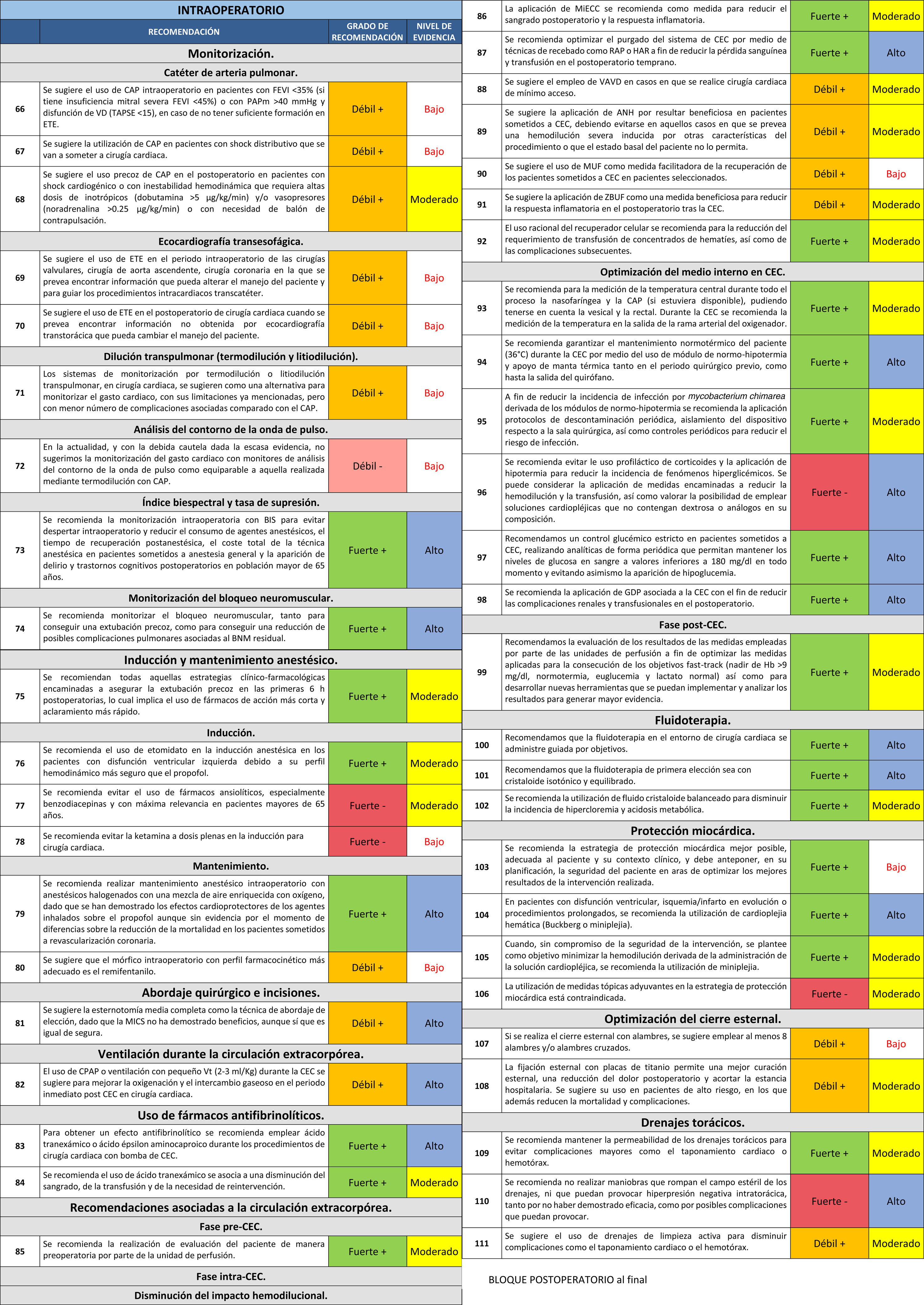
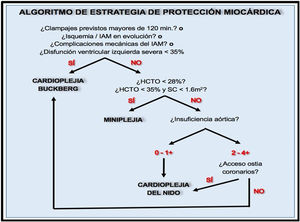
Etapa intraoperatorioMonitorizaciónCatéter de arteria pulmonar (CAP)En algunos ensayos clínicos se ha demostrado que su uso es seguro, al contrario que varios estudios observacionales180-182, pero sin que se observaran beneficios por su utilización. Sin embargo, se ha de tener en consideración que se excluía de los ensayos a los pacientes que ya llevaban el CAP o que, por ser pacientes de alto riesgo, se consideraba que requerían su uso. Algún estudio observacional de gran tamaño apunta a que aporta beneficios en los pacientes más graves183.
El CAP es de especial utilidad frente a la termodilución transpulmonar para distinguir entre disfunción de ventrículo izquierdo (VI) y derecho (VD) como causa del shock cardiogénico184.
Algún estudio cuasiexperimental apunta a beneficios de su empleo en cuanto a complicaciones y estancia hospitalaria185. Además, se ha de tener en cuenta que el CAP permite una detección precoz de la disfunción del VD si se monitoriza la curva de presión del VD de forma continua además de la curva de la presión de arteria pulmonar, dado que la aparición de una pendiente de la curva diastólica del VD con forma de raíz cuadrada o pendiente ascendente apunta a disfunción de VD frente a la pendiente horizontal normal186.
La ecocardiografía en el postoperatorio tiene la limitación de no permitir la monitorización continua y simultánea de varios pacientes frente al CAP.
La Guía de Consenso del 2014 del grupo de expertos en monitorización hemodinámica y shock circulatorio de la European Society of Intensive Care Medicine (ESICM), recomiendan el uso de control continuo del índice cardiaco, además de la utilización de la ecocardiografía187.
66. Se sugiere el uso de CAP intraoperatorio en pacientes con fracción de eyección del VI (FEVI) < 35% (si tiene insuficiencia mitral severa FEVI < 45%) o con presión media de arteria pulmonar (PAPm) > 40 mmHg y disfunción de VD (TAPSE < 15), en caso de no tener suficiente formación en ETE.
Recomendación débil +. Nivel de evidencia bajo.
67. Se sugiere la utilización de CAP en pacientes con shock distributivo que se van a someter a cirugía cardiaca.
Recomendación débil +. Nivel de evidencia bajo.
68. Se sugiere el uso precoz de CAP en el postoperatorio en pacientes con shock cardiogénico o con inestabilidad hemodinámica que requiera altas dosis de inotrópicos (dobutamina > 5 μg/kg/min) y/o vasopresores (noradrenalina > 0,25 μg/kg/min) o con necesidad de balón de contrapulsación.
Recomendación débil +. Nivel de evidencia moderado.
Ecocardiografía transesofágicaMediante la ETE se pueden obtener de manera no invasiva casi todas las variables obtenidas mediante el CAP, excepto la saturación venosa mixta (SvmO2), que se puede sustituir por la saturación venosa central (SvcO2). La ETE da más información acerca del mecanismo de la disfunción cardiaca (función VI, VD, función valvular, valoración estática y dinámica de la volemia). Aunque la necesidad de formación se suele poner como una limitación, los cursos disponibles para la adquisición de competencias en ETE van en aumento. La principal limitación es la imposibilidad de monitorizar simultáneamente a varios pacientes y la imposibilidad de monitorizar el índice cardiaco de manera continua.
El beneficio del uso de la ecocardiografía en el periodo intraoperatorio y postoperatorio de cirugía cardiaca se basa en la experiencia clínica y en estudios observacionales.
Las Guías del 2013 sobre el uso de la ETE de la Sociedad Americana de Ecocardiografía y la Sociedad Americana de Anestesia Cardiaca (ASE/SCA) recomiendan el uso de la ETE en todas las cirugías valvulares y cirugías de aorta torácica y en algunas cirugías coronarias. También recomienda el uso de la ETE en donde existe o se sospecha una patología cardiovascular que puede hacer empeorar el pronóstico del paciente188.
69. Se sugiere el uso de ETE en el periodo intraoperatorio de las cirugías valvulares, cirugía de aorta ascendente, cirugía coronaria en la que se prevea encontrar información que pueda alterar el manejo del paciente y para guiar los procedimientos intracardiacos transcatéter.
Recomendación débil +. Nivel de evidencia bajo.
70. Se sugiere el uso de ETE en el postoperatorio de cirugía cardiaca cuando se prevea encontrar información no obtenida por ecocardiografía transtorácica que pueda cambiar el manejo del paciente.
Recomendación débil +. Nivel de evidencia bajo.
Dilución transpulmonar (termodilución y litiodilución)Se trata de sistemas de monitorización mínimamente invasiva basados en la inyección por la vía central de suero frío o sales de litio, según el sistema, y medido su dilución en el catéter arterial femoral o radial. Por tanto, son sistemas de monitorización discontinua. Estos sistemas suelen asociar también una monitorización no invasiva continua por el análisis del contorno de la onda de pulso.
La validez de estos sistemas tanto frente al gold estándar del CAP, como frente a los basados en el análisis del contorno de la onda de pulso, se ha realizado con estudios observacionales con un número muy pequeño de pacientes, presentando en algunos de ellos unos resultados que los apuntan como el sistema más fiable189-191, mientras que en otros no se evidencian diferencias frente a los sistemas del contorno de la onda de pulso192-194.
Como limitaciones de estos sistemas están el ser un sistema de monitorización intermitente, con posibles valores inexactos en situaciones de muy bajo gasto cardiaco (< 2 l/min), la imposibilidad de determinar si el bajo GC es por disfunción del VI o del VD. Existe también la posibilidad de artefactos con shunt intracardiaco. Los basados en la dilución de litio además no son válidos en pacientes que reciben sales de litio y pueden artefactarse con los relajantes musculares no despolarizantes (son sales).
71. Los sistemas de monitorización por termodilución o litiodilución transpulmonar en cirugía cardiaca se sugieren como una alternativa para monitorizar el gasto cardiaco, con sus limitaciones ya mencionadas, pero con menor número de complicaciones asociadas comparado con el CAP.
Recomendación débil +. Nivel de evidencia bajo.
Análisis del contorno de la onda de pulsoPermiten el cálculo del gasto cardiaco de forma mínimamente invasiva (parámetros obtenidos de un catéter arterial) o no invasivos (tonometría de una arteria del dedo).
La validez de los parámetros de precarga dependencia (variación del volumen sistólico, VVS) en estos sistemas es pobre en los siguientes pacientes:
- •
Pacientes en ventilación mecánica con volumen tidal (Vt) < 8 mL/kg.
- •
Pacientes con ventilación espontanea.
- •
Pacientes con apertura de la caja torácica.
- •
Pacientes con disfunción sistólica del VD.
- •
Pacientes con arritmias cardiacas.
La validación de cada uno de los monitores se ha realizado mediante estudios con muy pocos pacientes, comparando los diversos tipos de monitor entre sí o frente al CAP (considerado como el gold estándar), pero con escasa evidencia en pacientes de cirugía cardiaca191,195-201.
72. En la actualidad, y con la debida cautela dada la escasa evidencia, no sugerimos la monitorización del gasto cardiaco con monitores de análisis del contorno de la onda de pulso como equiparable a aquella realizada mediante CAP.
Recomendación débil -. Nivel de evidencia bajo.
Índice biespectral y tasa de supresiónMantener el índice biespectral (BIS) en valores entre 40 y 60 durante la fase de mantenimiento anestésico permite una dosificación de los hipnóticos que resulta muy beneficiosa para minimizar el riesgo de despertar intraoperatorio, reducir el consumo de agentes anestésicos, tiempo de recuperación postanestésico y coste total en pacientes sometidos a anestesia general202.
El uso del BIS y la monitorización de la tasa de supresión para evitar la sobredosificación de fármacos anestésicos en pacientes mayores, podría reducir el riesgo de delirio y trastornos cognitivos en el postoperatorio203.
73. Se recomienda la monitorización intraoperatoria con BIS para evitar despertar intraoperatorio y reducir el consumo de agentes anestésicos, el tiempo de recuperación postanestésica, el coste total de la técnica anestésica en pacientes sometidos a anestesia general y la aparición de delirio y trastornos cognitivos postoperatorios en población mayor de 65 años.
Recomendación fuerte +. Nivel de evidencia alto.
Monitorización del bloqueo neuromuscular (BNM)En cirugía abdominal está demostrado que las altas presiones intraabdominales pueden empeorar la función cardiaca, impedir la correcta ventilación mecánica y reducir el flujo sanguíneo renal204. Hay evidencia de que la relajación neuromuscular profunda puede permitir alcanzar presiones intraabdominales inferiores a 10-12 mmHg, lo cual resulta beneficioso al contrarrestar los efectos antes descritos205,206.
La acumulación de niveles plasmáticos de relajantes musculares aumenta el riesgo de complicaciones pulmonares postoperatorias207.
La monitorización del BNM con el método de la aceleromiografía (monitorización objetiva) debería ser la utilizada por su mayor objetividad en comparación con el método de la estimulación de nervios periféricos. Además, la reversión del BNM con una relación del TOF (train-of-four) del 90% puede permitir evitar parálisis residual y riesgo de complicaciones pulmonares postoperatorias208.
74. Se recomienda monitorizar el bloqueo neuromuscular, tanto para conseguir una extubación precoz, como para conseguir una reducción de posibles complicaciones pulmonares asociadas al BNM residual.
Recomendación fuerte +. Nivel de evidencia alto.
Inducción y mantenimiento anestésicoSe ha demostrado que la extubación en las primeras seis horas postoperatorias es factible sin comprometer la seguridad del paciente y que se asocia a una reducción significativa de la estancia en la UC209. Se debe realizar la elección de los fármacos idóneos, que aporten la ventaja de no producir depresión miocárdica, aporten estabilidad hemodinámica, y tengan un perfil farmacocinético que nos permitan una extubación precoz con seguridad.
75. Se recomiendan todas aquellas estrategias clínico-farmacológicas encaminadas a asegurar la extubación precoz en las primeras seis horas postoperatorias, lo cual implica el uso de fármacos de acción más corta y aclaramiento más rápido.
Recomendación fuerte +. Nivel de evidencia moderado.
InducciónLa inducción anestésica puede causar graves trastornos hemodinámicos, y la hipotensión arterial posterior a la inducción puede aumentar tanto la morbilidad como la mortalidad, sobre todo en pacientes cardiópatas. Por lo tanto, se debe de realizar de manera muy exquisita, teniendo en cuenta la elección de fármacos con perfil de seguridad y buscando la máxima estabilidad hemodinámica.
El propofol es un fármaco con efecto hipnótico/anestésico de corta acción, usado para la inducción y mantenimiento de la anestesia general y sedación para ventilación mecánica, siendo un poderoso agente sedante.
Las alteraciones hemodinámicas tras la administración del propofol, sobre todo en bolo, consisten en la disminución de la presión arterial media (PAM), la fracción de eyección, el gasto cardiaco y la aparición de taquicardia refleja.
El propofol presenta varios efectos adversos directos e indirectos sobre la función cardiaca que puede inducir a compromiso hemodinámico, especialmente en pacientes con pobre reserva miocárdica e inestabilidad hemodinámica210-213.
El etomidato sería el fármaco hipnótico de elección en pacientes con disfunción ventricular izquierda debido a su perfil hemodinámico más seguro que el propofol, y aunque puede producir supresión del eje adrenal, ese efecto no parece tener relevancia clínica tras la sola administración de la dosis de inducción anestésica214,215.
76. Se recomienda el uso de etomidato en la inducción anestésica en los pacientes con disfunción ventricular izquierda debido a su perfil hemodinámico más seguro que el propofol.
Recomendación fuerte +. Nivel de evidencia moderado.
El uso de benzodiacepinas para la ansiolisis preoperatoria y en la inducción anestésica se ha relacionado con un retraso en el despertar y extubación tardía, asociando una mayor tasa de trastornos cognitivos y delirium en pacientes mayores de 65 años213.
77. Se recomienda evitar el uso de fármacos ansiolíticos, especialmente benzodiacepinas y con máxima relevancia en pacientes mayores de 65 años.
Recomendación fuerte -. Nivel de evidencia moderado.
La ketamina preserva la poscarga, pero al ser un fármaco inotrópico negativo, puede causar hipotensión arterial severa en pacientes con depleción catecolaminérgica, por lo que se aconseja evitar a dosis plenas en cirugía cardiaca215.
78. Se recomienda evitar la ketamina a dosis plenas en la inducción para cirugía cardiaca.
Recomendación fuerte -. Nivel de evidencia bajo.
MantenimientoLos anestésicos volátiles o inhalatorios, frente al propofol, han demostrado preservar mejor la función cardiaca tras la CEC (menor liberación de troponinas), asociarse a menor mortalidad y a menos complicaciones pulmonares216-219. Sin embargo, el ensayo MYRIAD concluye que no existe una reducción significativa de la mortalidad a los 30 días ni al año en pacientes sometidos a cirugía electiva de revascularización coronaria220. Por ello, varias guías clínicas sugieren que esos resultados deberían aplicarse a la anestesia cardiaca74,221.
No existe suficiente evidencia para recomendar el uso de un agente volátil u otro, dado que no se han encontrado diferencias entre el uso de sevoflurano e isoflurano222.
79. Se recomienda realizar mantenimiento anestésico intraoperatorio con anestésicos halogenados con una mezcla de aire enriquecida con oxígeno, dado que se han demostrado los efectos cardioprotectores de los agentes inhalados sobre el propofol, aunque sin evidencia por el momento de diferencias sobre la reducción de la mortalidad en los pacientes sometidos a revascularización coronaria.
Recomendación fuerte +. Nivel de evidencia alto.
En cuanto a la elección del mórfico intraoperatorio parece que es remifentanilo el que tiene un perfil farmacocinético más adecuado, favoreciendo así la extubación precoz. Si se opta por este fármaco se debe tener en cuenta y planificar correctamente la estrategia de analgesia posoperatoria que se ha de administrar al paciente223.
80. Se sugiere que el mórfico intraoperatorio con perfil farmacocinético más adecuado es el remifentanilo.
Recomendación débil +. Nivel de evidencia bajo.
Abordaje quirúrgico e incisionesLa esternotomía media completa es la técnica más empleada porque es la que permite mayor exposición de las estructuras cardiacas, con un 2 a 5% de complicaciones (desde dehiscencia hasta mediastinitis).
La cirugía cardiaca evoluciona hacia procedimientos menos invasivos que permitan disminuir la agresión corporal y el dolor, además de tener mejores resultados estéticos, y que se traduzcan en una reducción de costes debido a una menor estancia hospitalaria y una más rápida incorporación a la vida habitual y siempre con similares resultados en seguridad.
La cirugía mínimamente invasiva (MICS) comprende una variedad de técnicas que no utilizan la esternotomía media completa y que han demostrado ser al menos igual de seguras224-233.
Sin embargo, sigue dependiendo mayoritariamente de la CEC, la parada cardiaca y de una adecuada protección miocárdica, limitando así sus potenciales beneficios, lo que se traduce en que no ha demostrado con evidencia firme una reducción de la estancia en UC u hospitalaria, horas de intubación, sangrado, daño renal, neurológico o cardiaco228.
81. Se sugiere la esternotomía media completa como la técnica de abordaje de elección, dado que la MICS no ha demostrado beneficios, aunque sí que es igual de segura.
Recomendación débil +, Nivel de evidencia alto.
Ventilación durante la circulación extracorpóreaLa disfunción pulmonar postoperatoria que se produce en los pacientes sometidos a cirugía cardiaca es una complicación que está bien descrita y se asocia con una morbilidad y mortalidad significativas234. La presentación clínica es variable, pudiéndose observar desde aumento del trabajo respiratorio y disnea transitoria hasta hipoxemia, atelectasias, neumonía o síndrome de distrés respiratorio235. Los mecanismos fisiopatológicos son variados, incluyendo el cese de la circulación pulmonar y de la ventilación y el aumento de mediadores inflamatorios desencadenado por la CEC236.
Se ha postulado que la continuación de alguna forma de ventilación durante la CEC podría atenuar estos efectos adversos. En esta línea apuntan algunos metaanálisis en los que el uso de presión positiva continua en las vías aéreas (CPAP), maniobras de reclutamiento a capacidad vital o continuar la ventilación mecánica mejoran la oxigenación, aunque no modifican el pronóstico236-238. Algunos ensayos clínicos aleatorizados apoyan el uso de ventilación mecánica por disminuir la liberación sistémica y pulmonar de mediadores de la inflamación239-241.
No hay estudios de calidad sobre los efectos de diferente fracción inspirada de oxígeno (FiO2) durante la CEC en cuanto a oxigenación y complicaciones o repercusiones pulmonares.
82. El uso de CPAP o ventilación con pequeño volumen tidal (2-3 mL/kg) durante la CEC se sugiere para mejorar la oxigenación y el intercambio gaseoso en el periodo inmediato posterior a la CEC en cirugía cardiaca.
Recomendación débil +. Nivel de evidencia alto.
Uso de fármacos antifibrinolíticosLa hemorragia durante el perioperatorio de cirugía cardiaca es una complicación común y su aparición puede empeorar los resultados242.
Los fármacos antifibrinolíticos, como el ácido tranexámico y el ácido ?-aminocaproico, son de adecuada disponibilidad, bajo perfil de riesgo, alta rentabilidad y fácil implantación243-245, por lo que son ampliamente empleados en la práctica habitual. Está recomendado su uso desde el inicio de la intervención para prevenir la hiperfibrinolisis que se produce durante el procedimiento. La mayor evidencia se tiene en cirugías con CEC.
El ácido tranexámico ha demostrado disminuir el sangrado, la necesidad de reintervención y los requerimientos transfusionales246,247.
La dosificación de estos fármacos aún no está completamente establecida. Las dosis altas, sin aportar beneficio, parecen asociar convulsiones como efecto secundario, por ello la dosis máxima recomendada es de 10 mg/kg y precisa ajuste en pacientes con insuficiencia renal248.
83. Para obtener un efecto antifibrinolítico se recomienda el empleo de ácido tranexámico o ácido épsilon aminocaproico durante los procedimientos de cirugía cardiaca con CEC.
Recomendación fuerte +. Nivel de evidencia alto.
84. Se recomienda el uso de ácido tranexámico dado que se asocia con una disminución del sangrado, de la transfusión y de la necesidad de reintervención.
Recomendación fuerte +. Nivel de evidencia moderado.
Recomendaciones asociadas con la circulación extracorpóreaLa optimización de la CEC recoge una serie de estrategias de perfusión durante todo el proceso quirúrgico encaminadas a limitar la agresión y optimizar el medio interno del paciente con el fin de permitir una extubación precoz, así como garantizar la continuidad de la cadena de tratamiento multidisciplinar249.
Estas estrategias las podemos dividir en pre-CEC, intra-CEC y post-CEC.
Fase pre-CECExiste consenso por parte de las sociedades europeas de cirugía, anestesia y perfusión cardiovascular al respecto de que resulta crucial la realización de una evaluación preoperatoria del paciente por parte de la unidad de perfusión, a fin de establecer la estrategia general y disponer de las herramientas individualizadas que permitan optimizar la consecución de la CEC249,250.
En esta fase serán tenidas en cuenta condiciones como las medidas antropométricas, parámetros hematológicos y bioquímica, función renal, patología vascular periférica, historial de eventos isquémicos previos y estado nutricional, pudiéndose establecer parámetros de predicción de riesgo que permitan predecir el éxito en la rehabilitación temprana, como el score PERF251.
Además de las características previas del paciente, resulta necesario considerar las peculiaridades de la intervención propuesta a fin de individualizar el tipo de circuito a emplear y del tipo de estrategia de protección miocárdica, así como la aplicación de otras herramientas terapéuticas y de monitorización en el periodo intra-CEC250.
85. Se recomienda la realización de la evaluación del paciente de manera preoperatoria por parte de la unidad de perfusión.
Recomendación fuerte +. Nivel de evidencia moderado.
Fase intra-CECDisminución del impacto hemodilucionalEn esta fase serán puestas en marcha las estrategias previamente planificadas a fin de contener el impacto a nivel transfusional e inflamatorio por medio de medidas encaminadas a la reducción de la superficie de contacto y la protección del nadir del hematocrito por resultar predictor de transfusión en el periodo perioperatorio temprano y hasta el alta252. La transfusión asociada con cirugía cardiaca con CEC se relaciona con un aumento del tiempo de ventilación mecánica, de las complicaciones en el postoperatorio temprano, así como de la mortalidad perioperatoria252-254.
Las diferentes estrategias son: circulación extracorpórea mínimamente invasiva (MiECC), recebado sanguíneo del circuito, drenaje venoso activo por vacío (DVAV), hemodilución aguda normovolémica (ANH), la ultrafiltración modificada (MUF) y la ultrafiltración de balance cero (ZBUF).
La MiECC consiste en la aplicación de un sistema de CEC cerrado, de superficie de contacto reducida y biocompatible, con cabezal arterial centrífugo, oxigenador de membrana, intercambiador de calor, sistema de cardioplejia, atrapa-burbujas venoso y un sistema de aspiración con procesamiento independiente del sangrado mediastínico del tipo recuperador celular255. La combinación de estas medidas hace que deba ser considerado su uso para reducir la pérdida sanguínea y las necesidades perioperatorias de hemoderivados, así como aumentar la biocompatibilidad y reducir la respuesta inflamatoria, siendo evidenciable por una menor presencia de citocinas proinflamatorias en el postoperatorio que puede favorecer la recuperación del paciente256. A pesar de ello no existe fuerte evidencia de que suponga una mejora en el resultado total del proceso, existiendo consenso de expertos acerca de que se trata de una medida a contemplar a fin de mejorar los resultados250.
86. La aplicación de MiECC se recomienda como medida para reducir el sangrado postoperatorio y la respuesta inflamatoria.
Recomendación fuerte +. Nivel de evidencia moderado.
La aplicación de medidas de recebado sanguíneo del circuito basan su beneficio en la reducción de la agresión hemodilucional al paciente por medio del desplazamiento de la solución cristaloide que compone el cebado inicial del circuito con sangre autóloga del paciente, reduciendo así la transfusión de concentrados de hematíes y las complicaciones perioperatorias257. El purgado autólogo retrógrado (RAP), así como el recebado anterógrado hemático (HAR) cuentan con el máximo nivel de recomendación y evidencia para reducir la exposición a hemoderivados y sus complicaciones en el postoperatorio temprano y hasta el alta250,252.
87. Se recomienda optimizar el purgado del sistema de CEC por medio de técnicas de recebado como RAP o HAR a fin de reducir la pérdida sanguínea y transfusión en el postoperatorio temprano.
Recomendación fuerte +. Nivel de evidencia alto.
El DVAV permite optimizar el retorno venoso y facilitar la labor quirúrgica en la aplicación de MICS, lo que puede suponer una reducción en los tiempos de ventilación mecánica, el sangrado y la transfusión perioperatoria258, debiendo emplearse siempre un reservorio validado para tal efecto250, evitando los potenciales riesgos a nivel embólico y hemolítico asociados con elevadas presiones de succión (< -40 mmHg)259,260, su utilización puede asociarse con una menor tasa transfusional temprana sin presencia de un aumento de complicaciones y mortalidad postoperatoria.
88. Se sugiere el empleo de DVAV en casos en que se realice cirugía cardiaca de mínimo acceso.
Recomendación débil +. Nivel de evidencia moderado.
La ANH consiste en el secuestro preoperatorio de sangre completa del paciente a través de un catéter venoso central, con reposición de volumen por medio de solución cristaloide, para su almacenamiento y reinfusión tras las CEC260. La evidencia actual indica que su aplicación supone una reducción en el sangrado y las transfusiones en el perioperatorio temprano. A pesar de ello, han de ser consideradas previamente las características del paciente en cuanto a volemia circulante y hematocrito de manera previa a su indicación, a fin de evitar efectos derivados de una hemodilución severa a nivel microcirculatorio como la disfunción renal, ya que podría resultar contraproducente259,261. Del mismo modo, algunos autores refieren alteraciones potenciales en la hemostasia primaria afectando la función plaquetaria, derivadas del almacenamiento sanguíneo, que aún han de ser clarificadas260,262.
89. Se sugiere la aplicación de ANH por resultar beneficiosa en pacientes sometidos a CEC, debiendo evitarse en aquellos casos en que se prevea una hemodilución severa inducida por otras características del procedimiento o que el estado basal del paciente no lo permita.
Recomendación débil +. Nivel de evidencia moderado.
La MUF fue inicialmente descrita para cirugía cardiaca infantil. Permite retirar agua plasmática al final de la CEC, elevando el hematocrito e incrementando la concentración de factores de la coagulación y el recuento plaquetario263. En el paciente adulto puede aportar beneficios a nivel de sangrado perioperatorio y transfusional, pero no se traducen de una manera clara en un acortamiento del tiempo de ventilación mecánica y estancia en la UC en términos generales dado que, paralelamente, acarrea un aumento en la respuesta inflamatoria perioperatoria mediada por el factor de necrosis tumoral alfa (TNF-α)263-266. Puede resultar beneficiosa en pacientes seleccionados como los cirróticos sometidos a cirugía valvular al mejorar el sangrado y la función hepática, acortando la estancia267.
90. Se sugiere el uso de MUF como medida facilitadora de la recuperación de los pacientes sometidos a CEC en pacientes seleccionados.
Recomendación débil +. Nivel de evidencia bajo.
La ZBUF es una técnica de ultrafiltración de alto rendimiento, que ha mostrado ofrecer beneficios atenuando la respuesta inflamatoria en niños y acortando el tiempo de ventilación mecánica268. En adultos puede reducir los valores de interleucinas (IL-6, IL-10), TNF-α y troponina I269, disminuir la tasa de infecciones postoperatorias y optimizar los niveles de marcadores de disfunción renal como la relación NGAL/Cr (lipocalina asociada con la gelatinasa de neutrófilos/creatinina), urea, Cr e índice de filtrado glomerular, así como presentar resultados significativamente mejores en un indicador compuesto que aglutina muerte, infarto e ictus270. A pesar de todo ello, aún no se cuenta con suficiente evidencia para demostrar que supone una reducción en la estancia en la UC y el tiempo de ventilación mecánica en el adulto271.
91. Se sugiere la aplicación de ZBUF como una medida beneficiosa para reducir la respuesta inflamatoria en el postoperatorio tras la CEC.
Recomendación débil +. Nivel de evidencia moderado.
El uso del recuperador celular permite obtener concentrados de hematíes de la sangre aspirada del campo quirúrgico, con lo que se consigue una reducción de la transfusión de hematíes en el postoperatorio. Sin embargo, no permite una reducción de la morbimortalidad272.
Algunos autores indican, por el contrario, que puede llegar a reducir la estancia en la UC y las complicaciones postoperatorias debido a la reducción de la activación de la cascada inflamatoria gracias al procesamiento de la sangre expuesta al mediastino273.
Por otro lado, se recomienda su uso en el procesamiento de la sangre contenida en el circuito tras la finalización de la CEC a pesar de que existe cierta controversia respecto a sus beneficios reales250.
La sobreutilización del recuperador podría resultar contraproducente por incrementar el sangrado y el consumo de hemoderivados, sin que haya consenso sobre el umbral en el que comenzarían los efectos indeseados ni de si su uso se debe limitar al periodo previo a la CEC y la recuperación del remanente del circuito o de si resulta conveniente su uso durante toda la cirugía250,272-274.
92. El uso racional del recuperador celular se recomienda para la reducción del requerimiento de transfusión de concentrados de hematíes, así como de las complicaciones subsecuentes.
Recomendación fuerte +. Nivel de evidencia moderado.
Optimización del medio interno en CEC- a)
Manejo de la temperatura
Desde los albores de la cirugía cardiovascular a corazón parado se ha realizado CEC bajo condiciones de hipotermia, presuponiéndole un papel protector para el paciente.
Sin embargo, la disminución de la temperatura está directamente relacionada con el aumento del riesgo de infección, de disfunción plaquetaria durante las primeras 24 h posteriores a la cirugía, así como del subsecuente aumento del sangrado y de la mortalidad perioperatoria275,276. La hipotermia altera la farmacocinética y farmacodinamia de fármacos empleados para la anestesia como hipnóticos y relajantes musculares, lo que puede dificultar la extubación precoz276,277.
El mantenimiento de la normotermia prevendría la sensación de incomodidad en el paciente y los temblores asociados con la hipotermia, el aumento de la presión arterial y frecuencia cardiaca, así como la liberación de catecolaminas que aumentan el riesgo de eventos indeseables a nivel cardiológico y hemodinámico en el postoperatorio temprano de los pacientes sometidos a cirugía cardiaca276-278. La evidencia actual indica que está asociada con una disminución de los requerimientos transfusionales, menor incidencia de hiperglucemia, así como de neumonía, sepsis y disfunción en las funciones cognitivas durante el postoperatorio279,280.
Para garantizar un adecuado control térmico, se insta al uso de monitorización en múltiples canales contemplando tanto el paciente como el circuito281,282.
93. Se recomienda para la medición de la temperatura central durante todo el proceso han de considerarse la nasofaríngea y la CAP (si estuviera disponible), pudiendo tenerse en cuenta la vesical y la rectal. Durante la CEC se recomienda la medición de la temperatura en la salida de la rama arterial del oxigenador.
Recomendación fuerte +. Nivel de evidencia moderado.
94. Se recomienda garantizar el mantenimiento normotérmico del paciente (36 ̊C) durante la CEC por medio del uso de módulo de normo-hipotermia y apoyo de manta térmica tanto en el periodo quirúrgico previo, como hasta la salida del quirófano.
Recomendación fuerte +. Nivel de evidencia alto.
Dado el rol esencial de los módulos de normo-hipotermia y los recientes hallazgos epidemiológicos a pesar de no mostrar su efecto en el postoperatorio temprano, ha de tenerse en especial consideración la aplicación de medidas encaminadas a reducir el riesgo de contaminación del ambiente quirúrgico por Mycobacterium chimaera, que podría generarse en dichos dispositivos y liberarse al ambiente en forma de aerosol, causando un aumento de la morbilidad del paciente a medio plazo283,284.
95. A fin de reducir la incidencia de infección porMycobacterium chimaeraderivada de los módulos de normo-hipotermia se recomienda la aplicación protocolos de descontaminación periódica, aislamiento del dispositivo respecto a la sala quirúrgica, así como controles periódicos para reducir el riesgo de infección.
Recomendación fuerte +. Nivel de evidencia moderado.
- b)
Glucemia en CEC
La hiperglucemia durante el periodo perioperatorio en cirugía cardiovascular se asocia con una mayor morbimortalidad debida a causas de origen isquémico e infeccioso tanto en pacientes diabéticos como en aquellos que no cuentan con dicho diagnóstico previo285,286. Diversas circunstancias directamente vinculadas a la CEC como el uso de corticoides, la hipotermia, la hemodilución o la composición de la cardioplejia pueden suponer factores modificables que fomenten la hiperglucemia incluso en pacientes no diabéticos.
El uso de corticoides puede contribuir a reducir la respuesta inflamatoria sistémica y el riesgo de fibrilación postoperatoria, pero puede provocar hiperglucemia y aumentar el riesgo de infarto de miocardio perioperatorio, por lo que se han de limitar sus indicaciones250,287-290.
La hipotermia lleva a una reducción de la producción de insulina y a una disminución de la respuesta tisular a la misma, por lo que se recomienda mantener la normotermia siempre que el paciente y la intervención lo permitan, para facilitar el control glucémico279,280.
Se ha observado que, en pacientes no diabéticos, un nadir de hematocrito < 20% y la transfusión de hemoderivados son factores predictores independientes de hiperglucemia y mayor morbimortalidad en el postoperatorio287,291.
Hay dos tipos principales de cardioplejia, las que contienen dextrosa (Buckberg, etc.) y las que no lo llevan (Del Nido, Calafiore, etc.). El uso de cardioplejia con base dextrosa supone mayor elevación de la glucemia intraoperatoria y requerimiento de insulina292,293.
96. Se recomienda evitar el uso profiláctico de corticoides y la aplicación de hipotermia para reducir la incidencia de fenómenos hiperglicémicos. Se puede considerar la aplicación de medidas encaminadas a reducir la hemodilución y la transfusión, así como valorar la posibilidad de emplear soluciones cardiopléjicas que no contengan dextrosa o análogos en su composición.
Recomendación fuerte -. Nivel de evidencia alto.
Se ha observado que los pacientes sometidos a CEC tratados con un estricto control glucémico se asocian con una menor mortalidad, menor dependencia de marcapasos, FA, tiempos más cortos de ventilación mecánica y menor estancia en la UC, favoreciendo la aplicación de estrategias de fast-track y aumentando la supervivencia a cinco años en cirugía coronaria, si bien se puede permitir un control ligeramente más liberal de la glucemia en aquellos pacientes con diabetes preexistente250,294.
El control glucémico estricto se establece a fin de evitar cifras de glucemia superiores a 180 mg/dL durante la CEC295,296. A fin de lograr un correcto control glucémico existe evidencia a favor del uso de perfusión continua computerizada en base a los niveles de glucosa en sangre297, pudiendo llegar a considerarse el empleo de bolos si se usa cardioplejia con base de dextrosa298. En todo caso, se requerirá siempre adaptar la pauta a las determinaciones analíticas y las condiciones del paciente, ya que habrá de evitarse la hipoglucemia por sus efectos deletéreos296-298.
97. Recomendamos de un control glucémico estricto en pacientes sometidos a CEC, realizando analíticas de forma periódica que permitan mantener los niveles de glucosa en sangre a valores inferiores a 180 mg/dL en todo momento y evitando asimismo la aparición de hipoglucemia.
Recomendación fuerte +. Nivel de evidencia alto.
- c)
Perfusión dirigida a objetivos (GDP)
La estrategia de GDP está encaminada principalmente a reducir la incidencia de daño renal agudo (DRA), incluso en fase i299,300, que se asocia con una alta morbimortalidad y aumento de costes en el postoperatorio301,302. El aporte de oxígeno (DO2) durante la CEC es un factor determinante para la disminución de la aparición de DRA.
El manejo de las estrategias GDP van dirigidas a proporcionar un DO2i > 280 mL/min/m2 durante la CEC300 mediante la aplicación, combinación, o ambas, de tres actuaciones:
- •
Adaptación del gasto cardiaco de bomba a los requerimientos.
- •
Aplicación de maniobras y estrategias encaminadas al incremento o preservación de los valores de Hb.
- •
Regulación de la FiO2 entregada a través de la membrana de oxigenación por el mezclador de gases, para optimizar la presión parcial de oxígeno arterial (PaO2).
De este modo, la estrategia GDP podría permitir el manejo del paciente con mayor tolerancia a un nadir más bajo de los niveles de Hb, garantizando en todo momento una adecuado DO2i por medio del aumento de gasto de bomba303 y reduciendo el uso de productos hemoderivados304.
98. Se recomienda la aplicación de GDP asociada con la CEC con el fin de reducir las complicaciones renales y transfusionales en el postoperatorio.
Recomendación fuerte +. Nivel de evidencia alto.
Fase post-CECEn esta fase es crucial la evaluación por parte de las unidades de perfusión a fin de arrojar una evidencia más sólida acerca de la aplicación de las medidas propuestas anteriormente, así como de las que pudieran implementarse teniendo como objetivo el mantenimiento de la normotermia, la euglucemia, la correcta perfusión tisular y la hemostasia del medio interno como medidas que puedan favorecer el alta y recuperación precoces249.
Se han de recopilar los datos relativos a la perfusión, así como evaluarlos posteriormente, a fin de incrementar la calidad en términos de eficiencia y seguridad para el paciente, así como desarrollar nueva literatura científica que pueda aportar nuevas medidas a considerar o ahondar en el conocimiento existente de las actualmente estimadas250,259,305.
99. Recomendamos la evaluación de los resultados de las medidas empleadas por parte de las unidades de perfusión a fin de optimizar las medidas aplicadas para la consecución de los objetivosfast-track(nadir de Hb, normotermia, euglucemia y lactato normal), así como para desarrollar nuevas herramientas que se puedan implementar y analizar los resultados para generar mayor evidencia.
Recomendación fuerte +. Nivel de evidencia moderado.
FluidoterapiaLos importantes cambios volumétricos que se producen durante la cirugía cardiaca hacen imprescindible una monitorización adecuada para evitar tanto la hipovolemia como la sobrecarga hídrica. Se realiza principalmente a través de los parámetros dinámicos extraídos dependiendo de la situación previa del paciente de la monitorización invasiva (CAP) o de la monitorización con ETE intraoperatoria o ecocardiografía transtorácica en el postoperatorio306. El uso de fluidoterapia guiada por objetivos en cirugía cardiaca durante todo el perioperatorio permite individualizar el uso de fluidos intravenosos, vasopresores e inotrópicos y lograr objetivos hemodinámicos específicos307, optimizando así la DO2 y la perfusión de órganos y contribuyendo a evitar el descenso de la Hb y en algunos casos las necesidades transfusionales. Como efecto directo, la restricción del aporte de fluidos disminuye la hemodilución, y esta práctica tiene una importante evidencia científica formando parte de los protocolos de ahorro de sangre308. La evidencia disponible hasta este momento apunta a que permite una disminución de las complicaciones a los 30 días, la incidencia de DRA y la estancia hospitalaria309-311.
100. Recomendamos que la fluidoterapia en el entorno de cirugía cardiaca se administre guiada por objetivos.
Recomendación fuerte +. Nivel de evidencia alto.
Respecto al tipo de fluidoterapia intravenosa recomendada en este momento se aboga por los cristaloides isotónicos y equilibrados ya que los estudios con el uso de los cristaloides balanceados no han conseguido evidenciar mejoría en las complicaciones, aunque si en la disminución de la aparición de hipercloremia y acidosis metabólica312.
101. Se recomienda que la fluidoterapia de primera elección sea con cristaloide isotónico y equilibrado.
Recomendación fuerte +. Nivel de evidencia alto.
102. Se recomienda la utilización de fluido cristaloide balanceado para disminuir la incidencia de hipercloremia y acidosis metabólica.
Recomendación fuerte +. Nivel de evidencia moderado.
Protección miocárdicaLa protección miocárdica intraoperatoria constituye un aspecto fundamental para el éxito del procedimiento quirúrgico. Así, debe ser considerada como una verdadera estrategia más que la mera administración protocolizada de una solución cardiopléjica. Aún hoy se debate en la literatura sobre la «mejor» solución cardiopléjica cuando, dado el abanico disponible (tabla 7), debería orientarse la discusión preferentemente hacia cuál es la solución más «adecuada» según cada procedimiento quirúrgico y contexto clínico313.
La variedad de soluciones cardiopléjicas, modificaciones de las mismas y protocolos de utilización es amplia en la literatura, comportando una importante heterogeneidad para su análisis. La disponibilidad de estudios comparativos es limitada, siendo la mayoría de ellos no aleatorizados, analizando escenarios clínicos diversos (enfermedad coronaria, enfermedad valvular aislada, cirugía cardiaca en general, etc.). No obstante, basados en la evidencia, se puede proponer el siguiente algoritmo de decisión314-320 para adaptar las indicaciones a las circunstancias particulares de cada paciente (fig. 2).
103. Se recomienda la estrategia de protección miocárdica utilizada mejor posible, adecuada al paciente y su contexto clínico, y debe anteponer, en su planificación, la seguridad del paciente en aras de optimizar los mejores resultados de la intervención realizada.
Recomendación fuerte +. Nivel de evidencia bajo.
La dilución de la solución de cardioplejia junto con sangre en proporción 4:1 es característica de la solución de Buckberg, que es especialmente útil al incorporar agentes tampón, antioxidantes y de sustrato energético a los presentes en la propia sangre cuando se prevé importante vulnerabilidad del miocardio al daño isquemia-reperfusión321-323. La «estrategia Buckberg» comporta la utilización de soluciones específicas para la inducción, el mantenimiento y la reperfusión, adaptadas a las necesidades del miocardio en cada momento, a fin de minimizar el daño por isquemia y reperfusión. Indicaciones similares presenta la miniplejia, que es una simplificación de solución extracelular que añade a la sangre completa diferentes concentraciones de potasio y magnesio para adaptarlas a las fases de inducción, mantenimiento y reperfusión. Ambas destacan por la versatilidad de administración, pudiendo utilizarse por vía anterógrada o retrógrada, si bien requieren redosificaciones cada 15-20 minutos.
104. En pacientes con disfunción ventricular, isquemia/infarto en evolución o procedimientos prolongados, se recomienda la utilización de cardioplejia hemática (Buckberg o miniplejia).
Recomendación fuerte +. Nivel de evidencia alto.
La miniplejia o solución de Calafiore, al carecer de otros componentes salvo sangre, potasio y magnesio, es especialmente eficaz a la vez que limita los efectos deletéreos de la hemodilución324.
105. Cuando, sin compromiso de la seguridad de la intervención, se plantee como objetivo minimizar la hemodilución derivada de la administración de la solución cardiopléjica, se recomienda la utilización de miniplejia.
Recomendación fuerte +. Nivel de evidencia moderado.
Aunque se han propuesto modificaciones y aditivos a la composición de las soluciones de cardioplejia, no puede emitirse recomendación alguna ante la debilidad de la evidencia hallada, recomendándose respetar la formulación original de todas ellas; bien sean comercializadas, bien sean elaboradas en cada institución325-328. Si bien las soluciones de Del Nido, Custodiol, St. Thomas II o Celsior, permiten tiempos superiores al de las anteriormente citadas para la redosificación en pacientes adultos, no existe consenso sobre el protocolo de redosificación óptima, debiendo establecerse protocolos internos en cada institución basados en la literatura y respetados durante el procedimiento quirúrgico. La vía de administración en todas ellas reconocida en la literatura es fundamentalmente anterógrada, aceptándose la vía retrógrada sólo en el caso de la St. Thomas II.
Las medidas tópicas no se recomiendan porque no ofrecen sinergia alguna a la protección ofrecida por la administración de las soluciones cardiopléjicas y son fuente de importante morbilidad por criolesión del nervio frénico329,330.
La administración guiada por dispositivos como la sonda de temperatura septal no dispone de evidencia sólida para emitir alguna recomendación.
106. La utilización de medidas tópicas adyuvantes en la estrategia de protección miocárdica está contraindicada.
Recomendación fuerte -. Nivel de evidencia moderado.
Optimización del cierre esternalLa esternotomía media es el acceso más frecuente en la cirugía cardiaca. El procedimiento más habitual y extendido de cierre es mediante cerclaje con alambres de acero debido a la facilidad de uso, rapidez, bajo coste y un relativamente bajo índice de complicaciones.
Lo más extendido es el cierre con seis alambres simples, pero existe cierta evidencia de que se deben emplear al menos ocho alambres, y si el esternón es osteoporótico mejor con alambres cruzados331-333.
107. Si se realiza el cierre esternal con alambres, se sugiere emplear al menos ocho alambres, alambres cruzados o ambos.
Recomendación débil +. Nivel de evidencia bajo.
El uso de alambres de refuerzo longitudinales paraesternales (Robicsek) no ha demostrado una clara ventaja en pacientes de alto riesgo334,335.
La extensión natural de los principios en la estabilización de huesos aprendidos en otras localizaciones del cuerpo humano nos lleva al empleo de sistemas de fijación rígida mediante placas de titanio atornilladas al esternón, costillas o ambos. La evidencia apunta a una mejor y más rápida curación del esternón, que conlleva una reducción del dolor y permite una recuperación precoz del paciente y acorta la estancia hospitalaria 336-338. En pacientes de alto riesgo está especialmente indicado su uso, porque permiten reducir las complicaciones y la mortalidad339.
108. La fijación esternal con placas de titanio permite una mejor curación esternal, una reducción del dolor postoperatorio y acortar la estancia hospitalaria. Se sugiere su uso en pacientes de alto riesgo, en los que además reducen la mortalidad y complicaciones.
Recomendación débil +. Nivel de evidencia moderado.
Se puede recomendar un algoritmo de cierre esternal tras analizar la presencia o no de factores de riesgo: 1) sexo femenino y obesidad; 2) diabetes; 3) enfermedad obstructiva pulmonar severa; 4) extracción bilateral de arteria mamaria; y 5) esternotomía fuera de la línea media340 (fig. 3).
Algoritmo sugerido de cierre esternal según factores de riesgo (modificado de Nenna A. et al.)340
Tras la cirugía cardiaca se requiere siempre dejar algún tipo de drenaje que permita evacuar el sangrado que se presenta siempre en una menor o mayor cantidad, puesto que, de lo contrario, su acumulación podría llevar a provocar hemotórax o taponamiento cardiaco, entidades con incidencia desde un dos a un 19%341,342, y que conllevan peor pronóstico.
Sin embargo, los tubos de drenaje tienden a coagularse en la práctica clínica, pudiendo llegar hasta al 36% con algún grado de obstrucción por coagulación interna343.
109. Se recomienda mantener la permeabilidad de los drenajes torácicos para evitar complicaciones mayores como el taponamiento cardiaco o hemotórax.
Recomendación fuerte +. Nivel de evidencia moderado.
Para asegurar la permeabilidad de los tubos, existen varias técnicas para fragmentar los coágulos y facilitar su salida, que se pueden realizar a pie de cama por enfermería, como el ordeño (milking), la creación de presión negativa mediante oclusión cerca del paciente y vaciado del tubo hacia el colector (stripping) o comprimir varios segmentos del tubo plegados sobre sí mismo (fanfolding). Todas estas maniobras en múltiples estudios y revisiones se ha demostrado que no solo no son de utilidad, sino que incluso podrían producir daños internos por el aumento de la presión negativa344-347, por lo que no se deben realizar.
También hay quien desconecta los tubos y pasa un catéter por su interior para limpiarlos348, lo cual rompe el campo estéril y la propia sonda introducida puede producir daños en estructuras internas, por lo que tampoco se debe realizar esta maniobra.
Actualmente se puede recomendar, en caso de utilizar drenajes clásicos o acanalados, el dejar el tubo en posición horizontal en la cama del paciente y luego verticalmente hasta el sistema colector, no realizar maniobras que rompan el campo estéril y en todo caso, de ser absolutamente imprescindible, realizar unas compresiones suaves del tubo (milking o fanfolding)345.
110. Se recomienda no realizar maniobras que rompan el campo estéril de los drenajes, ni que puedan provocar hiperpresión negativa intratorácica, tanto por no haber demostrado eficacia, como por posibles complicaciones que puedan provocar.
Recomendación fuerte -. Nivel de evidencia alto.
Existen tres tipos fundamentales de drenajes: los convencionales, los acanalados o tipo Blake® y los de limpieza activa.
Entre los dos primeros tipos de drenaje, se han realizado estudios con los que no se aprecian diferencias entre ellos, por lo que cualquiera puede tener la misma utilidad349,350. Por último, se han desarrollado un tipo de drenajes con limpieza activa. Los estudios que analizan esta nueva tecnología aportan resultados esperanzadores, aunque no totalmente concluyentes351-354. Por tanto, se puede considerar el empleo de drenajes de limpieza activa con la intención de disminuir las complicaciones de taponamiento o hemotórax debidas a coagulación de los drenajes.
111. Se sugiere el uso de drenajes de limpieza activa para disminuir complicaciones como el taponamiento cardiaco o el hemotórax.
Recomendación débil +. Nivel de evidencia moderado.
Consultar la tabla 8
Periodo postoperatorioAnalgesia multimodalLa naturaleza multifactorial y la diversidad de vías de transmisión nociceptiva que actúan en el dolor postoperatorio justifican la utilización de analgesia multimodal para su control. Dentro de un programa de recuperación intensificada de cirugía, las diversas estrategias de la analgesia multimodal no sólo persiguen mejorar el control del dolor postoperatorio y reducir el estrés quirúrgico sino también reducir la disfunción multiorgánica inducida por el dolor no controlado, reducir los efectos secundarios asociados principalmente con los opioides u otras medicaciones antiálgicas, y facilitar una recuperación temprana de la ingesta oral y de la movilización, todo ello con el fin último de acelerar la recuperación postquirúrgica355.
112. La analgesia multimodal está recomendada/indicada como elemento fundamental de un programa RICC.
Recomendación fuerte +. Nivel de evidencia moderado.
OpioidesLos opioides han ocupado un papel central en la anestesia y analgesia cardiaca desde sus orígenes por su potente y efectiva analgesia, estabilidad hemodinámica y cardioprotección, a costa de una recuperación retardada y ventilación mecánica prolongada asociadas con sus conocidos efectos secundarios de depresión respiratoria, prurito, náuseas y vómitos postoperatorios, con los que se han asociado recientemente la hiperalgesia, el dolor crónico y el aumento de la mortalidad por el desarrollo de dependencia356. La preocupación por estos últimos efectos ha hecho que nos planteemos el uso de técnicas de ahorro de opioides o incluso la cirugía cardiaca libre de opioides (OFCS)357 utilizando en su más amplio significado la analgesia multimodal. La ventaja de esta analgesia encuentra una disminución de su consumo y un mejor control de sus efectos secundarios, lo que no significa que tengan que ser eliminados de nuestra estrategia, sino que es nuestra obligación utilizar las dosis mínimas efectivas para controlar el dolor postoperatorio358.
113. Recomendamos minimizar la dosis de opiáceos perioperatoria para potenciar la recuperación y reducir la incidencia de sus efectos secundarios en cirugía cardiaca.
Recomendación fuerte +. Nivel de evidencia moderado.
Antiinflamatorios no esteroideosLos AINE son un elemento clásico de la estrategia de analgesia postoperatoria por su efecto analgésico y antiinflamatorio especialmente interesante en el control del «dolor dinámico postcirugía», mejorando los índices postoperatorios de la escala visual analógica y reduciendo el consumo de opioides. Sin embargo, están asociados con una serie de efectos secundarios gastrointestinales, renales, cardiovasculares y plaquetarios, que se describen sobre todo con su uso a largo plazo, pero pueden surgir en el postoperatorio inmediato, y que son especialmente preocupantes en el perioperatorio de cirugía cardiaca por la complejidad de las intervenciones y el perfil del paciente359,360.
Valorando las recomendaciones más recientes elaboradas por organismos internacionales como la FDA (2015), European Medicines Agency (EMA 2012) y nacionales como la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS 2012), podemos concluir que361:
- •
Debemos evitar un uso rutinario de los AINE en el perioperatorio de cirugía cardiaca, seleccionando al paciente no solo por su estado preoperatorio sino también por su perfil intra y postoperatorio tanto hemodinámico como hematológico.
- •
La intensidad del dolor osteocondral y pleurítico postoperatorio es máxima en las primeras 72 h lo que nos permite limitar siempre que sea posible la duración de su uso y en las dosis mínimas efectivas.
- •
Respecto al riesgo cardiovascular de cada AINE recordar que solo el AAS ha sido sometida a estudios clínicos con distribución aleatoria que demuestran su perfil de seguridad a este respecto. Tras el paracetamol y el AAS aparecería el naproxeno como opción preferida; en el extremo opuesto se situarían la ciclooxigenasa 2 (COX2), el diclofenaco y el ibuprofeno a dosis diarias superiores a 1.200 mg. Entre los AINE de administración parenteral, recordar que la EMA en el año 2005 consideró que el ketorolaco y el ketoprofeno tenían más beneficios que riesgos en pacientes con osteoartritis y artritis reumatoide.
114. Sugerimos el uso de AINE en el perioperatorio de cirugía cardiaca, de forma limitada en el tiempo y con la dosis mínima efectiva, tras valorar individualmente el riesgo/beneficio de cada caso particular.
Recomendación débil +. Nivel de evidencia moderado.
KetaminaA pesar de ser un fármaco conocido hace más de 40 años, ha despertado en los últimos años el interés general como un elemento prometedor dentro de una estrategia de recuperación intensificada.
Existe una importante controversia entre los resultados de los estudios realizados en esta área con ketamina como atenuante del dolor agudo, el consumo de analgésicos postoperatorios y la tasa de dolor a largo plazo tras la cirugía cardiaca362-366. Esta disparidad de resultados puede deberse a la diversidad de pautas (intra y postoperatorio) y a la dosis de administración (bolo ± infusión continua) utilizados, siendo necesarios estudios más amplios y de calidad para determinar en qué procedimientos y en qué dosis debemos utilizar la ketamina como coadyuvante analgésico.
115. Sugerimos el uso prudente de dosis subanestésicas de ketamina como coadyuvante analgésico en el perioperatorio de cirugía cardiaca.
Recomendación débil +. Nivel de evidencia moderado.
DexametasonaNo puede recomendarse el uso rutinario de dexametasona con finalidades analgésicas.
MagnesioEl magnesio es un bloqueador fisiológico de los canales de calcio además de ser un antagonista del receptor N-metil D-aspartato (NMDA) y dicha acción participa en el desarrollo del dolor agudo y crónico. Un metaanálisis de 2013367, recoge numerosas especialidades quirúrgicas en las que se empleó el magnesio como adyuvante de analgesia y concluye efectos beneficiosos y ahorro de opioides. Otras vías de administración, como la infiltración de la herida preesternal con magnesio asociado con el anestésico local, se han descrito con aceptables resultados frente a técnicas de analgesia convencional368.
La literatura existente no arroja suficiente evidencia para recomendar su uso rutinario. Estudios mayores serían necesarios y también la homogeneización de la vía de uso y las dosis a emplear.
Gabapentinoides: gabapentina y pregabalinaLa gabapentina es un fármaco habitualmente empleado como antiepiléptico. Es un análogo estructural del neurotransmisor GABA que disminuye la liberación de mediadores de la nocicepción. En la literatura disponible no se alcanza la significación suficiente para recomendar el uso de gabapentina de forma rutinaria como parte de la analgesia multimodal en cirugía cardiaca, pareciendo incluso que prolonga el tiempo de ventilación mecánica369, por lo que no se puede recomendar su uso rutinario.
En cuanto a la pregabalina, se atribuyen sus beneficios a la reducción de los scores de dolor en reposo y en movimiento, reducción del consumo de opioides en las primeras 24 h postcirugía y disminución de la incidencia de náuseas, vómitos y prurito369.
Aunque la literatura no es extensa, los resultados con el empleo de pregabalina en pacientes de cirugía cardiaca parecen ofrecer ventajas más allá del control del dolor, aportando estabilidad emocional en el postoperatorio. Estudios más extensos son necesarios para poder hacer una recomendación de uso más firme.
116. La pregabalina se sugiere como parte de la analgesia multimodal en los pacientes intervenidos de cirugía cardiaca.
Recomendación débil +. Nivel de evidencia bajo.
Anestésicos locales (lidocaína)La lidocaína es un anestésico local de la familia de las amidas. Se le atribuyen propiedades analgésicas, antihiperalgésicas y antinflamatorias. Sus mecanismos de acción son a través del bloqueo de los canales de sodio, la inhibición de receptores acoplados a la proteína G y la inhibición de receptores NMDA. Existen varias revisiones sistemáticas acerca del uso de la lidocaína en la analgesia pero no alcanzan la suficiente evidencia370.
117. Sugerimos evitar el uso rutinario de magnesio, gabapentina y lidocaína en las pautas de analgesia multimodal para enfermos de cirugía cardiaca.
Recomendación débil -. Nivel de evidencia bajo.
Anestesia regionalEpidural torácicaSe han comunicado importantes beneficios con su uso (amortiguación de la respuesta de estrés a la cirugía, vasodilatación coronaria, mejoría de la presión tisular de oxígeno miocárdico371, reducción de la inmunosupresión inducida por el estrés) además de su indudable control del dolor y la consecuente disminución de necesidad de anestésicos y analgésicos postoperatorios. Sin embargo, la técnica epidural torácica en el área de cirugía cardiaca no se ha extendido mayoritariamente entre los grupos de anestesia cardiaca dado el riesgo consecuente de aparición de hematoma epidural (incidencia 1:3552)372 en un paciente que se va a someter a anticoagulación plena. Por ello, y a pesar de sus importantes beneficios, su uso se realiza sólo en centros con gran experiencia.
En el caso de la cirugía de revascularización sin CEC se requiere menos heparinización, por lo que el riesgo de hematoma epidural es menor.
118. Sugerimos la analgesia epidural como parte de la analgesia multimodal en cirugía cardiaca con CEC tomando todas las medidas de precaución necesarias en el contexto de un paciente que va a estar bajo los efectos de antiagregantes y anticoagulantes.
Recomendación débil +. Nivel de evidencia moderado.
119. Recomendamos el uso de analgesia epidural como parte de la analgesia multimodal en cirugía cardiaca sin CEC tomando todas las medidas de precaución necesarias en el contexto de un paciente que va a estar bajo los efectos de antiagregantes y anticoagulantes.
Recomendación fuerte +. Nivel de evidencia moderado.
Analgesia intratecalComparada con la introducción de un catéter epidural, la alternativa intratecal parece fácil, asequible y más económica. Con la literatura disponible, sin embargo, no puede hacerse una recomendación formal para el uso rutinario de la analgesia intratecal en cirugía cardiaca.
Bloqueo paravertebralSe postula el bloqueo paravertebral continuo como una alternativa menos invasiva en la analgesia regional en cirugía cardiaca373,374. Existe poca evidencia y resultados dispares respecto del uso del bloqueo paravertebral torácico.
Bloqueo de los nervios pectorales (PECS)Inicialmente descrito para la cirugía de mama, ya existe literatura acerca de su empleo en cirugía cardiaca demostrando que la técnica del bloqueo es simple, segura y efectiva, proporcionando buena calidad analgésica, menor necesidad de rescates analgésicos, mejor trabajo respiratorio y rehabilitador y reducción en el consumo de opioides375, aunque aún el pequeño tamaño muestral de los estudios no permite establecer una recomendación.
Bloqueo del plano erector de la espina (ESP)Descrito en 2016, el efecto del bloqueo del erector de la espina es similar al del bloqueo paravertebral pero sin el riesgo de punción pleural. La difusión craneocaudal del anestésico local es extensa y provee mejor cobertura analgésica. Recientemente, se han publicado resultados muy favorables a la utilización de este bloqueo376. Aunque prometedor, la evidencia para el uso de bloqueo ESP en cirugía cardiaca es aún insuficiente.
Infiltración de la herida esternal/bloqueo paraesternalLa administración de anestésicos locales en la herida esternal, bien mediante punción única o manteniendo una infusión continua a través de catéter, son medidas simples y que han demostrado eficacia como parte del plan analgésico en el postoperatorio de cirugía cardiaca, acortando tiempos de extubación y optimizando parámetros respiratorios. A pesar de ello, la evidencia publicada es escasa.
120. Se recomienda la realización de bloqueos periféricos junto a la analgesia multimodal en el contexto de la cirugía cardiaca.
Recomendación fuerte +. Nivel de evidencia moderado.
HipotermiaLa anestesia general produce una alteración de la regulación de la temperatura corporal produciendo descenso de la misma entre 1 y 2 ̊C durante la primera hora pudiendo llegar, sin tomar medidas, hasta a descensos de 3,5 ̊C a partir de la tercera hora de anestesia377. Además, la piel expuesta durante períodos prolongados y la infusión de grandes volúmenes de líquidos intravenosos y la irrigación del campo quirúrgico favorece esta situación.
Definimos la hipotermia postoperatoria como la imposibilidad de mantener la normotermia (≥ 36 ̊C) tras 2 a 5 h de ingreso en la UC377,378.
Las complicaciones relacionadas con la hipotermia perioperatoria incluyen la aparición de coagulopatía que asocia mayores necesidades transfusionales, un incremento de la tasa de infección de herida quirúrgica, retraso en el metabolismo de los fármacos, recuperación más lenta y prolongada, escalofríos e incomodidad térmica. Todo ello deriva en estancias hospitalarias más largas y aumento de la mortalidad379,380.
La prevención de la hipotermia debe realizarse mediante el uso de mantas de aire caliente, la infusión de fluidos intravenosos calientes a 37 ̊C381 y la elevación de la temperatura ambiente en el período postoperatorio inmediato382-384. Una vez alcanzada la normotermia se retirarán las medidas anteriores y se continuará con la monitorización de la temperatura corporal.
121. Recomendamos el uso de mantas de aire caliente, la infusión de fluidos intravenosos calientes y la elevación de la temperatura ambiente para evitar la hipotermia mantenida (< 36 ̊C) tras la CEC y en el periodo postoperatorio precoz.
Recomendación fuerte +. Nivel de evidencia moderado.
122. Recomendamos monitorizar la temperatura corporal a la llegada del paciente a la UC.
Recomendación fuerte +. Nivel de evidencia alto.
Extubación precozExiste una clara asociación entre la ventilación mecánica prolongada en cirugía cardiaca y el aumento de la morbimortalidad, costos y estancia hospitalaria385. La creciente necesidad de evitar los efectos adversos asociados con la ventilación prolongada llevó al desarrollo del fast-track, considerado como la desvinculación del respirador en las seis primeras horas posteriores a la intervención386,387. Se ha demostrado en diversas publicaciones que la desvinculación precoz del respirador se puede realizar sin comprometer la seguridad del procedimiento, incluso en pacientes de alto riesgo quirúrgico388-390. La extubación precoz en cirugía cardiaca ha demostrado disminuir la morbilidad, los costes económicos y los tiempos de estancia en la UC y hospitalización; sin embargo, el impacto sobre la mortalidad perioperatoria general no ha podido ser consistentemente demostrado388,391,392.
Pese a que los beneficios de la extubación temprana son bien conocidos, en la actualidad existe debate con respecto a las ventajas de la extubación precoz de los pacientes en la sala quirúrgica conocida como ultra fast-track. Algunos detractores evocan que al realizar ultra fast-track podría presentarse una respuesta adrenérgica o hipoxia tisular que llevaría a compromiso miocárdico en el posoperatorio inmediato393,394. La evidencia en este campo continúa siendo contradictoria. En tres estudios observacionales no se observaron diferencias significativas con respecto a la estancia en la UC y mortalidad perioperatoria395,396; aunque, en un estudio observacional con un gran volumen de pacientes se demostró que la extubación precoz (ultra fast-track) disminuía la estancia en la UC y estancia hospitalaria total sin afectar el resto de los parámetros del postquirúrgico397. En otro estudio observacional que comparó fast-track vs. ultra fast-track se observó que la extubación en el quirófano disminuía la estancia hospitalaria significativamente sin impacto sobre la morbimortalidad398.
123. Se recomienda el empleo de estrategias que aseguren la desconexión del respirador en las primeras seis horas de la cirugía.
Recomendación fuerte +. Nivel de evidencia moderado.
124. Sugerimos la aplicación de estrategias para la desconexión del respirador en la sala quirúrgica de forma individualizada teniendo en cuenta las características del paciente y del centro hospitalario.
Recomendación débil +. Nivel de evidencia moderado.
Movilización precoz y rehabilitación generalEl encamamiento postoperatorio se asocia con un aumento de las complicaciones pulmonares (atelectasia, neumonía…) alterando el transporte de oxígeno y la perfusión tisular. Además, aumenta el riesgo de trombosis venosa profunda y tromboembolismo pulmonar, contribuyendo a la pérdida de masa muscular y fuerza399.
Por tanto, la movilización precoz tras la cirugía cardiaca forma parte del protocolo RICC como medio de prevención de complicaciones, mejora de la capacidad funcional y disminución de la estancia en la UC y hospitalaria total400,401.
Existen potenciales dificultades para la movilización precoz en pacientes de cirugía cardiaca debido a la inestabilidad hemodinámica, sangrado, monitorización invasiva, drenajes torácicos, dolor, etc.402, pero se ha demostrado que la movilización 12-24 h después de la cirugía cardiaca electiva es un procedimiento seguro en la medida en que se realice bajo estrecha vigilancia hemodinámica y seguimiento clínico en la UC403.
Así mismo, se ha demostrado que los pacientes octogenarios deben adherirse a los programas de recuperación intensificada, puesto que les permite tener similar estancia hospitalaria, número de readmisiones y complicaciones que los pacientes jóvenes404.
125. Recomendamos la movilización precoz tras la cirugía cardiaca. Forma parte del protocolo RICC como medio de prevención de complicaciones y permite mejorar la capacidad funcional, disminuir la estancia en la UC, así como la estancia hospitalaria total.
Recomendación fuerte +. Nivel de evidencia bajo.
Retirada precoz de drenajes, vías, sonda urinaria y cables de marcapasosRetirada precoz de drenajesEl manejo tradicional de los drenajes era el mantenerlos durante 48 h postoperatorias hasta que el drenaje se reduce a menos de 50 mL en 4 o 5 h consecutivas. Evidentemente, esta actitud retrasa la rehabilitación y recuperación del paciente en el postoperatorio. Sin embargo, existe evidencia de que en cuanto el líquido del drenaje sea macroscópicamente serosanguinolento405 se pueden retirar los drenajes con seguridad, independientemente del flujo de drenaje.
126. Se recomienda la retirada de los drenajes torácicos desde el momento en que el débito sea macroscópicamente serohemático.
Recomendación fuerte +. Nivel de evidencia moderado.
Retirada precoz de vías y sonda urinariaLa mayoría de los protocolos ERAS o consensos de expertos recomiendan relegar el uso de vías venosas y arteriales y de sonda urinaria a cuando sean médicamente necesarios, debiendo ser retirados cuando las condiciones médicas lo permitan, dado que su presencia puede aumentar la incidencia de infección y sepsis406,407.
Para aquellos pacientes que necesitan ser portadores de un acceso venoso central, debería ser sustituido a la semana o si el paciente presentase un pico febril408.
127. Se recomienda retirar todos los catéteres, accesos vasculares y sondaje vesical cuando las condiciones médicas lo permitan.
Recomendación fuerte +. Nivel de evidencia moderado
Retirada precoz de cables de marcapasosNo hay ningún consenso respecto al momento temporal en el postoperatorio en el que se deban retirar los cables de marcapasos y cada centro adopta un acuerdo a este respecto409. Parece que pueden retirarse a partir del tercer día si el paciente no ha presentado arritmias en las primeras 48 h postcirugía, siendo monitorizado el electrocardiograma durante su retirada.
Para su retirada, en el caso de que el paciente reciba HBPM, deberán haber pasado al menos 4 h desde la última dosis y determinación de adecuados niveles de antifactor X activado (anti-Xa). En el caso de que reciba heparina sódica, se ha suspender al menos 4 h antes y realizar un control de tiempo de tromboplastina parcial activado (TTPA). En el caso de ACO, se retirarán antes del inicio de la pauta o con rango de INR < 2410.
Se recomienda controlar al paciente durante unas horas tras la retirada de los cables de marcapasos411. Por ello, se sugiere no retirarlos el mismo día del alta hospitalaria.
128. Antes de la retirada de los cables de marcapasos se sugiere la realización de un estudio de coagulación y permitir un periodo de tiempo adecuado desde la última dosis de anticoagulante.
Recomendación débil +. Nivel de evidencia bajo.
129. Se recomienda no retirar los cables de marcapasos el mismo día del alta hospitalaria.
Recomendación fuerte -. Nivel de evidencia bajo.
Alimentación precozUn soporte nutricional inadecuado o tardío puede agravar la malnutrición ya presente en los pacientes intervenidos de cirugía cardiaca. Los protocolos ERAS recientes recomiendan el inicio de la ingesta de líquidos dentro de las 6 h siguientes a la extubación y dieta completa en el primer día de postoperatorio en la UC412,413.
Las guías internacionales de nutrición recomiendan de forma unánime el inicio de la nutrición enteral en las primeras 24-48 h de postoperatorio en pacientes incapaces de mantener la ingesta oral, con el fin de mantener la función intestinal, promover la función inmune y de esta forma, reducir las complicaciones infecciosas, la estancia en la UC y hospitalaria y reducir la mortalidad16. El uso de vasopresores no supone una contraindicación por sí misma para el inicio de la nutrición enteral. En particular, el tercer día de postoperatorio se debe reevaluar el estado nutricional y en pacientes de riesgo los esfuerzos deben estar dirigidos a alcanzar al menos el 80% de los requerimientos proteínicos y energéticos20,414.
130. El inicio de ingesta oral completa se recomienda en las siguientes 24 h a la extubación.
Recomendación fuerte +. Nivel de evidencia alto.
131. Se sugiere la monitorización de la ingesta alimentaria diaria en pacientes intervenidos de cirugía cardiaca durante su estancia en la UC.
Recomendación débil +. Nivel de evidencia moderado.
Nutrición enteral precozLa detección de pacientes en riesgo de desnutrición en el periodo postoperatorio podría ser útil para realizar un soporte nutricional más precoz. Actualmente no existen escalas de riesgo de malnutrición postoperatoria validadas en cirugía cardiaca. Ante la ausencia de otros métodos, el score NUTRIC (Nutrition Risk In The Critical III), que identifica pacientes críticos con alto riesgo de desnutrición (NUTRIC score > 5), podría emplearse como herramienta en pacientes de cirugía cardiaca. Otras escalas como el APACHE II (Acute Physiology and Chronic Health Evaluation) pueden emplearse para predecir un alto riesgo de malnutrición (APACHE > 10)20.
132. Se recomienda el empleo de escalas de riesgo de malnutrición para la detección de pacientes que se beneficiarán de soporte nutricional postoperatorio precoz (< 48 h).
Recomendación fuerte +. Nivel de evidencia moderado.
A la espera de una herramienta más específica, según las recomendaciones de las guías ESPEN23, pueden considerarse en riesgo de malnutrición a todos aquellos pacientes con ingreso en la UC superior a 48 h, con ventilación mecánica, sin un correcto soporte nutricional durante más de cinco días, en situación de sepsis o con una enfermedad crónica severa.
Aunque no existen guías específicas de soporte nutricional en cirugía cardiaca, la Sociedad Americana de Nutrición Clínica y Metabolismo (ASPEN) recomienda el inicio de la nutrición en las primeras 24 h tras la intervención quirúrgica y el aporte de 25-30 kcal/kg/día y 1,5-2,5 g/kg/día de proteínas23.
El soporte nutricional trata de asegurar unos requerimientos energéticos adecuados en el periodo catabólico posterior a la cirugía. Como en otros pacientes críticos, la nutrición enteral se considera el soporte nutricional de elección si no es posible la vía oral.
133. Se recomienda que todos los pacientes ingresados más de 48 h en UC sean considerados de alto riesgo de malnutrición.
Recomendación fuerte +. Nivel de evidencia alto.
En los pacientes intervenidos de cirugía cardiaca la estabilidad hemodinámica juega un papel clave en la función gastrointestinal. Sin una evidencia clara al respecto, se ha postulado que la nutrición enteral en pacientes con compromiso cardiocirculatorio severo puede repercutir negativamente sobre la circulación esplácnica, incrementando las complicaciones gastrointestinales.
Diversos estudios han analizado la respuesta a la nutrición enteral en presencia de compromiso hemodinámico severo. Se ha observado que la nutrición enteral puede ser segura en pacientes con requerimientos altos de vasopresores o sistemas de asistencia circulatoria tras un periodo de estabilización inicial (dosis estables de fármacos vasoactivos, PAM adecuada, descenso de cifras de lactato)415.
Las guías ESPEN recomiendan la administración de nutrición parenteral en los pacientes que no alcancen requerimientos calóricos superiores al 50% en siete días. Las guías americanas ASPEN recomiendan su inicio en 5-7 días si no se alcanzan los objetivos energéticos a través de la vía oral o la nutrición enteral. Podría recomendarse iniciar su administración de forma más precoz (día tres) en aquellos pacientes con alto riesgo de malnutrición para evitar los balances energéticos negativos23,416,417.
134. Se recomienda la dieta oral sobre el soporte enteral o parenteral en pacientes críticos que sean capaces de ingerir alimentos por vía oral. Si no es posible la alimentación por vía oral, se recomienda la nutrición enteral precoz (< 48 h).
Recomendación fuerte +. Nivel de evidencia alto.
135. Se recomienda el inicio progresivo de la nutrición enteral y el seguimiento estrecho de las posibles complicaciones gastrointestinales.
Recomendación fuerte +. Nivel de evidencia alto.
136. Cuando la nutrición enteral se encuentra contraindicada o no es posible alcanzar los objetivos nutricionales, se recomienda suplementar con nutrición parenteral.
Recomendación fuerte +. Nivel de evidencia alto.
Prevención del delirium y detección precozEl delirium es un síndrome clínico consistente en una alteración de la conciencia, asociado con un déficit de atención y percepción con pensamiento desorganizado, que puede conducir a un trastorno cognitivo general. Aparece dependiendo de la franja de edad entre un 11,5 y un 80% de los pacientes que se someten a cirugía cardiaca418-420 Se ha descrito que se trata de una disregulación neuronal producida por trastornos sistémicos que se desarrolla en un período relativamente corto de tiempo y representa un cambio con respecto a la línea basal conductual del paciente421.
Aumenta las complicaciones postoperatorias, la duración de la ventilación mecánica, la morbimortalidad, y se ha asociado con cambios cognitivos a largo plazo422,423.
Es multifactorial (dolor, hipoxemia, bajo gasto, sepsis), por lo que requiere un enfoque de equipo interdisciplinario para la prevención, el diagnóstico, la estratificación del riesgo y el tratamiento. La detección precoz es esencial para determinar la causa subyacente e iniciar el tratamiento adecuado421.
Las escalas de predicción actuales más empleadas son la Confussion Assessment Method o CAM-ICU y la Intensive Care Delirium Screening Checklist o ICDSC424. La ICDSC está validada por el DSM-IV-TR para la evaluación del delirium, y es la escala que presenta en la actualidad una especificidad y un valor predictivo positivo más altos, por lo que es una herramienta útil para su correcta identificación419, y usa las siguientes variables: alteración del grado de conciencia, falta de atención, desorientación, alucinación o delirio, agitación o retraso psicomotor, mal humor o habla inapropiados, alteración del ciclo sueño/vigilia y fluctuación de los síntomas.
137. Se recomienda realizar la detección sistemática deldeliriummediante escalas validadas (como ICDSC) en el postoperatorio de cirugía cardiaca al menos una vez por turno de enfermería para la detección precoz.
Recomendación fuerte +. Nivel de evidencia moderado.
La prevención del delirium mediante estrategias no farmacológicas como la movilización temprana, el manejo del dolor, la minimización y titulación dirigida de sedación, evitar el uso de benzodiacepinas, reorientación del paciente, estimulación cognitiva, reducción de la discapacidad auditiva, visual o ambas (p. ej., permitir el uso de dispositivos como audífonos o gafas), uso de relojes/calendarios y la promoción del patrón circadiano normal de sueño-vigilia han mostrado resultados prometedores425,426.
La prevención farmacológica con haloperidol o ketamina no ha demostrado beneficios en la clínica a gran escala en los ensayos clínicos427,428. La evidencia sugiere que el uso de antipsicóticos atípicos, haloperidol o una estatina no afecta la duración del delirium o su morbilidad relacionada423. Existen datos esperanzadores sobre el uso de agonistas adrenérgicos alfa-2, como la dexmedetomidina en la prevención de su aparición425.
138. En el caso de la existencia de factores de riesgo para el desarrollo de delirium postoperatorio o si se detecta su aparición, se recomienda administrar dexmedetomidina a dosis bajas (0,2 μg/kg/h).
Recomendación fuerte +. Nivel de evidencia moderado.
Biomarcadores y estrategias de prevención de daño renal agudoEl DRA asociado con la cirugía cardiaca es una complicación que aparece según procedimiento y su definición entre un 22-36% de los pacientes429-432. Su aparición conlleva un aumento de la morbimortalidad y una repercusión importante en el gasto sanitario total430.
Las definiciones clásicas de lesión renal RIFLE (R-renal risk, I-injury, F-failure, L-loss of kidney function, E-end-stage renal disease)433, AKIN (Acute Kidney Injury Network)434 y KDIGO (Kidney Disease: Improving Global Outcomes)435 utilizan el incremento de la Cr, pudiendo retrasar su detección entre 24 y 72 h en comparación con los nuevos biomarcadores como el inhibidor tisular de la metaloproteasa-2 (IGFBP7), la proteína de enlace siete del factor de crecimiento insulínico (TIMP-2) y la lipocalina asociada con la gelatinasa neutrófila (NGAL)436,437.
139. Sugerimos la determinación de biomarcadores para la identificación temprana de DRA en pacientes en riesgo, permitiendo guiar una estrategia de intervención precoz con el objetivo de reducir el DRA.
Recomendación débil +. Nivel de evidencia moderado.
Para disminuir la incidencia de DRA en todo el perioperatorio se ha de evitar la depleción de volumen intravascular, optimizar gasto cardiaco con monitorización estricta, no administrar fármacos nefrotóxicos, evitar glucemias > 180 mg/dL y las grandes fluctuaciones mediante control y administración precoz de insulina438. Durante la CEC se ha de emplear la ZBUF en pacientes con filtrado glomerular < 60 mL/min270, mantener DO2 > 300 mL O2/min/m2 y no administrar (o reducir) vasopresores si el paciente tiene una PAM > 70 mmHg299.
El ensayo PrevAKI439 describe una serie de medidas (KDIGO CT surgery bundle) consistentes en: evitar agentes nefrotóxicos, interrupción de medicamentos inhibidores de la enzima convertidora de angiotensia (IECA) y antagonistas de los receptores de la angiotensina II (ARA-2) las primeras 48 h tras la cirugía, monitorización estrecha de Cr y del gasto urinario, evitar la hiperglucemia (> 180 mg/dL) durante las primeras 72 h tras la cirugía, considerar alternativas al contraste en radiodiagnóstico, monitorización con catéter PICCO® o similar con una optimización del volumen intravascular y de los parámetros hemodinámicos de acuerdo con un algoritmo específico. Dicho algoritmo incluía como objetivo hemodinámico un índice cardiaco > 3 l/min/m2, consecuentemente se observó un mayor uso de dobutamina (9 vs. 31%) en el grupo intervención, con menor prevalencia de DRA. La aplicación de estas medidas permite, por tanto, reducir la frecuencia y gravedad del DRA tras cirugía cardiaca. Estos resultados requerirían para su confirmación un gran ensayo multicéntrico según las últimas guías de recomendación440.
En caso de diagnóstico de DRA en estadio 2 de KDIGO (diuresis < 0,5 mL/kg/h durante más de 12 h o Cr doble de la basal), el inicio precoz (en menos de 8 h) de terapia de reemplazo renal ha demostrado mejorar los resultados441.
140. Recomendamos la aplicación del paquete de medidas de protección renal del protocolo PrevAKI para prevenir el DRA asociado con cirugía cardiaca.
Recomendación fuerte +. Nivel de evidencia moderado.
Anemia postoperatoriaLa anemia postoperatoria es un hallazgo común en los pacientes sometidos a cirugía cardiaca pudiendo encontrarse hasta en el 90% de los pacientes442, y puede condicionar la rehabilitación precoz y la reincorporación a la actividad habitual. Es por ello que su tratamiento se contempla dentro de los programas multidisciplinares de manejo sanguíneo perioperatorio o patient blood management (PBM)308. La transfusión de sangre alogénica sigue siendo el método comúnmente utilizado para la restauración de los niveles de Hb adecuados en el postoperatorio443. Sin embargo, los riesgos potenciales de la transfusión han llevado a la revisión de esta práctica transfusional y a la búsqueda de medidas alternativas para el tratamiento de la anemia postoperatoria. A este respecto, parece que la administración precoz de Fe intravenoso puede mejorar la evolución de la Hb postoperatoria y reducir la transfusión, aunque se desconoce su repercusión en la recuperación del paciente o en la calidad de vida en este contexto444.
Siguiendo las recomendaciones de la guía NICE de transfusión sanguínea, la instauración del tratamiento postoperatorio con Fe y ácido fólico para la recuperación de la anemia postoperatoria debe ser precoz445,446. No todos los autores son coincidentes en esta recomendación, ya que existen trabajos que no encuentran resultados positivos en su utilización447,448. Por ello sería recomendable la realización de estudios prospectivos que aclaren su utilidad.
141. Recomendamos la utilización de un programa PBM en los pacientes sometidos a cirugía cardiaca, optimizando la eritropoyesis, minimizando la pérdida de sangre e implantando estrategias del control de la anemia.
Recomendación fuerte +. Nivel de evidencia alto.
142. Sugerimos la instauración precoz del tratamiento postoperatorio con Fe intravenoso y ácido fólico para mejorar la recuperación de la anemia postoperatoria en los pacientes de cirugía cardiaca.
Recomendación débil +. Nivel de evidencia moderado.
Manejo de la fibrilación auricularLa FA es la arritmia más frecuente tras la cirugía cardiaca, llegando a ocurrir hasta en un 45% del total de pacientes125 y en porcentajes aún más elevados en subgrupos como el de cirugía valvular mitral. Es de vital importancia tanto su prevención como su tratamiento ya que la FA se asocia con un aumento de las tasas de complicaciones y mortalidad, así como de la estancia hospitalaria449.
En cuanto a actuaciones preventivas de la FA postoperatoria es de máxima importancia el tratamiento con betabloqueadores continuado en todo el proceso perioperatorio450, ya que su efecto protector es mucho mayor que si solo se administran postoperatoriamente. Puede considerarse la administración postoperatoria de colchicina, pero no existe evidencia sobre el uso de otros fármacos como las estatinas o la digoxina450.
Es importante el control de los factores de riesgo cardiovascular y los posibles desencadenantes de FA451-453.
143. Se recomienda la administración de betabloqueadores en el periodo perioperatorio para la prevención de la FA postoperatoria.
Recomendación fuerte +. Nivel de evidencia alto.
144. Se sugiere la administración de colchicina en el periodo postoperatorio para reducir la aparición de FA.
Recomendación débil +. Nivel de evidencia moderado.
145. Se recomienda controlar los factores de riesgo cardiovascular y los desencadenantes de FA en los pacientes que reciben tratamiento antiarrítmico para facilitar el mantenimiento del ritmo sinusal.
Recomendación fuerte +. Nivel de evidencia moderado.
En los pacientes sometidos a cirugía cardiaca en los que se produce FA postoperatoria, se recomienda restablecer el ritmo sinusal como tratamiento de primera línea454.
En los pacientes hemodinámicamente estables se puede optar por administrar flecainida, propafenona o vernakalant siempre que el paciente no presente cardiopatía isquémica ni cardiopatía estructural455-457, y en caso contrario se debe optar por la amiodarona458-460.
146. En pacientes sin hipotensión ni historia de cardiopatía isquémica o de enfermedad estructural se sugiere flecainida, propaferona o vernakalant para la cardioversión farmacológica de la FA de nueva aparición.
Recomendación débil +. Nivel de evidencia moderado.
147. En pacientes con cardiopatía isquémica, cardiopatía structural o ambas, se recomienda la administración de amiodarona para la cardioversión farmacológica de la FA de nueva aparición.
Recomendación fuerte +. Nivel de evidencia alto.
En los pacientes hemodinámicamente inestables, se debe realizar cardioversión eléctrica461,462, pudiendo considerarse el pretratamiento con amiodarona o flecainida463.
148. En pacientes hemodinámicamente inestables con FA postoperatoria, se recomienda cardioversión eléctrica y fármacos antiarrítmicos para restablecer el ritmo sinusal y restaurar el gasto cardiaco.
Recomendación fuerte +. Nivel de evidencia moderado.
149. Se sugiere el pretratamiento con amiodarona o flecainida para aumentar la eficacia de la cardioversión eléctrica y prevenir la FA recurrente.
Recomendación débil +. Nivel de evidencia moderado.
En el caso de optarse por el control de la frecuencia cardiaca, se puede optar por administrar diltiazem o verapamilo en el caso de pacientes con fracción de eyección ≥ 40%, y se puede administrar tanto betabloqueadores como digoxina independientemente de la fracción de eyección464-470. Si la monoterapia no es efectiva se debe considerar la combinación de diferentes fármacos.
En los pacientes con FA permanente sobre la que no se ha intervenido durante la cirugía, se debe realizar siempre control de frecuencia454,471,472.
150. Se recomiendan los betabloqueadores y la digoxina para el control de la frecuencia cardiaca en la FA postoperatoria (independientemente de la fracción de eyección del paciente).
Recomendación fuerte +. Nivel de evidencia moderado.
151. En pacientes con FA postoperatoria y FEVI ≥ 40% se sugiere optar por la administración de diltiazem o verapamilo.
Recomendación débil +. Nivel de evidencia moderado.
152. En los pacientes con FA permanente que no haya sido objeto de tratamiento durante la intervención, se sugiere el empleo de fármacos antiarrítmicos para el control de la frecuencia.
Recomendación débil +. Nivel de evidencia alto.
Dado que la FA postoperatoria se asocia con un aumento del riesgo de ictus y de la morbilidad y mortalidad a los 30 días, se ha de considerar la anticoagulación precoz a dosis terapéuticas473.
153. Se sugiere la anticoagulación a dosis terapéuticas de heparina no fraccionada o HBPM en las primeras 12-48 h de la aparición de FA postoperatoria, considerando el riesgo-beneficio entre fenómeno tromboembólico y sangrado quirúrgico.
Recomendación débil +. Nivel de evidencia bajo.
En pacientes con FA postoperatoria al alta, la ACO se asocia con una reducción de la mortalidad a largo plazo, por lo que se recomienda iniciarla y mantenerla al menos cuatro semanas, dependiendo del CHA2DS2-VASc risk score473,474.
154. En pacientes con FA postoperatoria al alta, se recomienda tratar con ACO durante al menos cuatro semanas dependiendo delCHA2DS2-VASc risk score.
Recomendación fuerte +. Nivel de evidencia moderado.
Tratamiento antiagregante y anticoagulanteTromboprofilaxisLos eventos trombóticos vasculares incluyen la trombosis venosa profunda y la embolia pulmonar, siendo una fuente de morbilidad y mortalidad potencialmente prevenible. Todos los pacientes se benefician de una tromboprofilaxis mecánica con medias de compresión o sistemas neumáticos de compresión intermitente hasta que tienen una adecuada movilidad475,476. Existe evidencia de que la anticoagulación profiláctica permite una reducción de los eventos trombóticos sin aumentar el sangrado ni el taponamiento cardiaco477. Por ello, se ha de considerar la tromboprofilaxis farmacológica desde el momento en que se ha conseguido una adecuada hemostasia (normalmente el primer día postoperatorio) hasta el alta477-479.
155. Se sugiere la tromboprofilaxis mecánica en el postoperatorio de cirugía cardiaca mientras el paciente no alcance una movilidad adecuada.
Recomendación débil +. Nivel de evidencia moderado.
156. Se sugiere la tromboprofilaxis farmacológica desde el primer día postoperatorio hasta el alta hospitalaria.
Recomendación débil +. Nivel de evidencia bajo.
Antiagregación simpleLa reintroducción precoz en las primeras 24 h del AAS a dosis bajas (75-100 mg/día) en el postoperatorio inmediato de cirugía de revascularización coronaria protege de la trombosis precoz de los injertos coronarios480.
En el caso particular de la cirugía de revascularización coronaria, está demostrado que la administración de AAS de forma indefinida tras la cirugía disminuye la tasa de eventos adversos isquémicos, y aunque esta evidencia es menor a partir del año de la cirugía en cuanto a permeabilidad del injerto de arteria mamaria izquierda, las recomendaciones generales abogan por mantener este tratamiento de por vida481.
157. Se recomienda la reintroducción del tratamiento antiagregante con AAS dentro de las 6 primeras horas tras una intervención de revascularización coronaria y mantenerlo de manera indefinida.
Recomendación fuerte +. Nivel de evidencia alto.
158. En pacientes intolerantes al AAS, el clopidogrel se recomienda como una alternativa en el postoperatorio de cirugía coronaria.
Recomendación fuerte +. Nivel de evidencia moderado.
Doble antiagregaciónPara el inicio de la DAP se recomienda iniciar el tratamiento antiagregante con AAS durante las primeras 24 h después de la cirugía. El momento y tipo de antiagregante que se ha de añadir al AAS depende del contexto en que se ha realizado la intervención.
En aquellos pacientes que presentaban indicación preoperatoria de DAP, el segundo antiagregante se debe reintroducir durante los siete primeros días tras la cirugía. En pacientes con alto riesgo trombótico es recomendable hacerlo durante las primeras 48 h, en ausencia de riesgo de sangrado, y se puede iniciar con una dosis de carga de clopidogrel (300-600 mg), prasugrel (60 mg) o ticagrelor (180 mg). En casos de riesgo de trombosis moderado, la introducción de la DAP se puede demorar hasta las primeras 96 h postoperatorias.
159. En pacientes con indicación preoperatoria de DAP y alto riesgo de trombosis, se recomienda reiniciar esta tan pronto como no exista riesgo de sangrado, pero a ser posible dentro de las primeras 48 h postoperatorias.
Recomendación fuerte +. Nivel de evidencia bajo.
160. En pacientes con indicación preoperatoria de DAP y riesgo de trombosis bajo-moderado, se recomienda reiniciarla tan pronto como no exista riesgo de sangrado, pero a ser posible dentro de las primeras 96 h postoperatorias.
Recomendación fuerte +. Nivel de evidencia bajo.
Menor grado de evidencia existe en cuanto a la DAP tras la cirugía coronaria en pacientes sin indicación previa482. Existe indicación en pacientes revascularizados tras un síndrome coronario agudo y en el contexto de la cirugía coronaria sin CEC.
Se ha recomendado administrar DAP con AAS y clopidogrel a todo paciente revascularizado tras un síndrome coronario agudo74. Sin embargo, los ensayos aleatorizados TRITON-TIMI 38 y PLATO compararon la DAP con prasugrel y ticagrelor respectivamente frente al clopidogrel, obteniendo mejores resultados que éste (aunque con un mayor sangrado con el prasugrel)483,484.
161. En pacientes intervenidos de cirugía de revascularización coronaria tras un síndrome coronario agudo, se recomienda administrar postoperatoriamente DAP con AAS e inhibidores de P2Y12 y continuarla durante 12 meses.
Recomendación fuerte +. Nivel de evidencia bajo.
La DAP con clopidogrel y AAS disminuye la tasa de oclusión de los injertos venosos y la mortalidad a 30 días en aquellos pacientes revascularizados quirúrgicamente sin CEC485,486.
162. Tras cirugía de revascularización coronaria sin CEC, se recomienda administrar doble antiagregación con AAS y clopidogrel durante un año para reducir la oclusión de injertos venosos.
Recomendación fuerte +. Nivel de evidencia moderado.
163. En pacientes intervenidos de cirugía coronaria con CEC y sin estar en el contexto del síndrome coronario agudo, se sugiere la administración de doble antiagregación durante un año con AAS e inhibidores del receptor plaquetario P2Y12, aunque su beneficio no está claramente establecido.
Recomendación débil +. Nivel de evidencia moderado.
Tratamiento anticoagulanteEn una gran parte de procedimientos de cirugía cardiaca se va a requerir la administración postquirúrgica de tratamiento anticoagulante. Esto puede ser, reintroduciendo el tratamiento que tomaba previamente, o bien introduciendo de novo la anticoagulación a causa del mismo procedimiento quirúrgico (implante de material protésico).
En líneas generales, y excepto en el caso de que el paciente presente un alto riesgo hemorrágico tras la cirugía, el inicio que la anticoagulación se suele recomendar a las 24 h de la intervención.
Si el paciente presenta un alto riesgo trombótico, hasta alcanzar el rango deseado de INR, se debe administrar terapia puente con heparina no fraccionada, o utilizar como alternativa HBPM.
164. Cuando está indicada la anticoagulación, se recomienda iniciarla con antagonistas de la vitamina K en el postoperatorio inmediato, tan pronto como el riesgo hemorrágico esté controlado.
Recomendación fuerte +. Nivel de evidencia bajo.
165. Se recomienda diferir al menos 72 h el inicio de la anticoagulación con ACOD.
Recomendación fuerte +. Nivel de evidencia bajo.
166. En pacientes con riesgo tromboembólico alto, se recomienda el inicio de terapia puente tras 12-24 h de la intervención con heparina sódica, hasta alcanzar niveles adecuados de INR.
Recomendación fuerte +. Nivel de evidencia bajo.
167. En pacientes con riesgo tromboembólico alto, se recomienda el inicio de terapia puente tras 24-48 h de la intervención con heparinas de bajo peso molecular, hasta alcanzar niveles adecuados de INR.
Recomendación fuerte +. Nivel de evidencia bajo.
Se establecen las siguientes recomendaciones de anticoagulación tras cirugía valvular74:
168. Se recomienda administrar tratamiento anticoagulante con antagonistas de la vitamina K a todo paciente portador de prótesis mecánica, para INR objetivo de 2,5 en portadores de prótesis aórticas sin otros factores de riesgo, o INR objetivo de 3 en cualquier otro caso.
Recomendación fuerte +. Nivel de evidencia moderado.
169. El uso de ACOD está contraindicado en pacientes portadores de prótesis mecánicas.
Recomendación fuerte -. Nivel de evidencia moderado.
170. Se recomienda la anticoagulación con antagonistas de la vitamina K durante los tres primeros meses postoperatorios en pacientes intervenidos de plastia o prótesis biológica mitral, tricúspide o ambas.
Recomendación fuerte +. Nivel de evidencia moderado.
171. Se recomienda la antiagregación con AAS durante los tres primeros meses postoperatorios en pacientes intervenidos de plastia o prótesis biológica aórtica.
Recomendación fuerte +. Nivel de evidencia moderado.
172. En los casos de cirugía cardiaca con apertura de cavidades, sin cirugía valvular, tipo cierre deshuntso resección de tumores intracardiacos, en que la reparación de la cardiopatía conlleve el empleo de parches intracavitarios, se recomienda la antiagregación con AAS salvo que concurran otras comorbilidades que recomienden la anticoagulación.
Recomendación fuerte +. Nivel de evidencia bajo.
Cuidados postoperatorios de la esternotomíaCon el objetivo de reducir la incidencia de dehiscencia esternal y el dolor en el proceso de rehabilitación tras la intervención, se pueden usar chalecos o corsés especialmente diseñados para los pacientes en el postoperatorio de cirugía cardiaca con esternotomía. Su uso en pacientes de alto riesgo está especialmente indicado487-490.
173. Se recomienda el uso en el postoperatorio inmediato de cirugía cardiaca con esternotomía media de sistemas de corsé esternal en pacientes de alto riesgo, ya que permite la reducción de las complicaciones, reduce el dolor y favorece la recuperación funcional.
Recomendación fuerte +. Nivel de evidencia alto.
Consultar la tabla 9.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
FinanciaciónLa publicación de este artículo ha sido financiada por Edwards Lifesciences.
Este documento de consenso de la Sociedad Española de Anestesiología, Reanimación y Terapéutica del Dolor (SEDAR), la Sociedad Española de Cirugía Cardiovascular y Endovascular (SECCE) y la Asociación Española de Perfusionistas (AEP), se publica simultáneamente en Cirugía Cardiovascular (https://doi.org/10.1016/j.circv.2020.11.004) y Revista Española de Anestesiología y Reanimación (https://doi.org/10.1016/j.redar.2020.11.005), con el consentimiento de los autores y editores.