Los accesos alternativos «no femorales» aparecen como una alternativa para el implante de válvulas transcatéter, cuando la vía femoral no es posible. El principal objetivo es describir la actividad realizada en nuestro centro, y mostrar los resultados de una serie de prótesis transcatéter implantadas exclusivamente por un equipo de cirujanos cardiovasculares.
MétodosEstudio descriptivo sobre una serie TAVI implantada por cirujanos cardiovasculares por vía no transfemoral. Recogida de datos sobre variables preoperatorias y postoperatorias.
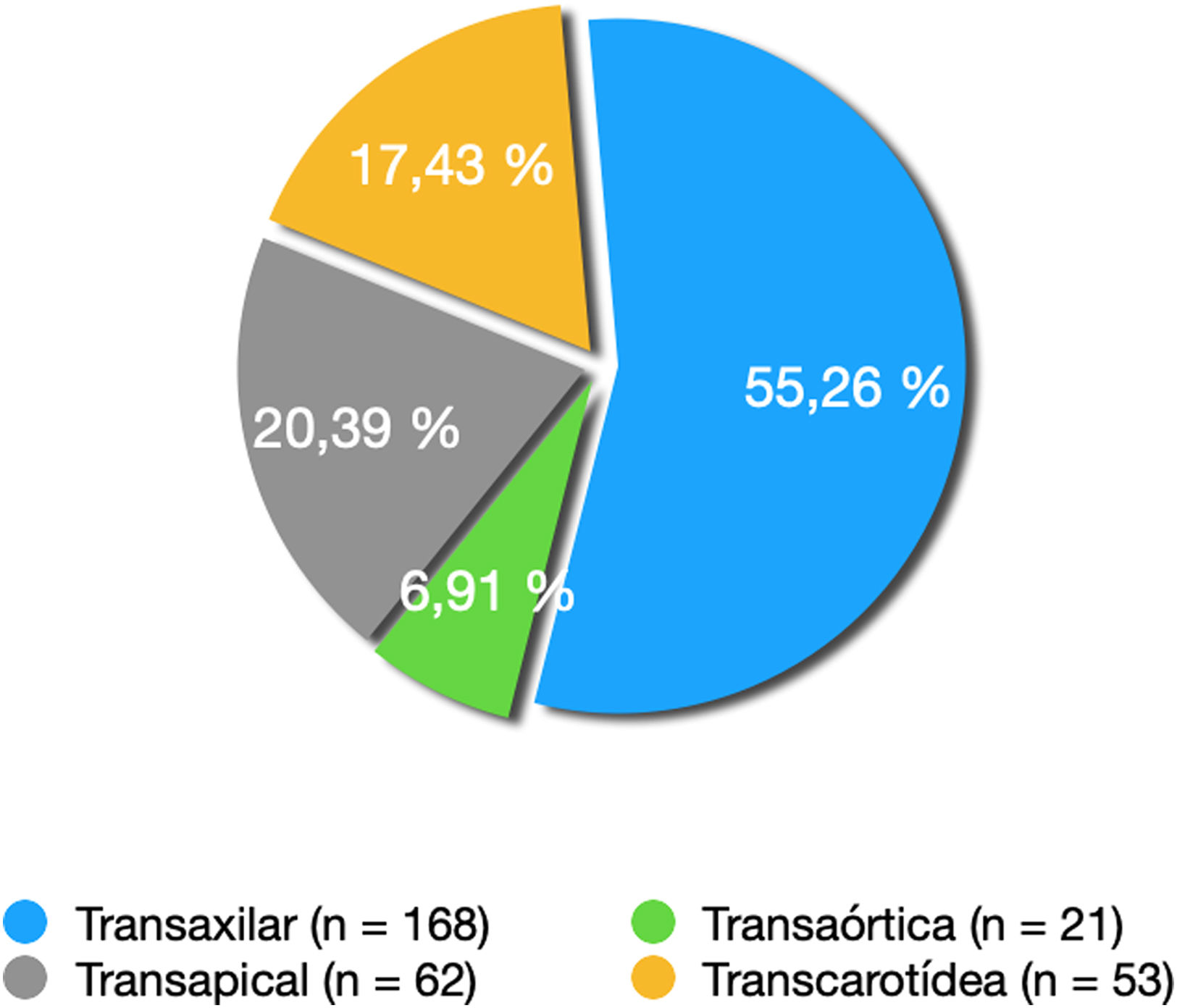
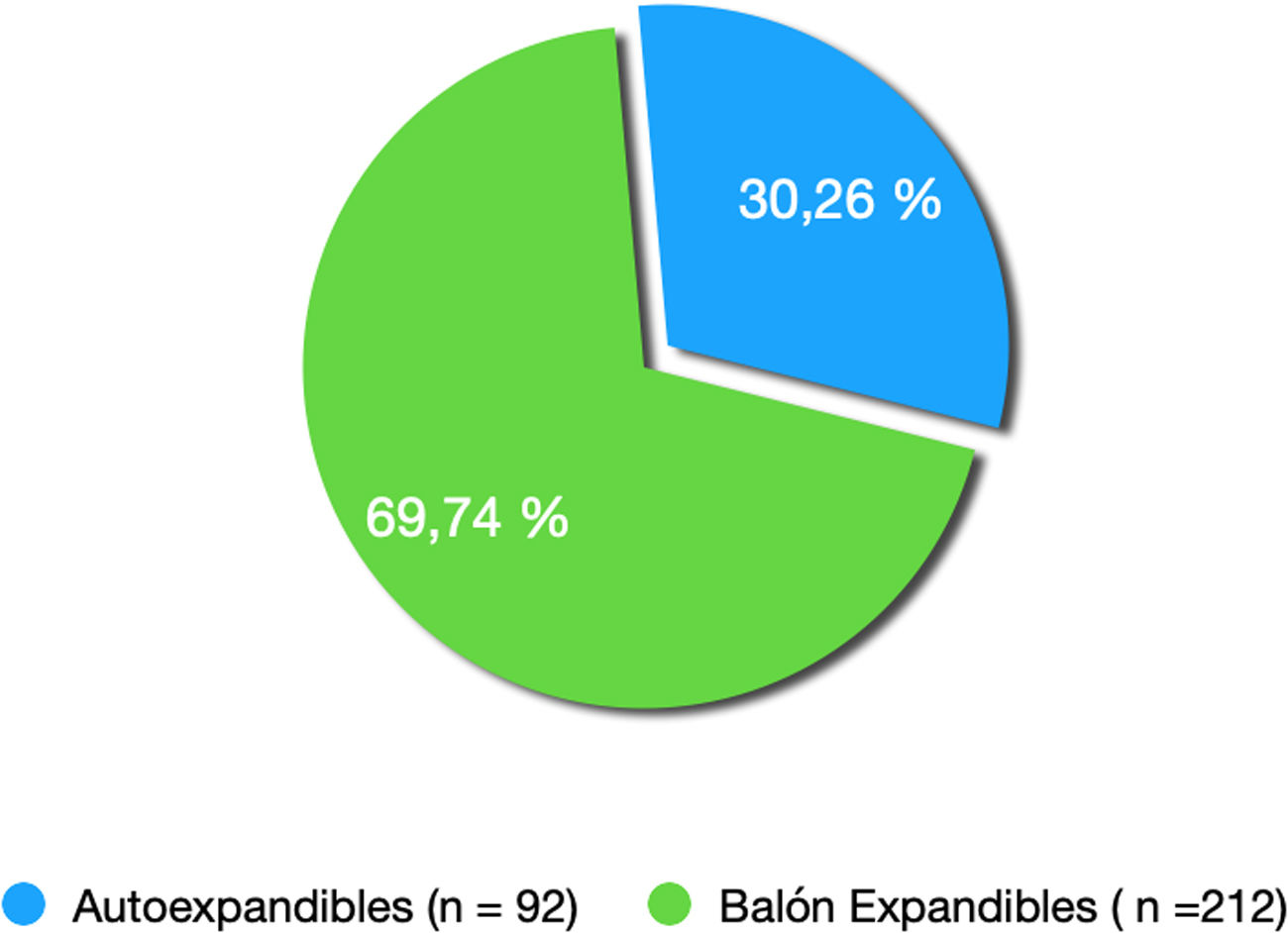
ResultadosTrescientos cuatro implantes no transfemorales: 21 implantes por vía transaórtica (6,91%), 62 por vía transapical (20,40%), 168 transaxilares (55,26%) y 53 transcarotídeos (17,43%). El 69,73% (212) de los implantes han sido con prótesis autoexpandibles y el 30,27% (92) con prótesis balón expandibles Se han registrado un total de 65 fugas (21,38%). Una mortalidad en el primer año del 5,38%. Se han producido 3 ictus isquémicos (0.98%). Cuarenta y cinco pacientes (14,80%) han precisado implantación de un marcapasos definitivo. Se han registrado 4 complicaciones vasculares en la vía transaxilar (2,43%) y una en la vía transapical (1,62%).
ConclusionesLas prótesis balón expandibles tienen menos tasa bloqueo y menos fugas periprotésicas, pero tienen una mortalidad ligeramente superior (no significativa). Las vías transaxilar y transcarotídea no son inferiores a la transfemoral en términos de morbimortalidad. Estas vías deben ser valoradas como una opción cuando sean de mejor calidad. La vía transcarotídea se está posicionando como una alternativa posiblemente mejor que la transaxilar.
Alternative “non-femoral” access routes are presented as an alternative option in current clinical guidelines for transcatheter valve implantation when the femoral route is not possible. Our main objective is describing the activity carried out in our center and to show the results of a series of transcatheter aortic prostheses implanted exclusively by a team of cardiovascular surgeons.
MethodsDescriptive study of a series of TAVIs implanted by cardiovascular surgeons with non-transfemoral approach. Data collection on preoperative variables and postoperative variables.
Results304 non-transfemoral TAVI: 21 implants with transaortic access (6.91%), 62 transapical access (20.40%), 168 transaxillary (55.26%) and 53 transcarotid (17.43%). A total of 69.73% (212) implantations were with self-expandable prostheses and 30.27% (92) with balloon expandable prostheses. A total of 65 leaks (21.38%) were registered. First year mortality was 5.38%. Three ischaemic strokes (0.98%).
Forty-five patients (14.80%) required implantation of a permanent pacemaker. There were 4 vascular complications in the case of the transaxillary approach (2.43%) and 1 in the case of the transapical approach (1.62%).
ConclusionsBalloon expandable prostheses have lower blockage rates and fewer periprosthetic leaks but slightly higher mortality (non-significant). The transaxillary and transcarotid access are not inferior to the transfemoral access in terms of morbidity and mortality. Vascular non-transfemoral access should be considered an option when they are of better quality. The transcarotid access is positioning itself as a possibly better alternative to the transaxillary access.
Mucho ha pasado desde que el equipo dirigido por el Dr. Cribier implantara la primera válvula aórtica transcatéter (TAVI) en un ser humano el 16 de abril de 2002 en Ruán (Francia), los buenos resultados de aquel caso hicieron que Edwards Lifesciences® comprara la patente y desarrollara la válvula transcatéter balón expandible SAPIENS®. El aumento exponencial de implantes llevó a la empresa a realizar los estudios PARTNER.
Edwards diseñó los sistemas de implante para su acceso transfemoral, y prácticamente a la vez también diseñó un sistema de implante por vía transapical como alternativa a los pacientes que no podían optar al implante femoral por afección arterial. Ya en el primer estudio PARTNER (en concreto, el PARTNER IA) se hizo un estudio comparativo entre las 2 vías: la vía transapical tenía más morbimortalidad que la vía transfemoral. Paralelamente, aparecieron otros estudios comparativos que apoyaban los mismos resultados1. Sin embargo, todos comparten el mismo sesgo: los pacientes que eran derivados a la vía transapical tenían mayor morbilidad y perfil de riesgo que los que optaban a la vía transfemoral.
En el PARTNER IIA, se incorpora al estudio comparativo una nueva vía de acceso, la vía transaórtica. Este estudio fue aleatorizado y la vía transfemoral tuvo mejores resultados que la vía transapical y transaórtica. No es difícil pensar que estas 2 últimas vías tienen peores resultados porque son más agresivas que la transfemoral. Es por ello que se empezó a pensar en otras vías alternativas que pudieran ofrecerse a los pacientes cuando la vía femoral no fuera posible y que, a su vez, tuvieran un grado de agresividad comparable.
La vía transaxilar y la vía transcarotídea se presentaron como esas vías alternativas, pero su incorporación ha sido, y sigue siendo, un caballo de batalla. Esto se debía, o se debe, a varias razones:
- •
La incapacidad de los servicios de hemodinámica de utilizar estas vías de manera independiente, teniendo que pedir la colaboración de servicios quirúrgicos, o derivando al paciente a los servicios de cirugía cardiovascular.
- •
La falta de evidencia científica y estudios de resultados sobre la utilización de estas vías vasculares no femorales. Tal es así que, en las guías europeas sobre valvulopatías de 20212, siguen recomendando en pacientes candidatos a TAVI la opción quirúrgica tradicional si la vía transfemoral no es posible, sin considerar las vías alternativas. Solo mencionan las vías alternativas con recomendación IIb y nivel de evidencia C.
La vía transaxilar apareció como una alternativa vascular a la vía transfemoral. Su acceso, más complejo que la vía transfemoral debido a la presencia de más estructuras anatómicas y su acceso más profundo, hizo que fuese adoptada por los cirujanos cardiovasculares que podían realizar un abordaje abierto a través de una incisión. En ocasiones, y según el centro, esta vía es utilizada por los hemodinamistas con la ayuda de cirujanos vasculares o cardiovasculares que les realizan la exposición de la arteria. Estos centros suelen ser aquellos donde no existen cirujanos cardiovasculares implantadores de TAVI.
Sobre los resultados de esta vía, los datos difieren, y esto parece depender de quién escriba la historia. La ausencia de estudios aleatorizados limita la significación de dichos estudios. Faroux et al. realizaron una revisión retrospectiva sistemática de más de 20 estudios comparando la vía transfemoral y la vía transaxilar3, en los que no consiguieron encontrar diferencias significativas en términos de mortalidad, complicaciones vasculares o sangrado. Con respecto a la presencia de ictus, sí demostraron diferencias significativas a favor de la vía transfemoral. Sylvain Beurtheret et al. publicaron con los datos del registro prospectivo FRENCH TAVI un artículo en el que no encontraba diferencias significativas entre la vía transfemoral y la vía transaxilar en términos de ictus y mortalidad; sin embargo, publican la presencia de un mayor número de complicaciones vasculares en la vía transfemoral de manera significativa4.
Una vez familiarizados con la vía transaxilar, fue cuestión de poco tiempo empezar a utilizar cada vez más la vía transcarotídea como alternativa vascular tanto para la vía transfemoral como para la vía transaxilar. La vía transcarotídea había causado respeto entre los cirujanos por la creencia de que su utilización iba a tener más riesgo de ictus. Pero, de nuevo con los datos del FRENCH TAVI, Debry et al. publicaron no encontrar diferencias significativas en términos de ictus con respecto a la vía transfemoral e, incluso, describen una tendencia a presentar menos complicaciones vasculares5. Estos resultados, junto a la mejor accesibilidad de la vía, hacen que cada vez se utilice más esta vía.
Los objetivos de este artículo son los siguientes:
- •
Mostrar los resultados de una serie de prótesis aórticas transcatéter implantadas exclusivamente por un equipo de cirujanos cardiovasculares.
- •
Comparar los resultados postoperatorios entre las distintas vías de acceso no femorales.
- •
Demostrar que las vías no femorales son accesibles, reproducibles y pueden ser una alternativa válida incluso cuando la vía femoral es factible pero subóptima.
Se ha realizado un estudio descriptivo sobre los TAVI implantados por vía no transfemoral en nuestro centro. Para ello, se ha utilizado la información recogida en una base de datos propia de este servicio que se lleva completando desde el año 2011.
Siendo fieles al título del artículo quizás no deberíamos hablar de las vías transapical y transaórtica, ya que podrían no considerarse estrictamente vasculares al no realizarse a través de un «vaso sanguíneo». Sin embargo, la información que nos aporta es crucial para la discusión y comparación de las distintas vías, así que hemos decidido incluirlas.
La población utilizada para el estudio son los 328 pacientes tratados desde el 1 de enero de 2011 hasta el 31 de diciembre de 2022.
Se han recogido y cuantificado una serie de variables, preoperatorias y postoperatorias:
- A.
Preoperatorias:
- •
Edad.
- •
Sexo.
- •
EuroSCORE I logístico calculado: aunque ya algo obsoleto, la recogida de datos comenzó cuando se utilizaba el EuroScore I, por lo que se ha decidido seguir utilizándolo para comparar el riesgo de los pacientes.
- •
Vía de acceso vascular utilizada: vía transapical, vía transaórtica, vía transcarotídea y vía transaxilar.
- •
Tipo de prótesis utilizada: autoexpandible o prótesis balón expandible.
- •
Año de implante.
- •
Indicación del implante. Se han clasificado en 4 grandes grupos: aorta torácica ascendente severamente calcificada, fragilidad y/o octogenario, alta morbilidad y/o EuroScore alto, y otras razones.
- •
- B.
Postoperatorias:
- •
Muerte precoz: se han incluido todos los éxitus tanto intraoperatorios como los ocurridos en el primer mes relacionados directamente con el intervencionismo.
- •
Muerte tardía: muertes ocurridas por cualquier causa en el primer año excluyendo los que cumplen criterios de muerte precoz.
- •
Presencia de fuga periprotésica: se ha clasificado como fuga leve, moderada o severa.
- •
Necesidad de implante de marcapasos definitivo postoperatorio.
- •
Aparición de ictus isquémico.
- •
Insuficiencia renal aguda postoperatoria: definida por la escala RIFLE, aumento de la creatinina 3 veces al valor preoperatorio o superior a 4mg/dl, anuria durante 12h y/o diuresis inferior a 0,3ml/kg/h/durante al menos 24h. Se han excluido las que se han establecido en pacientes con insuficiencia renal crónica.
- •
Complicaciones relacionadas con el acceso vascular utilizado para el implante.
- •
- C.
Otras complicaciones: se han recogido de manera cualitativa las complicaciones no relacionadas con el acceso vascular.
Las variables cualitativas se han expuesto en forma de frecuencias y porcentajes. En el caso de las variables cuantitativas se han descrito con las herramientas habituales de centralidad (media) y variabilidad (desviación estándar e intervalos de confianza).
En los casos que ha interesado, se ha realizado el cruce de variables categóricas con el objetivo de encontrar diferencias significativas para lo que hemos utilizado el test de Chi-cuadrado. El nivel de significación fijado es el habitual 5% (significativo si p<0,05).
ResultadosDe la población de 328 pacientes objeto del estudio a los que se le ha implantado una TAVI, esta población incluye 304 pacientes con implante de TAVI por vía no transfemoral.
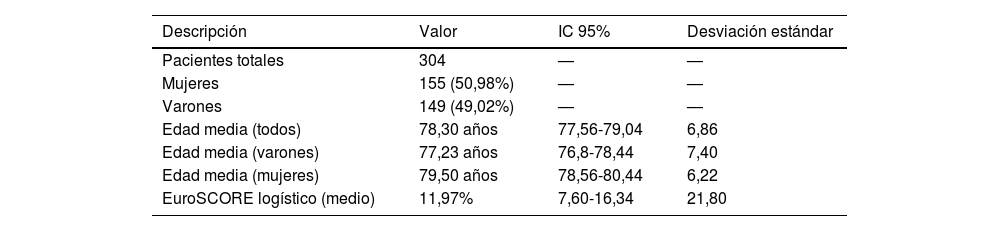
De estos 304 pacientes, el 50,98% (155) han sido mujeres y el 50,02% (149) varones. La edad media de los pacientes ha sido de 78,30 años (con un IC al 95%: 77,56-79,04 y una desviación estándar de 6,86). En el caso de los varones la media de edad ha sido 77,23 años (con un IC al 95%: 76,8-78,44 y una desviación estándar de 7,40) y, en el caso de las mujeres, 79,50 años (con un IC al 95%: 78,56-80,44 y una desviación estándar de 6,22).
El EuroSCORE I logístico medio ha sido del 11,97% (con un IC al 95%: 7,60-16,34 y una desviación estándar de 21,80).
Los resultados arriba mencionados se resumen en la tabla 1.
Datos demográficos y EuroSCORE I de los pacientes
| Descripción | Valor | IC 95% | Desviación estándar |
|---|---|---|---|
| Pacientes totales | 304 | — | — |
| Mujeres | 155 (50,98%) | — | — |
| Varones | 149 (49,02%) | — | — |
| Edad media (todos) | 78,30 años | 77,56-79,04 | 6,86 |
| Edad media (varones) | 77,23 años | 76,8-78,44 | 7,40 |
| Edad media (mujeres) | 79,50 años | 78,56-80,44 | 6,22 |
| EuroSCORE logístico (medio) | 11,97% | 7,60-16,34 | 21,80 |
IC 95%: intervalo de confianza del 95%.
Fuente: Elaboración propia.
Se han realizado 21 implantes por vía transaórtica (6,91%), 62 por vía transapical (20,40%), 168 transaxilares (55,26%) y 53 transcarotídeos (17,43%) (fig. 1).
El 69,73% (212) de los implantes han sido con prótesis autoexpandibles y el 30,27% (92) con prótesis balón expandibles (fig. 2).
En el caso de la vía transapical, todas las prótesis (62) han sido prótesis balón expandibles; en el caso de la vía transaórtica, 13 fueron prótesis balón expandibles y 8 autoexpandibles; en la vía transaxilar, 4 prótesis balón expandibles y 164 autoexpandibles; y por vía transcarotídea, 13 prótesis balón expandibles y 40 autoexpandibles.
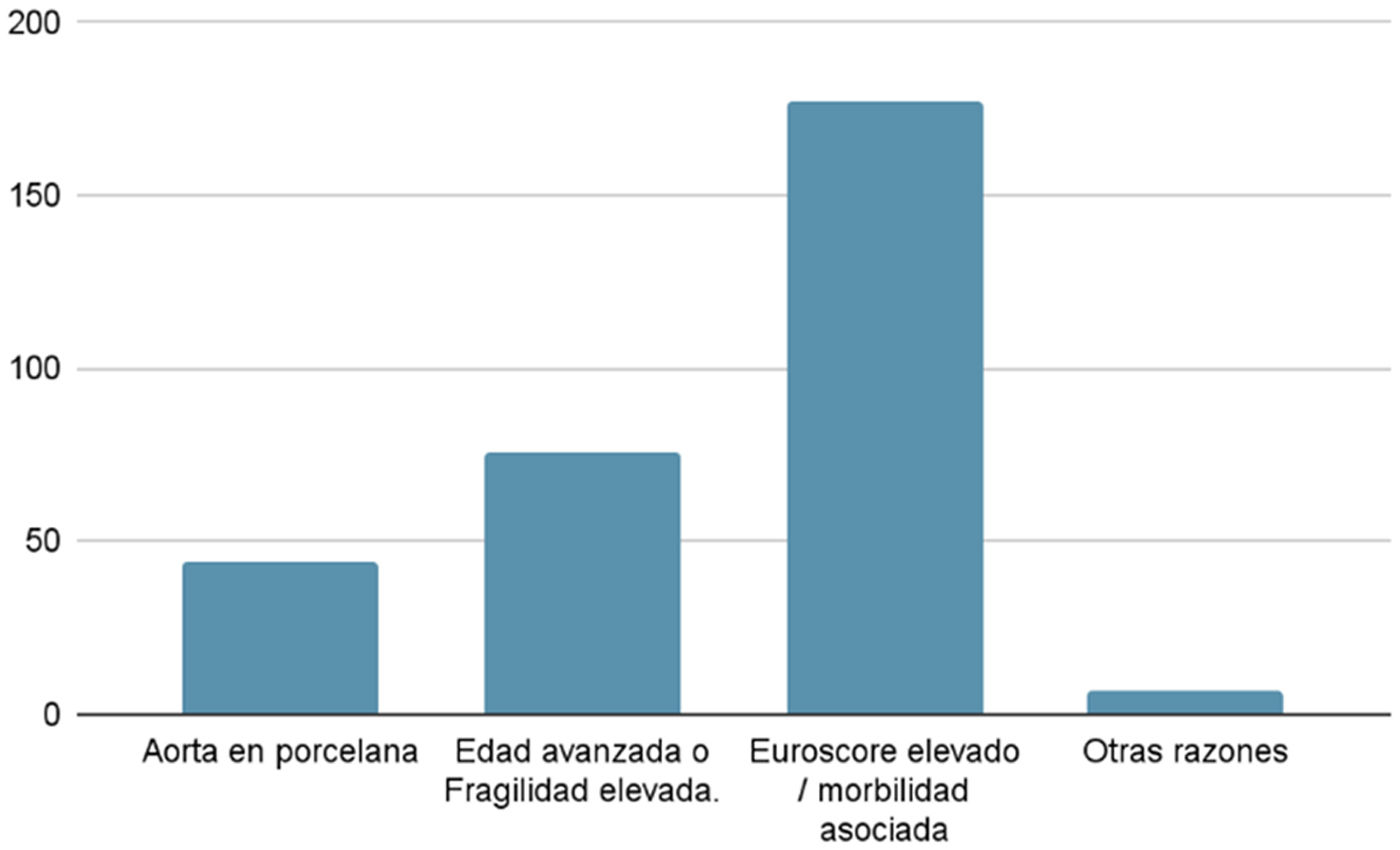
Sobre las indicaciones de la TAVI, se han recogido que 44 pacientes (14,48%) fueron indicados para TAVI por tener una aorta torácica ascendente severamente calcificada (aorta en porcelana); 76 pacientes (25%) por ser muy añoso y/o ser considerado muy frágil para una cirugía convencional; 177 pacientes (58,22%) por tener un EuroSCORE elevado y/o morbilidad asociada; y 7 pacientes (2,30%) por otras razones (fig. 3).
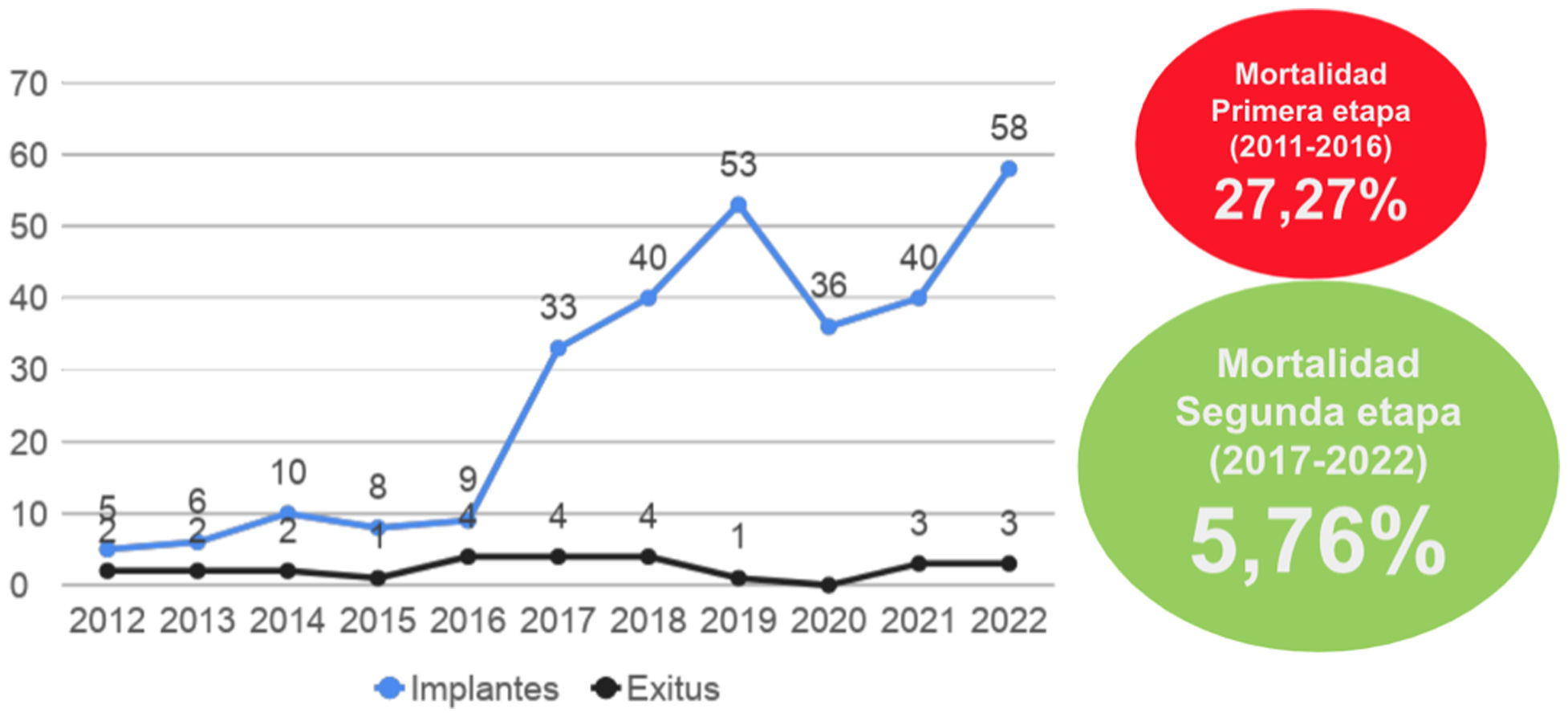
Durante los 12 años de programa TAVI, han fallecido 27 pacientes durante el procedimiento o en el primer mes postoperatorio; por ello, la muerte precoz es de un 8,88%. La muerte tardía ha sido de un 0%. El número de implantes y mortalidad por año se ha repartido de la siguiente manera (fig. 4).
La mortalidad por tipo de acceso utilizado se ha resumido en los siguientes datos, existiendo diferencias significativas entre las vías transaórtica-transapical vs. Transcarotídea/transaxilar, y no existiendo diferencias significativas entre la vía transaxilar y transcarotídea:
- •
Vía transaórtica: 4 exitus (19,04% de mortalidad).
- •
Vía transaxilar: 11 exitus (6,54% de mortalidad).
- •
Vía transapical: 11 exitus (17,74% de mortalidad).
- •
Via transcarotídea: un paciente (1,88% de mortalidad).
Del total de fallecidos, 15 recibieron prótesis balón expandibles y 12 autoexpandibles, la mortalidad por tipo de prótesis ha sido del 16,30% y 5,66%, respectivamente, siendo esta diferencia significativa.
Con respecto a las complicaciones relacionadas con el acceso vascular se han registrado 4 casos por la vía transaxilar (2,43%) y uno por la vía transapical (1,62%). No se han reportado complicaciones vasculares relacionadas con la vía ni en los casos transaórticos ni en los transcarotídeos. Se han producido 3 ictus isquémicos (0,98%), 2 por vía transaxilar (1,19%) y uno por vía transaórtica (4,76%) (tabla 2).
Resultados de las variables mortalidad, ictus, complicaciones vasculares e IRA
| Variable | Vía transaórtica | Vía transapical | Vía transaxilar | Vía transcarotídea |
|---|---|---|---|---|
| Mortalidad | 4 (19,04%) | 11 (17,64%) | 11 (6,54%) | 1 (1,88%) |
| Ictus isquémicos | 1 (4,76%) | 0 | 2 (1,19%) | |
| Complicaciones vasculares | 0 | 1 (1,62%) | 4 (2,43%) | 0 |
| IRA | 3 (14,29%) | 1 (4,55%) | 6 (3,57%) | 1 (1,88) |
IRA: insuficiencia renal aguda.
Fuente: Elaboración propia.
Once pacientes sufrieron insuficiencia renal aguda (IRA) en el postoperatorio:
- •
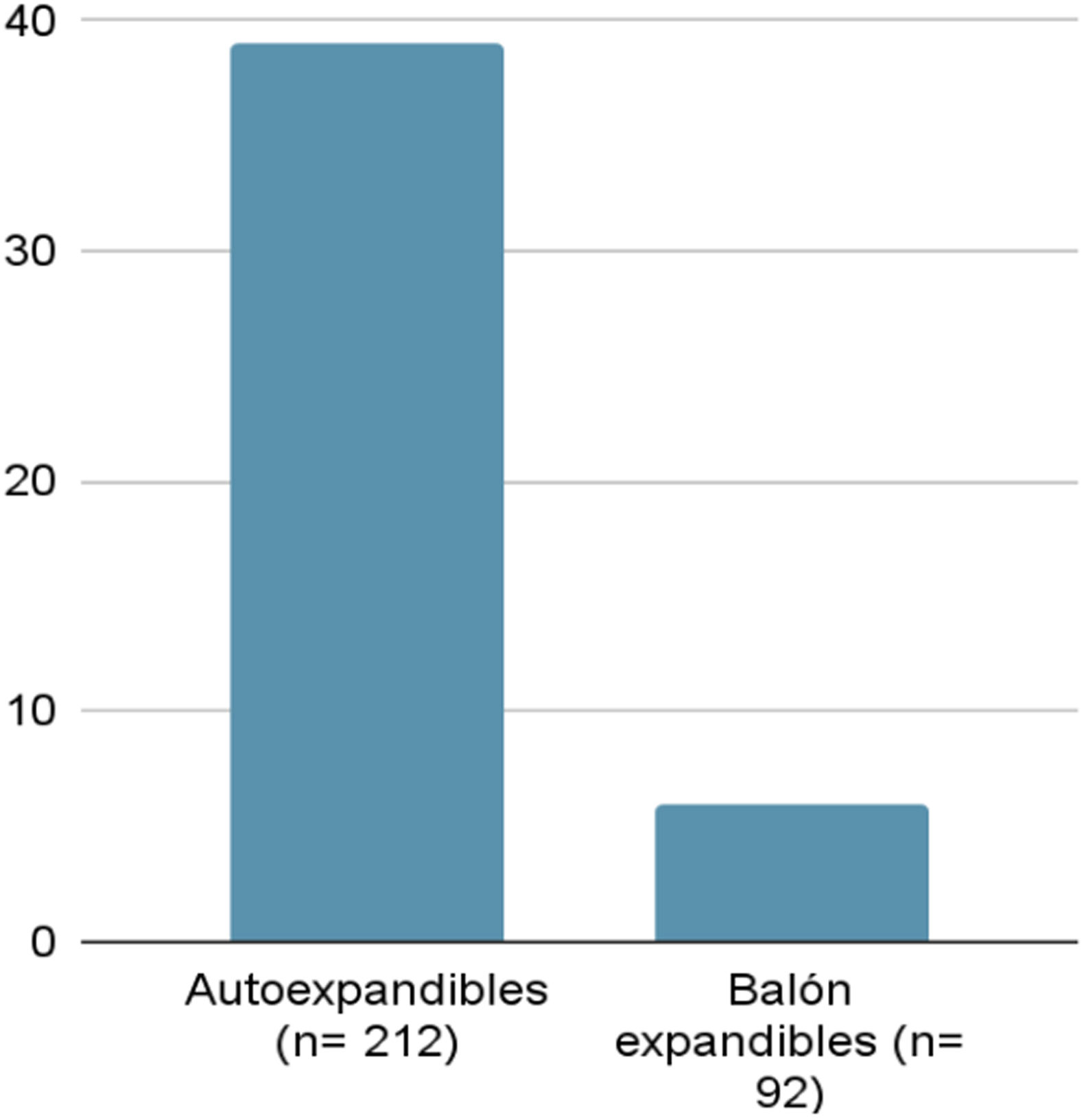
Tras el intervencionismo, 45 pacientes (14,80%) han precisado implantación de un marcapasos definitivo. De ellos, 6 (13,33%) pacientes habían recibido una prótesis balón expandibles y el resto (39 pacientes - 89,66%) autoexpandibles. La diferencia ha sido significativa (fig. 5).
- •
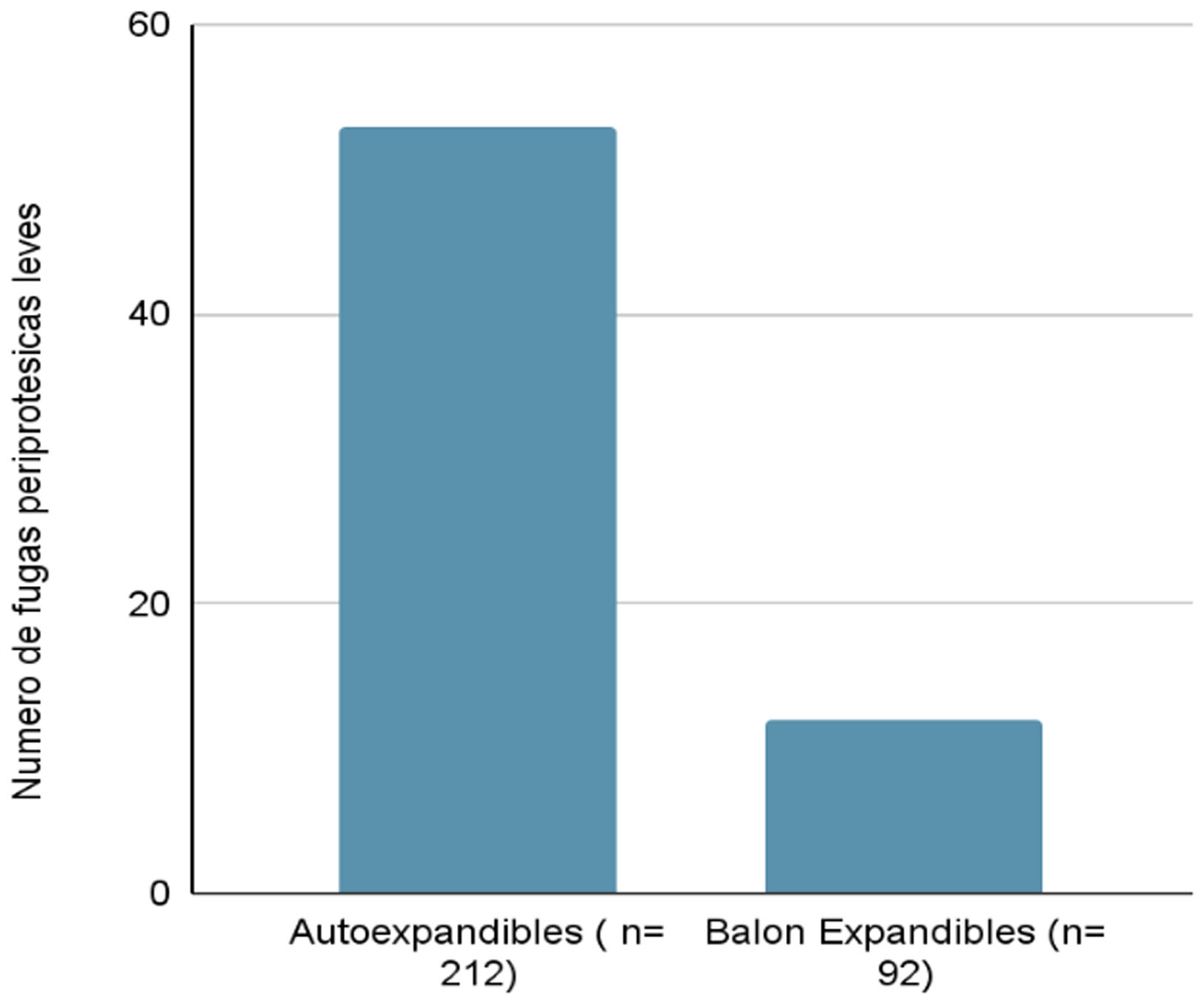
Sobre las fugas periprotésicas, se han registrado un total de 65 fugas (21,38%); en el caso de las expandibles han sido 12 fugas (13,04%) y en el caso de las autoexpandibles, 53 fugas (25%) siendo esta diferencia también significativa (fig. 6).
El análisis de los resultados describe de manera fiel el inicio, desarrollo y continuidad de un programa TAVI desarrollado en nuestro centro por un servicio eminentemente quirúrgico.
Se pueden diferenciar perfectamente 2 etapas: una primera etapa que corresponde desde 2011 hasta 2016, y una segunda etapa que incluye desde 2017 hasta 2022.
La primera etapa describe un inicio discreto del programa TAVI, con un volumen de casos pequeño (44 pacientes) y con una vía de acceso limitada a la transapical y transaórtica. En la segunda etapa, se observa un incremento exponencial de casos (260 pacientes) coincidiendo con la implementación de la vía transaxilar.
Este incremento es debido al cambio de actitud que tiene el servicio ante el TAVI femoral y la adopción de una filosofía: la vía de acceso no debe ser, por obligación, la vía transfemoral si existen otras arterias en el paciente de mejor calibre y calidad que se puedan utilizar como acceso para el implante. Tras negociaciones con el servicio de cardiología, conseguimos crear un equipo multidisciplinar (Heart Team) que iba a evaluar tanto la indicación como la «vía de acceso idónea» del implante, defendiendo por nuestra parte que la artería axilar o subclavia es igual de válida, o incluso mejor en algunas ocasiones, y que el principal objetivo de todo ello es minimizar en lo posible el riesgo de complicaciones vasculares relacionadas con la vía de implante.
El perfil de paciente ha cambiado también a lo largo de estos años. El EuroSCORE I medio logístico ha pasado de rondar cifras medias superiores al 20%6 antes de 2010 a medias de EuroSCORE por debajo del 10% actualmente7, tal y como se recoge en el registro de intervenciones de la Sociedad Española de Cirugía Cardiovascular. Se ha pasado del perfil de paciente inoperable por vía convencional por tener una aorta severamente calcificada o una morbilidad asociada muy alta, a indicar la TAVI prácticamente por edad elevada y/o fragilidad. Aunque en nuestro registro el EuroSCORE elevado y la morbilidad son todavía la principal razón de la indicación, hemos observado también un claro cambio de tendencia, sobre todo desde que la Sociedad Europea de Cardiología y Cirugía Cardiotorácica incorporaran en su guía de valvulopatías de 2021 la edad igual o superior a 75 años como un ítem que apoya la TAVI como método para tratar la estenosis aórtica en este grupo de pacientes2.
Sobre la mortalidad asociada a nuestro registro se pueden realizar múltiples matices. La mortalidad precoz observada es de un 8,88%, que se corresponde también con la mortalidad tardía ya que no hubo ningún éxitus en el primer año tras dar de alta a los pacientes. A priori, puede parecer una mortalidad elevada comparada con la mortalidad observada en otros registros8. Sin embargo, si calculamos la mortalidad entre la primera etapa (2011-2016) y la segunda etapa (2017-2022) se calculan cifras de mortalidad muy distintas. Para la primera etapa, se recoge una mortalidad de un 27,27% y, en la segunda etapa, una mortalidad del 5,76%. Esta mortalidad tiene una diferencia estadísticamente significativa. Las razones son obvias y se resumen principalmente en que, en la primera etapa:
- •
Existía un volumen de pacientes muy bajo.
- •
Coincidió con el periodo de curva de aprendizaje perjudicado a su vez por ese bajo volumen.
- •
Los pacientes que llegaban a nuestras manos asociaban una gran morbilidad y estaban descartados para la vía transfemoral (asociaban, por lo tanto, una arteriopatía periférica severa).
- •
Se utilizaba únicamente la vía transapical y la vía transaórtica, que son las vías más agresivas, utilizadas además en los peores pacientes (cuando los EuroSCORE eran muy altos y, verdaderamente, eran pacientes inoperables).
- •
La vía de acceso obligaba, en la mayoría de los casos, a la utilización de dispositivos con perfiles de mayor grosor y, únicamente, prótesis balón expandibles.
Estos resultados en la primera etapa fueron una de las principales causas del cambio de actitud en el servicio: nuestros resultados no podían ser comparables a los del servicio de cardiología, ya que ni el tipo de paciente ni las vías de acceso eran equiparables. Es por ello que decidimos incorporar a nuestra cartera de servicios el acceso por una arteria periférica que pudiera ser equiparable a la vía transfemoral y poder, así, optar a pacientes con un perfil de riesgo similar.
En el momento que incorporamos la vía transaxilar (y, posteriormente, la vía transcarotídea) y aumentamos el número de implantes, la mortalidad bajó hasta un 5,38%; es decir, esa es la mortalidad de las vías no femorales puramente vasculares, equiparable e incluso menor a otros registros TAVI8. Destacamos la diferencia significativa que aparece en los resultados entre las vías transaxilar/transcarotídea y las vías transaórtica/transapical. Llama la atención la baja mortalidad (1,88%) de la vía transcarotídea, aún sin diferencias significativas con la vía transaxilar en el número de pacientes estudiados. Recordemos que la mayoría de los pacientes derivados a vías vasculares no transfemorales asocian una arteriopatía periférica que, por sí misma, aumenta el riesgo de morbimortalidad, por lo que, en un estudio comparativo no aleatorizado, ese factor siempre empeorará los resultados de la vía vascular no transfemoral con respecto a la femoral.
La diferencia significativa de mortalidad que aparece entre las prótesis balón expandibles (16,30%) y autoexpandibles (5,66%) está también sesgada. La mayoría de las prótesis balón expandibles se implantaron en la primera etapa, es por ello que la mortalidad observada en este tipo de prótesis está directamente relacionada con las razones de mortalidad achacadas a la primera etapa, y no con el tipo de prótesis implantadas. Si calculamos la mortalidad para estas prótesis en la segunda etapa, se consigue una mortalidad del 6,52% para las prótesis balón expandibles y un 5,60% para las autoexpandibles, no siendo esta diferencia significativa.
Revisando las causas de las muertes, las prótesis balón expandibles tienen relación con una complicación fatal: la rotura del anillo aórtico.
Con la finalidad de evitar este tipo de complicaciones en la medida de lo posible, disminuir el número de fugas, optimizar la vía de acceso y facilitar el implante, el Heart Team también discute sobre el tipo de prótesis más adecuada para el paciente. La experiencia nos ha enseñado a interpretar con el angio-TC qué prótesis (de las que ofrece el mercado) puede ser mejor según la anatomía de la raíz, angulación de la aorta torácica ascendente y plano valvular, y distribución de calcio en el anillo. No todas las prótesis son válidas para todos los pacientes y una adecuada selección es crucial para el éxito del programa TAVI.
Por la misma razón, la vía transapical y transaórtica también tienen actualmente unas cifras de mortalidad menores que las calculadas, ya que estas vías en la segunda etapa disminuyeron su mortalidad a un 13,63 y un 0%, respectivamente.
Sobre la tasa de implantación de marcapasos, nuestros datos refuerzan lo ya sabido y recogido en la mayoría de estudios TAVI: las prótesis balón expandibles tienen menor necesidad de marcapasos definitivo postimplante que las autoexpandibles9. Este hecho está relacionado con el daño o estrés del haz de His, y aunque existen varios factores que influyen en ello, el tipo de prótesis utilizada y su profundidad de implante en el tracto de salida del ventrículo izquierdo es uno de los factores determinantes para la necesidad de marcapasos definitivo postoperatorio.
El número de ictus recogidos (0,98%) es sorprendentemente bajo comparado con otros registros como puede ser el estudio Evolut Low Risk que arroja una incidencia del 3,4% o el artículo de Kleiman et al. sobre eventos neurológicos en un registro CoreValve® donde presenta una tasa de ictus que ronda el 4,1-4,3%10,11. Es importante mencionar la nula presencia de eventos neurológicos en la vía transcarotídea que tiene nuestra serie, vía que a priori podría hacernos pensar que tiene ese riesgo inherente. Sin embargo, ya existen muchos estudios que comparan esta vía con otras, demostrando igual número de eventos neurológicos, como puede ser el estudio de Debry et al. en 20205. Para justificar esta baja tasa de ictus, una de las razones podría ser la ausencia del paso de guías de alta resistencia y del dispositivo TAVI a través del arco aórtico y de su apoyo en la curvatura mayor. Esta secuencia no está presente en las vías no transfemorales.
La baja tasa de complicaciones vasculares relacionadas con el acceso (1,64%) es un reflejo del trabajo realizado para elegir el acceso ideal para cada paciente, decidido de manera conjunta en el Heart Team. Ninguna de estas complicaciones vasculares fue fatal y pudieron ser solucionadas en el mismo quirófano. La principal complicación de la vía axilar fue la disección de la arteria. Estos resultados apoyan los conseguidos en el metaanálisis realizado por Sylvain Beurtheret en 2019 sobre acceso femoral y no femoral; en este metaanálisis, no encontraron diferencias significativas con respecto a las complicaciones vasculares entre la vía femoral y no femoral, llegando a considerar que las vías no femorales son incluso mejor que la femoral, sobre todo si la vía femoral no es idónea7. De nuevo, en nuestra serie, destaca los buenos resultados de la vía transcarotídea, que no presenta ninguna complicación vascular. Relacionado con ello, la mejor accesibilidad de la carótida con respecto a la subclavia.
También cabe mencionar las complicaciones vasculares (no fatales) de los accesos arteriales no relacionados con la vía de acceso para el TAVI. Nos referimos a los introductores de bajo perfil que se precisan para la introducción del «pigtail». Estos introductores se colocan por vía femoral, radial o humeral. Hemos tenido 2 seudoaneurismas femorales, una trombosis femoral y 2 trombosis de la arteria humeral.
Al analizar la relación entre el tipo de vía utilizada y la presencia de fuga (de cualquier tipo), observamos que solo existe una diferencia significativa entre la vía transaxilar (26,19% de fugas) y la vía transapical (12,90% de fugas). Pero de nuevo esta afirmación está sesgada, ya que en el caso de la vía transaxilar prácticamente todas las prótesis utilizadas (excepto 4) son autoexpandibles y, en el caso de la vía transapical, todas son prótesis balón expandibles. Esto demuestra que el factor más determinante de presencia de fugas de las variables estudiadas es el tipo de prótesis utilizada y no la vía, ya que como se registró en los resultados, existe una diferencia significativa entre el tipo de prótesis y la presencia de fugas.
Con respecto a la presencia de fugas moderadas y severas, la incidencia fue de un 6,25%, cifra comparable con los datos de grandes series como el PARTNER y el PARTNER 21,12. Las 4 fugas severas fueron tratadas con la implantación de una nueva prótesis balón expandible «valve in valve» en 3 ocasiones, y con la reconversión a cirugía convencional en una ocasión.
También mencionamos la presencia de insuficiencia renal aguda, que con baja incidencia (3,16%), es una complicación inherente a la utilización de contrastes yodados durante el implante. Poca o ninguna relación con la vía de acceso ni con el tipo de prótesis utilizada.
Por último, y aprovechando este artículo y los datos recogidos, queremos animar a otros servicios de cirugía cardiovascular que no hayan comenzado un programa TAVI a emprenderlo, defendiendo la legitimidad y el derecho que tiene nuestra especialidad a participar de manera activa en el tratamiento transcatéter de cualquier cardiopatía estructural, sobre todo a la que se refiere a enfermedad valvular adquirida.
Conclusiones- 1.
En las etapas de curva de aprendizaje de una técnica es crucial tener un volumen importante de pacientes para mejorar los resultados de manera rápida.
- 2.
La vía transapical es la más agresiva y con peores resultados en términos de mortalidad.
- 3.
Las prótesis balón expandibles tienen menos tasa de bloqueo y menos fugas periprotésicas, pero, a su vez, tienen una mortalidad ligeramente superior (no significativa).
- 4.
Las vías transaxilar y transcarotídea no son inferiores a la vía transfemoral en términos de morbimortalidad.
- 5.
Estas vías deben ser valoradas como opción de acceso no solo cuando no se pueda por vía transfemoral, si no cuando sean de mejor calidad que esta última.
- 6.
La vía transcarotídea se está posicionando como una posiblemente mejor alternativa que la vía transaxilar.
Los autores declaran no tener fuente de financiación para el presente artículo.
Conflicto de interesesEl Dr. Miguel Ángel Gómez Vidal es proctor de Abbott y Edwards.