La enfermedad coronaria puede estar presente en un 40-75% de los pacientes con estenosis aórtica severa que se someten a implante transcatéter de la válvula aórtica (TAVI). Se pretende evaluar la seguridad de un procedimiento híbrido en que se realiza simultáneamente la cirugía de revascularización coronaria y TAVI respecto a la cirugía convencional de revascularización coronaria e implante de prótesis aórtica con circulación extracorpórea.
MétodosSe analizaron los pacientes intervenidos de TAVI concomitantemente a revascularización coronaria sin circulación extracorpórea, de forma consecutiva, desde que se comenzó a realizar este procedimiento en el 2017 hasta el último paciente intervenido en el 2020 (n=19), y se compararon con los casos intervenidos de implante de prótesis aórtica biológica, con circulación extracorpórea, concomitantemente a revascularización coronaria quirúrgica, en el 2021 (n=24). Se utilizaron los parámetros unificados del Valve Academic Research Consortium 3 (VARC-3).
ResultadosRespecto a las variables preoperatorias, se encontraron diferencias estadísticamente significativas en la edad media (77,89±5,91 años en el grupo TAVI respecto a 70,33±5,48 años en el grupo de cirugía convencional; p<0,001), y en la tasa de vasculopatía (63,2% respecto a 25%; p=0,012). No se encontraron diferencias en el número de anastomosis coronarias realizadas entre ambos grupos. En los resultados posoperatorios, solo se encontraron diferencias estadísticamente significativas en la tasa de regurgitación periprotésica (47,4% vs. 8,3%; p=0,005).
ConclusiónEl TAVI concomitantemente a cirugía de revascularización coronaria se demuestra segura sin diferencias estadísticamente significativas en los objetivos primarios de mortalidad, tasa de ictus y de reintervenciones, así como en los objetivos combinados de éxito técnico, del dispositivo, de seguridad precoz y de eficacia clínica.
Coronary artery disease may be present in 40-75% of patients with severe aortic stenosis who undergo transcatheter aortic valve implantation (TAVI). The aim is to evaluate the safety of a hybrid procedure in which coronary artery bypass grafting and TAVI are performed simultaneously with respect to conventional coronary artery bypass grafting and aortic prosthesis implantation with cardiopulmonary bypass.
MethodsPatients who underwent TAVI concomitantly with coronary revascularization off-pump were analyzed, consecutively, from when this procedure began in 2017 until the last patient operated on in 2020 (n=19), compared with the cases operated on for biological aortic prosthesis implantation, with cardiopulmonary bypass, concomitantly with surgical coronary revascularization, in the last year 2021 (n=24). Unified Valve Academic Research Consortium 3 (VARC-3) parameters were used.
ResultsRegarding the preoperative variables, statistically significant differences were found in mean age (77,89±5,91 years in the TAVI group compared to 70,33±5,48 years in the conventional surgery group; p<0.001), and in the rate of vascular disease (63,2% vs. 25%; p=0,012). No differences were found in the number of coronary anastomoses performed between the two groups. In the postoperative results, only statistically significant differences were found in the rate of paravalvular regurgitation (47,4% vs. 8,3%; p=0.005).
ConclusionTAVI concomitantly with coronary artery bypass grafting has been shown to be safe with no statistically significant differences in the primary endpoints of mortality, stroke rate, and reoperations, as well as in the combined endpoints of technical success, device success, early safety, and of clinical efficacy.
La estenosis aórtica es la valvulopatía más frecuente que requiere tratamiento quirúrgico o intervencionista en Europa y Norteamérica, y su prevalencia aumenta debido al envejecimiento de la población1–4. Las fases tempranas de la estenosis aórtica son asintomáticas y están asociadas con un buen pronóstico, siendo la enfermedad avanzada la que se asocia con una considerable morbilidad y mortalidad5. No hay tratamiento médico que frene la progresión de la enfermedad, siendo el único tratamiento definitivo la sustitución valvular aórtica, bien de forma quirúrgica mediante cirugía convencional con circulación extracorpórea o mediante intervencionismo a través del implante transcatéter de la válvula aórtica (TAVI)1,5.
En 2014, el TAVI se recomendaba a pacientes con riesgo quirúrgico prohibitivo y esperanza de vida>12 meses, y también se consideraba razonable en pacientes de alto riesgo quirúrgico6. A lo largo de los años, se ha modificado la indicación TAVI en riesgo quirúrgico menor, de forma que ya en las guías europeas de 2021 se recomienda en pacientes de 75 años o más, en alto riesgo y en pacientes inoperables. También se equipara a la cirugía para riesgo intermedio y se deja la decisión entre TAVI o cirugía al equipo cardiológico y al paciente7–9.
La enfermedad coronaria puede estar presente en un 40-75% de los pacientes con estenosis aórtica severa que se someten a TAVI. La cirugía híbrida de revascularización coronaria, con o sin abordaje mínimamente invasivo, con TAVI concomitante puede ser una alternativa terapéutica vs. la actual tendencia a realizar intervencionismo coronario previamente a TAVI, y en un procedimiento diferido TAVI10,11. Se pretende evaluar la seguridad de un procedimiento híbrido en que se realiza simultáneamente la cirugía de revascularización coronaria y TAVI respecto a la cirugía convencional de revascularización coronaria e implante de prótesis aórtica con circulación extracorpórea.
MétodosRecogida de datosSe analizaron los pacientes intervenidos de TAVI concomitantemente a revascularización coronaria sin circulación extracorpórea, de forma consecutiva. Desde que se comenzó a realizar este procedimiento en el 2017 hasta el último paciente intervenido en el 2020, se obtuvieron un total de 19 pacientes. Para realizar el estudio comparativo se recogieron los casos intervenidos de implante de prótesis aórtica biológica, con circulación extracorpórea, concomitantemente a revascularización coronaria quirúrgica, en el último año 2021. Se excluyeron los casos de implante de prótesis mecánica, los de endocarditis y los de ampliación de anillo aórtico, aortoplastia o cualquier otro procedimiento asociado, contando con un total de 24 pacientes. Se trata de un estudio unicéntrico, en el Servicio de Cirugía Cardiovascular del Hospital Universitario y Politécnico La Fe de Valencia, y retrospectivo, recogiendo los datos de las variables informatizadas. Se utilizaron los parámetros unificados del Valve Academic Research Consortium 3 (VARC-3)12.
Variables utilizadasEn primer lugar, se recogieron las variables demográficas preoperatorias edad, sexo, índice de masa corporal (IMC), riesgo quirúrgico preoperatorio estimado según EuroSCORE II, clase funcional para disnea de la New York Heart Association (NYHA), infarto agudo de miocardio previo, revascularización coronaria quirúrgica previa, intervencionismo coronario percutáneo previo, enfermedad pulmonar obstructiva crónica, diabetes mellitus, insuficiencia renal, fibrilación auricular, fragilidad, presencia de insuficiencia mitral moderada o severa, y los parámetros ecocardiográficos de área valvular aórtica, gradiente valvular aórtico medio y máximo, y fracción de eyección del ventrículo izquierdo (FEVI). Respecto a los datos intraoperatorios, se recogió el tipo de prótesis y el número de anastomosis coronarias realizadas.
Para los resultados posoperatorios se utilizaron los parámetros unificados VARC-312: mortalidad, con la causa y el tiempo desde la intervención; tasa de ictus, con el tipo, el grado, la discapacidad producida y el tiempo desde la intervención; tasa de sangrado y transfusiones, según tipo; complicaciones vasculares y del acceso; complicaciones cardiacas estructurales; otras complicaciones del procedimiento; tasa de arritmias y tipos; tasa de infarto agudo de miocardio según la cuarta definición universal; y la tasa de disfunción protésica, con el grado de insuficiencia periprotésica y la presencia o ausencia de obstrucción protésica. Además, se utilizaron los objetivos combinados de éxito técnico (en caso de ausencia de mortalidad, éxito en el acceso, correcto posicionamiento de una única prótesis y ausencia de cirugía o intervencionismo debido a una complicación mayor vascular, del acceso o estructural cardiaco), de éxito del dispositivo a 30 días (en caso de éxito técnico, ausencia de mortalidad, de cirugía o intervencionismo debido a una complicación mayor vascular, del acceso o estructural cardiaco, y no obstrucción protésica o regurgitación mayor a ligera), de seguridad precoz a 30 días (en caso de ausencia de mortalidad, de evento neurológico, de sangrado tipo 2-4, o tipo 3-4 si existe un acceso quirúrgico, de complicación mayor vascular, del acceso o estructural cardiaco, de daño renal estadio 3-4, de regurgitación mayor a ligera, de implante de marcapasos y de cirugía o intervencionismo debida al dispositivo) y de eficacia clínica a un año (ausencia de mortalidad, de evento neurológico y de rehospitalización debida al procedimiento o causa valvular).
Análisis estadísticoSe utilizó la herramienta estadística SPSS (Chicago, EE. UU.) para la recogida y análisis de los datos. Las variables cuantitativas se expresan como media±desviación estándar (DE), y el análisis estadístico se realizó con el test paramétrico t de Student al comprobar la distribución normal de la variable con el test de Kolmogorov-Smirnov. Solo la variable EuroSCORE II resultó no tener una distribución normal, expresándola entonces como mediana y rango intercuartílico (IQR), y usando el test no paramétrico U de Mann-Whitney. Las variables cualitativas se expresan como porcentaje, y el análisis estadístico se realizó con el test X2 o con la prueba F de Fisher cuando la frecuencia esperada era menor al 5%. Se consideraron significativas las diferencias con p<0,05.
ResultadosDe los 19 pacientes intervenidos de procedimiento híbrido TAVI con revascularización coronaria, se utilizó un abordaje por esternotomía media completa en ocho pacientes (42,1%) y un abordaje por minitoracotomía anterolateral izquierda en 11 pacientes (57,9%). El acceso para el TAVI fue transapical en la mayoría (17 pacientes, que suponía un 89,5%), mientras que en dos casos se usó el acceso transaórtico (10,5%). Respecto al tipo de prótesis, se optó por una prótesis autoexpandible en 11 casos y por una prótesis balón-expandible en ocho casos (57,9% y 42,1%, respectivamente). De los 24 pacientes intervenidos con circulación extracorpórea de implante de prótesis aórtica y revascularización coronaria, se incluyeron 14 pacientes con implante de prótesis aórtica biológica convencional (58,3%), ocho con implante de prótesis aórtica biológica sin sutura o de despliegue rápido (33,4%) y dos con implante de prótesis aórtica biológica no soportada (8,3%).
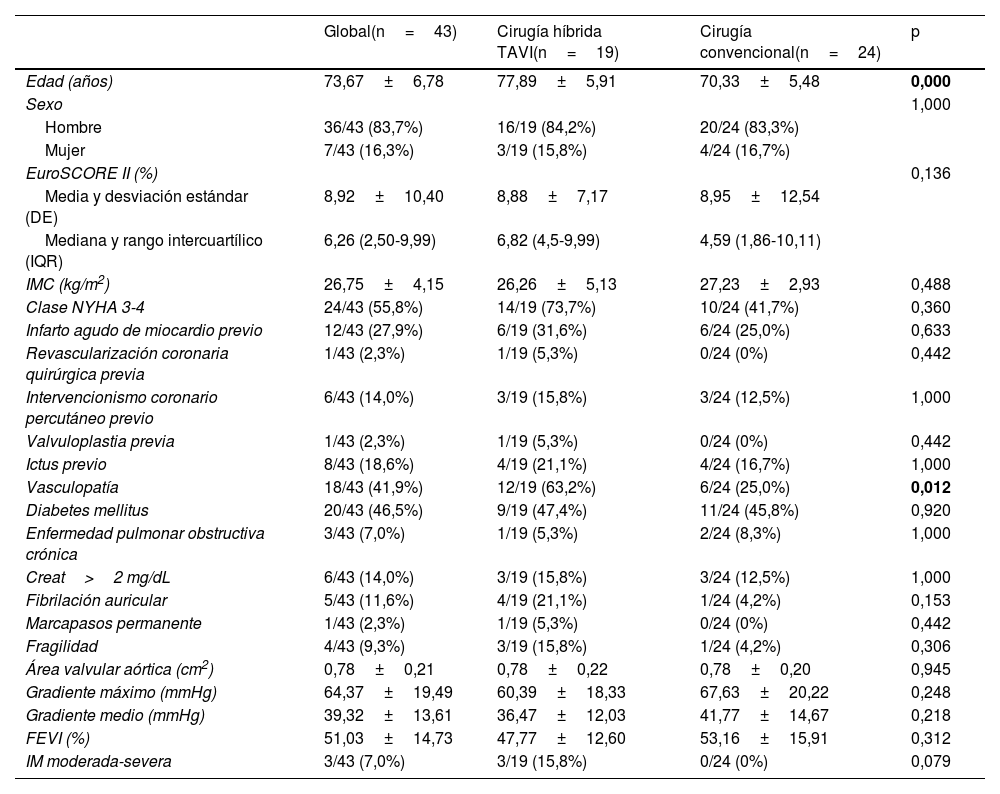
Respecto a las variables preoperatorias, no se encontraron diferencias en el análisis estadístico entre ambos grupos, excepto en la edad, que se encontró una edad media de 77,89±5,91 años en el grupo TAVI respecto a 70,33±5,48 años en el grupo de cirugía convencional, siendo estadísticamente mayor en el grupo TAVI (p<0,001), y en la tasa de vasculopatía que era también mayor en el grupo TAVI (63,2% respecto a 25%, con p=0,012). En cuanto al sexo, hubo mayor porcentaje de hombres en ambos grupos: 84,2% en el grupo TAVI y 83,3% en el de cirugía convencional (p=0,488). Al comparar el resto de las variables en el grupo TAVI, respecto a cirugía convencional, el IMC medio era de 26,26±5,13 kg/m2 respecto a 27,23±2,93 kg/m2 (p=0,488). La mediana del EuroSCORE II fue de 6,82% vs. 4,59% (p=0,136). Se encontraban en NYHA avanzada clase 3-4 en el 73,7% respecto al 41,7% (p=0,360). Del grupo TAVI, el 31,6% habían tenido un infarto agudo de miocardio previo vs. 25% del grupo de cirugía convencional (p=0,633), con una tasa de revascularización quirúrgica previa del 5,3% y del 0%, respectivamente (p=0,442) y de intervencionismo coronario percutáneo del 15,8% y del 12,5%, respectivamente (p=1). Del grupo TAVI, el 63,2% había tenido un ictus respecto al 16,7% del grupo de cirugía convencional (p=1). La tasa de diabetes mellitus, de enfermedad pulmonar obstructiva crónica, de insuficiencia renal con creatinina>2mg/dL, de fibrilación auricular y de marcapasos permanente era, respectivamente, de 47,4% y 45,8% (p=0,920), de 5,3% y 8,3% (p=1), de 15,8% y 12,5% (p=1), de 21,1% y 4,2% (p=0,153), y de 5,3% y 0% (p=0,442). Hubo un mayor porcentaje de fragilidad en el grupo TAVI (15,8%) que en el de cirugía convencional (4,2%), aunque tampoco fue estadísticamente significativo (p=0,306), ni se encontraron diferencias estadísticamente significativas en los parámetros ecocardiográficos, aunque con menor FEVI en el grupo TAVI (47,77±12,60% respecto a 53,16±15,91%, con p=0,312). Se resumen las variables preoperatorias en la tabla 1.
Datos preoperatorios
| Global(n=43) | Cirugía híbrida TAVI(n=19) | Cirugía convencional(n=24) | p | |
|---|---|---|---|---|
| Edad (años) | 73,67±6,78 | 77,89±5,91 | 70,33±5,48 | 0,000 |
| Sexo | 1,000 | |||
| Hombre | 36/43 (83,7%) | 16/19 (84,2%) | 20/24 (83,3%) | |
| Mujer | 7/43 (16,3%) | 3/19 (15,8%) | 4/24 (16,7%) | |
| EuroSCORE II (%) | 0,136 | |||
| Media y desviación estándar (DE) | 8,92±10,40 | 8,88±7,17 | 8,95±12,54 | |
| Mediana y rango intercuartílico (IQR) | 6,26 (2,50-9,99) | 6,82 (4,5-9,99) | 4,59 (1,86-10,11) | |
| IMC (kg/m2) | 26,75±4,15 | 26,26±5,13 | 27,23±2,93 | 0,488 |
| Clase NYHA 3-4 | 24/43 (55,8%) | 14/19 (73,7%) | 10/24 (41,7%) | 0,360 |
| Infarto agudo de miocardio previo | 12/43 (27,9%) | 6/19 (31,6%) | 6/24 (25,0%) | 0,633 |
| Revascularización coronaria quirúrgica previa | 1/43 (2,3%) | 1/19 (5,3%) | 0/24 (0%) | 0,442 |
| Intervencionismo coronario percutáneo previo | 6/43 (14,0%) | 3/19 (15,8%) | 3/24 (12,5%) | 1,000 |
| Valvuloplastia previa | 1/43 (2,3%) | 1/19 (5,3%) | 0/24 (0%) | 0,442 |
| Ictus previo | 8/43 (18,6%) | 4/19 (21,1%) | 4/24 (16,7%) | 1,000 |
| Vasculopatía | 18/43 (41,9%) | 12/19 (63,2%) | 6/24 (25,0%) | 0,012 |
| Diabetes mellitus | 20/43 (46,5%) | 9/19 (47,4%) | 11/24 (45,8%) | 0,920 |
| Enfermedad pulmonar obstructiva crónica | 3/43 (7,0%) | 1/19 (5,3%) | 2/24 (8,3%) | 1,000 |
| Creat>2 mg/dL | 6/43 (14,0%) | 3/19 (15,8%) | 3/24 (12,5%) | 1,000 |
| Fibrilación auricular | 5/43 (11,6%) | 4/19 (21,1%) | 1/24 (4,2%) | 0,153 |
| Marcapasos permanente | 1/43 (2,3%) | 1/19 (5,3%) | 0/24 (0%) | 0,442 |
| Fragilidad | 4/43 (9,3%) | 3/19 (15,8%) | 1/24 (4,2%) | 0,306 |
| Área valvular aórtica (cm2) | 0,78±0,21 | 0,78±0,22 | 0,78±0,20 | 0,945 |
| Gradiente máximo (mmHg) | 64,37±19,49 | 60,39±18,33 | 67,63±20,22 | 0,248 |
| Gradiente medio (mmHg) | 39,32±13,61 | 36,47±12,03 | 41,77±14,67 | 0,218 |
| FEVI (%) | 51,03±14,73 | 47,77±12,60 | 53,16±15,91 | 0,312 |
| IM moderada-severa | 3/43 (7,0%) | 3/19 (15,8%) | 0/24 (0%) | 0,079 |
Clase NYHA: clase de la New York Heart Association; DE: desviación estándar; FEVI: fracción de eyección del ventrículo izquierdo; IM: insuficiencia mitral; IMC: índice de masa corporal; IQR: rango intercuartílico; TAVI: implante transcatéter de la válvula aórtica.
En negrita se marcan los resultados estadísticamente significativos.
No se encontraron diferencias en el número de anastomosis coronarias realizadas entre ambos grupos (p=0,699), si bien tiende a ser mayor en el de cirugía convencional respecto al abordaje híbrido de TAVI. Se realizó un monopontaje coronario en 31,6% del grupo TAVI respecto al 20,8% del grupo de cirugía convencional, doble pontaje coronario en el 42,1% respecto al 37,5%, triple pontaje coronario en el 15,8% vs. 29,2%, y cuádruple y quíntuple pontaje coronario en el 10,5% y 8,3%, así como 0% y 4,2%, respectivamente. Se resume la variable intraoperatoria de número de anastomosis coronarias en la tabla 2.
Resultados intraoperatorios
| Global(n=43) | Cirugía híbrida TAVI(n=19) | Cirugía convencional(n=24) | p | |
|---|---|---|---|---|
| Número de anastomosis coronarias | 0,699 | |||
| Monopontaje coronario | 11/43 (25,6%) | 6/19 (31,6%) | 5/24 (20,8%) | |
| Doble pontaje coronario | 17/43 (39,5%) | 8/19 (42,1%) | 9/24 (37,5%) | |
| Triple pontaje coronario | 10/43 (23,3%) | 3/19 (15,8%) | 7/24 (29,2%) | |
| Cuádruple pontaje coronario | 4/43 (9,3%) | 2/19 (10,5%) | 2/24 (8,3%) | |
| Quíntuple pontaje coronario | 1/43 (2,3%) | 0/19 (0%) | 1/24 (4,2%) | |
TAVI: implante transcatéter de la válvula aórtica.
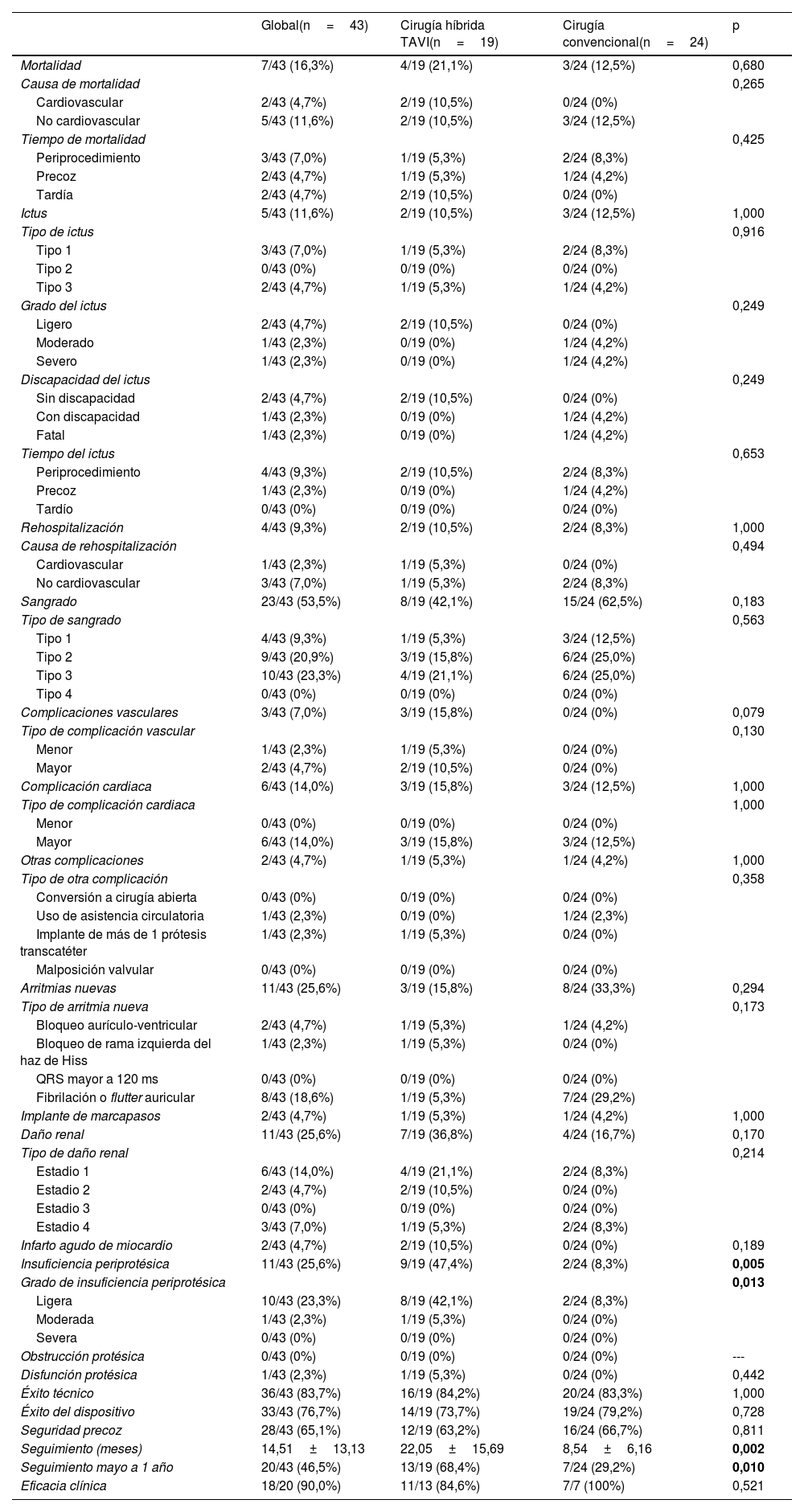
En los resultados posoperatorios, solo se encontraron diferencias estadísticamente significativas en la tasa de regurgitación periprotésica (p=0,005), siendo mayor en el grupo TAVI (47,4%) vs. grupo de cirugía convencional (8,3%). Además, también se encontraron diferencias estadísticamente significativas en este parámetro al analizarlo según los grados de insuficiencia: ligera en 42,1% respecto al 8,3% y moderada en 5,3% respecto al 0% (p=0,013). La mortalidad no presentó diferencias estadísticamente significativas, aunque fue mayor en el grupo TAVI (21,1% vs. 12,5%, con p=0,680), siendo de causa cardiovascular en el 10,5% del grupo TAVI y en el 0% de cirugía convencional, y de causa no cardiovascular en el 10,5% respecto al 12,5% (p=0,265). La mortalidad fue ligeramente mayor periprocedimiento en el grupo de cirugía convencional (5,3% vs. 8,3%), pero menor tardíamente (10,5% vs. 0%), aunque sin significación estadística (p=0,425). Tampoco se encontraron diferencias en la tasa de accidente cerebrovascular (10,5% y 12,5%, con p=1). La tasa de rehospitalización fue ligeramente mayor en el grupo TAVI (10,5% y 8,3%, con p=1). En cambio, la tasa de sangrado fue mayor en el grupo de cirugía convencional (42,1% y 62,5%, con p=0,183), y además de mayor grado, pero sin diferencias estadísticamente significativas, estando este parámetro penalizado por la tasa de transfusiones. No se encontró ninguna complicación vascular en el grupo de cirugía convencional (15,8% vs. 0%, con p=0,079) y la tasa de complicaciones cardiacas también fue mayor en el grupo TAVI (15,8% y 12,5%, con p=1), pero sin alcanzar la significación estadística. Ningún caso requirió conversión a cirugía abierta. Se encontró un caso de necesidad de uso de asistencia circulatoria en el grupo de cirugía convencional, y se encontró un caso de implante de más de una prótesis transcatéter en el grupo TAVI. La tasa de arritmias nuevas fue mayor en el grupo de cirugía convencional (15,8% y 33,3%, respectivamente, con p=0,294), con mayor tasa de fibrilación y flutter auricular (5,3% y 29,2%, con p=0,173), pero solo con un caso en cada grupo de necesidad de implante de marcapasos. En cambio, hubo mayor tasa de daño renal en el grupo TAVI (36,8% vs. 16,7%, con p=0,170), aunque mayormente en estadio 1 (21,1% vs. 8,3%, con p=0,214). No se encontraron diferencias en la tasa de infarto agudo de miocardio entre ambos grupos, aunque mayor en el grupo TAVI (10,5% respecto al 0%, con p=0,189).
Por último, respecto a los objetivos combinados, no se encontraron diferencias. Hubo un éxito técnico del 84,2% en el grupo TAVI respecto al 83,3% en el grupo de cirugía convencional (p=1). A 30 días, tampoco se encontraron diferencias en las variables combinadas de éxito del dispositivo y de seguridad precoz: 73,7% y 79,2% con p=0,728, y 63,2% y 66,7% con p=0,811, respectivamente. Además, a un año, no se encontraron diferencias en la eficacia clínica, no obstante, fue mayor en el grupo de cirugía convencional (84,6% vs. 100%, con p=0,521), considerando también el menor seguimiento a largo plazo del grupo de cirugía convencional analizado estadísticamente significativo (seguimiento mayor a un año en el 68,4% del grupo TAVI respecto al 29,2% del grupo de cirugía convencional, con p=0,01). Se resumen las variables posoperatorias en la tabla 3.
Resultados posoperatorios
| Global(n=43) | Cirugía híbrida TAVI(n=19) | Cirugía convencional(n=24) | p | |
|---|---|---|---|---|
| Mortalidad | 7/43 (16,3%) | 4/19 (21,1%) | 3/24 (12,5%) | 0,680 |
| Causa de mortalidad | 0,265 | |||
| Cardiovascular | 2/43 (4,7%) | 2/19 (10,5%) | 0/24 (0%) | |
| No cardiovascular | 5/43 (11,6%) | 2/19 (10,5%) | 3/24 (12,5%) | |
| Tiempo de mortalidad | 0,425 | |||
| Periprocedimiento | 3/43 (7,0%) | 1/19 (5,3%) | 2/24 (8,3%) | |
| Precoz | 2/43 (4,7%) | 1/19 (5,3%) | 1/24 (4,2%) | |
| Tardía | 2/43 (4,7%) | 2/19 (10,5%) | 0/24 (0%) | |
| Ictus | 5/43 (11,6%) | 2/19 (10,5%) | 3/24 (12,5%) | 1,000 |
| Tipo de ictus | 0,916 | |||
| Tipo 1 | 3/43 (7,0%) | 1/19 (5,3%) | 2/24 (8,3%) | |
| Tipo 2 | 0/43 (0%) | 0/19 (0%) | 0/24 (0%) | |
| Tipo 3 | 2/43 (4,7%) | 1/19 (5,3%) | 1/24 (4,2%) | |
| Grado del ictus | 0,249 | |||
| Ligero | 2/43 (4,7%) | 2/19 (10,5%) | 0/24 (0%) | |
| Moderado | 1/43 (2,3%) | 0/19 (0%) | 1/24 (4,2%) | |
| Severo | 1/43 (2,3%) | 0/19 (0%) | 1/24 (4,2%) | |
| Discapacidad del ictus | 0,249 | |||
| Sin discapacidad | 2/43 (4,7%) | 2/19 (10,5%) | 0/24 (0%) | |
| Con discapacidad | 1/43 (2,3%) | 0/19 (0%) | 1/24 (4,2%) | |
| Fatal | 1/43 (2,3%) | 0/19 (0%) | 1/24 (4,2%) | |
| Tiempo del ictus | 0,653 | |||
| Periprocedimiento | 4/43 (9,3%) | 2/19 (10,5%) | 2/24 (8,3%) | |
| Precoz | 1/43 (2,3%) | 0/19 (0%) | 1/24 (4,2%) | |
| Tardío | 0/43 (0%) | 0/19 (0%) | 0/24 (0%) | |
| Rehospitalización | 4/43 (9,3%) | 2/19 (10,5%) | 2/24 (8,3%) | 1,000 |
| Causa de rehospitalización | 0,494 | |||
| Cardiovascular | 1/43 (2,3%) | 1/19 (5,3%) | 0/24 (0%) | |
| No cardiovascular | 3/43 (7,0%) | 1/19 (5,3%) | 2/24 (8,3%) | |
| Sangrado | 23/43 (53,5%) | 8/19 (42,1%) | 15/24 (62,5%) | 0,183 |
| Tipo de sangrado | 0,563 | |||
| Tipo 1 | 4/43 (9,3%) | 1/19 (5,3%) | 3/24 (12,5%) | |
| Tipo 2 | 9/43 (20,9%) | 3/19 (15,8%) | 6/24 (25,0%) | |
| Tipo 3 | 10/43 (23,3%) | 4/19 (21,1%) | 6/24 (25,0%) | |
| Tipo 4 | 0/43 (0%) | 0/19 (0%) | 0/24 (0%) | |
| Complicaciones vasculares | 3/43 (7,0%) | 3/19 (15,8%) | 0/24 (0%) | 0,079 |
| Tipo de complicación vascular | 0,130 | |||
| Menor | 1/43 (2,3%) | 1/19 (5,3%) | 0/24 (0%) | |
| Mayor | 2/43 (4,7%) | 2/19 (10,5%) | 0/24 (0%) | |
| Complicación cardiaca | 6/43 (14,0%) | 3/19 (15,8%) | 3/24 (12,5%) | 1,000 |
| Tipo de complicación cardiaca | 1,000 | |||
| Menor | 0/43 (0%) | 0/19 (0%) | 0/24 (0%) | |
| Mayor | 6/43 (14,0%) | 3/19 (15,8%) | 3/24 (12,5%) | |
| Otras complicaciones | 2/43 (4,7%) | 1/19 (5,3%) | 1/24 (4,2%) | 1,000 |
| Tipo de otra complicación | 0,358 | |||
| Conversión a cirugía abierta | 0/43 (0%) | 0/19 (0%) | 0/24 (0%) | |
| Uso de asistencia circulatoria | 1/43 (2,3%) | 0/19 (0%) | 1/24 (2,3%) | |
| Implante de más de 1 prótesis transcatéter | 1/43 (2,3%) | 1/19 (5,3%) | 0/24 (0%) | |
| Malposición valvular | 0/43 (0%) | 0/19 (0%) | 0/24 (0%) | |
| Arritmias nuevas | 11/43 (25,6%) | 3/19 (15,8%) | 8/24 (33,3%) | 0,294 |
| Tipo de arritmia nueva | 0,173 | |||
| Bloqueo aurículo-ventricular | 2/43 (4,7%) | 1/19 (5,3%) | 1/24 (4,2%) | |
| Bloqueo de rama izquierda del haz de Hiss | 1/43 (2,3%) | 1/19 (5,3%) | 0/24 (0%) | |
| QRS mayor a 120 ms | 0/43 (0%) | 0/19 (0%) | 0/24 (0%) | |
| Fibrilación o flutter auricular | 8/43 (18,6%) | 1/19 (5,3%) | 7/24 (29,2%) | |
| Implante de marcapasos | 2/43 (4,7%) | 1/19 (5,3%) | 1/24 (4,2%) | 1,000 |
| Daño renal | 11/43 (25,6%) | 7/19 (36,8%) | 4/24 (16,7%) | 0,170 |
| Tipo de daño renal | 0,214 | |||
| Estadio 1 | 6/43 (14,0%) | 4/19 (21,1%) | 2/24 (8,3%) | |
| Estadio 2 | 2/43 (4,7%) | 2/19 (10,5%) | 0/24 (0%) | |
| Estadio 3 | 0/43 (0%) | 0/19 (0%) | 0/24 (0%) | |
| Estadio 4 | 3/43 (7,0%) | 1/19 (5,3%) | 2/24 (8,3%) | |
| Infarto agudo de miocardio | 2/43 (4,7%) | 2/19 (10,5%) | 0/24 (0%) | 0,189 |
| Insuficiencia periprotésica | 11/43 (25,6%) | 9/19 (47,4%) | 2/24 (8,3%) | 0,005 |
| Grado de insuficiencia periprotésica | 0,013 | |||
| Ligera | 10/43 (23,3%) | 8/19 (42,1%) | 2/24 (8,3%) | |
| Moderada | 1/43 (2,3%) | 1/19 (5,3%) | 0/24 (0%) | |
| Severa | 0/43 (0%) | 0/19 (0%) | 0/24 (0%) | |
| Obstrucción protésica | 0/43 (0%) | 0/19 (0%) | 0/24 (0%) | --- |
| Disfunción protésica | 1/43 (2,3%) | 1/19 (5,3%) | 0/24 (0%) | 0,442 |
| Éxito técnico | 36/43 (83,7%) | 16/19 (84,2%) | 20/24 (83,3%) | 1,000 |
| Éxito del dispositivo | 33/43 (76,7%) | 14/19 (73,7%) | 19/24 (79,2%) | 0,728 |
| Seguridad precoz | 28/43 (65,1%) | 12/19 (63,2%) | 16/24 (66,7%) | 0,811 |
| Seguimiento (meses) | 14,51±13,13 | 22,05±15,69 | 8,54±6,16 | 0,002 |
| Seguimiento mayo a 1 año | 20/43 (46,5%) | 13/19 (68,4%) | 7/24 (29,2%) | 0,010 |
| Eficacia clínica | 18/20 (90,0%) | 11/13 (84,6%) | 7/7 (100%) | 0,521 |
TAVI: implante transcatéter de la válvula aórtica.
En negrita se marcan los resultados estadísticamente significativos.
Según la última guía europea de valvulopatías del año 2021, se recomienda la revascularización coronaria quirúrgica concomitantemente a la cirugía valvular aórtica, mitral o tricuspídea cuando existe una estenosis coronaria mayor o igual al 70% del diámetro, con una clase de recomendación I. No obstante, esta recomendación disminuye a clase IIa cuando se realiza TAVI o procedimiento transcatéter de la válvula mitral, debiéndose considerar el intervencionismo coronario percutáneo en estenosis coronarias mayor al 70% del diámetro en segmentos proximales9. Lo mismo se indicaba en la guía europea previa del año 2018 de revascularización coronaria13. La cirugía coronaria aumenta la complejidad del procedimiento, pero a su vez, la presencia de enfermedad coronaria, que puede encontrarse en un 40-75% de los pacientes con estenosis aórtica severa que se someten a TAVI, también aumenta el riesgo del paciente y puede comprometer los resultados a largo plazo11. El rápido desarrollo del TAVI y la ampliación de sus indicaciones en menor riesgo quirúrgico pueden hacer replantear el manejo óptimo de los pacientes con estenosis aórtica severa y enfermedad coronaria concomitante14. Además, no se ha establecido todavía claramente los beneficios de la evaluación funcional de la estenosis coronaria complementaria en el contexto de la estenosis aórtica15.
Se han encontrado resultados contradictorios respecto al intervencionismo coronario percutáneo previamente a TAVI. En algunas series aumenta la mortalidad respecto a los pacientes con ausencia de enfermedad coronaria, además de la posibilidad de fallo del intervencionismo coronario percutáneo y la imposibilidad técnica en algún paciente14,16,17. En otras series, el intervencionismo coronario percutáneo previamente a TAVI en la enfermedad coronaria encontrada incidentalmente aumenta la supervivencia de estos pacientes a largo plazo, requiriéndose por tanto estudios aleatorizados18. La cirugía coronaria sin circulación extracorpórea se ha demostrado segura disminuyendo la tasa de infartos y accidentes cerebrovasculares posoperatorios, al evitar la manipulación de la aorta14,19. A pesar de ello, sí se encontraron en los resultados descritos en el estudio una tasa de accidente cerebrovascular del 10,5% en el grupo de cirugía híbrida TAVI y del 12,5% en el grupo de cirugía convencional, sin diferencias entre ambos. Respecto a la tasa de infarto agudo de miocardio, solo se apreció en el grupo de TAVI, con un 10,5%, respecto al 0% en el grupo convencional.
Respecto a la insuficiencia periprotésica, en los resultados se encontraron diferencias estadísticamente significativas, siendo mayor en el grupo TAVI (47,4%) vs. grupo de cirugía convencional (8,3%). No se encontraron diferencias en mortalidad. No obstante, en la literatura se describe que incluso la insuficiencia periprotésica ligera se ha asociado con un aumento de la mortalidad a medio-largo plazo tras TAVI20,21. Este dato es importante debido a la extensión de la indicación de TAVI en pacientes de menor riesgo quirúrgico y más jóvenes9,21. Existen tres posibles mecanismos que explican el aumento de mortalidad asociada a la insuficiencia periprotésica ligera: en primer lugar, la hipertrofia ventricular izquierda asociada a la estenosis aórtica que lleva a un aumento de la precarga y gradualmente a la insuficiencia cardiaca peor tolerada por la insuficiencia aórtica de novo; en segundo lugar, se pueden observar mayores tasas de sangrado por pérdida de factor de Von Willebrand; y por último, la insuficiencia puede progresar de ligera a moderada-severa con el tiempo21.
Para finalizar, se debe remarcar la importancia de la existencia de unos criterios estandarizados, como lo son los VARC-3, que permiten la existencia de unas variables unificadas en la literatura con el objetivo de mejorar la calidad de los ensayos sobre intervenciones en la válvula aórtica12,22. El estudio presenta algunas limitaciones, entre ellas, que se trata de un estudio realizado en un único centro y con las limitaciones propias de este tipo de estudios retrospectivos y no aleatorizados. Además, la muestra es reducida y no existe un largo seguimiento que permita encontrar mayores diferencias entre ambos grupos en la supervivencia y libertad de reintervención a largo plazo.
ConclusionesEl rápido desarrollo del TAVI y la ampliación de sus indicaciones en menor riesgo quirúrgico pueden hacer replantear el manejo óptimo de los pacientes con estenosis aórtica severa y enfermedad coronaria concomitante14. El TAVI concomitantemente a cirugía de revascularización coronaria se demuestra segura sin diferencias estadísticamente significativas en los objetivos primarios de mortalidad, tasa de ictus y de rehospitalización, así como en los objetivos combinados de éxito técnico, del dispositivo, de seguridad precoz y de eficacia clínica.
Consideraciones éticasAprobado por el Comité de Ética de la Investigación con Medicamentos del Hospital Universitario y Politécnico La Fe. No se requiere Consentimiento Informado porque no aparecen datos identificativos de pacientes.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesTomás Heredia-Cambra ha participado como proctor de las plataformas Portico (Abbott), Navitor (Abbott) y MyVal (Meril) y ha recibido honorarios de Palex Medical, Mercé Electromedicina y Quilpro Cardio. No existe conflicto de intereses para el resto de los autores.
Fundación San Pablo Andalucía CEU.