El implante de prótesis valvular aórtica transcatéter (TAVI) ha experimentado un incremento del número de procedimientos del 50% sobre las cifras obtenidas con los riesgos alto e intermedio con su expansión al bajo riesgo. Recientemente se han hecho públicas actualizaciones en el seguimiento de los principales estudios clínicos aleatorizados (ECA) en este grupo de pacientes. Aunque los resultados de estos estudios han servido de base para recomendar el TAVI en pacientes añosos con riesgos intermedio o alto, todavía existen varios aspectos que necesitan ser aclarados antes de expandir, de forma indiscriminada o no seleccionada, esta modalidad de tratamiento a los pacientes más jóvenes de bajo riesgo. Esta revisión analizará los resultados disponibles en la evidencia publicada, así como las variables más significativas que pueden afectar a la consistencia de estos, tanto de forma precoz como en el largo plazo, para su consideración en la toma de decisiones individualizada y centrada en el paciente.
Transcatheter aortic valve implantation (TAVI) has experienced an increase in the number of procedures of 50% with its expansion to low risk, over the numbers obtained with high and intermediate risks. Recently, updates have been made public in the follow-up of the main randomized clinical studies (RCTs) in this group of patients. Although the results of these studies have served as a basis for recommending TAVI in elderly patients with intermediate or high risks, there are still several aspects that need to be clarified before expanding, in an indiscriminate or unselected manner to low-risk young patients. This review's aim is to analyze the results available in the published evidence, as well as the most significant variables that can affect their consistency, both in early and long term; for consideration in individualized patient-centered decision making.
Las enfermedades del aparato circulatorio constituyen la primera causa de muerte en Europa y en Estados Unidos, con una tasa de mortalidad que supera los 250/100.000 habitantes1, siendo responsables en España de más de 5 millones de estancias hospitalarias2. El riesgo de padecer enfermedades cardiovasculares se duplica entre la quinta y la octava décadas de la vida, alcanzando una prevalencia del 79-86% superados los 80años3, presentando en el 25% de los casos algún grado de limitación funcional por envejecimiento cardiovascular4, y en más del 10% de las personas mayores de 75años, manifestaciones clínicas de insuficiencia cardíaca5,6.
Según las proyecciones demográficas, el número de mayores de 65años en el año 2040 se duplicará respecto al comienzo de siglo, constituyendo más del 20% de la población mundial, al superar los 2.000 millones de personas7. En España, en el año 2001 los mayores de 65años superaron a la población infantil menor de 14 años, produciendo una histórica inflexión demográfica8 y alcanzando los 8,5 millones (18,1%), de los cuales 1,5 millones son mayores de 85años (3,2%)9. El Instituto Nacional de Estadística (INE) de España estima que la esperanza de vida para el año 2061 sería de 89años para los hombres y de 92años para las mujeres, lo que supondría un 21,1% de octogenarios. El aumento de la esperanza de vida, que supone un éxito incuestionable desde la perspectiva individual, constituye un desafío para la financiación de los sistemas sanitarios, que deben responder a la explosión de enfermedades crónicas y a múltiples casos de comorbilidad10-13.
Como consecuencia, se espera un incremento aproximado del 10% en la prevalencia de las enfermedades cardiovasculares14, a pesar del sesgo de las series hospitalarias15. La prevalencia promediada para la estenosis aórtica severa en mayores de 75años es del 3,4%16 y merece la consideración de problema de salud pública, en concordancia con algunos estudios poblacionales17. En España, el 7% de las personas mayores de 85años tienen algún grado de estenosis aórtica, lo que supone aproximadamente 100.000 pacientes9,18.
La historia natural de la estenosis aórtica fue definida en 1968 por Ross y Braunwald19, quienes, basados en la descripción que Contratto y Levine20 identificaron las tres manifestaciones clínicas cardinales en 1937, en concordancia con la larga fase latente subclínica descrita por Dry y Willius21, las cuales se asocian a un pronóstico ominoso una vez se inician los síntomas, con supervivencias medias inferiores a los 5años, y comparables con las expectativas de los tumores metastásicos más agresivos cuando alcanza estadios de insuficiencia cardíaca congestiva22,23.
La intervención está recomendada de forma categórica para pacientes sintomáticos con estenosis aórtica grave de gradiente alto (gradiente medio ≥40mmHg, velocidad pico ≥4,0m/s y área valvular ≤1,0cm2 o ≤0,6cm2/m2). En cuanto a los pacientes asintomáticos, se han incluido nuevas recomendaciones en las ediciones más recientes de las guías, debiendo considerarse la intervención en pacientes con FEVI<55% sin otra causa, o en aquellos con una estenosis aórtica muy grave (gradiente medio ≥60mmHg o velocidades ≥5m/s), calcificación valvular grave (preferentemente por TAC) con una tasa de progresión de Vmax ≥0,3m/s/año o valores de BNP elevados (más de tres veces corregidos para edad y sexo)24.
Previamente al inicio de la era del implante de válvula aórtica transcatéter (transcatheter aortic valve implantation [TAVI]), según se recoge en el Euro Heart Survey on Valvular Heart Disease, casi un tercio de los pacientes con indicación quirúrgica por enfermedad monovalvular no fueron referenciados a cirugía debido a sus comorbilidades25.
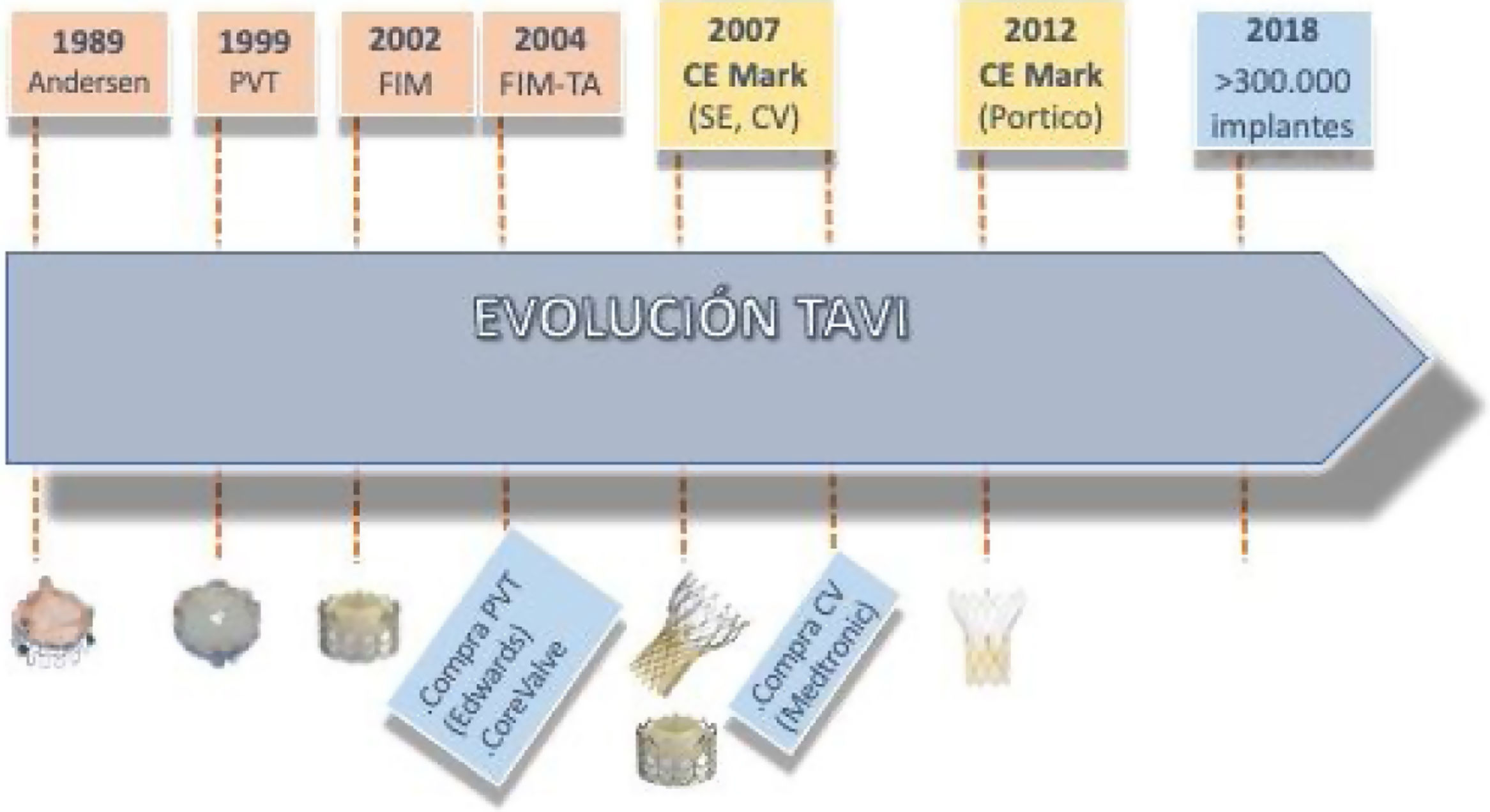
El TAVI ha tenido una fase pre-comercialización dilatada desde el inicio del modelo preclínico de Andersen et al.26, en el que «no podría aclarar la aplicabilidad clínica de la válvula-stent» hasta el primer implante en el humano en 200227. Pero desde la publicación, hace poco más de una década, del estudio PARTNER1 ha revolucionado el tratamiento de la estenosis aórtica severa, que hasta entonces únicamente era la sustitución valvular aórtica quirúrgica (SVAQ). En 2018 superó los 300.000 implantes mundiales (fig. 1), y las proyecciones permiten estimar 300.000 implantes anuales a partir de 202528. Paralelamente a la disminución de las complicaciones inherentes, se ha ampliado el rango de pacientes al expandirse al bajo riesgo. Este hecho contribuye a un crecimiento exponencial que puede alcanzar un incremento de procedimientos del 50% sobre las cifras obtenidas con los riesgos alto e intermedio29,30.
Aunque los resultados de los estudios clínicos aleatorizados (ECA) y los datos de los registros han servido de base para recomendar el TAVI en pacientes añosos con riesgo intermedio y alto, todavía existen varios aspectos que necesitan ser contrastados antes de expandirlo de forma indiscriminada a los pacientes más jóvenes de bajo riesgo. Algunas de estas consideraciones han sido destacadas en la edición más reciente de las guías ESC/EACTS (tabla 1). Otras, sin embargo, principalmente vinculadas al seguimiento, requieren un análisis detallado, y también deben fundamentar la toma de decisiones.
Factores que favorecen la sustitución valvular aórtica quirúrgica (SVAQ) recogidos en las Guías ESC/EACTS en su edición de 2021
| Factores clínicos | Factores anatómicos | Concomitancia |
|---|---|---|
| Bajo riesgo quirúrgicoaPacientes jóvenesbSospecha de EI | Acceso TF no posibleVABRiesgo obstrucción ostialCalcificación TSVITrombo en aortaAnuloectasia aórtica | CI multivasoValvulopatía mitral gravecValvulopatía tricuspídea graveAneurisma de la raíz aórticaHipertrofia septal (miectomía) |
CI: cardiopatía isquémica; EI: endocarditis infecciosa; TF: transfemoral; TSVI: tracto de salida del ventrículo izquierdo; VAB: válvula aórtica bicúspide.
Previamente, es necesario exponer que la selección de los pacientes se ha basado en la proyección comprensiva e individualizada del riesgo operatorio mediante los algoritmos The Society for Thoracic Surgery Predictive Risk of Mortality (STS-PROM)31 y el European System for Cardiac Operative Risk Evaluation (EuroSCORE)32, que se han validado en grandes grupos poblacionales33. Estas escalas han mostrado un poder de discriminación adecuado a la hora de estratificar a los pacientes en grupos de riesgo (con curvas ROC próximas a 0,8)34. Sin embargo, algunas variables integrales en el momento de las intervenciones, como son la discapacidad, la fragilidad o la morbilidad múltiple no convencional, pueden afectar a los resultados observados mermando la calibración de estas escalas, que priman la edad cronológica y los diagnósticos médicos. El EuroSCORE sobreestima la mortalidad operatoria, y se comporta mejor como predictor a largo plazo35-37. En este sentido, el registro voluntario alemán (GARY) en el año 2014 reporta una mortalidad operatoria para el recambio valvular aórtico del 2,1%, por debajo del 8,8% estimado con la escala predictiva del EuroSCORE38. En respuesta a este aspecto, la escala STS-PROM ha incorporado en su versión 2.73 una valoración de fragilidad (test de la marcha de 5metros) que, a pesar de no ser una evaluación multidominio, se esperaba que mejorase la calibración en los pacientes añosos, ya que la relación de la edad cronológica con el declive funcional y la vulnerabilidad es muy heterogénea y afecta de forma inequívoca a la toma de decisiones.
Esta revisión abordará los resultados disponibles en el bajo riesgo, así como las variables más significativas que pueden afectar a la consistencia de estos, tanto de forma precoz como en el largo plazo.
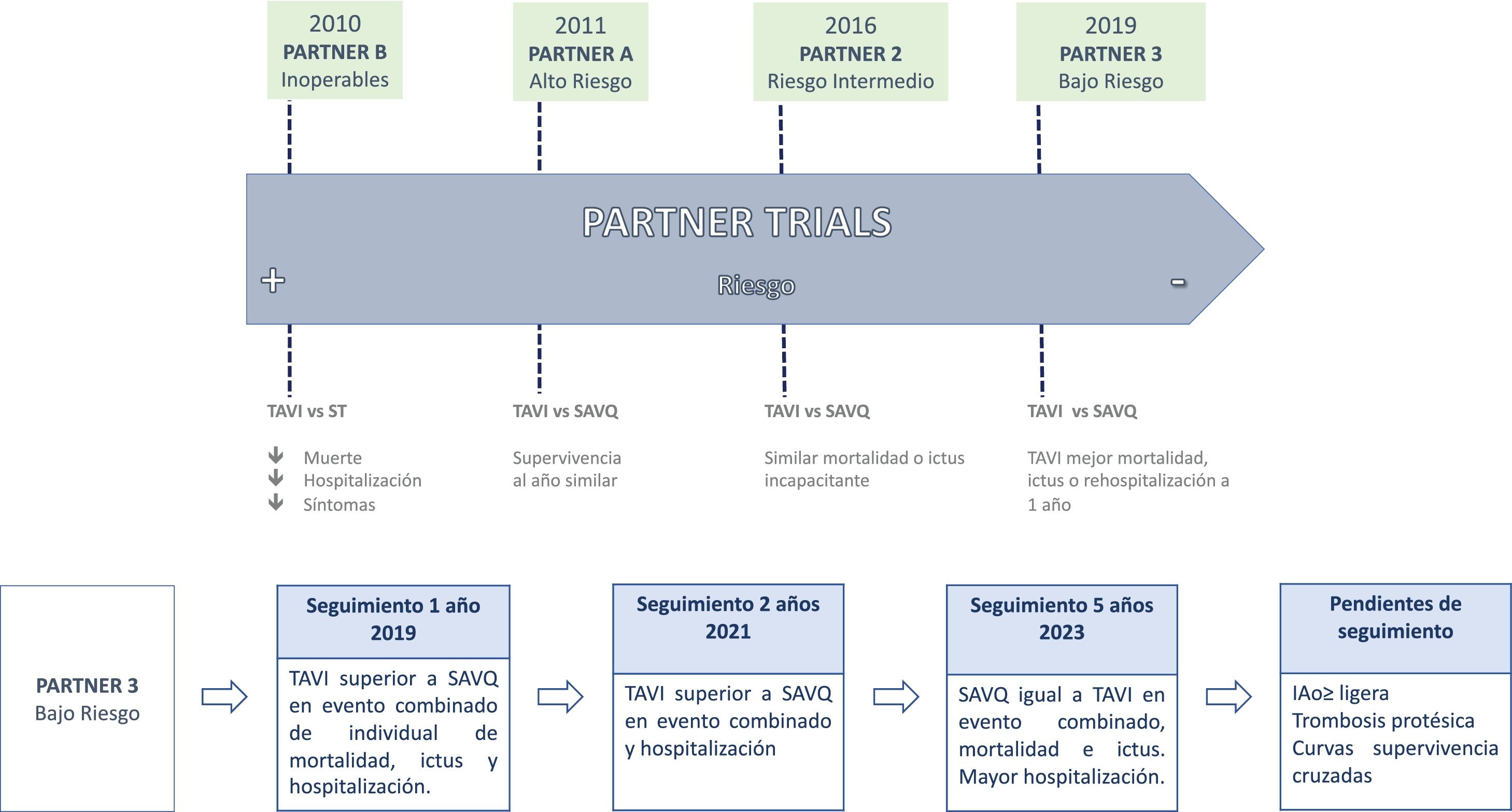
Seguimiento en estudios de bajo riesgoRecientemente se han hecho públicas actualizaciones en el seguimiento de los principales estudios aleatorizados de bajo riesgo.
El Nordic Aortic Valve Intervention (NOTION, NCT01057173), realizado entre los años 2010 y 2013 en hospitales daneses y suecos, reporta resultados clínicos y durabilidad a 8años de prótesis transcatéter y quirúrgicas39. Incluye pacientes ≥70años tratados con la primera generación de Medtronic CoreValve (n=145) frente a aquellos tratados quirúrgicamente (n=135) con una de las siguientes bioprótesis: Epic (29%), Mosaic (27%), Trifecta (24%), Carpentier-Edwards Perimount (10%) y Mitroflow (10%). La durabilidad se ha analizado mediante la disfunción y/o el fallo protésicos, según las definiciones estandarizadas de European Association of Percutaneous Cardiovascular Interventions (EAPCI)40. No hubo diferencias en el resultado combinado de mortalidad por cualquier causa, ictus o infarto de miocardio a 8años (54,5 vs 54,8%; p=0,9) o al fallo de la bioprótesis; la disfunción estructural valvular fue menor en el grupo TAVI (13,9% vs. 28,3%; p<0,05); si bien más de un tercio de la serie quirúrgica corresponde a prótesis Trifecta o Mitroflow, que presentan alta incidencia de fallos precoces41,42 que han motivado su retirada del mercado. Más de la mitad de las prótesis quirúrgicas son porcinas, que aunque presentan datos consistentes de durabilidad, se ven penalizadas cuando las definiciones utilizadas para la disfunción valvular se basan en gradientes fijos (>20mmHg), especialmente en los tamaños pequeños (≤21mm), que representan >40% de las prótesis implantadas en este estudio.
El ensayo Evolut Low Risk (Medtronic Evolut Transcatheter Aortic Valve Replacement in Low Risk Patients Trial, NCT02701283) incluye 1.414 pacientes sometidos a implante de prótesis aórtica autoexpandible (730 CoreValve/Evolut R/Pro (Medtronic) y 684 prótesis quirúrgicas. Muestra consistencia y sostenibilidad de los resultados de funcionamiento protésico y supervivencia libre de ictus incapacitante. El seguimiento realizado se completó en el 94,7% de los casos. En este estudio se describe una reducción del 26% del evento combinado —mortalidad por cualquier causa o ictus incapacitante— a 4años; sin embargo, la pérdida de seguimiento más llamativa en la cohorte quirúrgica supone una limitación a la generalización de estos resultados43.
El estudio PARTNER3 (NCT02675114) asignó aleatoriamente 1.000 pacientes: 503 para TAVI balón expandible SAPIEN3 y 497 para SVAQ. Analiza como resultado primario un evento combinado de mortalidad, ictus incapacitante, ictus no incapacitante y reingreso hospitalario relacionado con la prótesis, la intervención o la insuficiencia cardíaca. Recientemente se han publicado los resultados con un seguimiento a los 5años, completado en el 91,6% de la muestra (fig. 2). Se incluyen además resultados secundarios, características clínicas, ecocardiográficas y el estado de salud. Al igual que en el estudio Evolut Low Risk, se ha perdido el seguimiento en más pacientes del brazo quirúrgico que TAVI (88,3% vs 94,6%), por abandono voluntario del seguimiento. La mortalidad obtenida se muestra favorable, aunque sin alcanzar significación estadística, para la sustitución quirúrgica de la válvula aórtica (8,2% SAVQ vs 10,0% TAVI; HR: 1,23), una vez superada la repercusión inicial en las fases más precoces44. Este hallazgo es compatible con otras series quirúrgicas, que muestran un mayor impacto de la fragilidad en la mortalidad postoperatoria durante el primer año de seguimiento, tras el cual el impacto funcional de la SVAQ no representa un factor de riesgo independiente para mortalidad45. De hecho, las curvas para mortalidad en el estudio PARTNER3 se cruzan una vez superados los 24meses. También muestran una tendencia a aproximarse, sin llegar a cruzarse, las curvas de Kaplan-Meier para ictus durante el seguimiento (6,4% SVAQ vs 5,8% TAVI; HR: 0,87), compensando parcialmente los resultados del primer año. El resultado primario no presenta diferencias estadísticamente significativas entre los dos grupos (27,2% SVAQ vs 22,8% TAVI; HR: 0,79). La diferencia entre ambos grupos se debe a la rehospitalización (17,4% SVAQ vs 13,7% TAVI, HR: 0,75). Este hecho contrasta con los resultados presentados a los dos años del seguimiento, que mostraban una reducción del evento primario tras TAVI (11,5% vs. 17,4%; HR: 0,63; p=0,007), aunque en este punto del seguimiento las diferencias en mortalidad (TAVI 2,4% vs SVAQ 3,2%; p=0,47) o ictus (TAVI 2,4% vs SVAQ 3,6%; p=0,28) ya no eran estadísticamente significativas46. En el seguimiento a un año es necesario recordar que se presentaron resultados estadísticamente favorables para la cohorte tratada con TAVI, tanto en relación con el evento combinado primario (SVAQ 15,1% vs TAVI 8,5%; HR: 0,54) como con el análisis aislado de sus componentes: mortalidad (SVAQ 2,5% vs TAVI 1,0%; HR: 0,41), ictus (SVAQ 3,1% vs TAVI 1,2%; HR: 0,38) y rehospitalización (SVAQ 11,0% vs TAVI 7,3%; HR: 0,65). Los datos de durabilidad son similares en ambos grupos y consistentes con los aportados a los 2años de seguimiento o con los pacientes de riesgo intermedio. Los gradientes valvulares medios han permanecido estables (SVAQ 11,7mmHg vs TAVI 12,8mmHg), así como el área valvular aórtica (SVAQ 1,8cm2 vs TAVI 1,9cm2). La mayor tasa y grado de insuficiencia perivalvular en el grupo TAVI no se relacionó con mayor mortalidad, aunque es necesario considerar el cruce de ambas curvas cuando se analiza este evento de forma aislada. La trombosis protésica también ha tenido más incidencia en el grupo TAVI, y aunque aparentemente no han afectado a la durabilidad de la prótesis durante los 5 primeros años postimplante, es necesario aguardar a completar el seguimiento de diez años previsto. Los resultados funcionales (NYHA) o de estado de salud (pacientes vivos KCCQ-OS ≥75) han sido similares en ambos grupos.
Insuficiencia perivalvularLa insuficiencia perivalvular (IPV) se asocia con eventos cardiovasculares y peor evolución en el largo plazo47, aunque la tasa global de IPV y los grados moderados o graves han disminuido con los modelos de tercera generación (SAPIEN3 y Evolut R). La pre-planificación con TAC para la selección del tipo y tamaño protésicos resulta igualmente clave para disminuir la IPV48,49. A pesar de ello, su incidencia es superior en el TAVI respecto a SVAQ, especialmente en prótesis autoexpandibles, siendo, en el Evolut Low Risk, la IPV ≥ligera en TAVI 39,4% vs SVAQ 3,4% (3,4% vs 0,4% si se consideran los grados moderado o grave)50. En el estudio PARTNER3, el 20,8% de los pacientes presentaron IPV ≥ligera a los 5años (vs. 3,2% en la SVAQ)44. En el estudio PARTNER2, de riesgo intermedio, un tercio de los supervivientes en el mismo periodo de seguimiento presentaron IPV ≥ligera (vs. 6,3% en el grupo quirúrgico) y los grados moderados o graves, al igual que en otros estudios, se asociaron con mayor riesgo de mortalidad en la población estudiada51,52. Incluso los grados leves de IPV podrían relacionarse con resultados adversos, aunque es controvertido53. Es necesario recordar, en este punto, que los reingresos hospitalarios en los pacientes de riesgo intermedio han sido más frecuentes tras TAVI que tras SVAQ (33,3% vs 25,2%; HR: 1,28), al igual que la necesidad de reintervención (3,2% vs 0,8%), en la que la IPV ha motivado el 52% de las mismas52.
PPMEl patient prosthesis missmatch (PPM) de grado severo es una entidad que se genera cuando el área del orificio efectivo indexado disminuye de 0,65cm2/m2 (de 0,55cm2/m2 si el índice de masa corporal es ≥30kg/m2)54,55. Los pacientes que lo presentan tienen un riesgo aumentado de degeneración estructural de la prótesis y de mortalidad. Las últimas generaciones de prótesis balón expandibles han experimentado un aumento en la tasa de PPM a costa de la disminución de IPV por el faldón añadido56. Contrariamente, las prótesis autoexpandibles supraanulares muestran mejor comportamiento hemodinámico, especialmente en anillos pequeños57,58. Algunos estudios sugieren que el riesgo de PPM es mayor en pacientes jóvenes, en los cuales se debe considerar la opción quirúrgica con ampliación del anillo aórtico, técnica que ha experimentado un incremento en Estados Unidos (registro STS), del 3,9% entre 2012-2014, en la era pre-Valve in Valve (ViV), al 6,3%, entre 2015-2017, en la era post-ViV59.
Alteraciones de la conducción de nueva aparición. Marcapasos permanenteEl implante de marcapasos permanente ha sido la complicación más frecuente con los dispositivos de primera generación60-62 y no ha mejorado lo suficiente con los modelos más recientes. Las alteraciones de la conducción de nueva aparición, bloqueo de rama izquierda del haz de His e implante de marcapasos permanente son más frecuentes tras TAVI, especialmente en las autoexpandibles, que tras SVAQ. Su impacto en la supervivencia es controvertido, y oscila entre la ausencia del mismo a un año63 a un incremento en la mortalidad superior al 30%, según el registro TVT64. En el metaanálisis desarrollado por Zito et al.65 se objetiva un aumento en la mortalidad por cualquier causa y en los reingresos por insuficiencia cardíaca si se ha requerido un marcapasos permanente tras TAVI, especialmente si estimula más del 40% de los latidos66. Aunque el efecto deletéreo de las alteraciones de la conducción puede afectar más a los pacientes de alto riesgo58, su efecto pernicioso puede ser más evidente en la cohorte de bajo riesgo, al afectar a largo plazo67,68. Se han identificado predictores de necesidad de marcapasos permanente: anomalías de la conducción previas (bloqueo auriculoventricular de primer grado, hemibloqueo anterior izquierdo, bloqueo de rama derecha), sexo masculino y aspectos propios de la intervención (dispositivos autoexpandibles, bloqueo durante el procedimiento y profundidad en el implante)68. De hecho, el implante alto en las prótesis expandibles con balón parece reducir la tasa de marcapasos definitivo69. Por ello es necesario ampliar el seguimiento, dada la mayor esperanza de vida, en pacientes jóvenes, para valorar la influencia real de estas alteraciones. En ellos la pre-planificación es crucial, con el objetivo de minimizar la aparición de nuevas anomalías en la conducción.
Durabilidad y reintervenciónLa durabilidad de las prótesis transcatéter ha comenzado a ocupar un lugar central en la toma de decisiones para el abordaje personalizado de la estenosis valvular aórtica severa paralelamente a la disminución del riesgo quirúrgico y al aumento de la esperanza de vida de los candidatos/as. Recientemente dos ensayos aleatorizados mayores han demostrado que el TAVI no ha sido inferior a la SVAQ, si se analiza la mortalidad por cualquier causa o el ictus incapacitante50,70. Este hecho ha servido para que, en el año 2019, la American Food and Drug Administration (FDA) aprobase el TAVI para el tratamiento de la estenosis aórtica severa en el estrato de bajo riesgo, con lo que se completa el rango de riesgos objetivo de esta terapia (bajo, medio y elevado), lo cual desvía la decisión a otras características individuales de los pacientes. Este hecho ha sido considerado en las versiones más recientes de las guías europeas —European Society of Cardiology (ESC) /European Association for Cardio-Thoracic Surgery (EACTS)— y norteamericanas —American College of Cardiology (ACC) /American Heart Association (AHA)—24,71.
A pesar de un mayor riesgo de reintervención, la preferencia de los pacientes ≤65años se ha desviado hacia opciones biológicas con el fin de evitar la anticoagulación72. Paralelamente, las guías ESC/EACTS han disminuido el umbral de recomendación en cuanto a edad para considerar una prótesis mecánica en posición aórtica a los 60años24, mientras que las guías norteamericanas recomiendan prótesis mecánicas a <50años y biológicas a ≥65años, y dejan la franja entre 50 y 65años abierta a ambas posibilidades71. Esta tendencia realza el debate de la durabilidad.
Con la prótesis Carpentier-Edwards Magna Ease se ha obtenido una libertad de deterioro estructural del 93% a los 12años de seguimiento en pacientes <65años73. Los resultados del estudio COMMENCE a 5años han sido prometedores, mostrando una tasa del 0% de degeneración estructural para las bioprótesis aórticas con tejido Resilia74, y los recientemente reportados con un seguimiento medio de 7,7años muestran una tasa de libertad de degeneración estructural del 99,3%, mientras mantienen los resultados de seguridad y de eficacia mostrados por los modelos previos75, que presentan datos de seguimiento más largos. Bourguignon et al.76 obtienen una durabilidad esperada de 19años para pacientes entre 50-65años a los que se les ha implantado una prótesis Carpentier-Edwards Perimount.
Por otra parte, la intervención quirúrgica cuando se ha implantado un TAVI es un procedimiento con riesgo aumentado. El registro multicéntrico EXPLANT TAVR incluyó explantes de TAVI realizados en 42 centros entre 2009 y 2020, y aunque la endocarditis fue la primera causa de explante, más de la mitad se debieron a otras, entre las que se encuentran la IPV, la enfermedad protésica estructural o el missmatch. El 62,8% de las prótesis balón expandibles explantadas fueron SAPIEN3. El 13,4% de los pacientes han requerido sustitución de la raíz aórtica, y en el 54,6% se han realizado procedimientos concomitantes. La mortalidad observada a 30días se encuadra en el riesgo quirúrgico alto (>13%), siendo esta al año del 28,5%77. Las reintervenciones por degeneración estructural de prótesis quirúrgicas tienen una mortalidad considerablemente menor, similar al TAVI-in-valve, aunque con mejor hemodinámica, por los que deben considerarse, en ausencia de otras comorbilidades78.
Procedimientos concomitantesLa cardiopatía isquémica es una de las comorbilidades más prevalentes en los pacientes con estenosis aórtica severa degenerativa, con la que comparten varios factores de riesgo. En la mayoría de los registros TAVI afecta aproximadamente a la mitad de los pacientes79, porcentaje que asciende al 75% en el PARTNER180,81 o incluso al 80% en otras series, que describen una incidencia de síndrome coronario agudo de hasta el 10% en 2años82. En el estudio PARTNER3 el 7,9% de los pacientes del brazo TAVI se sometieron a procedimientos concomitantes durante el implante (26,4% en cirugía). El porcentaje de revascularización fue del 6,5% en TAVI vs. el 12,8% en SVAQ. Al contrario de lo que ocurre con la SVAQ, la canulación selectiva de las arterias coronarias puede resultar compleja tras el implante de TAVI83,84. Los datos publicados muestran una dificultad para el 35% de las angiografías post-TAVI, con casi un 8% de los casos en los que no se ha podido realizar, especialmente con las prótesis autoexpandibles85,86. Esto se debe a la relación espacial entre el stent y la raíz de la aorta, la alineación comisural respecto a los ostia coronaria, el diseño supraanular, el implante más alto y/o la sobredimensión58. Además de la dificultad en la canulación selectiva de los ostia coronaria, puede producirse una obstrucción coronaria aguda, como consecuencia de trombosis, o diferida, debida a crecimiento tisular periostial, que a pesar de ser poco frecuentes (<1%), presentan una elevada mortalidad87,88. En la toma de decisión de pacientes jóvenes debe evaluarse cuidadosamente la severidad y la progresión potencial de cardiopatía isquémica, tenerse en cuenta la posibilidad de obstrucción coronaria, y optimizar la técnica seleccionando un dispositivo y una alineación comisural que permitan el sondaje coronario.
Válvula aórtica bicúspideLa válvula aórtica bicúspide (VAB) es la cardiopatía congénita más frecuente, con una prevalencia aproximada del 0,5-0,8%89, y suele precisar tratamiento a una edad más temprana que en los casos asociados a válvulas tricúspides, con una edad media de 50años o menos en el acceso a cirugía, representando el 2-6% de los pacientes con estenosis aórtica severa90. Según los datos del registro TAVI de STS/ACC, el 3,2% de las intervenciones TAVI (5.412 pacientes) han sido realizadas en paciente con VAB91. La asimetría de los velos, la calcificación más severa, anillos valvulares más grandes y la dilatación de raíz o de aorta ascendente son más frecuentes en las VAB92, lo que deriva en mayor complejidad del implante, ya que requiere con más frecuencia de pre y post-dilatación. Los resultados, en las principales series, son más discretos en términos de incidencia de IPV y/o ictus93,94, además de mayor riesgo de rotura del anillo. La supervivencia al año y el éxito del dispositivo son similares a los obtenidos en las válvulas tricúspide95. Es necesario considerar la elección de una prótesis balón expandible y estrategias de protección cerebral durante la intervención58, además de generar evidencia más robusta en este apartado.
Pacientes asintomáticosLas complicaciones inherentes a las intervenciones y a los dispositivos empleados hacen que la expansión del tratamiento a pacientes asintomáticos merezca la máxima prudencia, al menos en ausencia de indicadores de pronóstico adverso. Ya en la antigua publicación de Contratto y Levine20 se hacía referencia a la escasa prevalencia de muerte súbita en pacientes asintomáticos, concepto reforzado por Ross y Braunwald19, que otorgaban apenas un 3-5% de la mortalidad por estenosis aórtica a muerte súbita en asintomáticos, lo que ha servido de base para las recomendaciones, imperantes hasta ahora, de mantener una actitud expectante en este grupo de pacientes.
Series posteriores reportan una mortalidad para los pacientes con estenosis aórtica severa mayor del 50% a 5años, y del 90% a 10años, aunque no responde a la cuestión específica de los pacientes asintomáticos96. Rapaport97 recomendaba, ya en 1975, SVAQ en asintomáticos, por un riesgo no despreciable de muerte súbita, aunque la morbimortalidad asociada a la intervención ha sido suficiente para otros autores a la hora de desaconsejar el tratamiento en este grupo de pacientes98,99. Las tasas de conversión en sintomáticos durante el seguimiento son variables. Brown et al.100 describen en 2008 que más de la mitad de los pacientes con estenosis aórtica severa asintomática experimentarán, en el plazo de 3años, un evento combinado de conversión sintomática o intervención quirúrgica. Recientemente, el ensayo multicéntrico aleatorizado RECOVERY (NCT01161732), realizado en pacientes asintomáticos diagnosticados de estenosis aórtica muy severa, muestra, mediante un análisis realizado por intención de tratar, unos resultados más favorables a cirugía que al tratamiento expectante, no habiéndose constatado mortalidad operatoria en el brazo quirúrgico101.
Consideraciones económicas: coste-efectividadEl TAVI es un tratamiento costoso que ha demostrado efectividad clínica para el tratamiento de la estenosis aórtica severa. La expansión de su uso a riesgos intermedios o bajos, de acuerdo con las recomendaciones recogidas en las guías de práctica clínica en sus recientes ediciones, ha incrementado sustancialmente el número de implantes. Esto ha reavivado el interés en los estudios que evalúen el impacto económico del crecimiento de esta técnica respecto a la cirugía o al tratamiento conservador. Una reciente revisión sistemática que incluye 29 estudios, 26 de ellos (90%) de alta calidad, y que engloba los tres estratos de riesgo (alto, intermedio y bajo, además de pacientes inoperables), ha asociado el TAVI a una ganancia en los años de vida ajustados por calidad (AVAC) con una ratio incremental de coste-efectividad (ICER) que oscila entre los 2.741 y los 1.027,7$ por AVAC102. Sin embargo, el coste-efectividad debe considerarse en el marco de los umbrales aceptables en cada país. Debido a que la tasa de complicaciones se relaciona directamente con la estimación de ICER, los eventos relacionados con el tiempo pueden condicionar estos resultados, por lo que el seguimiento a largo plazo resulta esencial. Algunos de los estudios incluidos no han considerado todas las complicaciones descritas (p.ej., ictus), lo que puede llevar a infraestimar los costes103,104. Son varias las publicaciones que sugieren que el TAVI se ha mostrado coste-efectivo en relación con el tratamiento conservador en pacientes inoperables, pero podría no serlo en pacientes que pueden ser sometidos a SVAQ105-107. Vázquez et al.108 sugieren que el TAVI con SAPIEN3 puede ser una opción coste-efectiva para el bajo riesgo en nuestro país, así como en otros de nuestro entorno, como Francia o Italia. Sin embargo, el modelo aplicado se basó en los datos a 1 y 2años del estudio PARTNER3, cuando más penalizado está el procedimiento quirúrgico en relación con un abordaje minimalista del TAVI. Tras los resultados a 5años del PARTNER3, que muestran una dilución de los beneficios iniciales del TAVI, se requeriría una nueva evaluación. No debemos olvidar que la operación que más rápido ha crecido en los últimos 5años en el registro nacional STS ha sido el explante de TAVI.
Los últimos modelos de prótesis quirúrgicas presentan un ahorro de 9.093$ en 5años, con una proyección de 20.755$ de ahorro a 15años en relación con las prótesis mecánicas, como consecuencia de los gastos asociados al manejo de la anticoagulación. Debido a que aproximadamente el 15% de los pacientes tras TAVI presentan trombosis subclínica de las valvas109, el papel de la anticoagulación oral y la identificación de pacientes que pudieran beneficiarse de ella, ponderando los riesgos específicos de sangrado y deterioro estructural, genera la necesidad de incluir este aspecto en los análisis de coste-efectividad a largo plazo, con especial significación en aquellos pacientes más jóvenes.
SumarioLos ECA que han sustentado la expansión del TAVI al bajo riesgo han sido objeto de análisis críticos, por parte de la comunidad científica, en algunos aspectos: selección por un comité no ciego, el análisis por protocolo en detrimento de por intención de tratar, la definición del resultado primario o la participación de la industria en la financiación. La reproductibilidad de estos resultados en el mundo real ha de contextualizarse en los obtenidos a nivel local. En estos ECA los beneficios descritos para el grupo TAVI durante los dos primeros años se atenúan o desaparecen cuando se amplía el seguimiento. Los análisis con propensión de riesgo del registro GARY110 o el estudio OBSERVANT111, ambos en mundo real, muestran resultados a 5años favorables a SVAQ, al igual que el estudio nacional francés112. Por ello sigue siendo necesario mantener la prudencia y continuar seleccionando el mejor tratamiento para cada paciente. No existen todavía datos consistentes en el largo plazo relativos a la durabilidad o al impacto en la supervivencia de la IPV, trombosis protésica o marcapasos permanente. Igualmente, la necesidad de procedimientos concomitantes o subsiguientes, en especial revascularización coronaria, debe considerarse especialmente en los más jóvenes. Son necesarios estudios de coste-efectividad que consideren el espectro completo de complicaciones relacionadas con la prótesis durante el seguimiento, incluyendo costes derivados de la anticoagulación o las intervenciones más allá de 2años. Mientras tanto, la evolución tecnológica continúa y han sido publicados datos del registro OCEAN-TAVI relativos al comportamiento hemodinámico optimizado de la SAPIEN3 Ultra Resilia113.
ConclusiónEl abordaje minimalista, la presión tecnológica y las preferencias de los pacientes seguirán estimulando el desarrollo y la expansión del TAVI, el cual, sin embargo, no está preparado todavía para su expansión a pacientes no seleccionados. En base a los resultados actuales, en aquellos pacientes de bajo riesgo quirúrgico con una esperanza de vida superior a los 5años, en función de las características técnicas, funcionales y de comorbilidad, debe considerarse la SVAQ, especialmente si las proyecciones estiman que no será el último procedimiento.