La detección del cáncer cervicouterino con citología disminuyó su incidencia en más del 50%. La causa de este cáncer son virus del papiloma humano de alto riesgo. Se requiere de una prueba sensible que proporcione la sensibilidad y especificidad suficientes para su detección oportuna, y mayor periodo de intervalo cuando los resultados son negativos. La prueba del virus del papiloma humano de alto riesgo es eficaz y segura debido a su excelente sensibilidad, valor predictivo negativo y reproducibilidad óptima, principalmente cuando se combina con citología en base líquida o biomarcadores con carga viral, con mayor sensibilidad y especificidad, reduciendo los falsos positivos para la detección de la neoplasia intraepitelial cervical grado 2 o para lesiones mayores, con excelentes beneficios clínicos para la detección del cáncer cervicouterino y otras enfermedades relacionadas con la infección del virus del papiloma humano. Actualmente es la mejor prueba para la detección temprana de la infección por virus del papiloma humano y el riesgo de carcinogénesis.
Cervicouterine cancer screening with citology decrease incidence by more than 50%. The cause of this cancer is the human papilloma virus high risk, and requires a sensitive test to provide sufficient sensitivity and specificity for early detection and greater interval period when the results are negative. The test of the human papilloma virus high risk, is effective and safe because of its excellent sensitivity, negative predictive value and optimal reproducibility, especially when combined with liquid-based cytology or biomarkers with viral load, with higher sensitivity and specificity, by reducing false positives for the detection of cervical intraepithelial neoplasia grade 2 or greater injury, with excellent clinical benefits to cervical cancer screening and related infection of human papilloma virus diseases, is currently the best test for early detection infection of human papillomavirus and the risk of carcinogenesis.
En los últimos 30 años, la tasa de mortalidad por cáncer cervicouterino en Estados Unidos se redujo más del 50% por la detección con la prueba de Papanicolaou o citología, que se desarrolla en la mayoría de mujeres que nunca se lo han realizado. A partir de 1928, cuando el Dr. Papanicolaou1–3 informó por primera vez sobre las células cancerosas en frotis vaginal y publicó sus resultados en 1941, la citología evolucionó a base líquida. La prueba del virus del papiloma humano (VPH) de alto riesgo (VPH-ar) fue aprobada en 2000 y la primera vacuna contra el VPH salió al mercado en 2006. Actualmente están en proyecto nuevas vacunas para mayor cobertura de genotipos y protección4,5.
EpidemiologíaLa citología redujo la incidencia y la tasa de mortalidad por cáncer cervicouterino en países desarrollados con programas de tamizaje organizados. Sin embargo, aún se reportan más de 68,000 y 12,000 nuevos casos por año en Europa y Estados Unidos respectivamente, con más de 4,000 muertes por cáncer cervicouterino en 2013 en Estados Unidos. Aunque existen pruebas de que la tasa de mortalidad por cáncer cervicouterino disminuyó incluso antes de la introducción de la vacuna contra VPH: la tasa global1,6 se redujo de 10.2 a 8.5 casos por 100,000 mujeres entre 1998 y 2002. En México se trata anualmente a 9,000 mujeres con cáncer cervicouterino y mueren 4,000; en 2008 la incidencia fue de 19.2 y la mortalidad de 9.7 por 100,000 mujeres. Existe una elevada mortalidad por la disparidad social. En 1974 se estableció en México el Programa Nacional de Detección del Cáncer Cervicouterino7,8 y desde 1992 se observa una discreta disminución en la mortalidad, que ha pasado de 13.3 en el año 2000 al 6-8 por 100,000 en 2008.
Conforme las tecnologías evolucionan, también las recomendaciones para el tamizaje cambian. La sensibilidad de un solo Papanicolaou para la detección de la neoplasia intraepitelial cervical (NIC) grado 2 o mayor (NIC-2+) o de las lesiones intraepiteliales escamosas de alto grado es baja2,7–11, y requiere intervalos frecuentes de repetición, alto nivel de organización y costos elevados para su implementación. Requiere la existencia de biomarcadores efectivos como predictores del riesgo de la NIC. De estos, los importantes son la determinación de la genotipificación del VPH-ar, que se identifican en más del 90% de las NIC o los cánceres cervicouterinos12. La evolución clínica de las nuevas estrategias de tamizaje basadas en pruebas de VPH-ar reduce la tasa de mortalidad por cáncer cervicouterino, ya que existen más de 40 genotipos diferentes de VPH-ar que causan infecciones cervicales persistentes, y el riesgo de progresión de la NIC difiere notablemente según el genotipo de VPH-ar. Pero la mayoría de los VPH-ar son raros y no todos se incluyen en la mayoría de las pruebas de VPH1. La prueba del VPH-ar ofrece alta sensibilidad para la detección13–16 de NIC-2+, pero la especificidad es limitada porque la mayoría de las infecciones por VPH son transitorias y solo una baja proporción de infecciones por VPH persiste y progresa a lesiones intraepiteliales escamosas de alto grado. Debido a la alta prevalencia de infecciones por VPH en mujeres menores de 30 años, la prueba de VPH-ar no se recomienda actualmente para la detección de mujeres menores de 30 años17.
La detección de VPH-ar en mujeres con citologías anormales tiene un papel en la identificación de mujeres con riesgo de enfermedad residual o recurrente después del tratamiento de la NIC. Aunque la prueba de VPH-ar es menos específica que la citología, esta no siempre distingue entre la infección transitoria y la crónica4,14,18–21. La expresión de las oncoproteínas E6 y E7 de los genotipos de VPH-ar, en células epiteliales escamosas del cuello uterino, provoca el desarrollo de crecimiento neoplásico1 y la sobreexpresión del biomarcador p16INK4a (p16)22–27 que es uno de los inhibidores de cinasas dependientes de la ciclina que previene la fosforilación de la proteína del retinoblastoma (pRb) y, por lo tanto, juega un papel importante en la regulación del ciclo celular. Su sobreexpresión se observa con frecuencia en la NIC asociada con infección por VPH-ar y se asocia con la disfunción de la proteína pRb a través de mutaciones que surgen naturalmente. También puede ir asociada con la oncoproteína E7 del VPH-16 que induce alteraciones del ciclo celular, sobreexpresando la p16. Este biomarcador predice el riesgo de progresión y aumenta con el mayor grado de la NIC-1 (20.7%), NIC-2 (80%) y NIC-3 (89.2%). La sobreexpresión de p16 es significativamente mayor para NIC-2 y 3 que en NIC-1 (p<0.001). Este biomarcador es eficaz comparado con la prueba de VPH-ar en pacientes con NIC-1 y 2. En pacientes evaluados con prueba de VPH-ar el 80% fueron positivas y la tasa de infección por VPH-ar también aumentó en lesiones de mayor grado, en NIC-1 (65.1%) y NIC-2 y 3 (87.7%) (p<0.001)28,29.
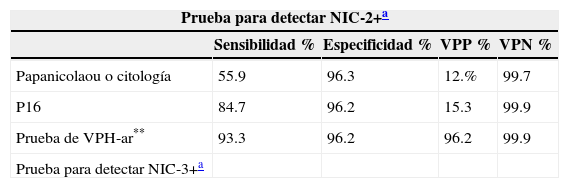
Aunque las pacientes infectadas con VPH-ar mostraron mayor prevalencia a la progresión de las lesiones, sin diferencias entre grupos con prueba de VPH-ar positivas y negativas, ni en la tasa de progresión ni en la regresión de las lesiones entre pacientes infectadas o no con VPH-16 o VPH-18 (p=0.60)7. La detección de la sobreexpresión de p16 es eficaz en el manejo de la citología con reporte de células escamosas atípicas de significado indeterminado (ASC-US) o lesión escamosa intraepitelial de bajo grado20–25 y para mujeres con pruebas de VPH-ar positivas. La sensibilidad para NIC-2+ es del 18%, mayor que la citología (p<0.001) en mujeres de todas las edades, con una especificidad del 95.2% (tabla 1)1,30. La especificidad de la citología con p16 es mayor comparada con la prueba de VPH-ar, con un 50% de menor número de falsos positivos. La citología de doble tinción y la combinación de biomarcadores p16/Ki-67, indicativos de la transformación de las infecciones por VPH, tienen mayor sensibilidad y especificidad para la detección de NIC-2+, principalmente en mujeres menores de 30 años, en la actualidad, ninguna otra prueba complementaria está disponible, las alternativas a la citología son limitadas6,17,19,28,29,31.
Sensibilidad, especificidad, valores predictivos positivos y negativos en la detección de NIC-2+ y NIC-3 en mujeres de 30 a 65 años
| Prueba para detectar NIC-2+a | ||||
|---|---|---|---|---|
| Sensibilidad % | Especificidad % | VPP % | VPN % | |
| Papanicolaou o citología | 55.9 | 96.3 | 12.% | 99.7 |
| P16 | 84.7 | 96.2 | 15.3 | 99.9 |
| Prueba de VPH-ar** | 93.3 | 96.2 | 96.2 | 99.9 |
| Prueba para detectar NIC-3+a | ||||
| Sensibilidad | Especificidad | |||
|---|---|---|---|---|
| Papanicolaou o citología | 59.0 | 96.1 | ||
| P16 | 87.2 | 95.9 | ||
| Prueba de VPH-ar | 96.2 | 92.7 |
La NIC tratada con eficacia previene la progresión a cáncer cervicouterino; la NIC-1 es una lesión que solo requiere seguimiento sin tratamiento: el 10% de las NIC-1 progresan a NIC-3 o cáncer cervicouterino; el 20% de NIC-2 progresan a NIC-3 o cáncer cervicouterino y el 40% de las NIC-2 remiten espontáneamente. El manejo de la NIC-1 y 2 es controvertido: algunas remiten espontáneamente. Se trata con procedimientos destructivos o escisionales a las pacientes que están en mayor riesgo de progresión, y se observa a las de bajo riesgo que remiten espontáneamente, pero es difícil predecir el resultado individual de cada paciente31.
Detección primaria de cáncer cervicouterinoLas pruebas de VPH-ar, para la detección y prevención de lesiones precursoras de cáncer cervicouterino, comparadas con la citología, ofrecen de un 60 a un 70% de mayor protección contra el cáncer cervicouterino. Principalmente son eficaces en mujeres de 30 a 34 años de edad, y cuando se realiza cada 5 años ofrecen mayor protección que el Papanicolaou realizado con intervalos de 3 años32. La incorporación de la prueba de VPH-ar en países desarrollados, en las estrategias de tamizaje para mujeres vacunadas, aún no ha sido determinada, aunque debe ser similar a la de mujeres no vacunadas. A corto plazo, la detección con prueba de VPH-ar será más barata y proporcionará mayor seguridad que el Papanicolaou convencional. A pesar de estos beneficios, los programas de salud pública tendrán problemas logísticos para el tamizaje. Problemas que incluyen qué tipo de prueba de VPH-ar se utilice, el determinar las edades e intervalos apropiados para la detección, el manejo de las mujeres VPH-ar positivas y garantizar la calidad, apego y aplicación de la prueba de VPH-ar en los programas de prevención del cáncer cervicouterino. La prueba de VPH-ar es más eficaz en la detección de lesiones intraepiteliales escamosas de alto grado y en la prevención del cáncer cervicouterino que la citología en mujeres mayores de 35 años; que el Papanicolaou o la inspección visual del cuello del útero con ácido acético, esto redujo la incidencia y tasa de mortalidad por cáncer cervicouterino avanzada en países en desarrollo2,14,33.
Nuevas directrices para la detección de cáncer cervicouterinoLas nuevas directrices recomendadas por diferentes agrupaciones internacionales para la detección oportuna de cáncer cervicouterino2,15 recomiendan la prueba de VPH-ar en combinación con el Papanicolaou en mujeres de 30 a 65 años de edad. Durante el seguimiento después de un Papanicolaou negativo, se ha demostrado que los intervalos de tamizaje a 5 años con prueba de VPH-ar son más seguros que los intervalos de 3 años con solo el Papanicolaou.
Con estas recomendaciones, la proporción de adenocarcinomas cervicales disminuyó un 40% en mujeres menores de 30 años; un 35% entre 30 y 34 años de edad; un 30% entre 35 y 49 años y, en mayores de 50 años, un 23%. La prevención de cáncer cervicouterino en mujeres en edad reproductiva es una prioridad, por lo que la detección con la prueba de VPH-ar debe iniciarse a la edad de 30 años. Estas directrices han cambiado sustancialmente las prácticas de salud de las mujeres y toman en cuenta la infección por VPH y la historia natural del cáncer cervicouterino2,15.
La mayoría de las infecciones por VPH son transitorias, el cuerpo es capaz de eliminarlas y solo la persistencia de las infecciones por VPH conduce al cáncer cervicouterino. La mayoría de mujeres, especialmente menores de 21 años de edad, eliminan la infección en 1-2 años. En las mayores de 30 son más propensas a persistir, y las tasas de lesiones de alto grado se incrementan; pero la mayoría de las lesiones relacionadas con VPH-ar progresan lentamente a cáncer cervicouterino. Se necesita, en promedio, 3.7 años para que una lesión intraepitelial escamosa de alto grado progrese a cáncer cervicouterino. Las nuevas directrices son1,2,15:
Inicio del tamizaje hacia los 21 años, independientemente de la conducta, factores de riesgo y la edad de la primera relación sexual.
Para las mujeres de 21 a 29 años de edad, el Papanicolaou cada 3 años, sin llevar a cabo la prueba del VPH-ar. Desde los 30 hasta los 65 años, prueba combinada (Papanicolaou y prueba de VPH-ar) cada 5 años. La prueba de VPH-ar es la recomendación preferida, pero la citología sola cada 3 años también es aceptable. En cambio, la prueba del VPH por sí sola no está indicada.
Después de los 65 años de edad, las recomendaciones de detección futuras dependen del tamizaje previo. Cuando los resultados han sido negativos, estas mujeres no lo requieren y no es necesario el tamizaje de rutina. Un tamizaje previo negativo significa 3 resultados de Papanicolaou negativos consecutivos o 2 resultados de las pruebas combinadas negativas consecutivas en los últimos 5 años. Mujeres con antecedentes de NIC-2, NIC-3 o adenocarcinoma no pueden dejarse sin tamizaje a los 65 años y deben continuar la detección. En mujeres con histerectomía, sin antecedentes de NIC-2 o superior, ya no se realiza tamizaje; en pacientes con NIC-2 o NIC-3 antes de la histerectomía, se mantiene el tamizaje con Papanicolaou cada 3 años durante 20 años, porque el cáncer recurrente se puede desarrollar en la cúpula vaginal incluso años más tarde. La prueba del VPH-ar en este entorno no está clara. Estas pautas de rutina no se aplican a mujeres con inmunosupresión, virus de la inmunodeficiencia humana positivo, las expuestas a dietilestilbestrol in útero, o con antecedentes de cáncer cervicouterino2,7,8,15.
Promoción de la saludLa educación de las mujeres y profesionales de la salud son aspectos fundamentales para el uso de las pruebas de VPH-ar, durante el tamizaje primario, manejo clínico y psicológico de mujeres con Papanicolaou normal, y pruebas de VPH-ar positivas, especialmente si se incluyen mujeres < 30 años, la infección por VPH, es de interés público, pero afecta emocionalmente a las personas e incrementa la ansiedad de estas por temor al cáncer, lo que afecta a su calidad de vida34,35.
El mejor momento para proporcionar información sobre la infección por VPH es antes de realizar la prueba de VPH-ar: se tiene el mayor nivel de atención, capacidad de comprensión y disminuye la ansiedad. Además, ayuda a proporcionar correctamente otros procedimientos de seguimiento (por ejemplo, repetir la prueba de VPH-ar, citología, colposcopia y otros marcadores biológicos) relacionados con la estratificación del riesgo31. Una prueba de VPH-ar positiva no representa una enfermedad, sino que es un factor de riesgo. Cuando la prueba de VPH-ar persiste positiva después de un año de la primera toma, se realiza un Triage citológico o pruebas no invasivas, que previenen el desarrollo de cáncer cervicouterino. Los algoritmos actuales están diseñados para las mujeres que tienen conciencia y fácil control clínico con seguimiento. Pero esto no es así en comunidades marginadas de los países latinoamericanos, asiáticos y africanos, con bajo nivel socioeconómico y cultural, que son las más afectadas por el cáncer cervicouterino, donde las tasas de prevalencia son más altas para el cáncer cervicouterino comparadas con las de las mujeres blancas de países desarrollados36.
DiscusiónLos reportes en las últimas 2 décadas sobre las pruebas de VPH-ar han demostrado definitivamente la asociación entre los genotipos de VPH-ar y el cáncer cervicouterino1 para el seguimiento de pacientes tratadas, comparando con el Papanicolaou convencional o colposcopia; en mujeres sintomáticas o asintomáticas, para la detección de lesiones precursoras de cáncer cervicouterino32, tanto tamizaje cervical primario y manejo de la citología «borderline» como ASC-US. Las pruebas del VPH-ar no siempre se llevan a la práctica clínica y, en los programas nacionales de tamizaje, aunque tengan mayor sensibilidad que el Papanicolaou1,11–13 en la detección de NIC-2+, las pruebas combinadas de VPH y Papanicolaou muestran altos valores predictivos negativos (VPN)14 para NIC-2+. Algunas NIC-2 remiten espontáneamente y la mayor sensibilidad para estas lesiones precancerosas y cáncer cervicouterino, agrupadas como NIC-3+, no son más que un exceso de diagnóstico, ya que existe menor incidencia futura de NIC-3+1,15.
El aumento de la sensibilidad tiene 2 resultados clínicos importantes: reducción de la tasa de mortalidad y alargamiento del intervalo de tamizaje, con mayor cumplimiento en la detección, menor costo y alta reproducibilidad. La prueba VPH-ar es más sensible que la citología en base líquida para la detección de NIC-3 o de lesiones mayores, pero menos específica que ella (92.0 versus 53.3%; diferencia del 38.7%). Aunque la adición de la citología líquida a la prueba del VPH aumenta la sensibilidad para NIC-3 o lesiones mayores (96.7%), también aumentó el número de pruebas positivas (35.2%). Aunque el uso de la prueba de VPH-16 o VPH-18da mejor información con resultados similares13,26,27.
La determinación de p16 en mujeres positivas en el estudio de apoyo o triaje para ASC-US/LSIL (ALTS) diseñado para comparar 3 opciones de manejo23. La prueba de VPH-ar mostró sensibilidad más alta e identificó 96.3% (IC del 95%: 91.6 a 98.8) de mujeres con NIC-3 o lesiones mayores24, mismo valor predictivo positivo que la detección con citología convencional (sin aumentar el envío a colposcopia), conservando un VPN más alto la prueba de VPH-ar26. En mujeres vacunadas contra VPH, el valor particular de la prueba de VPH-ar para la detección es más adecuado en estas. Lo que se espera de la vacunación en el futuro próximo y de la baja prevalencia de enfermedades relacionadas con el VPH es otro valor de la prueba de VPH-ar1,4,6,17-19,37-39. La enfermedad residual o recurrente en mujeres con VPH-16 o VPH-18 persistente es más alta (82%) que en mujeres con persistencia de otros tipos de VPH-ar tales como VPH 31, 33, 35, 45, 52, y 58 (66.7%) o VPH 39, 51, 56, 59, 68, 26, 53, 66, 73, y 82 (14.3%). Esto sugiere diferentes niveles de riesgo para la progresión de la NIC. La detección de la infección persistente con ciertos genotipos VPH-ar tiene el potencial de mejorar el manejo de estas pacientes. Evidentemente el seguimiento después del tratamiento debe incluir la citología convencional y la prueba de VPH-ar para identificar pacientes con mayor riesgo de recurrencia de la enfermedad1,38,39.
En los últimos 50 años, la proporción relativa, así como la incidencia absoluta, de las lesiones preinvasivas e invasivas glandulares del cuello uterino ha ido en aumento en países occidentales. En 1950-1960 los adenocarcinomas cervicales representaron el 5% del cáncer cervicouterino; en 1970 representaban del 20 al 25% de todos los cánceres del cuello uterino, la mayoría en mujeres en edad reproductiva que requieren cirugía conservadora de la fertilidad. Aunque el manejo del adenocarcinoma in situ es controvertido, durante el seguimiento de las pacientes con adenocarcinoma in situ que desean preservar la fertilidad1, la combinación de la prueba de VPH-ar y el Papanicolaou mostró mayor sensibilidad para detectar lesiones persistentes, con VPN del 100% que es útil y evita histerectomías innecesarias. Las pruebas de VPH-ar se han introducido en la práctica clínica como una prueba curativa, en las que la persistencia de un genotipo específico predice la recurrencia a corto plazo y la ausencia del genotipo de VPH, asociados con el diagnóstico preoperatorio, implican un tratamiento exitoso y bajo riesgo de recurrencia1,31,38.
ConclusiónEl VPH es la causa necesaria para el desarrollo de cáncer cervicouterino y su detección con la prueba de VPH-ar versus citología convencional o en base líquida; la sensibilidad, VPN y reproducibilidad; así como el manejo de la citología con reporte de ASC-US y seguimiento después del tratamiento de la NIC; las pruebas de VPH-ar tienen cerca de 100% de sensibilidad y VPN para la identificación de lesiones preneoplásicas o cáncer cervicouterino y es la principal prueba en la detección primaria de estas lesiones escamosas y glandulares o adenocarcinoma in situ, estas lesiones, además, son de difícil detección. La genotipificación de 14 VPH-ar y la carga viral1,40 reducen la cantidad de resultados falsos positivos, respectivamente. La sensibilidad para NIC-3 o para lesiones mayores se mantuvo en 100%, siendo eficaz y segura para la detección de cáncer cervicouterino, principalmente en combinación con la citología en base líquida con los biomarcadores p16/Ki-67 tendría la mayor sensibilidad y especificidad, para la detección de NIC-2 o lesiones mayores y mejor rendimiento clínico para la detección de cáncer cervicouterino y enfermedades relacionadas con la infección por VPH.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.