Dentro de la fisiopatología de la lesión medular, cada día se da más importancia a los procesos biológicos secundarios, con la participación de cambios en la expresión genética. Dentro de estos cambios, la expresión de diferentes microARN ha sido involucrada en algunos de los procesos fisiopatológicos de la lesión medular.
Existen diversos estudios que describen la expresión temporal de microARN en la lesión medular, algunos de ellos relacionados con la inflamación y la apoptosis, y otros con la recuperación funcional y la regeneración.
Estos microARN pueden ser blancos potenciales para el tratamiento de la lesión medular, al intervenir en los procesos de inflamación, oxidación y apoptosis, y en la recuperación funcional y regeneración.
Res ulta necesario continuar con el estudio de los microARN en la lesión medular, así como la identificación de sus genes blanco y los mecanismos de señalización que participan en sus efectos neurológicos. Con esto, el objetivo final será el desarrollo de estrategias terapéuticas y diagnósticas eficaces y seguras para los pacientes con lesión medular.
In the pathophysiology of spinal cord injury, the secondary biological processes involving changes in gene expression become more important day a day. Within these changes, the expression of different microRNAs has been involved in some of the pathophysiological processes of spinal cord injury.
There are several studies that describe the transient expression of microRNA in spinal cord injury, some of them related to inflammation and apoptosis and others to functional recovery and regeneration.
MicroRNA may be a potential target for the treatment of spinal cord injury, modifying the processes of inflammation, oxidation, apoptosis, functional recovery and regeneration.
It is necessary to continue the study of microRNAs in spinal cord injury, as well as the identification of their target genes and signaling mechanisms involved in its neurological effects. With this, the ultimate goal is the development of effective and safe therapeutic and diagnostic strategies for patients with spinal cord injury.
El papel crítico de la médula espinal tiene un amplio rango de funciones fisiológicas que está claramente demostrado por el déficit observado posterior a una lesión medular y, por las condiciones médicas que se desarrollan en las diversas fases ulteriores. Esta lesión usualmente lleva a alteraciones neurológicas devastadoras y a discapacidad, que provocan no solo la pérdida de las capacidades sensoriales y motoras (paraplejia o tetraplejia), sino también otros problemas comunes relacionados con lesión medular tales como: complicaciones urinarias, problemas gastrointestinales, disfunción cardiorrespiratoria y deformidades musculoesqueléticas1,2. A nivel mundial afecta principalmente a hombres de entre 18 a 32años de edad, con una incidencia estimada de 23casos por millón, en la lesión medular traumática (179,312casos al año), con una incidencia pico bimodal en jóvenes adultos (20 a 29años de edad en hombres y 15 a 19años en mujeres), y adultos mayores (hombres mayores de 70años y mujeres mayores de 60años)2.
Existen 2 principales mecanismos de daño en la lesión medular, a saber: un daño mecánico primario, y el daño secundario inducido por múltiples procesos biológicos que incluyen cambios temporales extensivos en la expresión genética3,4. Dentro del daño secundario están la inflamación, la oxidación y la apoptosis3, y como consecuencia la formación de una cicatriz glial que actúa como una barrera tanto física como molecular para la regeneración axonal5. Sin embargo, se ha demostrado que la astrogliosis también juega un papel crucial, ya que restaura la homeostasis posterior a la lesión medular, al facilitar la reparación de la barrera hematoencefálica y limitar la infiltración de células inflamatorias6,7. El efecto benéfico de la astrogliosis se ha encontrado en una fase temprana, hipertrófica, mientras que la fase hiperplásica tardía lleva a la formación de una cicatriz densa que impide la regeneración axonal8,9.
Por otro lado, en relación con la apoptosis, se ha demostrado que esta no solo afecta a las neuronas, sino también a otras células de la médula espinal, como oligodendrocitos y células de la microglia6. La pérdida de oligodendrocitos en los tractos de materia blanca continúa después de semanas de la lesión medular, y puede contribuir a la desmielinización progresiva tras la lesión10,11.
Se ha demostrado que la alteración en la expresión de diversos genes juega un papel importante en la patogénesis del daño medular secundario3,4. Sin embargo, poco se conoce de los mecanismos que regulan la alteración en la expresión de estos genes. Los microARN resultan candidatos atractivos como reguladores «río arriba» de la progresión secundaria del daño medular, ya que pueden regular series completas de genes de forma postraduccional11-13. Se han encontrado diversas formas de microARN en el sistema nervioso central de mamíferos, que incluyen al cerebro y a la médula espinal, donde juegan un papel esencial en el neurodesarrollo y parecen ser importantes mediadores de la plasticidad neuronal14,15. Incluso algunos microARN han sido involucrados en enfermedades neurológicas severas como los síndromes de la Tourette y de Xfrágil16. Algunos estudios han sugerido la posibilidad de que los microARN estén involucrados en la neurodegeneración17,18. Sin embargo, el papel de los microARN en la lesión medular aún permanece poco estudiado15, a pesar de que se ha demostrado la expresión de un gran número de microARN en la médula espinal de ratones adultos13.
A continuación se hace una breve revisión de la relación entre la lesión medular y los microARN.
Expresión de microARN en la lesión medularExpresión temporal de microARN en la lesión medularLiu et al.15 realizaron un experimento en ratas con lesión medular traumática para determinar la expresión temporal del microARN. Estos autores lograron demostrar que la médula espinal de la rata contiene aproximadamente el 77% (269) de los microARN identificados en la rata madura (350), lo que sugiere que la médula espinal es una rica fuente de microARN. De estos, 97 cambiaron de forma estadísticamente significativa después de la lesión de la médula. Así, 60 se expresaron en niveles moderados, altos y muy altos, y se clasificaron en 5diferentes grupos. Los gruposA y C contienen microARN regulados al alza, el grupoD contiene microARN regulados a la baja y los gruposB y E contienen microARN que fueron regulados al alza a las 4h de la lesión, y posteriormente regulados a la baja 1 y 7 días después de la lesión. Los 37 microARN restantes se expresaron a un nivel bajo y fueron inhibidos después de la lesión.
Debido a que la descompresión de la médula espinal es la principal opción de manejo quirúrgico, Ziu y su equipo19 realizaron un estudio para analizar la expresión espacial y temporal de los niveles de diferentes microARN y su relación con la duración de la compresión. Estos investigadores lograron demostrar que dependiendo del tiempo de compresión, la expresión temporal de algunos microARN es diferente. En particular, el miR-107 se sobrerregula en un modelo de compresión prolongada, mientras que sus niveles no varían en un modelo de compresión corta. Para el miR-148 encontraron que su expresión está sobrerregulada a las 3 y 6h tras la lesión en compresión prolongada y después de las 6h en compresión corta. Finalmente, encontraron que el miR-210 se sobrerregula a las 3, 6 y 24h en el modelo de compresión prolongada, y exclusivamente después de las 24h cuando la compresión es de corta duración.
MicroARN relacionados con la inflamación y la apoptosisPor su parte, Sahni y su grupo9 realizaron un experimento en ratones con lesión medular para determinar el papel de las proteínas morfogenéticas del hueso (BMP, por sus siglas en inglés) y sus receptores en la astrogliosis secundaria a la lesión medular. Estos autores lograron demostrar aumento significativo en los niveles de BMP4 a los 4, 7, y 15días después de la lesión. Encontraron además aumento modesto en los niveles de BMP7 a los 4días de la lesión, así como retorno a la basal a los 7días. Junto con estos hallazgos, demostraron aumento en la trascripción del receptor1a de la BMP (BMPR1a) y de la glial fibrillary acidic protein (GFAP) a los 4 y 7días después de la lesión. La vía de señalización de las BMP involucra a las proteínas SMAD, y se ha demostrado que estas proteínas controlan el procesamiento postranscripcional del microARN-21 (miR-21)17. En relación a esto, Sahni y su equipo9 estudiaron el comportamiento de este microARN en sus ratones. Lograron demostrar que la señalización del BMPR1a regula de forma negativa el procesamiento citoplasmático del miR-21, de tal forma que el producto final procesado de este microARN suele estar inhibido en la lesión medular. Posteriormente, Bhalala et al.20 hicieron un experimento en ratones transgénicos con la finalidad de entender el papel del miR-21 en la respuesta astrocítica tras la lesión medular. Para esto, generaron ratones con sobreexpresión del transcrito primario del miR-21 en astrocitos o con una esponja de microARN diseñada para inhibir la función del miR-21. Los autores demostraron que tras una lesión medular traumática, la sobreexpresión del miR-21 en astrocitos atenúa la respuesta hipertrófica, mientras que la expresión de la esponja aumenta el fenotipo hipertrófico, aun en etapas crónicas. Además, encontraron que la inhibición de la función del miR-21 se acompaña del aumento en la densidad axonal en el sitio de la lesión. Con estos resultados, los autores lograron demostrar un nuevo efecto del miR-21 en la regulación de la hipertrofia astrocítica y la progresión de la cicatriz glial tras la lesión medular.
También como parte del proceso inflamatorio, Izumi y su equipo21 se enfocaron en la expresión del miR-223 y lograron demostrar una alta expresión de ese microARN a las 12h de la lesión medular. Además, sus datos indican que el miR-223 puede regular a los neutrófilos en la fase aguda de la lesión medular.
En relación a la apoptosis, Liu et al.22 en otro trabajo, demostraron un cambio significativo en la expresión de algunos microARN proapoptóticos en ratas con lesión medular; en efecto, encontraron un aumento en la expresión de Let-7a y miR-16 a los 10días de la lesión, y disminución de los niveles de miR-15b.
MicroARN relacionados con la recuperación funcional y regeneraciónLa regeneración se refiere a la habilidad de reproducir réplicas precisas de estructuras perdidas, un fenómeno que se observa en algunas especies de vertebrados, como las salamandras, el ajolote y el pez cebra, pero perdida en los humanos. Los mecanismos moleculares mediante los cuales se lleva a cabo este proceso aún son inciertos23. Se ha investigado el papel de los microARN en la regeneración de la médula espinal tras su lesión en algunas de estas especies.
Sehm y su grupo23 realizaron un experimento en ajolotes para determinar el papel del miR-196 en la regeneración de la cola, posterior a su amputación. Estos autores demostraron aumento importante en la expresión del miR-196 en los primeros 14días tras la amputación, que no se mantuvo posteriormente. Además, la inhibición del miR-196 produjo defectos importantes en la regeneración. Estos datos sugieren que este microARN juega un papel clave en las primeras etapas de la regeneración de la cola amputada en ajolotes.
En esta misma especie, Díaz Quiroz y su equipo24 encontraron que el miR-125b es necesario para la recuperación funcional de la lesión medular. En efecto, estos autores demostraron que la disminución del miR-125b en el ajolote a niveles similares a los de la rata inhibe la regeneración mediante la sobrerregulación de un gen de «repulsión axonal», el Sema4D, que induce la formación de una cicatriz glial reminiscente.
Yu et al.25 por su parte, estudiaron el papel del miR-133b en la recuperación funcional tras la lesión medular. Para esto, utilizaron un modelo de lesión medular en el pez cebra y demostraron una regulación a la alza del miR-133b en las neuronas que presentaban datos de regeneración posterior a la sección de la médula y la inhibición del miR-133b que resultó en la alteración de la recuperación motora, así como en la regeneración axonal disminuida.
Blancos potenciales del microARN en la lesión medularInflamación, oxidación y apoptosisLiu et al.15 analizaron el papel del microARN después de la lesión medular al investigar blancos potenciales. Mediante un análisis bioinformático demostraron que estos blancos son genes que codifican para componentes involucrados en diversos procesos fisiopatológicos como inflamación, oxidación y apoptosis. Diversos genes inflamatorios son blancos potenciales del microARN regulados a la baja tras la lesión medular, como son miR-122, miR-181a, miR-411, miR-99a, miR-34a, miR-30c, miR-384-5p y miR-30b-5p. Por otro lado, varios genes antiinflamatorios antioxidativos son blancos potenciales para los microARN regulados a la alza después de la lesión medular, como lo son miR-221, miR-1, miR-206, miR-152 y miR-214. Algunos genes apoptóticos tales son blancos potenciales de los microARN regulados a la baja tras la lesión medular, tales como: miR-127, iR-181a, miR-411, miR-34a y miR-384-5p.
Estos hallazgos sugieren que la expresión anormal de los microARN después de una lesión medular traumática puede contribuir a la patogénesis del daño secundario, por lo que podrían ser blancos potenciales para intervenciones terapéuticas tras la lesión medular.
Por su parte, Sahni y su equipo9 demostraron que el miR-21 regula de forma negativa la hipertrofia reactiva de los astrocitos en la lesión medular. Sin embargo, no lograron determinar los blancos del miR-21 que pueden afectar el tamaño de estas células, por lo que sugieren la realización de nuevos estudios con este objetivo y para encontrar posibles blancos para intervenciones terapéuticas.
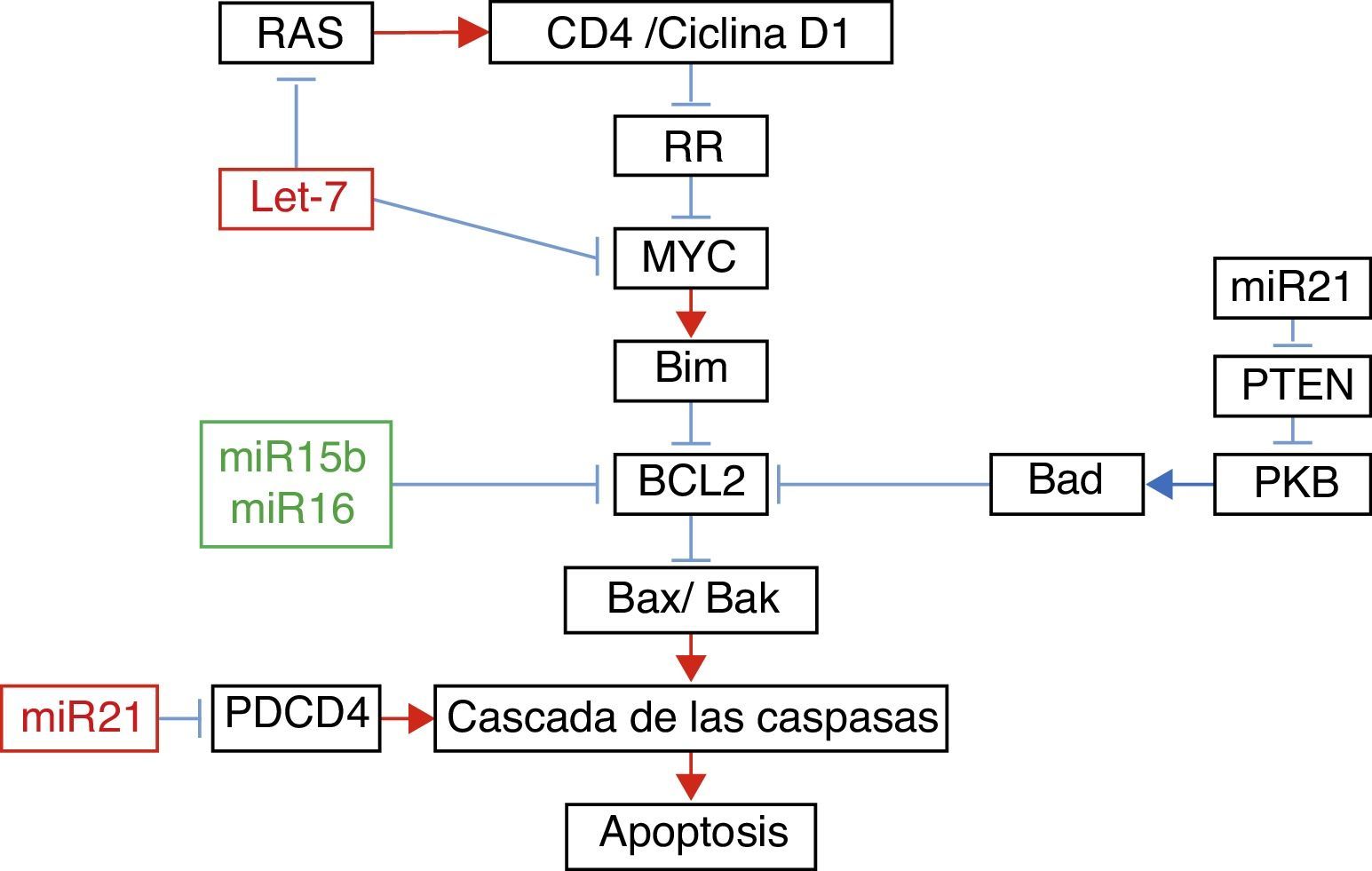
En el estudio de los microARN asociados con la apoptosis, Liu et al.22 demostraron que el aumento de la expresión de Let-7a se acompañó de aumento en la expresión de RAS y MYC a los 10días de la lesión; sin embargo, a los 31días la expresión de RAS y MYC regresó a los niveles basales, pese a que la de Let-7a se mantuvo elevada. El aumento en la expresión del miR-16 se asoció con el aumento en la expresión de Bcl-2 (fig. 1).
Relación entre diferentes microARN con sus genes blancos en apoptosis.
Adaptado con autorización de Liu et al.22
Por otro lado, se ha demostrado que el ejercicio tras la lesión medular mantiene la masa muscular en los miembros paralizados26, estabiliza los patrones rítmicos de disparo en las motoneuronas espinales27, estimula la plasticidad anatómica y bioquímica en la médula28 y produce aumento de los niveles de factores neurotróficos en el músculo y la médula espinal29,30. Es por esto que Liu et al.22 estudiaron el efecto del ejercicio en la expresión de algunos microARN. Estos autores lograron demostrar que 5días de ejercicio después de la lesión medular se acompañaron de aumento significativo en la expresión del miR-21, conocido por su efecto antiapoptótico31, así como de disminución importante de la expresión del miR-15b. El aumento de la expresión de miR-21 se acompañó de disminución en la expresión de ARN mensajero de PTEN y PDC4. Se sabe que la inhibición de estas proteínas se asocia con la disminución de la apoptosis en células cancerígenas mediante la inhibición de la PKB22. En relación con la disminución de la expresión de miR-15b, se encontró aumento paradójico en la expresión de Bcl-2 asociado al aumento de Bcl-2, estos autores encontraron disminución significativa en la expresión de ARNm de las caspasas7 y 9. Finalmente, pese a que no encontraron cambios en la expresión de Let-7a, estos autores demostraron que el ejercicio disminuyó de forma significativa la expresión de RAS. Todos estos cambios en la expresión de los microARN con el ejercicio podrían explicar algunos de sus efectos benéficos.
Recuperación funcional y regeneraciónSehm y su grupo23 estudiaron los blancos potenciales del miR-196 en relación con la regeneración de la cola en el ajolote. Estos autores mostraron que este microARN actúa directamente en el gen de Pax7 al regular a la baja los niveles de esta proteína, con lo que se afecta la división celular durante la regeneración y se produce un fenotipo con cola pequeña. El mecanismo mediante el cual esta proteína produjo dicho fenotipo fue mediante un asa de retroalimentación con las proteínas BMP4 y Msx1, conocidas por su control en la proliferación celular en la médula espinal.
Díaz Quiroz y su equipo24, después de identificar al miR-125 como un factor importante en la creación de un ambiente que permita la regeneración, probaron el efecto del aumento en los niveles de miR-125b en ratas después de la lesión medular. Para esto, inyectaron un miR-125b sintético en el sitio de la lesión 7días después del trauma, con lo que demostraron la disminución de los niveles de Sema4D y de la formación de cicatriz glial, así como un efecto positivo en la regeneración con una mejoría significativa de la locomoción en algunos animales.
En su estudio acerca del papel del miR-133b en la recuperación funcional tras la lesión medular, Yu et al.25 demostraron que este microARN es importante en la regeneración de la médula espinal del pez cebra adulto, mediante la reducción en los niveles de la proteína RhoA, una pequeña GTPasa. Se han estudiado los patrones de activación de esta proteína tras la lesión medular, y el papel de su activación en la apoptosis en el sistema nervioso central32. Tanto las proteínas inhibitorias del crecimiento derivadas de la mielina como el factor de necrosis tumoral (TNF) activan directamente a Rho. La p75NTR (receptor de neurotrofinap75) activa a Rho en ausencia de unión a neurotrofina. La inactivación de Rho por C3-05 (antagonista de RhoA) tras la lesión medular que bloquea la elevación de los niveles de la proteína p75NTR e inhibe la apoptosis. La inactivación de Rho con C3-05 previene la apoptosis y estimula la regeneración.
La forma en que el miR-133b produce esta disminución es mediante su interacción directa con el ARN mensajero de la RhoA. Este es un hallazgo importante, ya que se ha demostrado que la inactivación de esta GTPasa resulta en la recuperación rápida de la locomoción así como una recuperación progresiva de la coordinación entre miembros anteriores y posteriores en ratones adultos33.
Posibles intervenciones terapéuticasAún falta explorar más a fondo el papel de los microARN en la lesión medular; sin embargo, existe cada día mayor evidencia que sugiere que estos microARN representan una nueva clase de blancos terapéuticos34-36. El microARN en el sistema nervioso central disminuye los niveles de proteína mediante la regulación postranscripcional16,37. Así, la inhibición de un microARN ligado a una enfermedad particular puede remover el bloqueo de la expresión de una proteína terapéutica. Por el contrario, la administración de un microARN mimético puede estimular una población de microARN endógeno que a su vez reprima un gen perjudicial38. Si se toma ventaja de su pequeño tamaño y el conocimiento actual de la biogénesis del microARN, algunos ARN modificados pueden utilizarse transitoriamente como microARN preprocesados o como oligonucleótidos anti-microARN39.
Los oligonucleótidos anti microARN son oligonucleótidos de una cadena reversa complementarios. Su estabilidad, afinidad de unión y especificidad han sido mejoradas mediante modificaciones químicas. Las más comunes de las modificaciones en oligonucleótidos son los ácidos nucleicos cerrados (LNA por sus siglas en inglés), la modificación 2’-O-metil, y esqueletos de fosforotioato. Los oligonucleótidos con modificación 2’-O-metil han demostrado ser inhibidores efectivos en varias líneas celulares y en neuronas primarias cultivadas40-42. Recientemente, la administración de oligonucleótidos modificados por LNA y por fosforotioato contra el miR-122 aplicados por vía endovenosa a ratones y primates no humanos ha resultado en la disminución duradera y efectiva del colesterol plasmático, sin ninguna toxicidad aparente43. Los oligonucleótidos modificados por LNA contra miR-122 (SPC3649) están actualmente en un ensayo clínico en faseI para la infección por el virus de la hepatitisC y será el primer blanco terapéutico con microARN en humanos44.
Los imitadores del microARN son oligonucleótidos pequeños, generalmente de doble cadena, modificados químicamente que pueden ser utilizados para regular a la baja proteínas blanco específicas. La estructura en doble cadena es necesaria para el reconocimiento y unión eficaces al RISC. Una de las cadenas es el microARN maduro, y la cadena complementaria forma un complejo con la secuencia del microARN maduro36. A pesar de que estos imitadores se usan con frecuencia en investigaciones en cultivos, aún no existen datos in vivo que demuestren la eficacia de los imitadores del microARN45.
Aún existen muchos retos para el uso de microARN como blancos terapéuticos, a saber: su difícil administración, los posibles efectos en otros sistemas y el asegurar su seguridad. Sin embargo, la estrategia de manipulación de los microARN in vivo para regular procesos patológicos se está convirtiendo en un abordaje terapéutico factible. En un futuro, una mejor comprensión de la biogénesis y la función del microARN promoverá sin duda el desarrollo de terapias basadas en microARN.
ConclusionesLa lesión medular es causa importante de discapacidad, y a la fecha no existe un tratamiento exitoso. Se ha iniciado el estudio de los microARNs en esta patología, con lo que se ha mostrado su importancia en el control de la inflamación, la oxidación, la apoptosis, la proliferación y la regeneración. Es necesario continuar con el estudio de los microARN en la lesión medular, así como la identificación de sus genes blanco y los mecanismos de señalización que participan en sus efectos neurológicos. Con esto, el objetivo final será el desarrollo de estrategias terapéuticas y diagnósticas eficaces y seguras para los pacientes con lesión medular.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.