La reparación de una fractura implica procesos celulares complejos. Sin embargo, a pesar de un tratamiento óptimo, algunas fracturas curan lentamente o, simplemente, no se reparan. Estas complicaciones apoyan la necesidad de terapias innovadoras. La estimulación electromagnética es una tecnología no invasiva que pudiera tener un impacto directo sobre muchas vías celulares.
ObjetivoDemostrar la eficacia de la electroestimulación por corriente alterna, aplicada durante una elongación ósea para acelerar el proceso de consolidación, por 30 días en un modelo animal.
Materiales y métodosSe diseñó un dispositivo de circuito cerrado y voltaje graduado, que se mantuvo en contacto con el fijador externo. El grupo A fue elongado sin electroestimulación y el grupo B fue electroestimulado desde el inicio de la distracción. Se tomaron radiografías a los 15 y 30 días posquirúrgicos, se realizaron tinciones de hematoxilina y eosina, y de tricrómico de Masson.
ResultadosNo se observó una diferencia significativa en la densidad ósea del grupo A (4.05±3.24, p=0.163). En el grupo B existe una diferencia significativa (61.06±20.17, p=0.03), en la densidad ósea. El grupo A mantuvo un tejido de reparación fibroso, con zonas de cartílago y matriz ósea. El grupo B presentó un tejido más organizado en las fases de reparación ósea.
ConclusiónDebido a que existe una diferencia significativa en el crecimiento y formación del callo óseo a los 15 y 30 días entre ambos grupos, la electroestimulación podría considerarse como un adyuvante durante el proceso de elongación ósea.
A fracture repair involves complex cellular processes. However, despite optimal treatment, some fractures heal slowly or do not repair. These complications support the need for innovative therapies. Electromagnetic stimulation is a non-invasive technology that could have a direct impact on many cellular pathways.
ObjectiveTo demonstrate the effectiveness of electro-stimulation by alternating current applied during bone elongation to accelerate the consolidation process for 30 days in an animal model.
Materials and methodsA device with closed circuit and graduated voltage was designed and kept in contact with the external fixator. Group A was elongated without electro-stimulation and group B was electro-stimulated since the beginning of the distraction. Radiographs were taken at 15 and 30 days post-surgical. Haematoxylin and eosin staining and Masson's trichrome stain were performed.
ResultsNo significant difference were observed in bone density of group A (4.05±3.24, P=0.163). In group B there was a significant difference (61.06±20.17, P=0.03) in bone density. Group A maintained a fibrous tissue repair, with areas of cartilage and bone matrix. Group B had more organised tissue in the stages of bone repair.
ConclusionBecause there is a significant difference in the growth and callus formation at 15 and 30 days between groups, electro-stimulation could be considered as an adjuvant during bone elongation.
La fractura de un hueso se define como la pérdida en la continuidad normal del tejido óseo, producida como consecuencia de un traumatismo o de un proceso patológico que debilita su estructura normal. En general, las principales causas son producidas por la aplicación de una fuerza sobre el hueso que supera su resistencia elástica1,2. La reparación de una fractura implica procesos complejos de proliferación, así como de diferenciación celular, además de que intervienen varios factores de crecimiento, citocinas inflamatorias, antioxidantes, osteoclastos, osteoblastos, hormonas, aminoácidos y diferentes nutrientes3.
Es difícil establecer el momento en el que una fractura debe estar unida. Sin embargo, a pesar de un tratamiento óptimo, algunas fracturas curan lentamente o, simplemente, no se reparan4. La mayoría de los expertos coinciden en que no debe haber evidencia de curación clínica o radiológica por al menos 3 meses antes de aplicar el término «no unión», para describir la fractura5. Ocasionalmente las no uniones ocurren sin causa aparente, pero en muchos casos intervienen factores como el daño a los tejidos blandos asociados con fracturas abiertas y cerradas de alta energía, infección, fracturas segmentarias, fracturas patológicas, fracturas con interposición de tejido blando, suministro sanguíneo local pobre, enfermedades sistémicas, desnutrición, deficiencia de vitamina D, uso de corticosteroides y una pobre fijación mecánica, e interferencias iatrogénicas6.
Para la comprensión de los procesos para llevar a cabo una elongación ósea, se deben analizar los términos osteogénesis por distracción, que se refiere a la producción de hueso nuevo entre las superficies óseas vasculares, generadas por una osteotomía y separadas por una distracción gradual7 y la fisiólisis por distracción, que se refiere a la distracción mecánica de la placa de crecimiento sin una osteotomía, pero con una fractura fisiaria presente8,9.
Fue Ilizarov10 quien introdujo el concepto de callostasis, y logró elongaciones óseas con gran éxito. Posteriormente sus conceptos fueron ampliados de acuerdo con Peña Martínez et al.11.
El método de Ilizarov permite al cirujano realizar alargamientos complejos y prolongados de ambas extremidades cortas, ya sean congénitas o adquiridas, pero la técnica puede ser difícil y requiere de tiempo para dominar este procedimiento, en comparación con los métodos que implican el uso de un fijador monolateral12,13. El método de De Bastiani et al.14 ha ganado prestigio entre los ortopedistas pediátricos, porque es técnicamente menos exigente para el cirujano y el fijador monolateral tiende a ser más cómodo para el paciente que un fijador circunferencial. El método se basa en una osteotomía más convencional, que consiste en la apertura del periostio, la perforación a través de ambas cortezas y en varias direcciones, la interconexión de perforaciones visibles con un osteotomo y la finalización de la osteotomía, con una osteoclasia manual14.
En cuanto a los estímulos basados en descargas eléctricas o electroestimulación, de acuerdo con Boyer15, encontramos antecedentes para el tratamiento de no uniones que fueron realizadas por Birch en el año 1812. Posteriormente, Yasuda (1953) aportó estudios que demuestran que existe un efecto eléctrico en el hueso cuando se somete a cargas lineales o angulares, así como una pequeña corriente aplicada al hueso, que es capaz de estimular la osteogénesis16. Debido a que estos campos eléctricos endógenos pueden modular actividades celulares en el hueso, se han desarrollado diversos sistemas para la electroestimulación de uso terapéutico17,18. Los equipos de electroestimulación pueden ser de efecto inductivo (como una terapia pulsátil electromagnética), de efecto de capacitación y de corriente directa, actualmente aceptados por la FDA para el tratamiento de no uniones y fusiones vertebrales19,20. Pero la eficacia en la utilización en tejido de callostasis no está demostrada, por lo cual, en el presente trabajo, se pretende demostrar la eficacia de la electroestimulación para disminuir el tiempo en la fase de elongación, correspondiente a la remodelación y corticalización.
Materiales y métodosPrevia autorización del Comité de Ética de la Facultad de Medicina y del Hospital Universitario de la Universidad Autónoma de Nuevo León, se utilizaron 14 perros de raza mixta con un peso y edad promedio de 10kg y 3 años, respectivamente. Se diseñaron 2grupos de estudio. El grupo A fue conformado por 7 individuos tratados mediante una elongación ósea sin electroestimulación y en el grupo B se practicó una elongación ósea con electroestimulación en otros 7 perros.
Electroestimulador. Se diseñó un electroestimulador óseo que se mantuvo en contacto con el fijador externo, mediante un cátodo receptor y un ánodo. Para dirigir la conducción se diseñaron clavos tipo Kirschner de 0.62mm con una cubierta de polipropileno y con área de conducción de 5mm en los extremos, para evitar una interfase con los tejidos blandos. La corriente alterna emitida fue de 6V a 20μA, con una alimentación positiva de fuente dual de 9V.
Técnica quirúrgica. Para la fijación externa se utilizó el MiniRail System de Orthofix® que consiste en un fijador con 2cuerpos articulados para la fijación de los tornillos y un cuerpo central con aditamento para elongación de 0 a 8cm. Mediante la técnica de inserción de tornillos de De Bastiani, se disecaron lo planos hasta llegar al periostio de la diáfisis femoral. Posteriormente, con una broca de 2mm se realizaron orificios seriados en todo el diámetro del hueso. Estos orificios se unieron con un osteotomo plano de 0.5 a 1cm de ancho hasta que se completó la corticotomía21. Finalmente se cerró el periostio, así como los tejidos adyacentes y la piel con sutura de nailon 3-0 (ETHICON® Johnson & Johnson S. A.).
Radiografías. Los animales se sedaron con xilacina, para realizar las tomas radiográficas en las posiciones anteroposterior y lateral a los 15 y 30 días posquirúrgicos.
Eutanasia. Se realizó de acuerdo con la Norma Oficial Mexicana NOM-062-ZOO-1999, de Especificaciones técnicas para la producción, cuidado y uso de los animales de laboratorio, administrando pentobarbital sódico a dosis de 120mg/kg vía intravenosa y xilacina a dosis de 2mg/kg.
Tinciones histológicas. Las muestras se fijaron con la solución de Bouin y se descalcificaron con la solución Calci-Clear Rapid (Fisher Scientific, Reino Unido). Posteriormente el tejido fue deshidratado y empapado en parafina, para obtener los cortes histológicos. Se realizaron las técnicas de tricrómico de Masson, así como hematoxilina y eosina para observar la morfología celular, la matriz amorfa y el colágeno contenido.
Análisis densitométrico. Para el análisis de las imágenes radiográficas, se utilizó el software Image Pro Plus versión 6 (Media Cybernetics, Inc. EE. UU.), para medir la cantidad de materia presente en un material midiendo la cantidad de luz que pasa a través de ella.
Estadística. Los análisis estadísticos se realizaron mediante la prueba t de Student para ambos grupos, comparando la densidad ósea a los 15 y 30 días, con el software IBM SPSS versión 20 (SPSS, Inc, Armon, NY, EE. UU.).
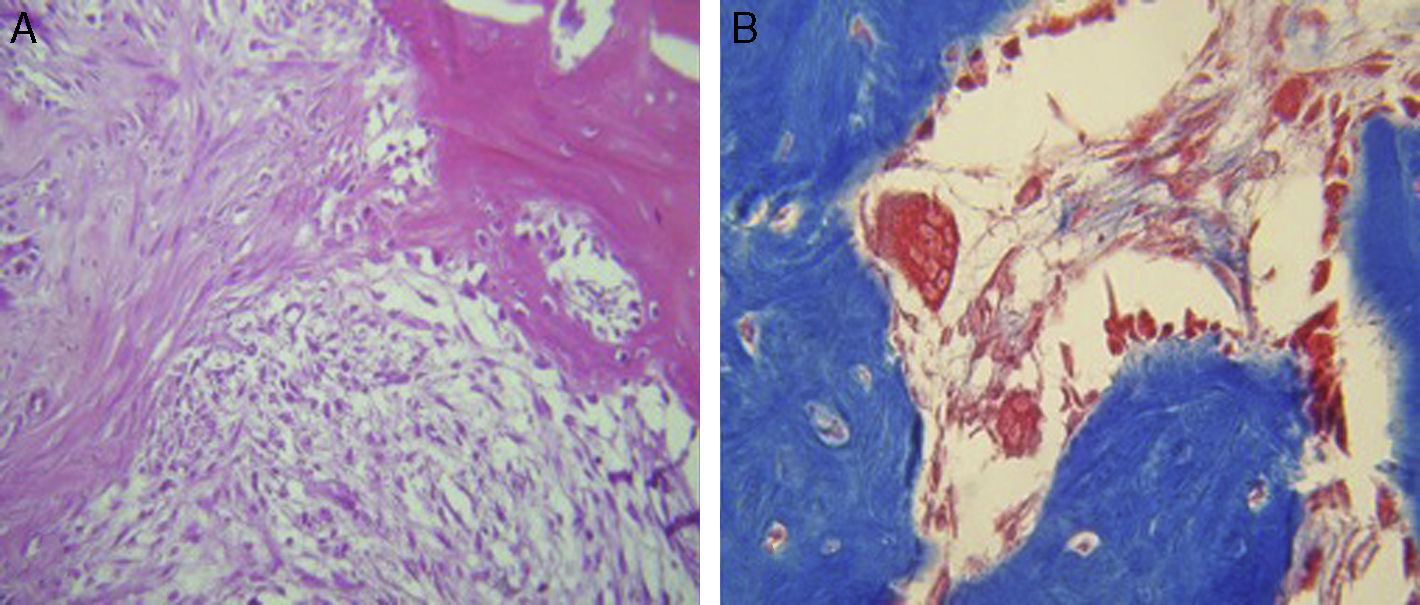
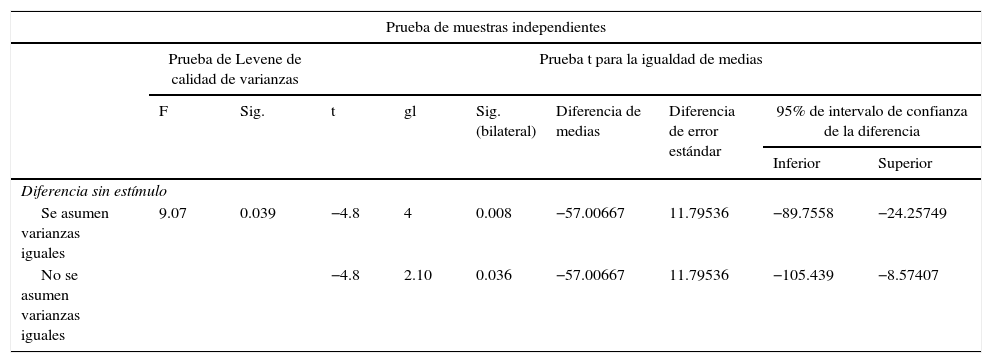
ResultadosPara el grupo A (fig. 1), en los casos en los que no hubo estímulo eléctrico, se analizaron los cortes teñidos con hematoxilina y eosina: se observó, en general, un tejido de reparación con características fibrosas. En otros niveles de corte, se observó una transición de tejido cartilaginoso a un tejido fibroso denso, hasta llegar a la formación de hueso primario. Se pueden apreciar componentes del periostio que dan lugar a fibroblastos y a tejido fibrocolagenoso denso formando haces paralelos, que se interconectan con el hueso primario, el cual va reemplazando al tejido cartilaginoso hialino. Existe la presencia de vasos sanguíneos en zonas fibrohialinas, así como una cicatriz fibrosa muy gruesa. En el hueso sano, se observaron trabéculas con osteoblastos planos, así como la formación de nuevas trabéculas con osteoblastos grandes y cuboides en franca proliferación. En diferentes zonas se detectó la formación de tejido conectivo laxo con células estrelladas y fusiformes, y abundantes vasos sanguíneos de diferentes calibres. Hacia la porción lateral se encontraron trabéculas óseas de espesor variable y, hacia el interior del hueso, el tejido conectivo se hace más denso con haces de colágena. También en esta porción del hueso se observan células mesenquimatosas, islotes de cartílago hialino con cambios morfológicos como consecuencia de la condensación de la matriz hacia un tejido fibroso más compacto. En las tinciones con el tricrómico de Masson (fig. 1) para el mismo grupo, se observa la presencia de una gran cicatriz fibrosa entre las trabéculas óseas de neoformación, que se continúan con las trabéculas preexistentes. Hay formación de fibras de colágeno que se van integrando a las trabéculas. Se detecta tejido fibrocartilaginoso laxo que experimenta un proceso de hipertrofia hacia un tejido denso. Existen numerosos osteoclastos en la periferia de las trabéculas de nueva formación, lo que habla de la restauración del centro hacia la periferia. En la zona del endostio, se observan macrófagos y osteoclastos que migran hacia las trabéculas óseas neoformadas. En la zona de la cicatriz, se distingue una degradación activa para permitir el desarrollo de tejido óseo.
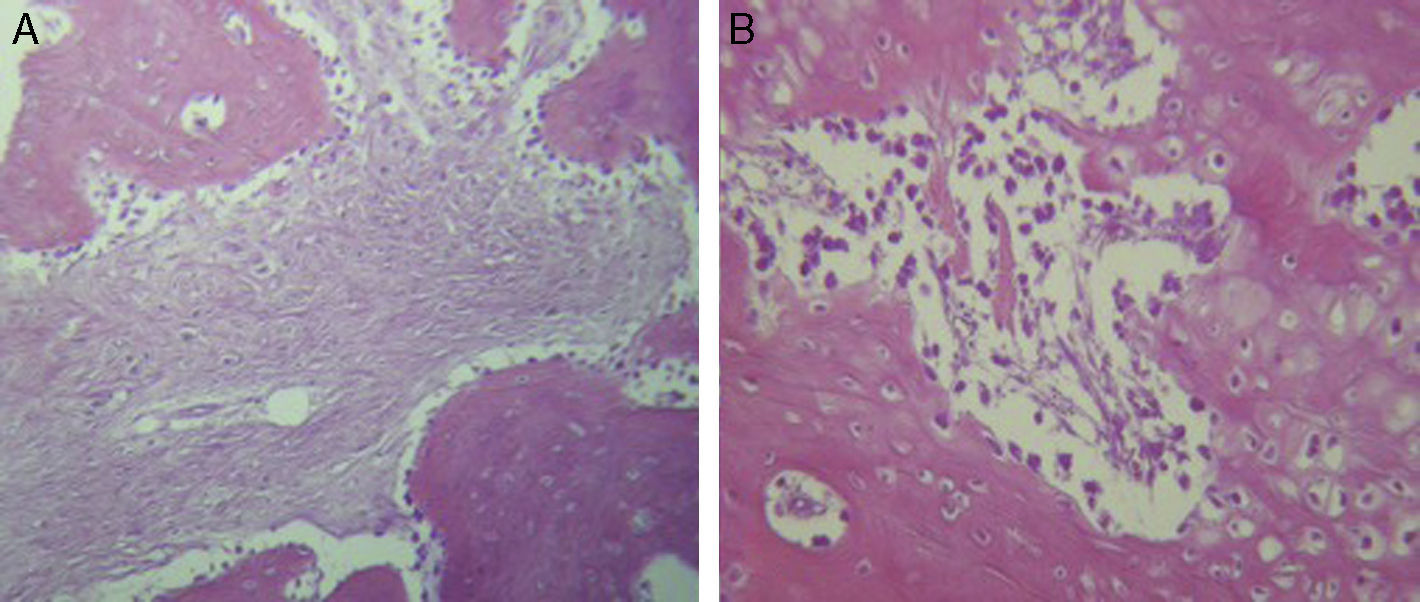
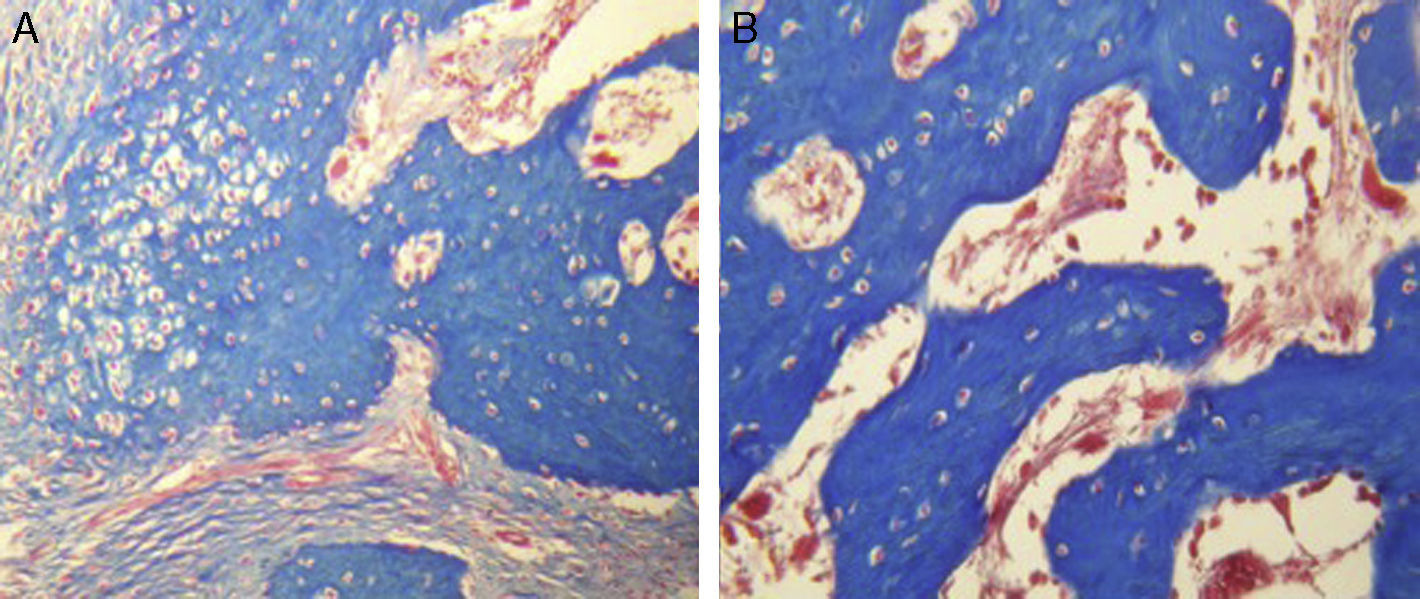
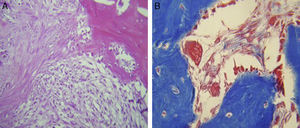
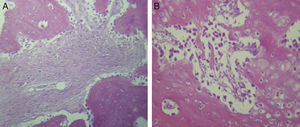
Para el grupo B, se observó en general, en las tinciones con hematoxilina y eosina (fig. 2), mayores áreas de cartílago hialino, así como transiciones de tejido fibroso a tejido cartilaginoso, hasta llegar a un tejido osteocolagenoso. Se distingue claramente un tejido más organizado en cuanto a las fases de reparación ósea en comparación con los cortes del grupo A. El tejido fibroso se observó con mayor consistencia en cuanto al arreglo de las fibras de colágeno en su integración con las trabéculas. Para el tricrómico de Masson (fig. 3), se observó en todos los cortes un tejido fibroso abundante, muy denso y compacto. En general, se observa poca presencia de osteoclastos en áreas de fibrina, la cual es más delgada. En el extremo de las trabéculas en regeneración, se observan pocos macrófagos y osteoclastos. Hacia la periferia del hueso, se distingue un periostio más organizado y fibroso. En la zona central del hueso se observa una concentración de osteoclastos y haces gruesos, compactos, que corren perpendiculares a las fibras de colágena.
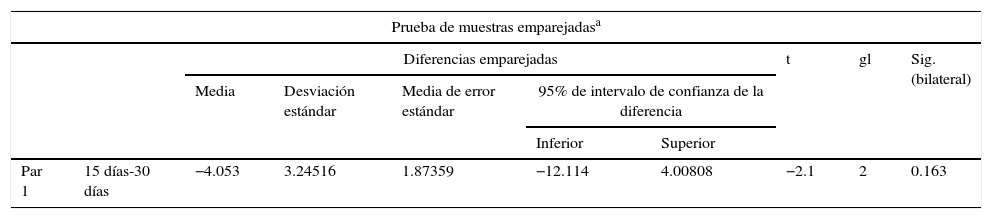
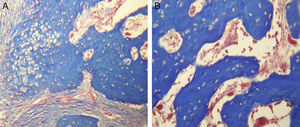
Se digitalizaron las imágenes radiográficas correspondientes a ambos grupos. La primera toma se realizó a los 15 días posquirúrgicos y la segunda toma radiográfica fue a los 30 días. Para ambos grupos, en la zona de neoformación se observó, en general, una zona radiolúcida predominante con poca presencia de áreas radioopacas, que fueron seleccionadas para su análisis y posterior comparación entre los diferentes días. Se calculó la media de los valores arrojados en el análisis densitométrico, en donde a los 15 días había una media de 113.66 y a los 30 días era de 117.71. Al realizar la prueba de muestras emparejadas, encontramos una diferencia de 4.05 con una p de 0.163, lo que significa que no hay una diferencia estadística en la densidad ósea desde el punto de vista radiográfico (tabla 1). Para el grupo que recibió estímulo (grupo B), a los 15 días postratamiento se encontró una media de 65.60 y a los 30 días la media de densidad fue de 126.66. Al emparejar los datos, se encontró una diferencia de 61.06 con valor de p=0.03, lo que indica una diferencia significativa (tabla 2). Al comparar ambos grupos con sus respectivos valores de p, encontramos una diferencia estadísticamente significativa debida a que no se asumen varianzas iguales (tabla 3).
Diferencia de muestras emparejadas para grupo A
| Prueba de muestras emparejadasa | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Diferencias emparejadas | t | gl | Sig. (bilateral) | ||||||
| Media | Desviación estándar | Media de error estándar | 95% de intervalo de confianza de la diferencia | ||||||
| Inferior | Superior | ||||||||
| Par 1 | 15 días-30 días | −4.053 | 3.24516 | 1.87359 | −12.114 | 4.00808 | −2.1 | 2 | 0.163 |
Diferencia de muestras emparejadas para grupo B
| Prueba de muestras emparejadasa | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Diferencias emparejadas | t | gl | Sig. (bilateral) | ||||||
| Media | Desviación estándar | Media de error estándar | 95% de intervalo de confianza de la diferencia | ||||||
| Inferior | Superior | ||||||||
| Par 1 | 15 días-30 días | −61.060 | 20.17079 | 11.54561 | −111.167 | −10.95298 | −5.24 | 2 | 0.035 |
Prueba t para la igualdad de medias
| Prueba de muestras independientes | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Prueba de Levene de calidad de varianzas | Prueba t para la igualdad de medias | ||||||||
| F | Sig. | t | gl | Sig. (bilateral) | Diferencia de medias | Diferencia de error estándar | 95% de intervalo de confianza de la diferencia | ||
| Inferior | Superior | ||||||||
| Diferencia sin estímulo | |||||||||
| Se asumen varianzas iguales | 9.07 | 0.039 | −4.8 | 4 | 0.008 | −57.00667 | 11.79536 | −89.7558 | −24.25749 |
| No se asumen varianzas iguales | −4.8 | 2.10 | 0.036 | −57.00667 | 11.79536 | −105.439 | −8.57407 | ||
Las no uniones siguen siendo las principales complicaciones en el tratamiento de las fracturas22. Se sabe que afectan del 5 al 10% de los 7.9 millones de fracturas que se producen anualmente en los Estados Unidos23. La carga socioeconómica asociada a la reparación de la fractura, incluyendo los costos hospitalarios y pérdida de salarios, es cuantiosa24,25. Estas complicaciones favorecen la necesidad de terapias innovadoras para optimizar la sanación de la fractura. La estimulación electromagnética es una tecnología no invasiva que mejora la curación de la fractura26–28. El uso de la estimulación eléctrica en el tratamiento de fracturas sin una adecuada unión se remonta a mediados de la década del 180029,30. En 1957, Fukada y Yasuda31 demostraron una relación entre la electricidad y la formación del callo óseo. Estudios recientes han señalado que la estimulación electromagnética tiene un impacto directo sobre muchas vías celulares, incluyendo la síntesis de factores de crecimiento32–34, en los proteoglicanos, en la regulación del colágeno35,36 y en la producción de citocinas37. Estas vías permiten al hueso responder a los cambios del entorno, así como la estimulación de la vía de señalización calcio-calmodulina, y favorecen así la consolidación ósea24,38. Diversos ensayos aleatorizados han evaluado el efecto de la estimulación electromagnética en la consolidación ósea, pero los resultados clínicos han sido variables39,40.
En el presente estudio se pretende demostrar la eficacia de la electroestimulación, mediante una corriente directa alterna aplicada con un dispositivo de circuito cerrado con voltaje graduado, en la maduración de un tejido obtenido por distracción en elongaciones óseas para, de esta forma, acelerar el proceso de consolidación (en promedio 30 días), específicamente en el foco de la elongación. Eyres et al.41 exploraron el uso de la estimulación electromagnética en procedimientos de alargamiento en la extremidad inferior y reportaron una mejora estadísticamente significativa en la densidad ósea, en el grupo de intervención a 12meses de seguimiento postratamiento, en segmentos proximales a la osteotomía. Borsalino et al.42 reportaron un aumento en el callo y en el puente trabecular con la estimulación electromagnética en la corteza media y lateral a 40 y 90 días, así como una mejor densidad del callo óseo a 90 días en pacientes tratados mediante una osteotomía intertrocantérica femoral.
En el presente estudio experimental con un modelo animal en perros, se analizaron las imágenes radiográficas correspondientes a los 15 y a los 30 días posquirúrgicos. Para el grupo en el que no se aportó ningún tipo de estímulo eléctrico (grupo A), se encontró que en la densidad ósea no existía una diferencia significativa entre los períodos de análisis establecidos, con 4.05±3.24 (p=0.163). Para el grupo al que se le aplicó electroestimulación (grupo B), se encontró una diferencia significativa entre los 15 y 30 días de estímulo eléctrico, con un valor de 61.06±20.17 (p=0.03). Al momento de comparar los datos de ambos grupos (con y sin electroestimulación), se asume una diferencia estadística, por la diferencia encontrada entre las varianzas (0.036).
Debido a que la mayoría de los estudios basados en la electroestimulación reportan resultados clínicos y radiográficos, ha sido difícil comparar nuestro estudio con otros en los que hayan realizado cortes histológicos en un modelo animal. Chen et al.43 examinaron histológicamente la evolución de una osteotomía para determinar el efecto de una estimulación eléctrica posquirúrgica, en la reparación ósea en un modelo facial en ratas. Aplicaron una corriente de 20μA en el sitio de la osteotomía, pero de manera subcutánea. Analizaron los cortes histológicos para caracterizar el proceso de cicatrización de la osteotomía. Sus resultados no mostraron diferencias estadísticamente significativas entre los 3grupos de animales (p>0.005).
En nuestro estudio, para el grupo en el que no hubo estímulo eléctrico, al analizar los cortes histológicos, se observó un tejido de reparación con características fibrosas, zonas de cartílago con una transición hacia una matriz ósea, es decir, estructura de hueso primario. También se observaron componentes del periostio que dan lugar a fibroblastos y a tejido fibrocolagenoso denso formando haces paralelos que se interconectan con el hueso primario que va reemplazando al tejido cartilaginoso hialino. En las tinciones con el tricrómico de Masson se observó la presencia de una cicatriz fibrosa entre las trabéculas óseas de neoformación, que se continúan con las trabéculas preexistentes. Además, se encontró una gran cantidad de osteoclastos en la periferia de las trabéculas de nueva formación, lo que indica la restauración desde el centro hacia la periferia. En el grupo en el que se aplicó un estímulo eléctrico directo de 20μA, se observó un tejido más organizado en cuanto a las fases de reparación ósea en comparación con los cortes del grupo A, así como mayores áreas de cartílago hialino, transiciones de tejido fibroso, que se continuaron hasta uno osteocolagenoso. Se encontró poca presencia de osteoclastos en las áreas de fibrina.
Petersson y Johnell44 describieron un modelo experimental en tibias de conejos, en los que se estableció una unión retrasada por medio de un espaciador de silicón en el sitio de la osteotomía durante 48 días. Posterior al retiro del espaciador, se utilizó un transistor eléctrico de corriente continua regulada de 20μA a través de electrodos de acero inoxidable, para estimular la osteogénesis en el lado derecho durante 62 días. En el lado izquierdo se realizó una operación simulada, insertando electrodos de acero inoxidable sin corriente: se encontró la formación de un callo bien establecido en el lado estimulado y, en el lado control, se encontró sinostosis entre los extremos del peroné y la tibia. Finalmente reportan que no hubo diferencia significativa en la formación de la sinostosis entre el derecho y el lado izquierdo, además no se observó ningún efecto adverso histológico provocado por la corriente.
ConclusionesBajo nuestras condiciones experimentales en el modelo animal, se observó una diferencia significativa en el crecimiento y formación del callo óseo radiográfica a 15 y 30 días. Histológicamente observamos un tejido más organizado al momento de aplicar electroestimulación a los 15 y 30 días en el modelo animal de osteosíntesis, con una significación en el tiempo de consolidación en el grupo con electroestimulación (grupo B) demostrada radiológica e histológicamente.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.
Al personal del Bioterio del Departamento de Fisiología de la Facultad de Medicina de la Universidad Autónoma de Nuevo León, por el cuidado y buen manejo de los animales sujetos de estudio.