En los últimos años, los avances en biología molecular han puesto en marcha innovaciones en el diagnóstico y la terapéutica del cáncer de mama. El advenimiento de la genómica ha revolucionado nuestra compresión en esta patología. MammaPrint® fue desarrollado como una herramienta de diagnóstico para predecir el riego de recurrencia de cáncer de mama mediante la expresión de 70 genes. La era de la genómica ha cambiado el paradigma clínico-patológico de selección de paciente para quimioterapia citotóxica adyuvante.
Material y métodosEl estudio incluyó a pacientes con diagnóstico de cáncer de mama en etapa clínica i-ii que se hayan sometido al estudio genómico MammaPrint®.
ResultadosEl uso de MammaPrint® fue un factor decisivo para la recomendación de tratamiento adyuvante con quimioterapia, en pacientes con riesgo elevado para recaída. En nuestro grupo de pacientes con bajo riesgo no han presentado recidiva.
DiscusiónLa determinación de las características genéticas y sus alteraciones en el cáncer de mama es de fundamental importancia para una mejor identificación del riesgo, así como una mejor selección de los tratamientos.
ConclusiónMammaPrint® es un estudio eficaz para determinar riesgo/recurrencia de cáncer de mama en etapa temprana.
In recent years, advances in molecular biology have resulted in innovations in breast cancer diagnostics and therapeutics. The development of genomics has revolutionized our understanding of this disease. MammaPrint® was developed as a diagnostic tool to predict risk of breast cancer recurrence using the expression of 70 genes altering the clinicopathologic paradigm of selection of patients for adjuvant cytotoxic chemotherapy.
Materials and methodsA study of stage i-ii breast cancer patients on whom the MammaPrint® genomic assay was performed.
ResultsThe use of the MammaPrint® assay was a decisive factor for the recommendation of adjuvant treatment with chemotherapy and/or hormone therapy in patients with high risk for relapse. In our group, the patients with low-risk have not presented local or systemic recurrences
DiscussionThe determination of the genetic characteristics and its alterations in breast cancer, is fundamentally important for a better identification of risk, as well as a better selection of cancer therapy.
ConclusionMammaPrint® is an effective study to determine risk of recurrence of in early stage breast cancer.
El cáncer de mama representa un desafío para la salud pública debido al incremento de casos en el mundo. De acuerdo con el informe de la Organización Mundial de la Salud, la incidencia de esta neoplasia maligna podría aumentar hasta en un 50% para el 2020, año en el que habría 15 millones de nuevos casos a nivel mundial y alcanzaría cerca de 20,000 en México1.
Los perfiles de expresión de genes son una tecnología relativamente nueva que identifica la actividad de los mismos para ser usada como firma molecular para predecir el pronóstico y servir de guía al tratamiento2. En el comercio se dispone de 3 pruebas genómicas principales para usar en el cáncer de mama en etapa temprana: Oncotype DX, MammaPrint® y PAM503.
Las 3 pruebas proporcionan una evaluación del riesgo total de recurrencia del cáncer de mama, aunque tienen diferencias importantes entre sí. En un sentido, estas 3 pruebas genómicas son biomarcadores de pronóstico, en virtud de que brindan un riesgo estimado de recurrencia e información de pronóstico independiente de la obtenida con los factores clínicos y patológicos estándar4,5.
Los términos «pronóstico» y «predictivo» con frecuencia se usan de manera indistinta; sin embargo, tienen diferencias importantes. En general, un biomarcador predictivo identifica a las pacientes que se pudieran beneficiar de una intervención específica. Un biomarcador pronóstico brinda información sobre el desenlace probable de la enfermedad independiente del tratamiento6,7.
El MammaPrint®, a diferencia del Oncotype DX, que solo evalúa 21 genes y puede reportar un resultado incierto, es un perfil de expresión de 70 genes que en un principio se desarrolló a partir de arreglos en todo el genoma de muestras de pacientes con de cáncer de mama7,8. Es un marcador de pronóstico independiente de los factores clínicos y patológicos convencionales, como tamaño del tumor, estatus de los receptores hormonales y estatus de factor de crecimiento epidermal 2 (HER2). Esta prueba se sometió al escrutinio y la validación por la Food and Drug Administration y fue autorizada en el año 2007, siendo la única prueba genómica para cáncer de mama aprobada a la fecha por esta organización9,10. Cabe resaltar que el Oncotype DX fue desarrollado sobre muestras de archivo, mientras que el MammaPrint® se hizo sobre tejido tumoral fresco, por lo que pudiera implicar un beneficio en la elaboración de esta prueba11.
Las funciones biológicas de los 70 genes de la firma de MammaPrint® se relacionan con los pasos esenciales necesarios para la progresión del tumor y las metástasis. Refleja las características malignas adquiridas de una célula cancerosa junto con el proceso de crecimiento del tumor y las actividades biológicas de las migración e implantación sistémica12,13. Una de las características más importantes del estudio es que se diseñó sobre la base de los niveles totales de expresión de los genes para dividir a las pacientes en grupos de riesgo bajo y alto, lo que corresponde a tasas de supervivencia a 10 años libre de metástasis a distancia mayor a 90% o menor a 90%, respectivamente13,14.
Con los análisis de expresión de los genes pueden desarrollarse otros perfiles y leerse en el tejido sometido para la clasificación original. Por ejemplo, el tejido sometido para los análisis en MammaPrint® también puede usarse para determinar otros perfiles, como BluePrint®, el cual establece subtipos moleculares a través de ARN mensajero (ARNm) de 80 genes, clasificándolos en 4 distintos subtipos (basal, luminal A, luminal B y HER2), proporcionando información sobre sensibilidad a quimioterapia y TargetPrint®, que es un estudio de microarreglos de expresión genética que provee una valoración cuantitativa de los niveles de receptores estrogénicos, receptores de progesterona y factor de crecimiento epidermal 2 (HER2) en el ARNm. TargetPrint® proporciona un resultado numérico en una escala continua entre –1.0 y +1.0, dando un resultado definitivo: positivo o negativo15,16. Combinar MammaPrint® con BluePrint® y TargetPrint® permite estadificar a las pacientes en los siguientes subgrupos: tipo luminal de bajo riesgo por MammaPrint® (similar al luminal A), tipo luminal de alto riesgo por MammaPrint® (similar a luminal B), tipo factor de crecimiento epidérmico 2 (HER2) y tipo basal17,18.
Aunque no se cuenta con una prueba estándar y ninguna de las tecnologías se ha aceptado de manera uniforme, muchos clínicos han adoptado las pruebas de genes múltiples porque son un instrumento efectivo para la toma de decisiones terapéuticas en pacientes con cáncer de mama en etapa temprana19.
El objetivo de este estudio es valorar la eficacia, entendida esta como la incidencia de pacientes con cáncer de mama en etapa temprana, con alto riesgo clínico pero con bajo riesgo genómico de recurrencia, que no recibieron quimioterapia, con una mejor sobrevida libre de metástasis, en comparación con las que recibieron quimioterapia (46% de mujeres con cáncer de mama que tienen alto riesgo clínico podrían no requerir quimioterapia20) y la utilidad clínica de la prueba genómica MammaPrint® como pronóstico del cáncer de mama frente a los índices convencionales de carácter clínico-patológico en nuestra población.
Material y métodosSe llevó a cabo un estudio de tipo observacional, longitudinal, analítico, descriptivo y prospectivo. La recolección de datos se realizó del archivo clínico del Centro de Estudios Mastológicos S.A. de C.V. (Mastológica Lomas), en el periodo de agosto del 2011 a noviembre del 2015. El universo de la muestra fueron todas las pacientes con diagnósticos de cáncer de mama en estadio temprano (i y ii) sometidas a la prueba genómica MammaPrint®.
En el estudio fueron incluidas las pacientes con diagnóstico de cáncer de mama en etapa clínica i-ii que se hayan sometido al estudio genómico MammaPrint®. No se incluyó a los pacientes cuyo resultado se encuentre pendiente al momento de la investigación.
Las variables dependientes de este estudio fueron: el estadio clínico del cáncer de mama, la solvencia económica para realización del estudio, el tipo histológico del cáncer de mama, los marcadores por inmunohistoquímica, la presencia de ganglios afectados y el tamaño del tumor. Las variables independientes fueron la edad y la ocupación.
Para el análisis estadístico se utilizó el programa informático SPSS versión 15.0 para MAC (SPSS; Chicago, IL, EE. UU.).
ResultadosEl periodo de recolección de datos comprendió a pacientes las cuales se realizaron el estudio desde agosto del año 2011 hasta noviembre del 2015, al que se le dará seguimiento por 10 años, con intervalos de revisión cada 5 años (periodo mínimo para valoración de supervivencia libre de enfermedad).
Se localizaron y cotejaron 27 expedientes, con 28 casos (uno de manera bilateral); se descartó únicamente a una paciente por el número de ganglios que presentaba (6); los demás presentaban los requisitos mencionados en las variables, es decir, diagnóstico de cáncer de mama en estadio temprano (i o ii), tamaño tumoral menor a 5cm y sin afectación ganglionar por clínica.
Las edades correspondieron de 38 a 78 años de edad, con una mediana de 52 años. En lo referente al tipo histológico, se encontraron 3 variantes: ductal infiltrante, lobulillar infiltrante y mixto (lobulillar 70%, ductal 30%) (tabla 1).
Se encontraron 4 subtipos biológicos luminal A, luminal B, basal y HER2, siendo el luminal A el más común (tabla 2).
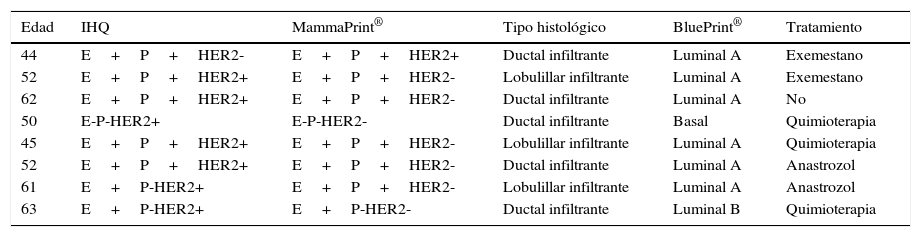
Se identificaron discrepancias en resultados de marcadores de HER2 obtenidos por inmunohistoquímica en comparación con los obtenidos por MammaPrint® en 8 expedientes; en estos casos debemos tener en cuenta que el estudio MammaPrint® incluye un estudio llamado TargetPrint® donde es evaluado el HER2/neu a nivel de ARN y al ser negativo se consideró que estas pacientes eran negativas (probablemente, por un error de lectura de la inmunohistoquímica contra la realización de una técnica ineficiente del mismo), por lo que se decidió no dar tratamiento con trastuzumab ni hacer estudios complementarios (tabla 3).
Discrepancia de resultados encontrada entre inmunohistoquímica y MammaPrint®
| Edad | IHQ | MammaPrint® | Tipo histológico | BluePrint® | Tratamiento |
|---|---|---|---|---|---|
| 44 | E+P+HER2- | E+P+HER2+ | Ductal infiltrante | Luminal A | Exemestano |
| 52 | E+P+HER2+ | E+P+HER2- | Lobulillar infiltrante | Luminal A | Exemestano |
| 62 | E+P+HER2+ | E+P+HER2- | Ductal infiltrante | Luminal A | No |
| 50 | E-P-HER2+ | E-P-HER2- | Ductal infiltrante | Basal | Quimioterapia |
| 45 | E+P+HER2+ | E+P+HER2- | Lobulillar infiltrante | Luminal A | Quimioterapia |
| 52 | E+P+HER2+ | E+P+HER2- | Ductal infiltrante | Luminal A | Anastrozol |
| 61 | E+P-HER2+ | E+P+HER2- | Lobulillar infiltrante | Luminal A | Anastrozol |
| 63 | E+P-HER2+ | E+P-HER2- | Ductal infiltrante | Luminal B | Quimioterapia |
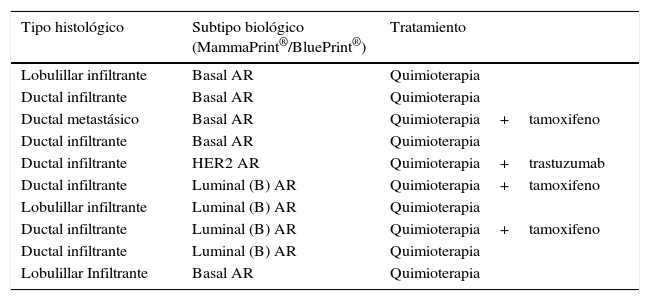
Se identificaron 10 casos (37%) considerados de alto riesgo, de subtipo luminal, basal y HER2, siendo el más común el tipo basal (tabla 4).
Casos de alto riesgo
| Tipo histológico | Subtipo biológico (MammaPrint®/BluePrint®) | Tratamiento |
|---|---|---|
| Lobulillar infiltrante | Basal AR | Quimioterapia |
| Ductal infiltrante | Basal AR | Quimioterapia |
| Ductal metastásico | Basal AR | Quimioterapia+tamoxifeno |
| Ductal infiltrante | Basal AR | Quimioterapia |
| Ductal infiltrante | HER2 AR | Quimioterapia+trastuzumab |
| Ductal infiltrante | Luminal (B) AR | Quimioterapia+tamoxifeno |
| Lobulillar infiltrante | Luminal (B) AR | Quimioterapia |
| Ductal infiltrante | Luminal (B) AR | Quimioterapia+tamoxifeno |
| Ductal infiltrante | Luminal (B) AR | Quimioterapia |
| Lobulillar Infiltrante | Basal AR | Quimioterapia |
Cabe mencionar que el subtipo biológico obtenido por la combinación de MammaPrint®/BluePrint® fue un factor indispensable para la instauración de tratamiento adyuvante con quimioterapia, el cual se implementó independientemente de su tipo biológico y sobre la base de las recomendaciones proporcionadas por el estudio genómico evaluando el riesgo de recurrencia con y sin tratamiento adyuvante. Hasta ahora, del total de pacientes comprendidas en el estudio no se han encontrado datos de recidiva por un intervalo de 5 años y esto ha sido igual para pacientes con bajo y alto riesgo.
DiscusiónA pesar de que el número de casos es relativamente pequeño, representa un estudio realizado en nuestra población lo que es una experiencia enriquecedora, ya que es pionero en nuestro país. Al ser un estudio de costo elevado, y a pesar de que es cubierto por la mayoría de los seguros de gastos médicos mayores, existe una limitante de tipo económico en la que algunas pacientes que son candidatas a realizárselo y recibir los beneficios de sus resultados, no tienen acceso al mismo. En este grupo de mujeres con cáncer de mama temprano, sin recursos para sufragarlo, se siguen utilizando criterios tradicionales para la decisión de recibir o no quimioterapia, muchas de las cuales no tendrían que ser sometidas a esta terapéutica, por lo tanto, se debería de implementar alguna estrategia para su incorporación a los sistemas nacionales de salud.
La determinación de las características genéticas y sus alteraciones en el cáncer de mama son de fundamental importancia para una mejor identificación del riesgo, así como una mejor selección de los tratamientos. Es de particular interés de acuerdo con los criterios tradicionales de buen pronóstico, como son la presencia de receptores hormonales (estrógenos y progesterona) positivos, ganglios negativos y el tamaño del tumor, estas pacientes no hubiesen recibido beneficio con un tratamiento de quimioterapia. No obstante, si el resultado del MammaPrint® los clasifica dentro del grupo de alto riesgo deberán recibir quimioterapia por la posibilidad de recurrencia (el esquema de quimioterapia se diseña individualmente de acuerdo con el estudio del panel mamario obtenido por la inmunohistoquímica al tejido tumoral, que incluye receptores de estrógenos, receptores de progesterona, HER2neu, Ki-67, p53), siendo este el principal beneficio en la utilización de esta firma genómica. Los pacientes con bajo riesgo presentan receptores de estrógenos y/o progesterona positivos, y recibirán terapia hormonal (tamoxifeno en mujeres premenopáusicas o inhibidores de aromatasa en las posmenopáusicas).
Tomando en cuenta que se trata de un estudio prospectivo, el cual requiere mayor tiempo de seguimiento para madurar las conclusiones finales, se demuestra la utilidad del estudio genómico para la detección de los subtipos de alto riesgo y la subsecuente instauración de tratamiento adyuvante personalizado, así como el cálculo de recurrencia en pacientes con diagnóstico de cáncer de mama en estadio temprano. Hasta el momento, no se han presentado casos de recurrencia en las pacientes estudiadas.
ConclusiónMammaPrint® es un estudio eficaz para evaluar el riesgo de recurrencia de cáncer de mama en etapa temprana, así como para proporcionar información esencial del tipo y subtipo específico de cada caso. Por lo tanto, se considera una herramienta de vital importancia para la toma de decisión de administración de quimioterapia adyuvante a un paciente en concreto, evitar tratamientos innecesarios, mejorar la calidad de vida y ahorrar costos, o en caso contrario, en pacientes con datos de alto riesgo, brindar los beneficios de la terapia antineoplásica para reducir la probabilidad de fracaso a mediano y largo plazo. Todo esto es parte de lo que hoy en día se considera la medicina personalizada, lo cual significa un impacto directo en la reducción de la tasa de mortalidad de esta enfermedad.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.