La historia de la cirugía laparoscópica en afecciones ginecológicas creció con los avances de Semm, el perfeccionamiento de instrumentos, equipos y energías, que permitió el desarrollo en todas las áreas quirúrgicas, incluyendo la Oncología.
ObjetivoPresentar la experiencia inicial en el tratamiento de dolencias benignas y malignas ginecológicas por laparoscopia, en el Hospital Regional de Alta Especialidad de Oaxaca.
Material y métodosSe analizaron 44 casos distribuidos en: histerectomía radical tipo III por cáncer cervicouterino invasivo, histerectomía tipo I por cáncer cervicouterino in situ, histerectomía extrafascial por enfermedad benigna, rutina de endometrio, rutina de ovario y salpingooforectomía. Variables: edad, índice de masa corporal (IMC), tiempo quirúrgico, sangrado, complicaciones transoperatorias y postoperatorias, conversión, estancia hospitalaria y reporte de anatomía patológica.
ResultadosHisterectomía tipo III; edad 40.2 años, IMC 25.8kg/m2, sangrado 238ml, tiempo quirúrgico 228min, estancia hospitalaria 2.6 días, sin complicaciones transoperatorias o postoperatorias, tamaño del tumor 1.1cm, 14 ganglios disecados, borde vaginal y parametrios negativos. Histerectomía tipo I por cáncer cervicouterino in situ: 51 años, IMC 23.8kg/m2, sangrado 283ml, tiempo quirúrgico 127min, útero de 9cm, estancia hospitalaria 2 días, una conversión por lesión de arteria ilíaca externa con sangrado de 1,500ml. Rutina de endometrio: 50.3 años, IMC 30.3kg/m2, sangrado 83ml, tiempo quirúrgico 180min, útero 12.6cm, estancia hospitalaria 2.3 días, sin complicaciones.
ConclusiónEl manejo de afecciones benignas y malignas pélvicas por laparoscopia es factible, seguro, con menor estancia hospitalaria y una recuperación más pronta de las actividades cotidianas.
The history of laparoscopic surgery in gynaecological diseases progressed with the advances of Semm, as well as with the development of tools, equipment, and energy that led to its development in all surgical areas, including oncology.
ObjectiveTo present the initial experience in the laparoscopic treatment of benign and malignant gynaecological disease in the Hospital Regional de Alta Especialidad in Oaxaca.
Material and methodsAn analysis was performed on a total of 44 cases, distributed into: type III radical hysterectomy for invasive cervical cancer, hysterectomy type I cervical cancer in situ, extrafascial hysterectomy for benign disease, routine endometrium, ovary and routine salpingo-oophorectomy. The variables included age, BMI, surgical time, bleeding, intraoperative and postoperative complications, conversion, hospital stay, and pathology report.
ResultsHysterectomy type III; age 40.2 years, BMI 25.8kg/m2, 238ml bleeding, operative time 228min, 2.6-day hospital stay, intraoperative or postoperative complications, tumour size 1.1cm, 14 lymph nodes dissected, vaginal and negative parametrical edge. Type I hysterectomy cervical cancer in situ: 51 years, BMI 23.8kg/m2, 80ml bleeding, operative time 127minutes, uterus of 9cm, length of stay of 2 days, a conversion by external iliac artery injury, with bleeding of 1500ml. Routine endometrium: 50.3 years, BMI 30.3kg/m2, 83ml bleeding, operative time 180minutes, uterus 12.6cm, length of stay 2.3 days, no complications.
ConclusionThe management of benign and malignant pelvic diseases using laparoscopy is feasible and safe, with shorter hospital stays and a prompt recovery to daily activities.
La necesidad del ser humano por realizar el diagnóstico de enfermedades en forma más exacta lo motivó a introducir métodos invasivos de exploración de órganos abdominales.
La exploración del interior de nuestro organismo se inicia con la introducción del cistoscopio por Nitze en la Real e Imperial Sociedad de Medicina de Viena en 1879, instrumento mejorado en 1886 por Leiter, al adaptarle una pequeña lámpara incandescente de Edison1.
El desarrollo de la laparoscopia abdominal lo inició Kelling, en Dresde, quien utilizó el cistoscopio urológico descrito por Nitze, que introdujo a través de un orificio abierto en la pared abdominal de un perro, con la finalidad de inspeccionar el contenido intestinal. A esta técnica de exploración la denominó «celioscopia» y, presentó los resultados en el Congreso de la Sociedad Médica y de Biología Germana, en Hamburgo, en septiembre de 19012.
Ott, un ginecólogo de San Petersburgo, describió la «ventroscopia» con la que visualizaba el interior de la cavidad a través de una cánula iluminada por un fotóforo frontal. En 1910, en Estocolmo, Jacobeus3 empleó el cistoscopio en humanos, lo introdujo en el abdomen a través de un trocar, tras distender la cavidad con agua o aire, para explorar su interior, y denominó al método «laparoscopia», técnica que reprodujo en el tórax. En 1911 Berheim, de Estados Unidos, publico¿ó un trabajo titulado: «Organoscopia: cistoscopia de la cavidad abdominal»4. En 1916, Goetze desarrolló una aguja de punción para mejorar la insuflación de aire; Ordoff, en 1920, perfeccionó la punta y la convirtió en piramidal para facilitar su penetración; Stone desarrolló un dispositivo valvular en el trocar para impedir la salida del gas. En 1929, Kalk creó la visión óptica de 135° con visión oblicua; Zollikofer, en 1934, utilizó dióxido de carbono en lugar de aire para la insuflación abdominal, de modo que disminuye el riesgo de embolia gaseosa e irritación peritoneal5.
En 1938 el húngaro Veress, médico internista de Viena, diseñó una aguja atraumática para la creación de neumotórax, que posee una vaina externa con la punta en bisel y un estilete interno romo, que se exterioriza en el momento de penetrar en la cavidad abdominal, con lo que evita dañar los órganos internos, razón por la cual fue adoptada inmediatamente para la producción del neumoperitoneo6.
Semm6, un ginecólogo e ingeniero de Kiev, describió el insuflador automático, y en 1966, comenzó la realización de procedimientos quirúrgicos bien elaborados; además, diseñó un gran número de instrumentos de corte, coagulación, ligadura y sutura para poder llevar a cabo esta cirugía, por lo que se le considera el padre de la laparoscopia, y desde ese momento, la laparoscopia entró de lleno en el campo de la Ginecología6. La historia de la histerectomía se remonta al siglo V a. C. ya que existían referencias de la realización de dicho procedimiento. En el siglo II d. C. en época de Hipócrates se dice que Soranus de Éfeso amputó un útero por vía vaginal. En 1517 en Italia, Berengario de Capri realizó una histerectomía vaginal y desde 1825 se encuentran los primeros datos de intentos de ejecución de histerectomías. Fue en 1846 cuando Bellinger realizó la primera histerectomía abdominal programada.
Una vez que, a principios del año 1900, la tasa de mortalidad fue menor del 1%, la histerectomía comenzó a ser una opción en el tratamiento de enfermedades y síntomas ginecológicos y rompió el tabú histórico impuesto por Johnson, director del London Medical Chirurgical Review, quien declaró en 1825: «Nosotros consideramos que la extirpación del útero no asociada con protrusión o inversión previas representa una de las operaciones más crueles e impracticables concebidas o ejecutadas por el hombre7. No es nuestra intención desalentar intervenciones quirúrgicas audaces y novedosas, pero existe un límite que sería imprudente sobrepasar».
Esta técnica quirúrgica ha tenido una evolución vertiginosa. En 1984, Semm6 realizó la primera histerectomía laparoscópica asistida vía vaginal; luego la primera histerectomía totalmente laparoscópica fue realizada en Pensilvania en enero de 1988 por Reich et al., y publicada en 19897. Más tarde, el mismo doctor Semm, de Alemania, publicó los resultados de una técnica supracervical, conocida como «classical abdominal Semm histerectomy»8.
La cirugía oncológica en un principio era rehuida por algunos, por el riesgo de diseminación de células tumorales y por la necesidad de desmenuzar el tumor para su extracción, aunque este paradigma cambió cuando Coptcoal, en 1991, presentó en el III Congreso de Mínima Invasión en Boston una nefrectomía radical por un carcinoma9, y Ono et al.10 en 1993, 2 casos de nefrectomía por carcinoma renal sin destrozar el riñón, que se extrajo con la ayuda de una pequeña incisión.
La histerectomía representa la cirugía ginecológica más frecuentemente realizada en Estados Unidos, con 555,000, y en Reino Unido, con 100,000 procedimientos anualmente realizados11.
En Estados Unidos en 1997, el 63% de las histerectomías se realizaban abiertas y solo el 9.9% por vía laparoscópica, y el 1.5% era radical laparoscópica por enfermedad maligna; para el 2001 se elevó a 41 y 32%, respectivamente12.
La histerectomía radical laparoscópica es actualmente la cirugía realizada con mayor frecuencia, con un índice de complicaciones intraoperatorias como: sangrado, lesión vesical y ureteral similar a las del abordaje abierto, con ventajas como: menor dolor postquirúrgico, tiempo de recuperación más rápido13, menor índice de transfusiones sanguíneas. Sin embargo, se ha reportado mayor tiempo quirúrgico14. Con respecto a los resultados patológicos, el análisis retrospectivo de Taylor no mostró diferencias con respecto al número de ganglios y bordes quirúrgicos positivos. Parck et al.15, en un análisis retrospectivo de 99 pacientes en etapas clínicas IA1, IA2, obtuvieron resultados oncológicos y complicaciones intraoperatorias similares. Spirtos et al.16 evaluaron a 78 pacientes. Otro autor con Lee et al.17 evaluaron a 24 pacientes con etapas clínicas IA2 y IBI; en ambos estudios se realizó histerectomía total abdominal radical laparoscópica tipo III con linfadenectomía pélvica y paraaórtica, con seguimiento oncológico a 3 y 5 años, con resultado similar al de la cirugía abierta. Por otro lado, Yan et al.18, en un seguimiento a 12 años, demostraron que la supervivencia depende, al igual que la cirugía abierta, de la biología tumoral y no del procedimiento realizado. La extensión de la radicalidad (parametrios, borde vaginal) tampoco se ve comprometida de acuerdo con el estudio de Ghezzi et al.19 que trata específicamente de las complicaciones de las vías urinarias, como lesión vesical o ureteral. En la retención aguda tampoco hubo diferencia estadística en el grupo laparoscópico vs. abierto20. Incluso Choi et al., en Corea21, realizaron un estudio que comparaba la histerectomía total abdominal radical totalmente laparoscópica con la histerectomía radical laparoscópica asistida vía vaginal, con resultados similares, pero con una recuperación más rápida y menor sangrado para el procedimiento totalmente laparoscópico. Lo anterior convierte a dicho procedimiento en una opción segura y viable de realizar22,23.
Por otro lado, en un estudio se determinó que el número de casos para una curva de aprendizaje es de 40, y para disminuir los tiempos quirúrgicos, de 57. Esta curva se acorta con un programa de entrenamiento básico24, al iniciar con procedimientos benignos y con la experiencia de haber realizado procedimientos abiertos previamente, aunque este último punto es más debatible25. El porcentaje de conversión del procedimiento laparoscópico al abierto en un análisis de 260 pacientes consecutivos, independientemente del índice de masa corporal (IMC), edad, cirugía previa, tamaño del útero, y tumor fue de 1.5%26,27.
En el Hospital Regional de Alta Especialidad de Oaxaca la afección del tracto genital femenino es de las más frecuentes, y de ellas, el cáncer cervicouterino predomina. Se inició en agosto de 2013 el programa de cirugía ginecooncológica laparoscópica (o de mínima invasión), con la asesoría de un cirujano oncólogo del Instituto Nacional de Cancerología y perito en la materia.
ObjetivoPresentar la experiencia inicial de 44 casos con enfermedad benigna y maligna ginecológica, tratados mediante cirugía de mínima invasión.
Material y métodosSe evaluaron en forma consecutiva a partir de agosto de 2013 hasta octubre del 2014, 44 casos de pacientes tratadas mediante cirugía laparoscópica por enfermedad ginecooncológica. Se recabaron los datos generales como: edad, peso, talla e índice de masa corporal (IMC), diagnóstico preoperatorio, días de estancia hospitalaria, tiempo quirúrgico, sangrado, tamaño del útero, conversión y causa de la conversión en su caso, diagnóstico postquirúrgico, complicaciones intraoperatorias, postoperatorias, con un seguimiento a 30 días como tiempo mínimo para ser incluidas, y el reporte de anatomía patológica: histología, número de ganglios, parametrios y bordes quirúrgicos.
Criterios de inclusiónSe incluyó a todas las pacientes de 18 años en adelante, con cualquier enfermedad benigna (masas anexiales, miomatosis uterina de pequeños, medianos y grandes elementos), maligna (cáncer cervicouterino in situ, cáncer cervicouterino microinvasivo [IA1, IA2] invasivo [IB1] con tamaño tumoral de 2cm o menos, cáncer de endometrio en etapas tempranas, sarcoma uterino) o afección sospechosa de malignidad (tumor pélvico: ovario, hiperplasia endometrial simple o compleja con o sin atipia).
Criterios de exclusiónTumores mayores de 2cm en cuello uterino, neuropatía o cardiopatía que contraindicara anestesia general.
Criterios de eliminaciónPacientes en que se inició el procedimiento quirúrgico laparoscópico, pero se convirtió el procedimiento por presentar datos de enfermedad avanzada, con adenopatías retroperitoneales, carcinomatosis peritoneal e implantes en epiplón supramesocólico.
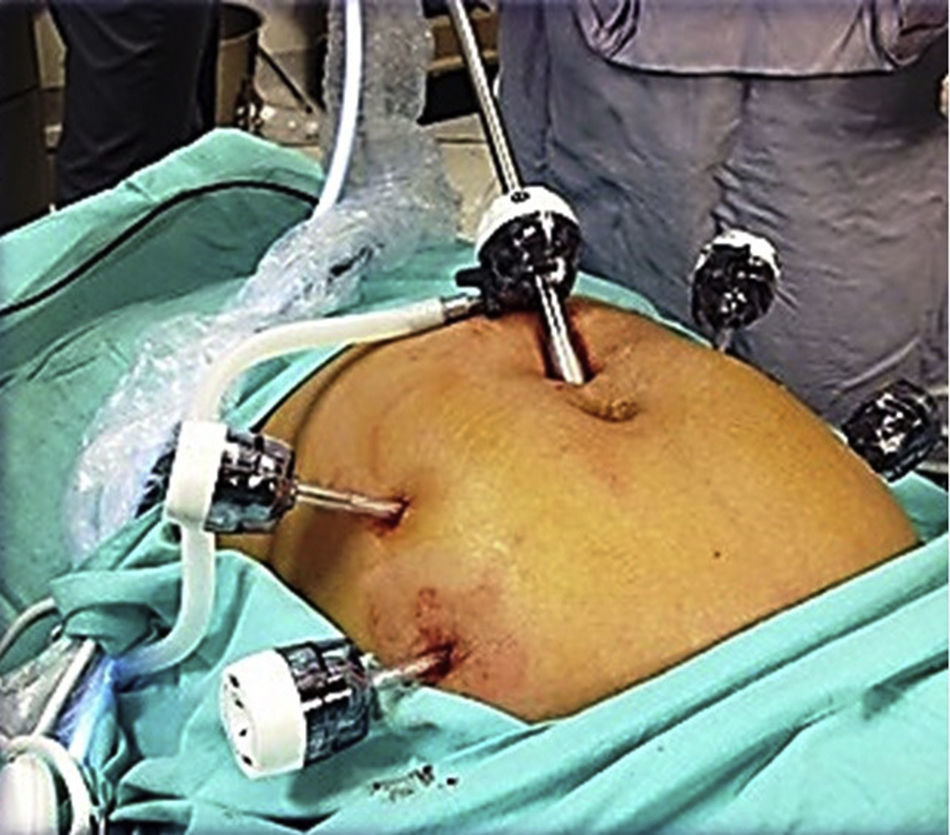
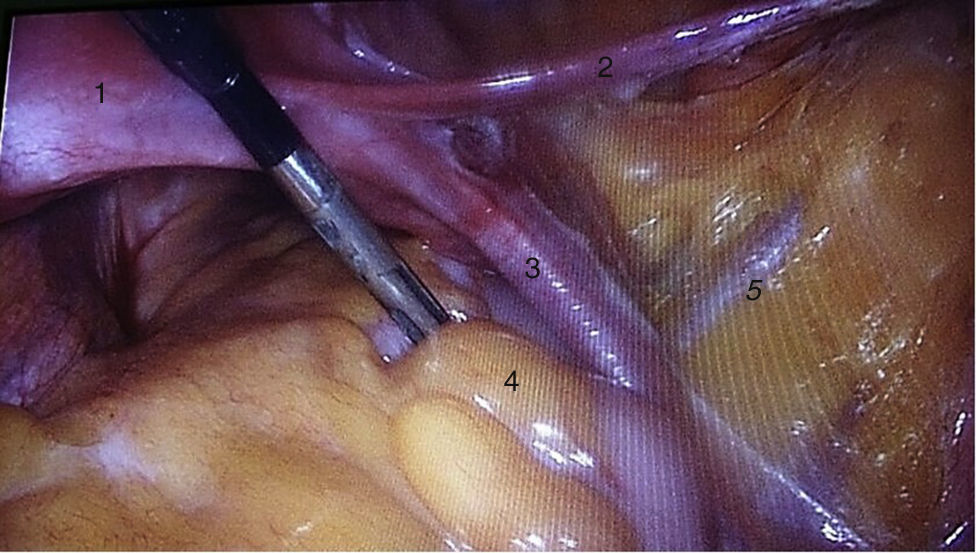
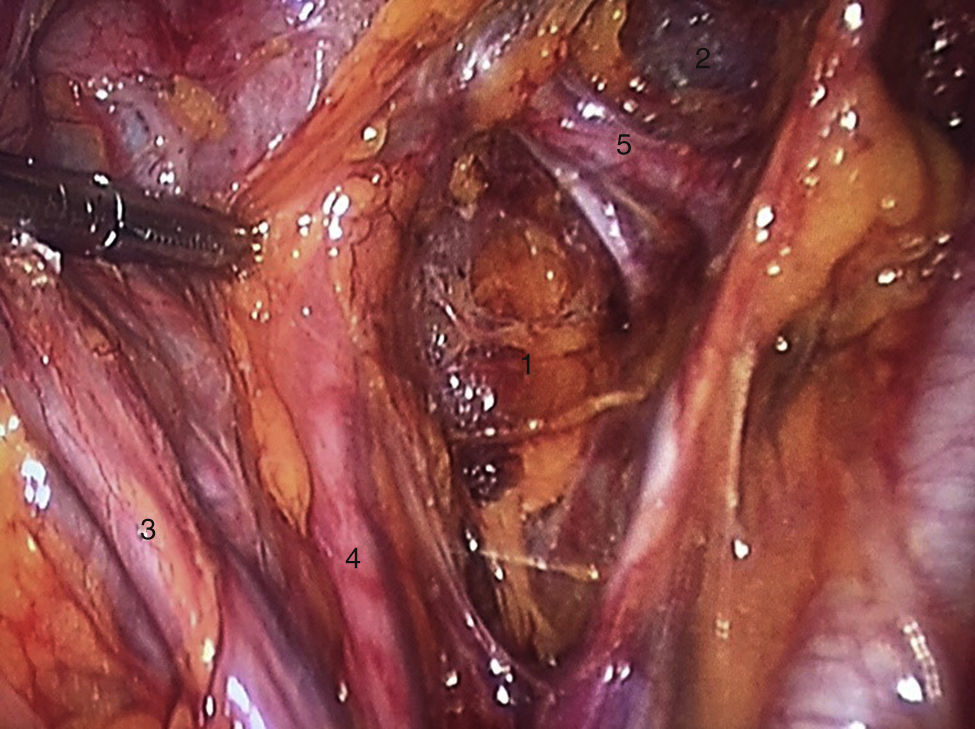
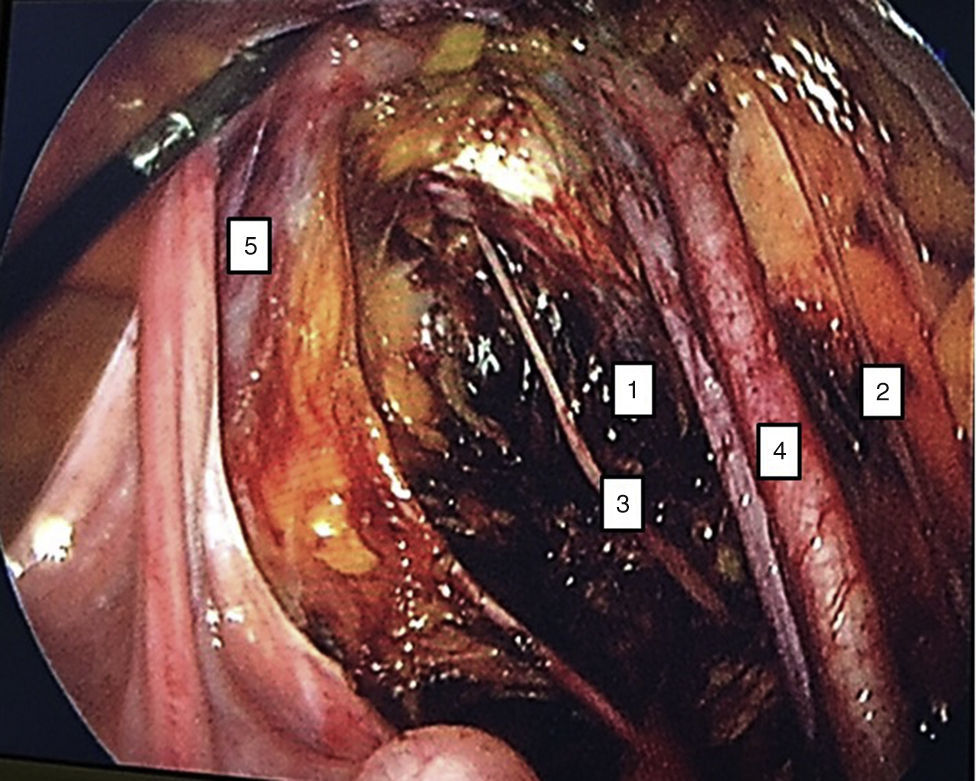
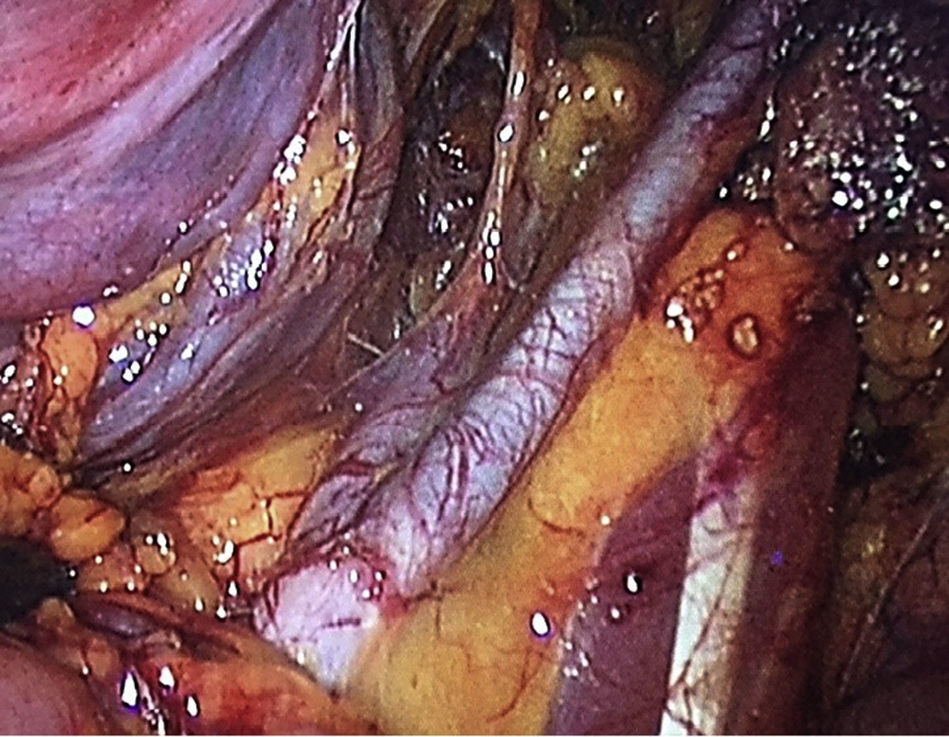
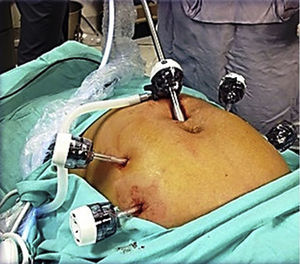
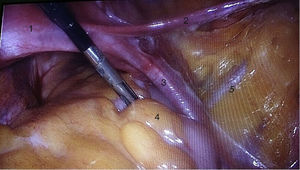
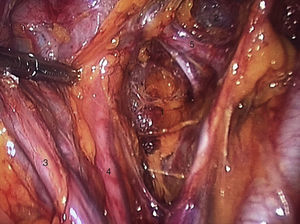
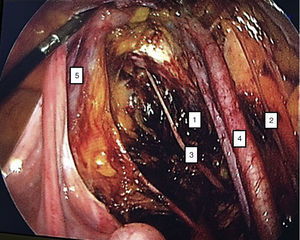
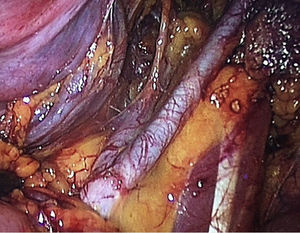
Para la estandarización de la técnica quirúrgica se realizaron los 2 procedimientos iniciales bajo la supervisión de un cirujano oncólogo con experiencia en laparoscopia. La técnica quirúrgica de la histerectomía total abdominal laparoscópica es con 5 trocares colocados de la siguiente manera: puerto supraumbilical a 2cm de la cicatriz umbilical, de 10mm para la cámara con visión de 30°, 4 trocares de 5mm, 2 colocados en fosas ilíacas a 2 cm de la espina ilíaca anterior y superior, y 2 colocados en los flancos derecho e izquierdo (fig. 1). La energía utilizada en los primeros 5 casos, fue: Ligasure Atlas y en el resto de los casos energía monopolar y Enseal, auxiliados por manipulador uterino Ascleaup o Clermont Ferrand. El procedimiento comenzó con la identificación de estructuras anatómicas (fig. 2), creación del espacio paravesical y pararrectal (fig. 3), y evaluación del parametrio (fig. 4). La linfadenectomía pélvica es con energía monopolar, respetando los límites convencionales (vena circunfleja, nervio obturador, uréter y 2cm por arriba de la bifurcación de los vasos ilíacos comunes) (fig. 5). La extracción de la pieza quirúrgica es vía vaginal, con cierre de la cúpula vaginal mediante sutura continua con vycryl del 0 o 1 intracorpóreo (fig. 6). En el caso de masas anexiales, el manejo inicial es con 3 trocares: uno de 10mm umbilical y 2 de 5mm en región de fosa ilíaca derecha e izquierda.
Se analizó a 44 pacientes, tratadas mediante diversos procedimientos ginecooncológicos y agrupadas de la siguiente manera: 9 histerectomías radicales por cáncer cervicouterino invasivo, 11 histerectomías simples por enfermedad benigna del útero (miomatosis), 7 histerectomía tipo I por cáncer cervicouterino in situ, 12 ooforectomías por masas anexiales benignas, 3 rutinas de endometrio, una histerectomía más linfadenectomía pélvica bilateral por sarcoma uterino y un complemento de rutina de ovario.
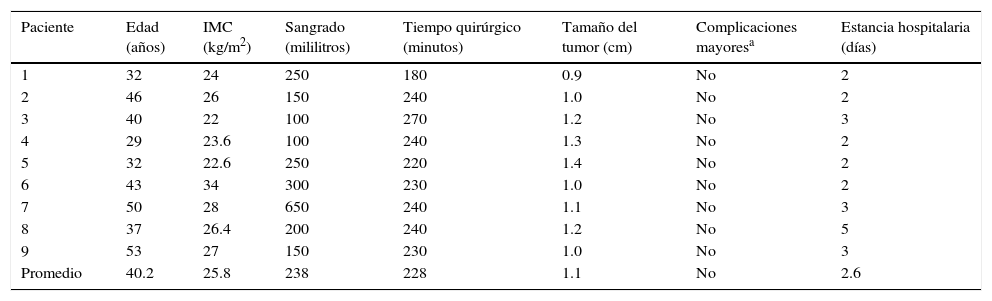
Del grupo de histerectomía radical el promedio de edad fue de 40.2 años, con un IMC de 25.8kg/m2, sangrado de 238ml, tiempo quirúrgico de 228 min, tamaño del útero de 8.4cm, estancia hospitalaria 2.6 días, no hubo complicaciones transoperatorias ni postoperatorias. El reporte histopatológico fue de 4 pacientes con cáncer invasivo con un tamaño del tumor de 1 a 1.2cm, tipo histológico 2 epidermoide, 2 adenocarcinomas de 12 a 14 ganglios pélvicos disecados, borde vaginal 0.8/1.1cm negativo, parametrios negativos. Solo una paciente requirió tratamiento adyuvante por un ganglio positivo, 2 pacientes con cáncer cervicouterino microinvasivo IA2, 13 ganglios pélvicos disecados, borde vaginal y parametrios negativos, 3 pacientes con diagnóstico de cáncer cervicouterino in situ (pacientes con diagnóstico externo de cáncer invasivo por biopsia o cono externo, y en las que no fue factible la revisión de laminillas, y con diagnóstico citocolposcópico de carcinoma invasivo) (tabla 1).
Histerectomía radical laparoscópica
| Paciente | Edad (años) | IMC (kg/m2) | Sangrado (mililitros) | Tiempo quirúrgico (minutos) | Tamaño del tumor (cm) | Complicaciones mayoresa | Estancia hospitalaria (días) |
|---|---|---|---|---|---|---|---|
| 1 | 32 | 24 | 250 | 180 | 0.9 | No | 2 |
| 2 | 46 | 26 | 150 | 240 | 1.0 | No | 2 |
| 3 | 40 | 22 | 100 | 270 | 1.2 | No | 3 |
| 4 | 29 | 23.6 | 100 | 240 | 1.3 | No | 2 |
| 5 | 32 | 22.6 | 250 | 220 | 1.4 | No | 2 |
| 6 | 43 | 34 | 300 | 230 | 1.0 | No | 2 |
| 7 | 50 | 28 | 650 | 240 | 1.1 | No | 3 |
| 8 | 37 | 26.4 | 200 | 240 | 1.2 | No | 5 |
| 9 | 53 | 27 | 150 | 230 | 1.0 | No | 3 |
| Promedio | 40.2 | 25.8 | 238 | 228 | 1.1 | No | 2.6 |
IMC: índice de masa corporal.
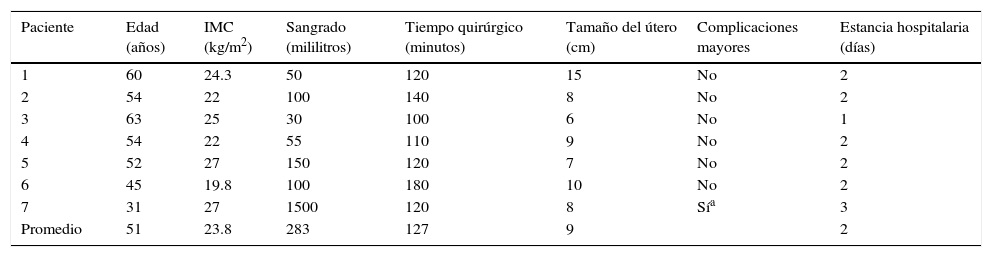
Del grupo de histerectomía tipo I por diagnóstico de cáncer cervicouterino in situ, el promedio de edad fue de 51 años, con un IMC de 23.8 kg/m2, sangrado de 283ml, tiempo quirúrgico de 127 min, tamaño del útero de 9cm, estancia hospitalaria de 2 días. Una paciente presentó conversión por lesión de la arteria ilíaca externa con sangrado de 1,500ml. No hubo complicaciones como lesión a vejiga, recto o uréter. El reporte de enfermedad en todos los casos confirmó el diagnóstico in situ (tabla 2).
Histerectectomía simple
| Paciente | Edad (años) | IMC (kg/m2) | Sangrado (mililitros) | Tiempo quirúrgico (minutos) | Tamaño del útero (cm) | Complicaciones mayores | Estancia hospitalaria (días) |
|---|---|---|---|---|---|---|---|
| 1 | 60 | 24.3 | 50 | 120 | 15 | No | 2 |
| 2 | 54 | 22 | 100 | 140 | 8 | No | 2 |
| 3 | 63 | 25 | 30 | 100 | 6 | No | 1 |
| 4 | 54 | 22 | 55 | 110 | 9 | No | 2 |
| 5 | 52 | 27 | 150 | 120 | 7 | No | 2 |
| 6 | 45 | 19.8 | 100 | 180 | 10 | No | 2 |
| 7 | 31 | 27 | 1500 | 120 | 8 | Sía | 3 |
| Promedio | 51 | 23.8 | 283 | 127 | 9 | 2 |
IMC: índice de masa corporal.
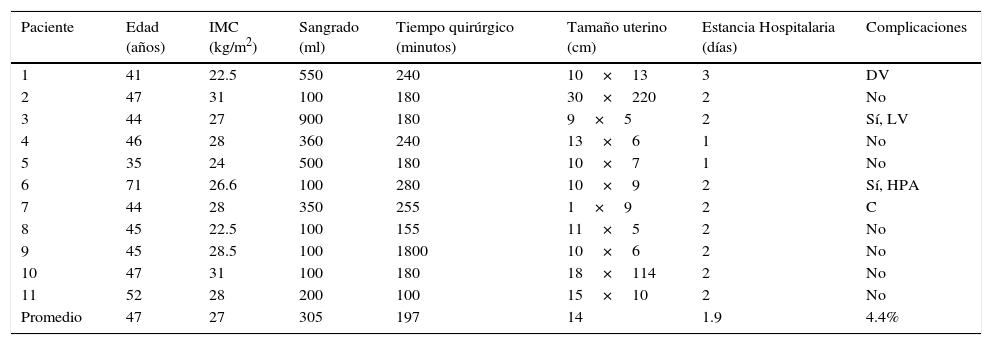
Del grupo de histerectomía tipo I por diagnóstico de miomatosis uterina, el promedio de edad fue de 47 años, con un IMC de 27kg/m2, sangrado de 305ml, tiempo quirúrgico de 197 min, tamaño del útero 14cm, estancia hospitalaria de 1.9 días. En este grupo se presentaron 2 conversiones: por perforación del cuerpo uterino por el manipulador uterino, que no permitió su movilización, y por desgarro de la arteria uterina con sangrado de 900ml transoperatorio. Una paciente presentó desgarro parcial de la vejiga, sin llegar a la rotura total, que fue reparado mediante laparoscopia, y finalmente, una paciente presentó hematoma de pared abdominal extenso a las 2 semanas de postoperada, y a las 4 semanas presentó prolapso de asas intestinales a través de la vagina. No hubo complicaciones a órganos como vejiga, recto ni uréter (tabla 3).
Tumor benigno del cuerpo del útero (miomatosis, hiperplasia, pólipo)
| Paciente | Edad (años) | IMC (kg/m2) | Sangrado (ml) | Tiempo quirúrgico (minutos) | Tamaño uterino (cm) | Estancia Hospitalaria (días) | Complicaciones |
|---|---|---|---|---|---|---|---|
| 1 | 41 | 22.5 | 550 | 240 | 10×13 | 3 | DV |
| 2 | 47 | 31 | 100 | 180 | 30×220 | 2 | No |
| 3 | 44 | 27 | 900 | 180 | 9×5 | 2 | Sí, LV |
| 4 | 46 | 28 | 360 | 240 | 13×6 | 1 | No |
| 5 | 35 | 24 | 500 | 180 | 10×7 | 1 | No |
| 6 | 71 | 26.6 | 100 | 280 | 10×9 | 2 | Sí, HPA |
| 7 | 44 | 28 | 350 | 255 | 1×9 | 2 | C |
| 8 | 45 | 22.5 | 100 | 155 | 11×5 | 2 | No |
| 9 | 45 | 28.5 | 100 | 1800 | 10×6 | 2 | No |
| 10 | 47 | 31 | 100 | 180 | 18×114 | 2 | No |
| 11 | 52 | 28 | 200 | 100 | 15×10 | 2 | No |
| Promedio | 47 | 27 | 305 | 197 | 14 | 1.9 | 4.4% |
C: conversión; DV: despulimiento de vejiga; HPA: hemorragia de pared abdominal; IMC: índice de masa corporal; LV: lesión vascular.
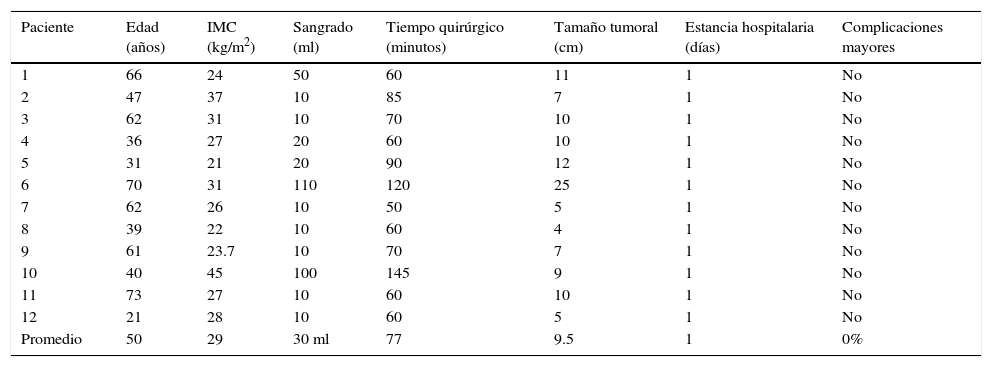
Del grupo de salpingooforectomía por masa anexial, el promedio de edad fue de 50 años, con un IMC de 29kg/m2, sangrado de 30ml, tiempo quirúrgico de 77 min, tamaño del quiste de 9.5cm, estancia hospitalaria de un día. En este grupo no hubo complicaciones transoperatorias ni complicaciones postquirúrgicas a los 30 días de seguimiento; el reporte histopatológico en todos los casos fue benigno y un solo caso fue absceso tuboovárico (tabla 4).
Salpingooforectomía laparoscópica
| Paciente | Edad (años) | IMC (kg/m2) | Sangrado (ml) | Tiempo quirúrgico (minutos) | Tamaño tumoral (cm) | Estancia hospitalaria (días) | Complicaciones mayores |
|---|---|---|---|---|---|---|---|
| 1 | 66 | 24 | 50 | 60 | 11 | 1 | No |
| 2 | 47 | 37 | 10 | 85 | 7 | 1 | No |
| 3 | 62 | 31 | 10 | 70 | 10 | 1 | No |
| 4 | 36 | 27 | 20 | 60 | 10 | 1 | No |
| 5 | 31 | 21 | 20 | 90 | 12 | 1 | No |
| 6 | 70 | 31 | 110 | 120 | 25 | 1 | No |
| 7 | 62 | 26 | 10 | 50 | 5 | 1 | No |
| 8 | 39 | 22 | 10 | 60 | 4 | 1 | No |
| 9 | 61 | 23.7 | 10 | 70 | 7 | 1 | No |
| 10 | 40 | 45 | 100 | 145 | 9 | 1 | No |
| 11 | 73 | 27 | 10 | 60 | 10 | 1 | No |
| 12 | 21 | 28 | 10 | 60 | 5 | 1 | No |
| Promedio | 50 | 29 | 30 ml | 77 | 9.5 | 1 | 0% |
IMC: índice de masa corporal.
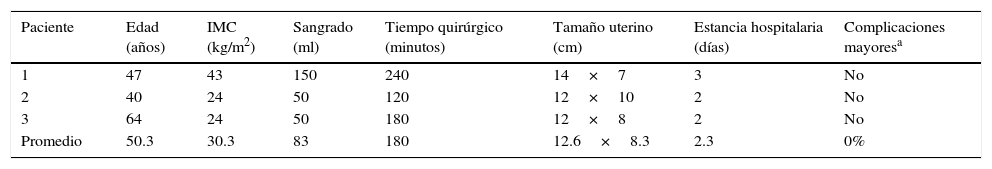
Del grupo de cáncer de endometrio, el promedio de edad fue 50.3 años, con un IMC de 30.3kg/m2, sangrado 83ml, tiempo quirúrgico 180 min, tamaño del útero de 12.6cm, estancia hospitalaria de 2.3 días, sin conversiones ni complicaciones. El reporte histopatológico de 2 pacientes con tipo histológico endometriode, una con enfermedad limitada a endometrio y 12 ganglios pélvicos negativos; otra con invasión menor del 50% de afección al miometrio y 14 ganglios pélvicos negativos. El último tipo fue carcinosarcoma con afección mayor al 50% del miometrio y 7 de 14 ganglios pélvicos positivos (tabla 5).
Rutina de endometrio
| Paciente | Edad (años) | IMC (kg/m2) | Sangrado (ml) | Tiempo quirúrgico (minutos) | Tamaño uterino (cm) | Estancia hospitalaria (días) | Complicaciones mayoresa |
|---|---|---|---|---|---|---|---|
| 1 | 47 | 43 | 150 | 240 | 14×7 | 3 | No |
| 2 | 40 | 24 | 50 | 120 | 12×10 | 2 | No |
| 3 | 64 | 24 | 50 | 180 | 12×8 | 2 | No |
| Promedio | 50.3 | 30.3 | 83 | 180 | 12.6×8.3 | 2.3 | 0% |
IMC: índice de masa corporal.
Una paciente con diagnóstico preoperatorio de sarcoma uterino, con edad de 36 años, un IMC de 27 kg/m2, sangrado de 100ml, tiempo quirúrgico de 200 min, tamaño del útero de 13cm, estancia de 2 días, sin complicaciones ni conversiones. El reporte histopatológico indicó sarcoma uterino de alto grado, con 15 ganglios pélvicos negativos.
Finalmente, una paciente con diagnóstico de complemento de rutina de ovario, de 36 años, con un IMC de 27kg/m2, sangrado de 50ml, tiempo quirúrgico de 210 min y tamaño del útero de 8×7cm. El reporte de anatomía patológica con epiplón inframesocólico, lavado peritoneal, biopsia de peritoneo y ganglios pélvicos (14 ganglios) negativos a malignidad, tamaño del útero de 8cm, estancia hospitalaria de 2 días (tabla 6).
Se destaca la no utilización de antibiótico profiláctico, ni preparación intestinal o vaginal, sin evidencia de infección del sitio operatorio a un mes de seguimiento.
DiscusiónCon el advenimiento de toda la infraestructura que gira alrededor de la cirugía laparoscópica, la realización de procedimientos cada vez más complejos por esta vía se ha convertido en una realidad. Un ejemplo de ello es la cavidad pélvica y la realización de procedimientos como histerectomía total tipo I, II o III, de la clasificación de Piver: linfadenectomía pélvica, paraaórtica o paracaval27,28 o series de más de 500 pacientes con cáncer endometrial, tratadas con laparoscopia29 con resultados a 4 años similares al procedimiento abierto. Incluso este beneficio se mantiene en pacientes obesas con IMC mayor de 40kg/m2 y cáncer de endometrio30, aunque existen reportes de que la obesidad se asocia a complicaciones importantes en el postoperatorio, por las alteraciones metabólicas que produce31. Sin embargo, la recurrencia y la supervivencia global a largo plazo aún están siendo evaluadas. Hasta el momento, a mediano plazo (37 meses) del ASTEC Trial no existen diferencias con el procedimiento abierto. Machana et al.32 evaluaron y compararon el procedimiento abierto versus el robótico y laparoscópico para cáncer de endometrio, con resultados favorables para estos 2 últimos con respecto a menor sangrado33, menor estancia hospitalaria y recuperación más rápida34.
Con respecto al cáncer de ovario, Zhang et al.35 analizaron a pacientes en etapas tempranas con resultados favorables a la laparoscopia, con menor morbilidad y estancia hospitalaria. Así mismo, es una herramienta importante para el estadiaje por menor índice de complicaciones comparado con la laparotomía36,37. El reto acerca de la laparoscopia y el cáncer se ha superado hace mucho con la realización de procedimientos vía laparoscópica, como la operación de Whipple o la derivación biliodigestiva. Con respecto al cáncer cervicouterino, Mendivil et al.38 encontraron en un estudio retrospectivo de 5 años de experiencia que los procedimientos laparoscópicos para el tratamiento de dicha dolencia se asociaban a menor estadía hospitalaria, (2.9 días) datos compatibles con nuestros resultados, y a una supervivencia global de hasta el 89.7% a 60 meses38,39. En el Hospital Regional de Alta Especialidad de Oaxaca la cirugía de mínima invasión se inició con enfermedades benignas (miomatosis uterina y masas anexiales). En dicho grupo se presentaron la mayoría de las complicaciones (sangrado mayor de 500ml, despulimiento de vejiga, lesión vascular) y, posteriormente, se continuó con enfermedades malignas ginecológicas, con días de estancia similares o más cortos que los de la cirugía abierta, ninguna complicación mayor, como lesión intestinal, lesión vesical o lesión ureteral40, sangrados similares o menores a los de los procedimientos abiertos41, el tiempo quirúrgico con una tendencia a ser mayor, una cosecha de ganglios menor a la de la cirugía abierta, pero con una integración más rápida a las actividades normales. Según la literatura internacional, las complicaciones mayores antes mencionadas se reducen significativamente cuando el cirujano realiza más de 30 histerectomías laparoscópicas42, resultados concordantes con los obtenidos en nuestra unidad.
Aunque en la actualidad el manejo de la enfermedad benigna y maligna de la pelvis por vía laparoscópica de la histerectomía simple, radical y linfadenectomía pélvica es factible, segura, con menor estancia hospitalaria y recuperación más pronta a sus actividades normales que la cirugía abierta42, el reto institucional será aumentar el número de ganglios disecados y disminuir los tiempos quirúrgicos.
ConclusionesEl manejo de enfermedad benigna y maligna pélvica por laparoscópica es factible, seguro, con menor estancia hospitalaria y una recuperación más pronta de las actividades cotidianas.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores reportan no tener conflicto de intereses.