Obtener márgenes libres en cirugía conservadora del cáncer de mama (CCCM) es esencial para evitar la recurrencia local, precisando para ello la reintervención en múltiples ocasiones. La ablación por radiofrecuencia (ARF) de los márgenes tras tumorectomía parece ser una herramienta útil para evitar las reintervenciones, aunque con insuficiente evidencia. En este estudio se analiza la eficacia y seguridad de la ARF tras la CCCM para obtener márgenes libres.
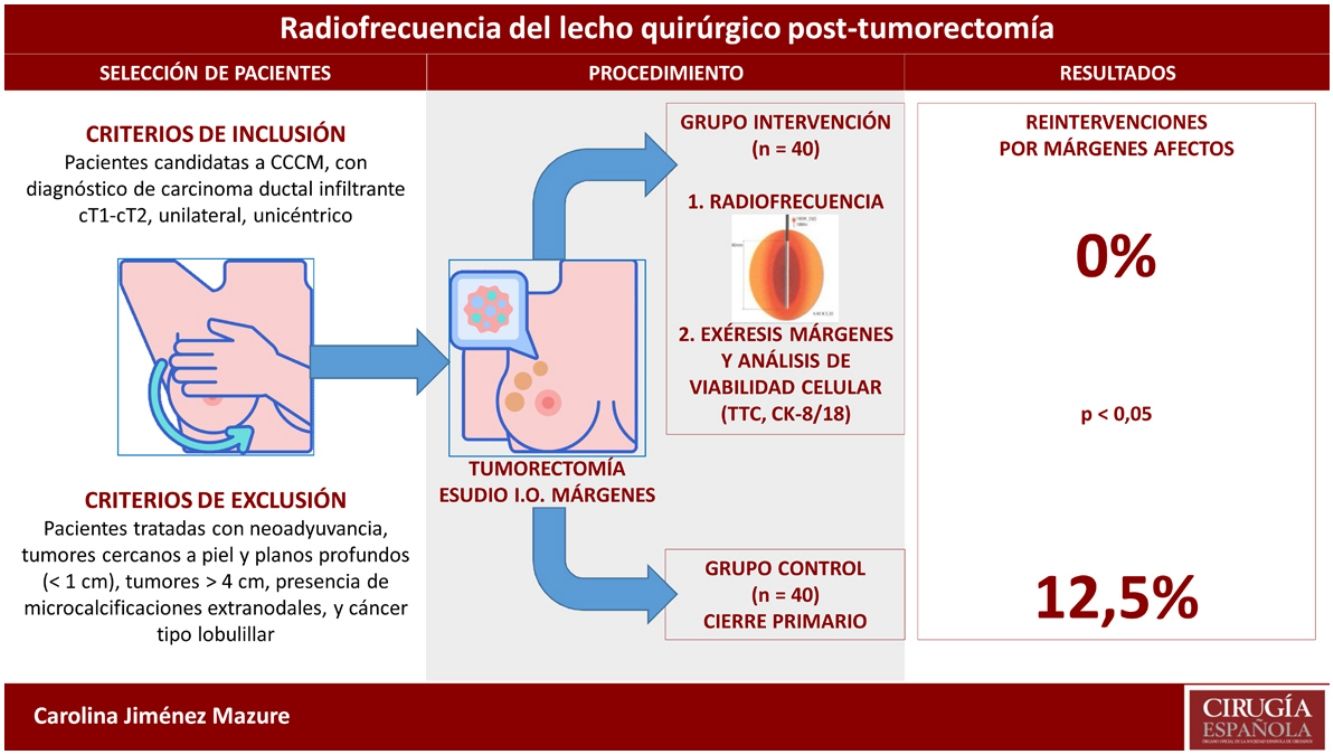
MétodosEstudio experimental, no aleatorizado, realizado en un grupo intervención de 40 pacientes al que se aplicó ARF tras tumorectomía y exéresis posterior de los márgenes, y otro grupo control histórico de 40 pacientes al que se realizó CCCM. En el grupo intervención, se analizó el efecto de la ARF sobre la viabilidad de las células tumorales en los márgenes extirpados. Se realizó además un análisis comparativo sobre el porcentaje de reintervenciones, las complicaciones y el resultado estético en ambos grupos.
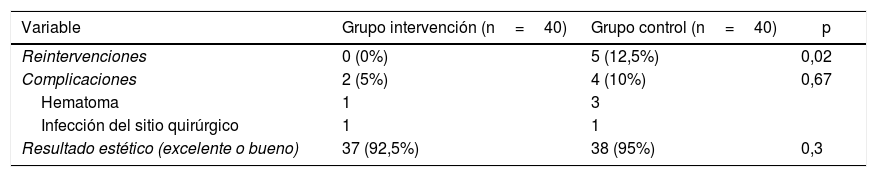
ResultadosSe estudiaron 240 márgenes extirpados tras ARF, evidenciando un elevado número de márgenes libres. Comparado con el grupo control, disminuyó significativamente el número de reintervenciones (0% vs. 12%; p=0,02), sin hallar diferencias respecto a las complicaciones (5% vs. 10%; p=0,67) ni al resultado estético (excelente o bueno 92,5% vs. 95%; p=0,3).
ConclusionesLa ARF tras tumorectomía es una técnica sencilla, segura y eficaz para la obtención de márgenes libres, y permite reducir las reintervenciones sin afectar a las complicaciones ni al resultado estético.
Obtaining tumor-free margins during breast conservative surgery (BCS) is essential to avoid local recurrence and frequently requires reoperation. Radiofrequency ablation (RFA) of surgical margins after lumpectomy seems to be a helpful tool to avoid reoperations, but evidence is insufficient. This study analyzes the efficacy and safety of RFA after BCS to obtain free surgical margins.
MethodsNon-randomized experimental study performed in an intervention group of 40 patients assigned to receive RFA after lumpectomy and successive resection of surgical margins, and a historical control group of 40 patients treated with BCS alone. In the intervention group, the RFA effect on tumor cell viability in the surgical margins was analyzed. Also, reoperation rate, complications and cosmetic results were compared in both groups.
ResultsA total of 240 excised margins were analyzed after RFA, obtaining a high number of tumor-free margins. Compared to the control group, the reoperation rate decreased significantly (0% vs 12%; P=.02), without differences in terms of postoperative complications (10% vs 5%; P=.67) or cosmetic results (excellent or good 92.5% vs 95%; P=.3).
ConclusionsRFA after lumpectomy is a reliable, safe and successful procedure to obtain tumor-free surgical margins and to decrease the reoperation rate without affecting complications or compromising cosmetic results.
La principal misión de la cirugía conservadora del cáncer de mama (CCCM) es la obtención de márgenes quirúrgicos libres de células tumorales, con el objetivo de reducir la recurrencia local1. En condiciones ideales, este procedimiento debería poder efectuarse en un único acto quirúrgico, con el mejor resultado estético y con el menor número y gravedad de complicaciones posibles. Sin embargo, la tasa de reintervenciones por márgenes afectos llega a ser en algunos estudios del 25-40%2. Esto condiciona un mayor estrés para la paciente, el retraso de eventuales tratamientos, un elevado número de cirugías blancas en las reintervenciones, peores resultados estéticos, mayores costos, y es en sí mismo un factor de riesgo para la recurrencia local3,4.
Además, el 63% de los tumores candidatos a CCCM presentan focos de células cancerosas en el área peritumoral, que van a permanecer en el lecho quirúrgico, y que justifican el tratamiento con terapias adyuvantes (principalmente radioterapia) tras la cirugía5. De hecho, gran parte de la recurrencia local, que actualmente se estima en entre un 2,5-5% a los 10 años, está condicionada por el insuficiente tratamiento de esta enfermedad residual6. En este sentido, obtener un margen negativo predice que el tumor residual es mínimo y potencialmente controlable con terapias adyuvantes.
Por otro lado, el empleo de la radiofrecuencia como técnica ablativa (ARF), ya instaurada de forma habitual en tumores localizados en otros órganos, se comunicó por primera vez en la mama en 19997, y desde entonces ha ido ganando protagonismo, al aportar un tratamiento añadido sobre el tumor y buena parte de los focos peritumorales residuales, sin necesidad de extirpar un exceso de tejido glandular8. Su eficacia ha sido demostrada en el carcinoma ductal infiltrante, siendo su papel mucho menos consistente en el carcinoma ductal in situ y en la neoplasia lobulillar9.
Sin embargo, son pocos los estudios que hasta ahora han buscado demostrar su beneficio para disminuir las reintervenciones en la CCCM10,11, en los cuales la ARF intraoperatoria se presenta como una herramienta potencialmente segura y eficaz en el control de los márgenes durante la CCCM, aunque aún son necesarias más pruebas acerca de la eficacia y la seguridad clínica de esta técnica9.
El objetivo de este estudio es describir los efectos de la ARF intraoperatoria sobre los márgenes quirúrgicos, y evaluar su eficacia en términos de reducción de las reintervenciones, y su seguridad en cuanto al número de complicaciones y al resultado estético.
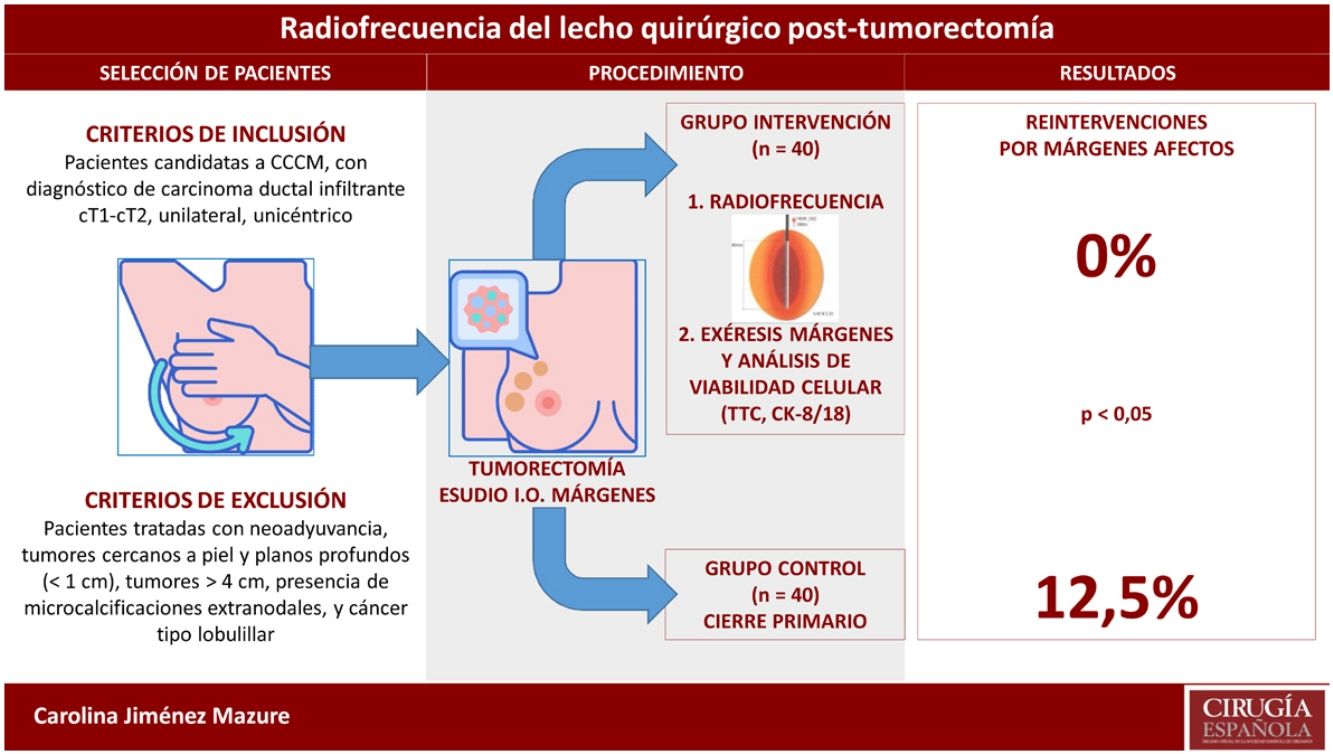
MétodosDiseñoEstudio experimental, unicéntrico, no aleatorizado, con un grupo intervención, recogido de forma prospectiva, en el cual se aplicó la intervención a estudio, y un grupo control, recogido de forma retrospectiva, el cual fue tratado según el procedimiento habitual del centro.
Selección de las pacientesCriterios de inclusión: pacientes candidatas a CCCM, con diagnóstico de carcinoma ductal infiltrante cT1-cT2, unilateral, unicéntrico.
Criterios de exclusión: pacientes tratadas con neoadyuvancia, tumores cercanos a piel y planos profundos (<1cm), tumores >4cm, presencia de microcalcificaciones extranodales, y cáncer tipo lobulillar.
Descripción de los procedimientos y la intervenciónEvaluación preoperatoria y tumorectomíaEn todas las pacientes candidatas a CCCM se realizó una evaluación preoperatoria con mamografía, ecografía mamaria y axilar, biopsia con aguja gruesa (BAG) y resonancia magnética nuclear. Posteriormente, en régimen de CMA, se efectuó tumorectomía, más biopsia selectiva del ganglio centinela o vaciamiento axilar según el caso, con envío en fresco de la pieza de tumorectomía para estudio intraoperatorio de los márgenes quirúrgicos.
Intervención: procedimiento de aplicación de la radiofrecuenciaLa ARF intraoperatoria tras la tumorectomía consistió en colocar un electrodo en el lecho quirúrgico que, mediante un generador de alta frecuencia, produce una corriente alterna que provoca agitación iónica, con la consiguiente fricción y generación de calor. Cuando se alcanzan los 45-50°C, acontece la desnaturalización proteica y la necrosis coagulativa. Los cambios degenerativos que produce la ARF pueden aumentar gradualmente hasta la desaparición completa de las células a lo largo de varios meses.
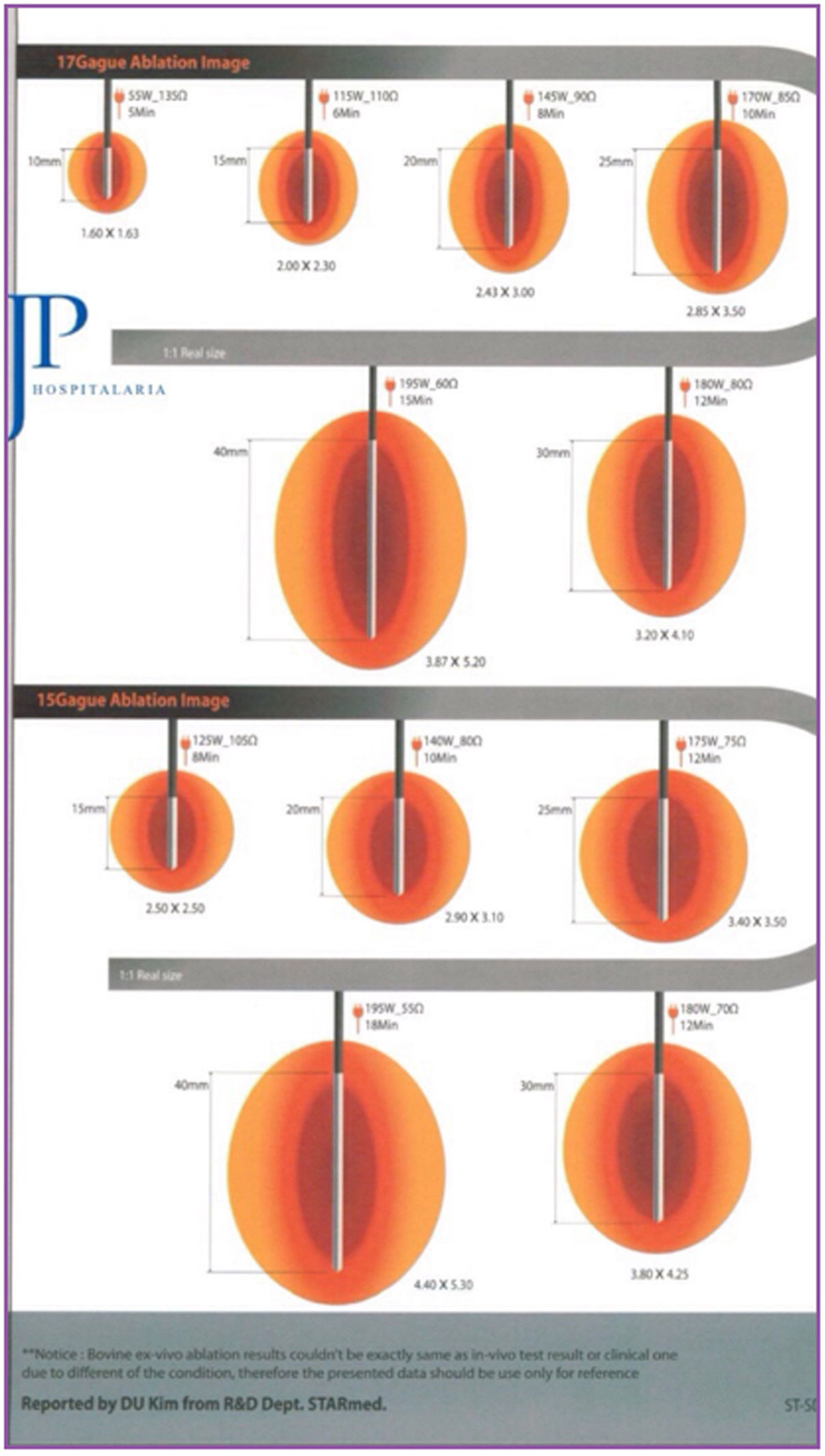
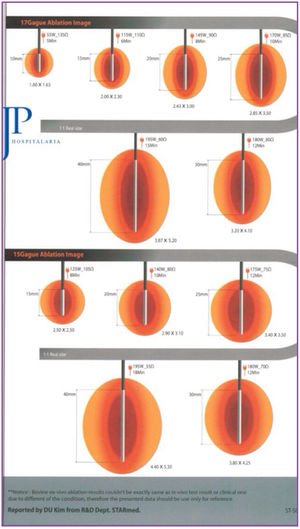
El sistema utilizado fue el VIVA RF (STARmed Co., Ltd., JJP Hospitalaria SL, Sevilla, España), con electrodo de coagulación VIVA RF (referencia 17-20V05-30) y potencia de 115W. Este terminal monopolar, de punta activa y longitud variable, permite un mejor control de la ablación, así como una menor dispersión de la energía. La intensidad y el tiempo de aplicación se estimaron en función de la longitud de la punta activa seleccionada y del área de ablación que deseamos, según las indicaciones del fabricante (fig. 1).
La técnica de aplicación de la ARF dependió del tamaño de la cavidad, a criterio del cirujano. En cavidades de pequeño tamaño, el terminal fue colocado y dirigido bajo control ecográfico en el lecho quirúrgico, previa confección de bolsa de tabaco y cierre de piel. En cavidades grandes, la ablación fue realizada margen a margen bajo visión directa.
Exéresis de márgenesEn el grupo intervención, tras finalizar la ARF se extirparon los 6 márgenes quirúrgicos (anterior, posterior, externo, interno, superior, inferior) para evaluar signos de viabilidad celular. En el grupo control, se extirparon únicamente los márgenes afectos en el análisis intraoperatorio.
Estudio anatomopatológicoPara el análisis de viabilidad celular en las muestras que recibieron ARF se usó la tinción con cloruro de 2,3,5-trifeniltetrazolio (TTC) mediante inmersión durante 1h a 37°C. El TTC es una técnica de tinción que utiliza la reducción de sales de tetrazolio como indicador de la actividad respiratoria celular11. En caso de persistencia de células tumorales viables, las sales de TTC se reducen y precipitan formando un complejo insoluble en agua de color rojo intenso, que es identificable macroscópicamente. Además, en algunas pacientes, a criterio del patólogo, se añadió la técnica inmunohistoquímica de las citoqueratinas 8/18 (CK-8/18), marcador muy específico, pero poco sensible, basado en la detección de esta queratina de filamento intermedio que se encuentra en el citoesqueleto intracitoplasmático del tejido epitelial, y que desaparece en una fase precoz de la apoptosis12.
Finalmente, y al igual que se efectuó en el grupo control, se procedió a la tinción con hematoxilina-eosina (H-E) para su estudio convencional.
Criterios de reintervenciónPresencia de carcinoma ductal infiltrante viable, demostrado por cualquiera de las técnicas empleadas (TTC, CK-8/18 o H-E), que contactase con el margen quirúrgico (no-ink) de la pieza de tumorectomía o, en su caso, del margen ampliado.
Recogida y medición de variablesSe recogieron las siguientes variables descriptivas: edad (años), menopausia (sí/no), tamaño tumoral (mm), afectación axilar (sí/no), histología del tumor (carcinoma ductal infiltrante±carcinoma ductal in situ), estadificación clínica (I/II) y patológica (I/II/III), y fenotipo (luminal A/B, HER2+, triple negativo).Las variables resultado fueron:
- –
Presencia de viabilidad celular, según las técnicas anatomopatológicas descritas, en los márgenes extirpados tras aplicar ARF.
- –
Porcentaje de reintervenciones.
- –
Número de complicaciones durante la cirugía o en el seguimiento posterior (hematoma, infección del sitio quirúrgico, etc.) y su forma de tratamiento (conservador, quirúrgico, etc.).
- –
Resultado estético al mes y a los 6 meses (antes y después de recibir radioterapia), clasificado desde pobre a excelente mediante la escala de cosmesis mamaria de Harvard/NSABO/RTOG13.
El tamaño muestral calculado, considerando una potencia del 80% mediante una prueba chi cuadrado (χ2) bilateral para 2 muestras independientes, teniendo en cuenta que el nivel de significación es del 5%, y asumiendo, según estudios previos11, que la tasa de reintervención en el grupo control es del 30% y del 5% en el grupo intervención, da como resultado que es necesario incluir 36 pacientes en cada grupo. Si estimamos un 10% de pérdidas, el número necesario asciende a 40 pacientes por grupo.
Para el análisis de resultados se empleó el programa SSPS versión 20. La expresión de los resultados de las variables categóricas se muestra como frecuencias y porcentajes, y las variables continuas como media y desviación estándar (DE). Para el análisis comparativo de variables categóricas se usó la prueba de χ2. La significación estadística se estableció en p<0,05.
Consideraciones éticasEl estudio siguió las normas de la Declaración de Helsinki, fue aprobado por el Comité Ético de Investigación, y se elaboró un consentimiento informado que se explicó y entregó a todas las pacientes.
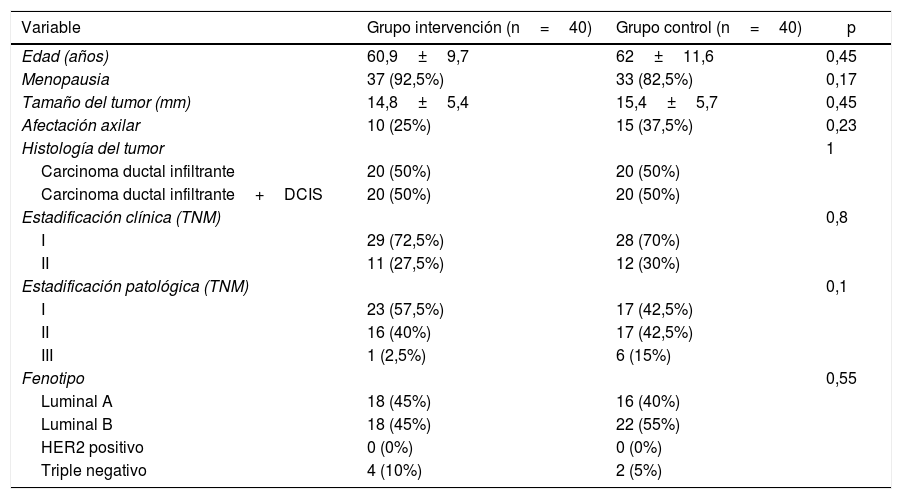
ResultadosSe incluyeron un total de 80 pacientes en el estudio, 40 en cada grupo, y no existieron pérdidas. Las características clínicas y los datos tumorales de estas pacientes se presentan en la tabla 1. No se encontraron diferencias significativas en ninguna de las variables recogidas, por lo que los grupos pueden considerarse homogéneos en cuanto a las características clínicas y del tumor.
Características generales y datos tumorales de las pacientes
| Variable | Grupo intervención (n=40) | Grupo control (n=40) | p |
|---|---|---|---|
| Edad (años) | 60,9±9,7 | 62±11,6 | 0,45 |
| Menopausia | 37 (92,5%) | 33 (82,5%) | 0,17 |
| Tamaño del tumor (mm) | 14,8±5,4 | 15,4±5,7 | 0,45 |
| Afectación axilar | 10 (25%) | 15 (37,5%) | 0,23 |
| Histología del tumor | 1 | ||
| Carcinoma ductal infiltrante | 20 (50%) | 20 (50%) | |
| Carcinoma ductal infiltrante+DCIS | 20 (50%) | 20 (50%) | |
| Estadificación clínica (TNM) | 0,8 | ||
| I | 29 (72,5%) | 28 (70%) | |
| II | 11 (27,5%) | 12 (30%) | |
| Estadificación patológica (TNM) | 0,1 | ||
| I | 23 (57,5%) | 17 (42,5%) | |
| II | 16 (40%) | 17 (42,5%) | |
| III | 1 (2,5%) | 6 (15%) | |
| Fenotipo | 0,55 | ||
| Luminal A | 18 (45%) | 16 (40%) | |
| Luminal B | 18 (45%) | 22 (55%) | |
| HER2 positivo | 0 (0%) | 0 (0%) | |
| Triple negativo | 4 (10%) | 2 (5%) |
ARF: ablación por radiofrecuencia; DCIS: carcinoma ductal in situ; HER2: human epidermal growth factor receptor 2.
En el grupo intervención, la ARF fue aplicada en un 70% de los casos en cavidades pequeñas con la técnica de bolsa de tabaco, empleando un tiempo medio de ablación de 6,36min, y en un 30% sobre cavidades grandes, margen a margen, con un tiempo medio de 22min.
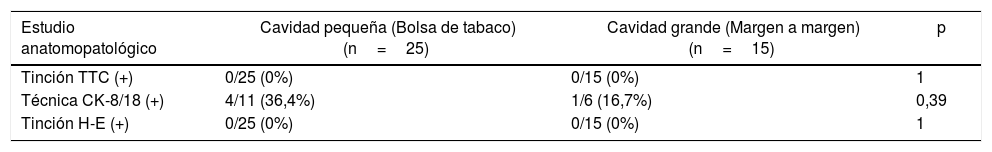
Se procedió a la extirpación y estudio de los márgenes de todos los pacientes (240 márgenes). La técnica de tinción con TTC se realizó en todos ellos y no mostró datos de viabilidad celular. La técnica inmunohistoquímica mediante detección de CK-8/18 se realizó en 17 pacientes (102 márgenes) y reveló positividad débil en 5 márgenes (4,9% del total de márgenes analizados con esta técnica; 2,1% del total de márgenes), aunque sin afectar al lado contralateral al tumor en ninguno de ellos. En 4 de estos casos la ARF fue aplicada en cavidades pequeñas tras la realización de una bolsa de tabaco, y en el caso restante sobre una cavidad grande, aplicada margen a margen. El análisis anatomopatológico ulterior mediante tinción con H-E tampoco evidenció afectación tumoral de los márgenes extirpados (ver tabla 2).
Análisis de los márgenes extirpados en el grupo intervención
| Estudio anatomopatológico | Cavidad pequeña (Bolsa de tabaco) (n=25) | Cavidad grande (Margen a margen) (n=15) | p |
|---|---|---|---|
| Tinción TTC (+) | 0/25 (0%) | 0/15 (0%) | 1 |
| Técnica CK-8/18 (+) | 4/11 (36,4%) | 1/6 (16,7%) | 0,39 |
| Tinción H-E (+) | 0/25 (0%) | 0/15 (0%) | 1 |
CK-8/18: citoqueratinas 8/18; H-E: hematoxilina-eosina; TTC: cloruro de 2,3,5-trifeniltetrazolio.
En el estudio anatomopatológico de la pieza de tumorectomía se encontró al menos un margen afecto en 14 pacientes (35%), y en otros 16 (40%) se encontró afectación cercana al margen (<2mm).
Los resultados del análisis comparativo con el grupo control se encuentran recogidos en la tabla 3. No se reintervino ninguna paciente por afectación de márgenes en el grupo intervención (0%), mientras que en el grupo control fue necesario en 5 pacientes (12,5%), siendo esta diferencia estadísticamente significativa. Por el contrario, los datos sobre los resultados cosméticos (obtención de un resultado excelente o bueno) y sobre el número y el tipo de complicaciones no reflejaron diferencias significativas. Todas las complicaciones descritas en ambos grupos tuvieron una evolución satisfactoria aplicando un tratamiento conservador. La paciente del grupo intervención que presentó la infección del sitio quirúrgico tuvo un resultado estético aceptable, al quedar cierta asimetría del complejo aréola-pezón.
Análisis comparativo de los resultados en ambos grupos
| Variable | Grupo intervención (n=40) | Grupo control (n=40) | p |
|---|---|---|---|
| Reintervenciones | 0 (0%) | 5 (12,5%) | 0,02 |
| Complicaciones | 2 (5%) | 4 (10%) | 0,67 |
| Hematoma | 1 | 3 | |
| Infección del sitio quirúrgico | 1 | 1 | |
| Resultado estético (excelente o bueno) | 37 (92,5%) | 38 (95%) | 0,3 |
La obtención de márgenes libres, junto al tratamiento de la enfermedad residual peritumoral, son la clave para la prevención de la recurrencia local tras la CCCM6. A pesar de todos los esfuerzos, hoy día la tasa de reintervenciones por márgenes afectos sigue siendo inaceptablemente alta2. Este trabajo confirma la hipótesis de que la aplicación de ARF es eficaz en tratar las células tumorales residuales del tejido mamario tras tumorectomía, es decir, consigue obtener un mayor número de márgenes libres y, por tanto, reducir la tasa de reintervenciones.
Con respecto a la eficacia de la ARF, cuando se aplica directamente sobre el tumor, su capacidad ablativa desciende del 92% en tumores pequeños al 30% en tumores >2cm9. Por tanto, al realizar la tumorectomía previa a la aplicación de la ARF, es razonable pensar que aumente la eficacia sobre los pequeños focos residuales persistentes peritumorales. Otra circunstancia que puede comprometer la eficacia de la ARF es una impedancia elevada, motivo por el cual se debe crear la bolsa de tabaco y colapsar la cavidad. En cavidades grandes, es más probable la persistencia de aire tras la confección de la bolsa de tabaco que condicione una mayor impedancia, por lo que, de forma novedosa, proponemos aplicar la ARF margen a margen bajo visión directa. Los resultados del análisis de la viabilidad celular del estudio no encuentran diferencias entre la nueva técnica y la habitual, a pesar de tratarse de cavidades más grandes.
Actualmente no está bien establecido qué técnica anatomopatológica permite confirmar de forma inequívoca la ablación completa cuando se realiza el análisis del tejido mamario tras aplicar ARF14, por lo que elegimos la tinción con TTC, utilizada en otros trabajos previos11, y la técnica de las CK-8/18, para aportar un enfoque más novedoso. El análisis de la pieza de tumorectomía del grupo intervención, no sometida a ARF, evidenció la afectación de al menos un margen en 14 pacientes y afectación cercana al margen (<2mm) en otros 16. Por el contrario, en los márgenes quirúrgicos extirpados tras ARF no se encontró ningún margen afecto tras la tinción con TTC (de 240 analizados), y solo se detectaron restos tumorales en 5 casos mediante la técnica de las CK-8/18 (5 márgenes de 102 analizados), todos ellos de forma débil, y que, además, se demostraron no viables según la técnica de tinción con TTC.
De igual manera que en otros estudios15, el significado de la positividad débil de las CK-8/18 no está claro, aunque no debe ser obviada, ya que podría poner de manifiesto que la apoptosis de restos celulares tumorales se habría producido de forma incompleta. Otra posible explicación es que se haya realizado el análisis en un momento demasiado próximo a la aplicación de la ARF, ya que los cambios degenerativos producidos por el calor se prolongan a lo largo de varios meses.
La obtención de márgenes libres tras aplicar ARF ha permitido evitar las reintervenciones en el grupo intervención, con una diferencia estadísticamente significativa respecto al grupo control (0% vs. 12%; p=0,02), y además sin comprometer el resultado estético ni aumentar el número y gravedad de las complicaciones. La evidencia a este respecto es muy escasa, siendo nuestros resultados congruentes con los de otros estudios en los que se aplica la ARF tras tumorectomía10,11. Nosotros aportamos un mayor número de pacientes, un grupo control y proponemos una técnica novedosa tanto por el terminal empleado como por su forma de aplicación intraoperatoria.
Sin embargo, el estudio tiene algunas limitaciones. Por un lado, la presencia de un grupo control histórico, recogido de forma retrospectiva, con todas las implicaciones que eso conlleva en la obtención de los datos, aunque finalmente las características clínicas y tumorales de las pacientes eran equiparables. Además, la ausencia de aleatorización y cegamiento pueden influir en el análisis de los resultados, fundamentalmente en el resultado estético, evaluado además por el mismo equipo que realizó la intervención quirúrgica. Otra limitación importante, debida al diseño del estudio, es que fue necesario extirpar todos los márgenes quirúrgicos para el análisis de la viabilidad celular, eliminando más cantidad de tejido tratado del necesario, lo cual potencialmente pudo infraestimar la aparición de complicaciones derivadas de la ARF.
Persisten cuestiones por resolver, como la eficacia de la ARF para disminuir la recurrencia local, las eventuales complicaciones a largo plazo al permanecer el tejido tratado in situ, la mejor técnica para su estudio histopatológico, así como el perfil de paciente que más se beneficiaría de este procedimiento en aras de una optimización de los recursos.
Como conclusión, la ARF tras tumorectomía en CCCM es una técnica segura, eficaz, y fácilmente reproducible, que contribuye a la obtención de márgenes libres y, por tanto, a reducir el número de reintervenciones.
FinanciaciónEl presente trabajo ha sido parcialmente financiado por JJP Hospitalaria, S.L., mediante la aportación gratuita de los terminales de ablación.
Conflicto de interesesNo existe conflicto de interés.