Se ha realizado una revisión literaria relativa a la cirugía de la recurrencia pélvica del cáncer de recto utilizando las bases de datos MedLine, Ovid, EMBASE, Cochrane y Cinahl. La evaluación por pruebas de imagen de la recidiva locorregional debe realizarse tanto para descartar la presencia de metástasis como con el objetivo de localizar el sitio preciso (subsitio) de la misma dentro de la pelvis. Como el único tratamiento curativo será la resección completa de la recidiva con márgenes negativos, se deben realizar preoperatoriamente TC, RMN, ecografía endorrectal y PET-TC para determinar la resecabilidad. Para una potencial curación, se deben realizar resecciones radicales, variando la técnica según la localización de la recurrencia sea central (axial), posterior (presacra) o lateral, así como el tratamiento efectuado del tumor primario. Los tratamientos neoadyuvantes, la braquiterapia y la RTIO mejoran los resultados de control local y la supervivencia en estos pacientes.
A literature review has been made on the pelvic recurrence of rectal cancer using the MedLine, Ovid, EMBASE, Cochrane and Cinahl data bases. Assessment of the locoregional recurrence must be made using imaging tests in order to rule out the presence of metastasis, as well as for locating its exact location within the pelvis. As the only curative treatment should be complete resection of the recurrence with negative margins, a pre-operative CT, NMR, endorectal ultrasound and PET-CT must be performed to determine its resectability. For a potential cure, radical resections must be made, with the technique varying according to whether the location is central (axial), posterior (presacral) or lateral, as well as treatment directed at the primary tumour. Neoadjuvant treatments, brachiterapy and intra-operative radiotherapy improve the local control results and survival in these patients.
La recurrencia locorregional (RLR) o pélvica aislada del cáncer de recto tras una resección curativa continúa siendo un grave y frustrante problema para pacientes y cirujanos, donde la única opción curativa será la realización de una cirugía de rescate o re-resectiva completa1. Las dos principales razones para este abordaje radical son por un lado las desastrosas consecuencias sintomáticas del cáncer pélvico incontrolado (principalmente dolor y tenesmo), sólo parcial y temporalmente paliado con radioterapia, y por otro que muchas de estas recidivas LR permanecerán localizadas exclusivamente en la pelvis, sin enfermedad diseminada2,3.
En los últimos años la incidencia de RLR ha disminuido gracias a los avances en el tratamiento quirúrgico del cáncer de recto y en la utilización neoadyuvante de la radio y quimioterapia (RQT), que aportan un mejor control locorregional (LR) de esta enfermedad. Por otra parte se observa además un sutil cambio en la distribución de las RLR en relación a su localización dentro de la pelvis4–6. En términos generales en los años previos a la cirugía con escisión total mesorrectal predominaban las formas de recurrencias pélvicas centrales (peri-anastomóticas y anteriores) y tras los tratamientos adyuvantes combinados predominan las formas laterales y posteriores (presacras)6.
No obstante la RLR mantiene unas tasas que oscilan entre el 2,6 y el 32%2, dependiendo tanto de factores del tumor primario como terapéuticos (estadio, márgenes, calidad de la cirugía, etc.). El 70% de estas recurrencias ocurre en los primeros 2 años tras la cirugía del tumor primario.
La supervivencia media de los pacientes tras el diagnóstico de la recidiva sin recibir ningún tratamiento es de 6-7 meses, con una supervivencia a 5 años menor al 5%3 y una morbilidad importante. Con tratamientos como RT combinada o no con quimioterapia la supervivencia media aumenta a 10-17 meses7, pero la regresión tumoral se consigue raramente y el alivio de los síntomas únicamente se da en un tercio de los pacientes. El único tratamiento con beneficio curativo será la resección quirúrgica radical, con mejores resultados si se asocia a un tratamiento multimodal con RQT1,4. Por esa razón será muy importante la formación y evaluación de los casos por equipos multidisciplinares, compuestos por diferentes especialistas con experiencia en la evaluación y tratamiento de la enfermedad. A pesar de ello la resección de la RLR del cáncer de recto no tiene la misma aceptación que la resección de las metástasis hepáticas o pulmonares de origen colorrectal por la percepción de que la morbimortalidad y las secuelas asociadas a esta cirugía parecen excesivas.
El objetivo de este trabajo es realizar una revisión de la literatura existente sobre diagnóstico, manejo y tratamiento quirúrgico con intención curativa de la RLR del cáncer de recto.
MétodosSe ha realizado una revisión de la literatura existente desde 1999 hasta noviembre de 2010 sobre el tratamiento quirúrgico de la recidiva del cáncer de recto. Se ha realizado una búsqueda en las bases de datos CINAHL, MedLine, Ovid, EMBASE y Cochrane. Se han utilizado como palabras clave: «rectal carcinoma», «recurrent rectal cancer», «local recurrence» y «surgery».
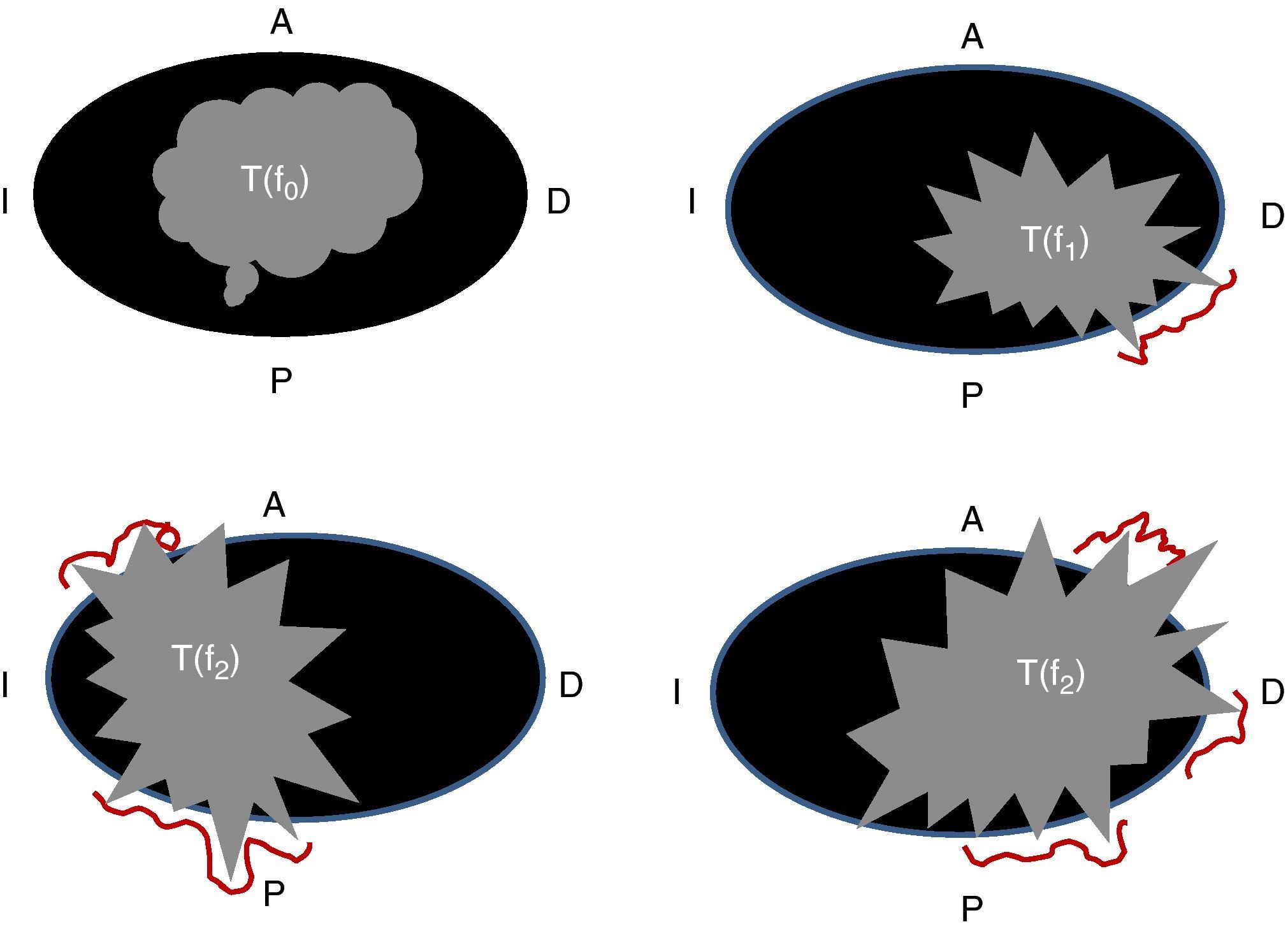
ClasificacionesExisten diversas clasificaciones para la RLR de este tipo de tumores, pero no hay un consenso universal para catalogar la recurrencia. Una de las clasificaciones es la descrita por la Clínica Mayo en la que se clasifican según los síntomas que presentan los pacientes (S0: asintomático; S1: sintomático sin dolor; S2: sintomático con dolor) y el número de fijaciones del tumor a la pared pélvica (F0: sin fijación a la pared pélvica; F1: fijación en un punto; F2: fijación en 2 puntos; F3: fijación en 3 o más puntos) (fig. 1). Esta publicación ha demostrado una disminución significativa en la supervivencia en pacientes que han presentado dolor y en los que tienen más de un punto de fijación8.
Clasificación de la recurrencia pélvica según la Clínica Mayo, 19964. f0: no fijación; f1: fijación en un punto (línea roja); f2: fijación en 2 puntos; f3: fijación en 3 puntos.
La clasificación del Memorial Sloan Kettering conjuga la localización de la recurrencia en la pelvis con la cirugía previa efectuada: local (tras resección transanal), axial anastomótica (tras resección anterior), axial-perineal (tras resección abdominoperineal), posterior (con infiltración de sacro o coxis), anterior (con invasión de órganos urogenitales o ginecológicos) y lateral (con infiltración de las estructuras de la pared pélvica). Utilizando este sistema, Moore et al9 han observado una reducción significativa de resección completa (R0) en tumores con componente lateral.
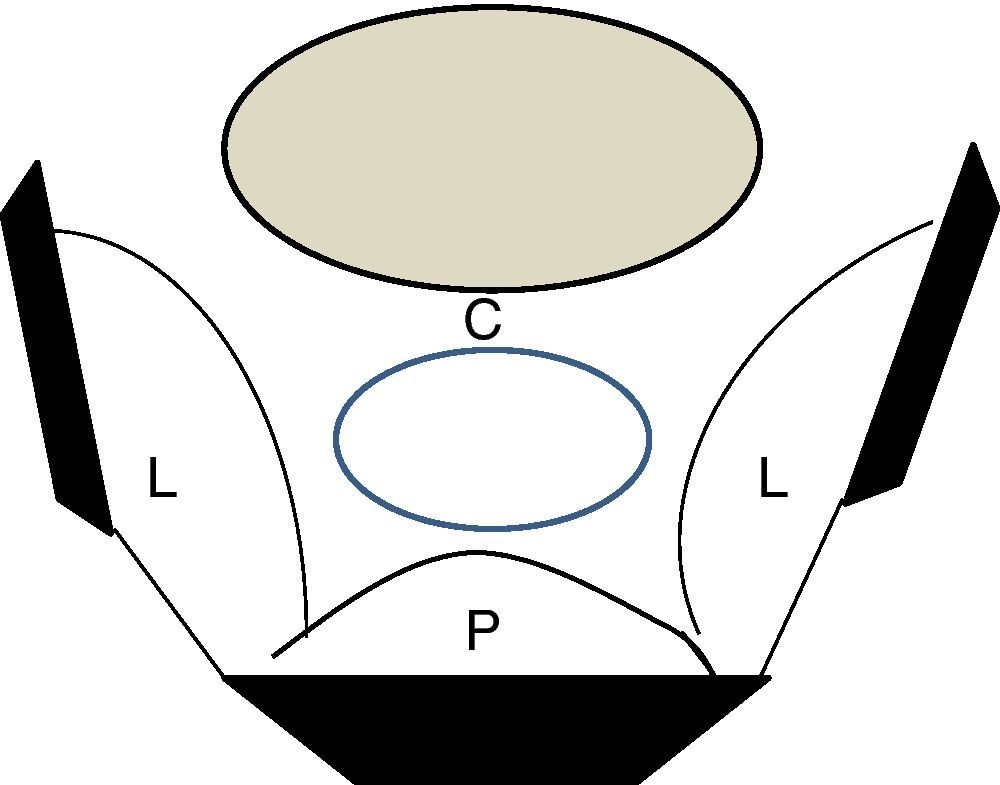
Una clasificación pragmática es la propuesta por el grupo de Leeds10, basada en la localización anatómica de la lesión recurrente: central (confinada a los órganos pélvicos), lateral (estructuras linfovasculares y osteoligamentosas de las paredes laterales de la pelvis), presacra (en contacto o afectando al hueso sacro) y compuesta (sacro y paredes laterales) (fig. 2).
Modo de presentaciónUn tercio de los pacientes será asintomático y la RLR se diagnosticará en el seguimiento postoperatorio de rutina8,11. Las recidivas anastomóticas pueden presentarse como rectorragias o modificación del hábito intestinal. El dolor es el síntoma más importante y se correlaciona con una tasa menor de resección R0 y presagia un peor pronóstico11. La recidiva local tras amputación abdominoperineal puede presentarse como una ausencia de cicatrización de la herida perineal, masa perineal, dolor pélvico u obstrucción intestinal por atrapamiento de asas de intestino delgado en la masa pélvica1. En general un 50% de todas las RLR se presentan con metástasis sincrónicas, sin embrago esta cifra puede ser superior (70-75%) en series que analizan exclusivamente las recurrencias pélvicas tras tratamiento neoadyuvante6.
Evaluación preoperatoriaAdemás de considerar el estado general y la reserva fisiológica de los pacientes, la evaluación preoperatoria deberá estar enfocada al diagnóstico y clasificación anatómica precisa de la RLR y a descartar metástasis a distancia, ya que su presencia descartaría la posibilidad de una resección quirúrgica curativa, aunque hay autores que han conseguido resultados aceptables en pacientes con RLR y metástasis pulmonar o hepática única resecable12,13. Dada la alta morbilidad de la resección solo se deberá considerar en casos muy seleccionados.
Habrá que realizar un estudio bioquímico preoperatorio completo con especial énfasis en la valoración de la función renal, dado que una creatinina alterada puede ser un dato de insuficiencia renal, frecuentemente asociada a una hidronefrosis por infiltración ureteral, típica de las recidivas laterales irresecables, a diferencia de lo que sucede con los tumores avanzados de recto o de unión rectosigmoidea primarios que infiltran uréteres y que no impiden su resección4,10. Aunque un CEA preoperatorio elevado puede presagiar un peor pronóstico no aporta información sobre la resecabilidad de la recurrencia1.
Siempre que sea posible habrá que realizar una rectoscopia para evaluar la localización y fijación del tumor. También es recomendable realizar una colonoscopia completa para descartar tumores colónicos sincrónicos a la RLR y obtener biopsias para el diagnóstico de confirmación en aquellas recurrencias que sean intraluminales.
Para estadificar las RLR e identificar las recurrencias sistémicas se realizarán pruebas de imagen radiológicas. La ecografía endorrectal podría diferenciar la fibrosis y la recurrencia, pero tiene limitaciones por la desestructuración de los tejidos tras la cirugía y radioterapia14,15.
Una de las pruebas más útiles será la TC toracoabdominopélvica que tiene una sensibilidad del 70% y una especificidad de 85% aunque tiene dificultades para predecir la infiltración de estructuras vecinas16–18. Aunque la TC no puede diferenciar entre la fibrosis y el tumor, sí puede predecir con precisión la operabilidad en un 85%16. El propósito de realizar una TC toracoabdominopélvica será ayudar a detectar enfermedad metastásica en el abdomen y el tórax16,17.
Aunque la RMN pélvica y la PET no se recomiendan para el seguimiento rutinario de los pacientes intervenidos de cáncer de recto, se ha visto que pueden llegar a ser de gran ayuda cuando existe una sospecha de RLR17. La RMN pélvica es más exacta y se piensa que es mejor que la TC para la identificación de órganos pélvicos. Tiene una alta sensibilidad y especificidad para la detección de la invasión local. La capacidad de diferenciar tejidos blandos mediante las diferentes densidades le proporciona una sensibilidad superior a la TC. Permite diferenciar entre tejido normal, cicatricial y tumoral. La RMN no es tan precisa para la re-estadificación tras tratamiento neoadyuvante por la dificultad que conlleva la evaluación de tejidos irradiados previamente18. También tiene menor sensibilidad para la evaluación de la pared ósea pélvica19,20.
Como se ha comentado previamente, otra de las pruebas que pueden ser útiles es el PET, que indica la actividad metabólica de cualquier lesión sospechosa. Esto permite la confirmación de la presencia de una recurrencia con una mayor precisión que la TC o la RMN. La PET-TC tiene una mayor sensibilidad y especificidad para la identificación de las metástasis y la evaluación de la RLR respecto a la PET19. La precisión de la PET en la detección de la RLR en la pelvis previamente irradiada es del 87%20. En algunas situaciones la PET-TC puede ayudar a establecer el diagnóstico mediante la forma, localización y la captación de la 18-fluorodeoxiglucosa, siendo especialmente valiosa para las recurrencias ganglionares. En algunos casos seleccionados con hallazgos de la PET indicativos de recurrencia se podría considerar la cirugía incluso si no hay biopsia confirmatoria. La PET-TAC tiene también sus limitaciones, una de ellas es la cercanía a la vejiga, ya que la captación fisiológica de FDG por este órgano altera la precisión; también tendrá dificultades en la detección de recidivas de pequeño tamaño y tumores con baja actividad metabólica, como lo son los tumores mucinosos17,20.
Siempre que sea posible, habrá que obtener una confirmación histológica de la recidiva previa a la cirugía. La biopsia se puede realizar por colonoscopia si la recidiva es intraluminal, o por punción guiada por TC si no es posible realizarla mediante colonoscopia. La interpretación de estas muestras puede resultar dificultosa dado que muchas veces son pacientes previamente irradiados. Por lo que en ausencia de histología de malignidad habrá que plantear una exploración quirúrgica con posible resección en pacientes con PET-TC sospechosa de malignidad y en lesiones que en el seguimiento han aumentado de tamaño1.
ResecabilidadLa resecabilidad se define como la posibilidad de realizar una resección quirúrgica completa con márgenes microscópicos negativos (R0) con una aceptable morbimortalidad postoperatoria. Dado que la resección es el único tratamiento curativo, se deberá identificar en el preoperatorio a los pacientes en los que es posible realizar una resección R0 y los pacientes en los que la resección está contraindicada. Esto puede resultar difícil y en algunos pacientes que se someten a una resección con intención curativa esta no será posible, determinando la resecabilidad en quirófano. La supervivencia tras la resección con márgenes afectos tanto microscópicos como macroscópicos será significativamente peor, por lo que estas resecciones son a menudo paliativas4,10,13.
En pacientes con RLR de cáncer de recto, la enfermedad extrapélvica irresecable, así como la presencia de adenopatías paraaórticas positivas, se consideran generalmente una contraindicación para la cirugía de rescate. A pesar de esto algunos autores han conseguido resultados aceptables en pacientes con recidiva local y metástasis hepáticas o pulmonares localizadas y potencialmente resecables12,21.
Análisis de multivariables han señalado que los factores que disminuyen la probabilidad de conseguir una resección quirúrgica con márgenes negativos son el sexo masculino, la edad avanzada al diagnóstico del tumor primario, la amputación abdominoperineal como cirugía primaria, el estadio avanzado del tumor primario, un antígeno carcinoembrionario elevado, y la presencia de dolor como síntoma9,13.
En cuanto a la enfermedad recurrente, la localización de la recidiva tumoral en una zona particular de la pelvis y el grado de invasión local son los dos factores más importantes que determinarán la resecabilidad6,8,9. La recurrencia axial o anterior se asocia a una tasa mayor de resección completa6. Cuando la recurrencia es de localización lateral la probabilidad de realizar una resección R0 disminuye, por lo que la presencia de invasión ureteral con hidronefrosis y el atrapamiento de los vasos ilíacos por el tumor se consideran una contraindicación a la cirugía10. El edema de extremidades inferiores y dolor perineal o en raíz del muslo son signos ominosos de crecimiento tumoral lateral y obturatriz.
Otra contraindicación de la cirugía es la invasión del sacro proximal al promontorio o si el tumor ha crecido sobre el músculo piriforme y a través de la escotadura ciática (manifestado generalmente por dolor-malestar glúteo). Aunque la infiltración sacra en niveles S1 y S2 se considera una contraindicación relativa, la infiltración de las raíces nerviosas de S1 y S2 serán contraindicaciones absolutas, por la gran morbilidad que conlleva la resección4,13,22. Por supuesto en todos los casos habrá que tener en cuenta que las comorbilidades del paciente pueden impedir la cirugía sin tener en cuenta la resecabilidad de la recidiva local.
Tratamiento neoadyuvanteComo hemos mencionado el único tratamiento curativo será una resección quirúrgica completa, pero esto puede resultar difícil por la necesidad de resecciones amplias y por la distorsión de los planos anatómicos por la cirugía previa. La QRT disminuye la RLR tras la cirugía del cáncer primario y frecuentemente se utiliza previamente a la cirugía de la recurrencia en aquellos pacientes con recidiva pélvica «naives», es decir que no recibieron tratamiento adyuvante cuando se trató el tumor primitivo, ya que con ella se ha observado un aumento de un 37% a un 69% en el control local de la enfermedad y una reducción del riesgo relativo de RLR de 61%23,24. Como ocurre con el tratamiento de los tumores de recto primitivos avanzados deben re-estadificarse los tumores recurrentes tras finalizar la QRT pues no es infrecuente detectar enfermedad diseminada en el periodo de descanso tras la QRT1–3,7,13.
En los pacientes con recurrencia e irradiación previa hay que tener en cuenta la dosis y el campo de irradiación, que limitan las posibilidades de re-irradiación. Aunque anteriormente en los pacientes con irradiación previa no se utilizaba la radioterapia por miedo a los efectos secundarios, en los últimos años se ha visto que en la recidiva local del cáncer de recto la QRT preoperatoria es segura y eficaz en dosis de 30Gy en pacientes seleccionados, con una baja toxicidad aguda y unas complicaciones tardías aceptables. Todavía no se ha determinado el intervalo seguro entre la radioterapia inicial y la re-irradiación, por lo que se necesitan grandes estudios multicéntricos25,26.
Por otra parte la braquiterapia, administrada con dispositivos intraluminales o inserción de agujas o semillas, permite la administración de altas dosis de irradiación concentrada en zonas específicas de enfermedad, minimizando las lesiones de tejidos normales, y ha sido utilizada con beneficio en el manejo de las RLR de cáncer rectal27,28.
Los centros que disponen de radioterapia intraoperatoria (RTIO) utilizan esta modalidad terapéutica en estos casos, comunicando un mayor control locorregional de la enfermedad, de resecciones R0 y de la supervivencia29,30. Cada vez se acepta más la necesidad de incorporar la RTIO (o braquiterapia) al tratamiento multimodal con radioterapia externa, quimioterapia y cirugía28,30. Las re-recurrencias tras la utilización de RTIO ocurren con frecuencia cuando no se consiguen márgenes quirúrgicos macroscópicos negativos. Curiosamente y a pesar de la alta dosis de irradiación administrada, el patrón de fallos terapéuticos con la RTIO señala que la mayoría ocurren en el área presacra, una zona que entra dentro del campo de irradiación, lo que lleva a suponer que el origen de estas recurrencias puede tener relación con células tumorales atrapadas en los ganglios pélvicos laterales5,6.
Abordaje quirúrgicoEl objetivo principal de la cirugía es conseguir un R0, para ello suele ser necesaria una resección amplia, con extirpación en bloque de los órganos adyacentes. La resección se define como resección radical extendida cuando se realiza una exéresis de los órganos circundantes11. Otro objetivo de la cirugía será el preservar los órganos adyacentes que no están afectos, lo que mantendrá en la medida de lo posible la calidad de vida del paciente. Si la resección no es posible, se deberá considerar un intento quirúrgico de paliación.
Dependiendo del caso, en la cirugía se requerirá la colaboración de distintos especialistas como Cirugía Plástica, Urología, Traumatología o Neurocirugía. En todos los casos, previamente a la cirugía se insertarán guías ureterales que ayuden a la identificación de los uréteres durante la cirugía. En la postura de Lloyd-Davies se realizará una laparotomía media. Se deberá excluir enfermedad a distancia, enfermedad peritoneal y evaluar la resecabilidad puesto que cerca de la mitad de los pacientes con recidiva local tendrá enfermedad diseminada o el tumor será irresecable. La disección de la pelvis se iniciará a distancia del punto de fijación, teniendo en cuenta que el procedimiento quirúrgico específico variará con la extensión tumoral10,13,21.
En las recurrencias axiales la resección dependerá de la cirugía primaria. Si al paciente se le realizó una resección anterior, la tendencia será realizar una amputación abdominoperineal, aunque en casos muy seleccionados con recidivas muy altas, se podrá optar por realizar una cirugía con preservación esfinteriana, con la dificultad que conlleva el conseguir una resección completa por existir una alteración de los planos quirúrgicos por la cirugía y la radioterapia previa. Habrá que tener en cuenta que el plano de disección se deberá realizar externamente al plano de la cirugía previa8,20.
La presencia de una recurrencia anterior implica una invasión del útero, vagina, vejiga, próstata o vesículas seminales. Se deberá intentar la disección posterior y lateral, antes de la evaluación de la fijación anterior del tumor. La amplitud de la resección dependerá de los órganos afectos, que se deberán resecar en bloque. Si hay una invasión del útero y la vagina, se deberá realizar una exenteración posterior con resección del recto residual, histerectomía y vaginectomía total o parcial, pudiendo realizar una reconstrucción con colgajos miocutáneos si el cierre primario no es deseable31–34. Si la infiltración es de la próstata, se podrá optar por una prostatectomía en bloque. Si hay una invasión de la cúpula vesical, se podrá realizar una resección en cuña de la vejiga o una cistectomía parcial con cierre primario, pero si existe una invasión del trígono vesical se realizará una exenteración pélvica total con resección de todos los órganos pélvicos. Para la reconstrucción intestinal y urológica se han descrito muchas técnicas quirúrgicas, siendo las más utilizadas la formación de un conducto ileal tipo Bricker10 o una colostomía húmeda en asa (double barrelled wet colostomy)35.
La invasión lateral del tumor es un factor limitante para el intento de una resección curativa, por asociarse a un peor pronóstico y menor oportunidad de lograr una resección R0. Se deberá identificar los vasos ilíacos y los uréteres proximales previamente a la disección pélvica con ayuda de las guías ureterales. Mientras que la infiltración de los tejidos blandos alrededor del músculo piriforme se puede resecar con una adecuada reconstrucción, en la invasión de la pared ósea es poco probable conseguir una resección R0, aunque si existen dudas de la que la resección sea completa, se puede administrar una RTIO para el tratamiento del margen lateral de resección, siempre recordando la posibilidad de obtener biopsias intraoperatorias. Se ha observado que las recidivas laterales suelen ser menos resecables que las centrales o anteriores1,4,5,9,10.
Cuando la recidiva es de localización posterior la fascia presacra se puede resecar en bloque con una elevación del periostio, pero una invasión ósea requerirá una resección del sacro. En estos casos se realizará una sacrectomía con una resección en bloque del neorrecto. Para realizar una resección del sacro, se cambiará la postura del paciente colocándolo en decúbito prono10. La sacrectomía es factible por debajo de S2, pero esta se asocia a una importante pérdida de sangre. Para disminuir de manera importante la hemorragia durante la sacrectomía se puede optar por la ligadura de los vasos ilíacos internos, ligando antes la arteria ilíaca interna y el complejo venoso dorsal del pene antes de ligar la vena ilíaca3,22. Habrá que identificar y disecar las raíces nerviosas S2, para prevenir las complicaciones por su lesión. Previamente a la sacrectomía habrá que seccionar los ligamentos sacroespinoso y sacrotuberoso22. Estas cirugías se deberán realizar por equipos especializados.
Tras la amputación abdominoperineal el defecto perineal puede ser sustancial, sobre todo tras una sacrectomía. Para la reconstrucción se han utilizado distintas técnicas, desde el cierre primario hasta colgajos miocutáneos. Se puede realizar un cierre primario sobre una epiploplastia o malla absorbible o biológica, pero los mejores resultados en cuanto a cicatrización e infección de herida quirúrgica se han obtenido con colgajos miocutáneos pediculados3,8,31–34. Para estos colgajos se puede utilizar los músculos gracilis, que aportan poca cantidad de tejido, los músculos glúteos y el músculo recto del abdomen, con el que se han obtenido los mejores resultados32.
ConclusionesLa RLR del cáncer de recto continúa siendo un gran reto terapéutico. Aunque la cirugía es el único tratamiento con beneficio curativo, el tratamiento multimodal y la valoración de estos pacientes por un equipo multidisciplinario será un punto importante. Una completa evaluación preoperatoria es importante para identificar la morbilidad y secuelas de esta cirugía, sí como la resecabilidad, si bien ocasionalmente esta sólo se podrá confirmar intraoperatoriamente. La técnica quirúrgica indicada en la recurrencia dependerá, además de la modalidad de tratamiento de la enfermedad primaria, de la localización anatómica precisa intrapélvica de la recidiva, siendo el objetivo de la cirugía realizar una R0. En estos pacientes los tratamientos con QRT preoperatoria, la braquiterapia y la RTIO permiten mejorar el control LR de la enfermedad y la supervivencia. Con este abordaje radical un 33% de los pacientes sobrevive a los 3-5 años, un 33% presentará una nueva RLR y otro tercio desarrollará una enfermedad diseminada1,3,30.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.