El impacto del tratamiento neoadyuvante sobre las complicaciones postoperatorias en el cáncer de estómago es motivo de controversia. El objetivo de este trabajo es analizar la morbilidad y la mortalidad postoperatoria en un grupo de pacientes a los que se les había aplicado un protocolo de quimiorradioterapia preoperatoria, así como identificar posibles factores de riesgo que se asocian al desarrollo de complicaciones.
Material y métodosEntre junio de 2005 y junio de 2008, pacientes diagnosticados de adenocarcinoma gástrico localmente avanzado se intervinieron en nuestro Centro tras haber seguido un protocolo de quimiorradioterapia preoperatoria. Se recogieron prospectivamente los datos sobre morbilidad y mortalidad postoperatoria y se analizaron las variables dependientes relacionadas con los pacientes, con el tipo de intervención y las características tumorales.
ResultadosSe evaluaron 40 pacientes. La morbilidad y la mortalidad global fue del 32,5% (13 pacientes) y del 2,5% (un paciente), respectivamente. Las complicaciones más frecuentes fueron la neumonía en el 12,9% y la sepsis por catéter en el 9,7% de los pacientes. Los factores de riesgo para el desarrollo de complicaciones fueron el índice de masa corporal (>25kg/m2) y la inclusión en la resección del páncreas o del bazo.
ConclusionesEl tratamiento preoperatorio con quimiorradioterapia en pacientes con cáncer de estómago localmente avanzado no incrementa la incidencia de complicaciones postoperatorias. La condición preoperatoria del paciente (índice de masa corporal) y la extensión de la cirugía del bazo y del páncreas son factores pronósticos de complicaciones postoperatorias precoces.
The impact of neoadjuvant treatment on the postoperative complications in stomach cancer is a subject of controversy. The aim of this study is to analyse the post-surgical morbidity and mortality in a group of patients who were treated using a chemoradiotherapy protocol before surgery, as well as to identify the possible risk factors that may be associated with the development of complications.
Material and methodsPatients diagnosed with locally advanced gastric adenocarcinoma between June 2005 and June 2008 were operated on in our Centre after having followed a preoperative chemoradiotherapy protocol. Data on postoperative morbidity and mortality were collected retrospectively and the dependent variables associated with the patients, the type of intervention and the tumour characteristics were analysed.
ResultsA total of 40 patients were evaluated. The overall morbidity and mortality was 32.5% (13 patients) and 2.5% (1 patient), respectively. The most frequent complications were pneumonia in 12.9% and sepsis due to the catheter in 9.7% of the patients. The risk factors for the development of complications were the body mass index (BMI 25kg/m2) and the inclusion of the pancreas and/or spleen in the resection.
ConclusionsPreoperative treatment with chemoradiotherapy in patients with locally advanced stomach cancer does not increase the incidence of post-surgical complication. The preoperative condition of the patient (BMI) and extending the surgery to the spleen and pancreas are prognostic factors of early postoperative complications.
El cáncer gástrico supone el 9,9% de todos los cánceres diagnosticados en el mundo y es el causante del 12,1% de los fallecimientos por cáncer1. Aunque la incidencia de cáncer gástrico está disminuyendo, éste sigue siendo —a nivel mundial— la segunda causa de muerte específica por cáncer2. El tratamiento quirúrgico sigue siendo la base del tratamiento de esta enfermedad, con porcentajes de supervivencia a 5 años del 15 al 35%1. En la actualidad se sigue avanzando en el mejor conocimiento de esta enfermedad, en aspectos como la extensión de la cirugía, el valor de la linfadenectomía, el régimen y secuencia óptima de quimioterapia y el impacto de las nuevas técnicas de radiación, bien sea como tratamiento neoadyuvante o adyuvante.
Las ventajas potenciales derivadas del tratamiento combinado multimodal frente a la cirugía como único tratamiento son el mejor control local de la enfermedad y el aumento de la supervivencia global3–5. El tratamiento preoperatorio parece ofrecer ventajas frente al postoperatorio, pues reduce el tamaño del tumor, facilita una resección R0 y aporta información pronóstica sobre la respuesta tumoral. Otra ventaja es que los tejidos presentan mayor sensibilidad a la radioterapia cuando se aplica antes de la acción quirúrgica6,7. Más aún, el tratamiento preoperatorio se tolera mejor cuando los pacientes no han tenido todavía la agresión quirúrgica.
En las últimas décadas se han descrito reducciones significativas del estadio tumoral (downstaging), mediante la aplicación de quimiorradioterapia preoperatoria, en pacientes con carcinoma gástrico o de la unión gastroesofágica6–8. A pesar de esto, la influencia de esta opción terapéutica en la morbimortalidad postoperatoria no se ha aclarado del todo, ya que son escasas las publicaciones que se ocupan de esta cuestión específicamente8.
El objetivo de este trabajo es analizar la frecuencia y naturaleza de las complicaciones postoperatorias en pacientes diagnosticados de adenocarcinoma gástrico localmente avanzado y tratados con quimiorradioterapia preoperatoria, así como identificar posibles factores de riesgo asociados a las complicaciones postoperatorias.
Pacientes y métodosSelección de los pacientesEntre junio de 2006 y junio de 2008 se evaluaron y se trataron en la Clínica Universidad de Navarra pacientes con diagnóstico de adenocarcinoma gástrico localmente avanzado con un protocolo de quimiorradioterapia preoperatoria. Un mismo equipo multidisciplinario de oncólogos, cirujanos y radioterapeutas atendió a todos éstos.
Los criterios de inclusión para este estudio fueron pacientes con diagnóstico histológico de adenocarcinoma gástrico o de la unión gastroesofágica en los que el estudio de la extensión de la enfermedad, de acuerdo con el sistema TNM9, reveló infiltración tumoral más allá de la capa muscular (cT3) con o sin ganglios linfáticos sospechosos de metástasis cN0-N+ en la ultrasonografía endoscópica (USE). Asimismo, también se incluyeron pacientes con grados del Eastern Cooperative Oncologic Group Performance Status10 entre 0-2 y aquellos que no habían recibido tratamiento quimioterapéutico o radioterapia previa en el abdomen. Fueron criterios adicionales de inclusión los valores de aclaramiento de la creatinina superior a 50ml/min, los niveles de enzimas hepáticos no superiores a 3 veces los valores de control y también una adecuada reserva de médula ósea, definida como recuento leucocitario superior a 3×109/l (recuento absoluto de granulocitos mayor de 1,5×109/l) y recuento de plaquetas superior a 75×109/l.
Se excluyeron del estudio aquellos pacientes con adenocarcinoma gástrico y metástasis a distancia (M1), citología peritoneal positiva o carcinomatosis. También se excluyeron pacientes con enfermedades asociadas graves (enfermedad cardiovascular, enfermedad cerebrovascular o enfermedad psiquiátrica) por considerarse que no estarían en condiciones para completar el protocolo de tratamiento. Todos los pacientes firmaron el consentimiento informado previo al tratamiento y el estudio contó con la aprobación del Comité Ético del Hospital.
El diagnóstico de adenocarcinoma gástrico se estableció mediante endoscopia alta con toma de biopsias, mientras que la tomografía axial computarizada del tórax y abdomen y la USE se utilizaron para establecer el TNM clínico de la enfermedad. Antes de iniciar el tratamiento con radioterapia se practicó laparoscopia diagnóstica a todos los pacientes para descartar enfermedad diseminada abdominal.
En todos los casos se recogió la información clínica de modo prospectivo y se almacenó en una base de datos, se prestó especial atención a las características de los pacientes (edad, sexo, índice de masa corporal [IMC] e índice American Society of Anesthesiologists [ASA, ‘Asociación Americana de Anestesiólogos’])11, del procedimiento quirúrgico (tipo y duración de la cirugía y transfusión de sangre), de la radioterapia y del tumor (estudio de extensión según la clasificación TNM) y su localización.
Tratamiento preoperatorio- 1.
Quimioterapia de inducción
Todos los pacientes recibieron 2 ciclos de quimioterapia de inducción y siguieron el esquema con docetaxel (60mg/m2), oxaliplatino (85mg/m2) y capecitabina (650mg/m2). Se realizó evaluación médica completa y recuento celular en sangre el primer día de cada ciclo.
- 2.
Quimiorradioterapia concurrente
- a)
Radioterapia
A las 3 semanas de finalizar la quimioterapia de inducción y después de realizar una laparoscopia diagnóstica se administró quimiorradioterapia concurrente. La radioterapia se aplicó según las recomendaciones de Ajani et al6, incluyendo en el volumen por irradiar el estómago, cualquier extensión perigástrica y el drenaje linfático locorregional. Técnica en 2 o 3 campos con fotones de alta energía (15MV) generados por un acelerador lineal hasta completar una dosis total de 45Gy (fracciones diarias de 1,8Gy durante 5 semanas).
- b)
Quimioterapia
Se planificó junto con la radioterapia la siguiente quimioterapia: oxaliplatino (50mg/m2 en las semanas 1, 2, 4 y 5), capecitabina (650mg/m2 de lunes a viernes, concurrente con radioterapia) y docetaxel (según la dosis en incremento escalonado en las semanas 1, 2, 4 y 5).
- a)
Cinco semanas después de la finalización del tratamiento con quimiorradioterapia y previamente a la cirugía se realizó de nuevo una tomografía axial computarizada toracoabdominal y USE alta para reevaluar el estadio clínico y valorar la respuesta al tratamiento. El mismo grupo de cirujanos realizó todas las intervenciones quirúrgicas. El tipo de cirugía dependió de la localización y de la extensión del tumor. Para los tumores en localización distal se realizó gastrectomía subtotal. Para localizaciones proximales se realizó gastrectomía total o esofagogastrectomía según la técnica de Ivor Lewis (esofagectomía con gastrectomía proximal) en casos de infiltración del esófago distal. Se realizó asimismo resección en bloque de los órganos adyacentes cuando éstos se encontraban infiltrados localmente. Se realizó una linfadenectomía D2 en la mayoría de los casos, se seccionaron los vasos gástricos izquierdos en su origen y se realizó disección de los ganglios en la región perigástrica y alrededor del tronco celíaco y sus ramas principales. Se añadió disección de los ganglios mediastínicos —por debajo de la vena ácigos— y ganglios paraesofágicos —cuando se realizó esofagogastrectomía—.
Estudio histopatológicoEl mismo patólogo realizó el examen patológico de la pieza quirúrgica y los clasificó de acuerdo con la clasificación TNM9. Se realizó un análisis estándar de todas las piezas quirúrgicas y se realizó una categorización de los hallazgos patológicos después de la quimiorradioterapia basada en una estimación de la cantidad de cáncer residual relativo a la extensión del tumor inicial. Se clasificó la respuesta tumoral de acuerdo con los criterios de Becker12.
En los casos en los que el examen patológico reveló ganglios linfáticos afectados o estadios de enfermedad avanzada, se indicó tratamiento postoperatorio basado en 3 ciclos de docetaxel, oxaliplatino y capecitabina.
ComplicacionesLas complicaciones postoperatorias se recogieron del siguiente modo: complicaciones de la herida (infección, seroma o absceso), absceso intraabdominal (confirmado por imagen radiológica), fuga de la anastomosis (considerada cuando se presentaron manifestaciones clínicas y requirió tratamiento), hemorragia postoperatoria, fuga pancreática (diagnosticada por valores altos de amilasa en el drenaje), complicaciones generales (cardiovasculares, sepsis por catéter o trombosis) y complicaciones pulmonares (confirmada por radiología). Se consideró mortalidad operatoria aquélla ocurrida durante los primeros 30 días posteriores a la cirugía o durante la estancia hospitalaria.
Análisis estadísticoDurante todo el estudio el mismo cirujano supervisó la recogida de datos. Las variables categóricas se analizaron con tablas de contingencia y χ2 o probabilidad exacta de Fisher, según los casos. Las variables continuas se analizaron mediante el test de la t de Student. La asociación entre variables independientes y complicaciones se analizó mediante regresión logística. Los valores de p menor de 0,05 se consideraron como estadísticamente significativos. El análisis de los datos se realizó con el programa SPSS versión 14.0 (SPSS, Chicago, Illinois).
ResultadosCaracterísticas de los pacientesDurante el período comprendido entre junio 2006 y junio 2008 se intervinieron 69 pacientes en la Clínica Universidad de Navarra con diagnóstico de adenocarcinoma gástrico, de los cuales 43 se incluyeron en el protocolo de quimiorradioterapia neoadyuvante, y se excluyeron de este trabajo 3 pacientes (2 por presentar progresión de la enfermedad durante el tratamiento y uno por no aceptar la intervención). La tabla 1 muestra las características de los pacientes.
Características de los pacientes
| Número de pacientes | 40 | 100% |
| Edad | ||
| <50 años | 11 | 27,5 |
| 51–65 años | 19 | 47,5 |
| >65 años | 10 | 25,0 |
| Sexo | ||
| Masculino | 32 | 80,0 |
| Femenino | 8 | 20,0 |
| ASA | ||
| I+II | 13 | 32,5 |
| III+IV | 27 | 67,5 |
| Localización tumoral | ||
| Proximal | 16 | 40,0 |
| Media | 6 | 15,0 |
| Distal | 6 | 15,0 |
| Difuso | 12 | 30,0 |
| Estadio TNM clínico | ||
| 0 | – | – |
| IA | – | – |
| IB | – | – |
| II | 5 | 12,5 |
| IIIA | 17 | 42,5 |
| IIIB | 1 | 2,5 |
| IV | 17 | 42,5 |
| Tipo de cirugía | ||
| Gastrectomía subtotal | 10 | 25,0 |
| Gastrectomía total | 19 | 47,5 |
| Gastrectomía+esplenectomía | 10 | 25,0 |
| Gastrectomía+pancreatectomía | 1 | 2,5 |
ASA: American Society of Anesthesiologists; TNM: tumor, node, metastasis system.
En la tabla 1 se muestran, de igual modo, los tipos de intervención realizadas. Se realizó gastrectomía total en 19 pacientes (47,5%); fue preciso realizar en un caso esofagogastrectomía según la técnica de Ivor Lewis por invasión tumoral del esófago distal. De éstos, en 14 casos (35%) el tumor se encontraba en la unión gastroesofágica. Se realizó gastrectomía subtotal en 10 pacientes (25%) y otros 10 pacientes (25%) requirieron una gastrectomía ampliada del bazo o del páncreas por invasión tumoral. La duración media de la intervención fue de 180 min (rango: 40–370). La media de ganglios linfáticos resecados fue de 16 (rango: 2–59), se realizó linfadenectomía D2 en el 90% de la serie. En 23 casos los pacientes ingresaron en la unidad de cuidados intensivos después de la cirugía y en 5 casos (12,5%) requirieron transfusión de hematíes con una pérdida hemática media estimada en quirófano de 300ml (rango: 50–1.700). Se realizó resección R0 en 36 casos (90%), resecciones paliativas R1 en 3 casos (7,5%) y R2 en un caso (2,5%). En el 55% de los casos se detectó una respuesta patológica mayor (según criterios de Becker) en el análisis anatomopatológico de las piezas quirúrgicas.
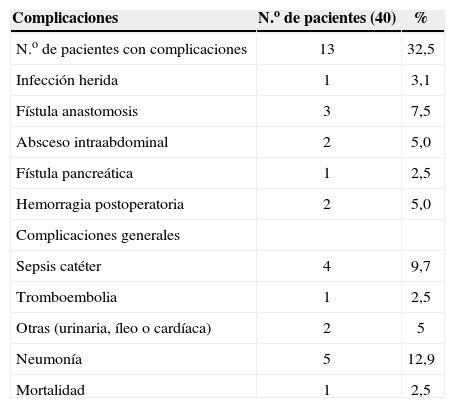
ComplicacionesLa morbilidad global fue del 32,5% y se encontraron complicaciones postoperatorias en 13 pacientes. Las complicaciones encontradas se detallan en la tabla 2. Las 2 complicaciones más frecuentes fueron la neumonía y la infección proveniente de catéter intravenoso. De igual modo se encontró asociación estadísticamente significativa entre obesidad e infección de herida (p = 0,027). Se reintervinieron 3 pacientes (8,8%) y la estancia media hospitalaria fue de 10 días (rango: 5–33). Un paciente falleció en el período postoperatorio (2,5%), la causa de la muerte fue fracaso pulmonar secundario a una aspiración masiva tras endoscopia.
Morbilidad y mortalidad operatoria
| Complicaciones | N.o de pacientes (40) | % |
| N.o de pacientes con complicaciones | 13 | 32,5 |
| Infección herida | 1 | 3,1 |
| Fístula anastomosis | 3 | 7,5 |
| Absceso intraabdominal | 2 | 5,0 |
| Fístula pancreática | 1 | 2,5 |
| Hemorragia postoperatoria | 2 | 5,0 |
| Complicaciones generales | ||
| Sepsis catéter | 4 | 9,7 |
| Tromboembolia | 1 | 2,5 |
| Otras (urinaria, íleo o cardíaca) | 2 | 5 |
| Neumonía | 5 | 12,9 |
| Mortalidad | 1 | 2,5 |
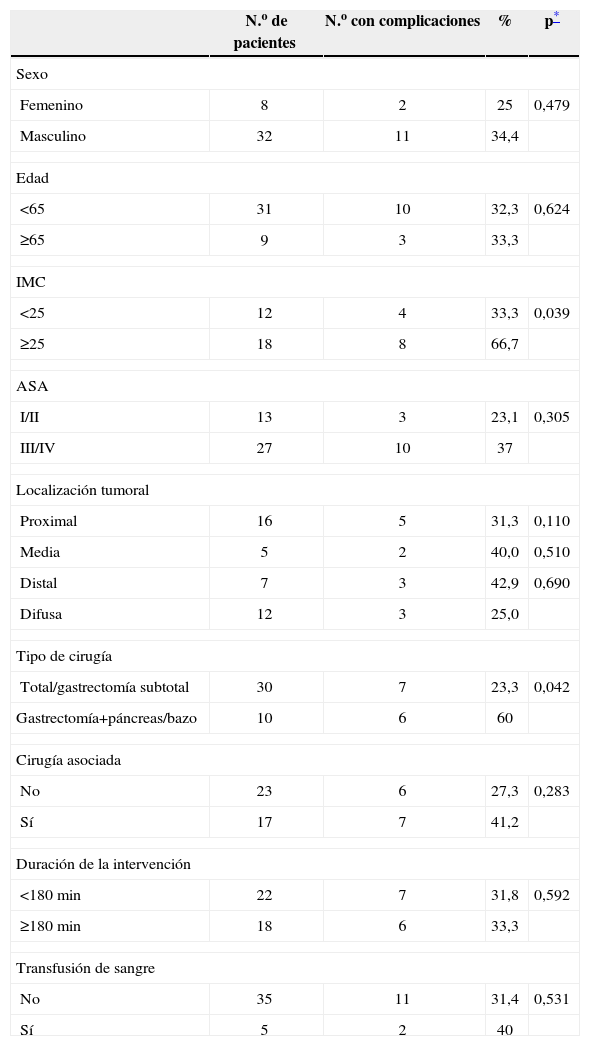
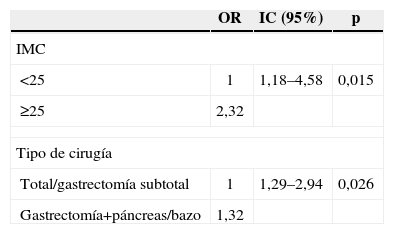
Los resultados del análisis univariante y multivariante relacionados con las variables asociadas a los pacientes, intervención quirúrgica y localización tumoral se muestran en las tablas 3 y 4. De entre todas las variables, las únicas que en este estudio se identificaron como posibles factores independientes de riesgo de complicaciones fueron la extensión de la cirugía del páncreas o del bazo y el IMC superior a 25kg/m2.
Análisis univariante
| N.o de pacientes | N.o con complicaciones | % | p* | |
| Sexo | ||||
| Femenino | 8 | 2 | 25 | 0,479 |
| Masculino | 32 | 11 | 34,4 | |
| Edad | ||||
| <65 | 31 | 10 | 32,3 | 0,624 |
| ≥65 | 9 | 3 | 33,3 | |
| IMC | ||||
| <25 | 12 | 4 | 33,3 | 0,039 |
| ≥25 | 18 | 8 | 66,7 | |
| ASA | ||||
| I/II | 13 | 3 | 23,1 | 0,305 |
| III/IV | 27 | 10 | 37 | |
| Localización tumoral | ||||
| Proximal | 16 | 5 | 31,3 | 0,110 |
| Media | 5 | 2 | 40,0 | 0,510 |
| Distal | 7 | 3 | 42,9 | 0,690 |
| Difusa | 12 | 3 | 25,0 | |
| Tipo de cirugía | ||||
| Total/gastrectomía subtotal | 30 | 7 | 23,3 | 0,042 |
| Gastrectomía+páncreas/bazo | 10 | 6 | 60 | |
| Cirugía asociada | ||||
| No | 23 | 6 | 27,3 | 0,283 |
| Sí | 17 | 7 | 41,2 | |
| Duración de la intervención | ||||
| <180min | 22 | 7 | 31,8 | 0,592 |
| ≥180min | 18 | 6 | 33,3 | |
| Transfusión de sangre | ||||
| No | 35 | 11 | 31,4 | 0,531 |
| Sí | 5 | 2 | 40 | |
ASA: American Society of Anesthesiologists; IMC: índice de masa corporal (kg/m2).
Las complicaciones postoperatorias secundarias a la cirugía gástrica son frecuentes, y se encuentra en la literatura médica una variación entre el 19 y el 63%, que depende de la población seleccionada, la experiencia quirúrgica, las intervenciones realizadas y el criterio utilizado para diagnosticar las complicaciones8,13–18. Aunque algunos cirujanos consideran que el tratamiento neoadyuvante incrementa la incidencia de complicaciones postoperatorias en el cáncer gástrico, no existe evidencia al respecto y únicamente se dispone de un estudio que analiza específicamente la influencia de la quimiorradioterapia en la morbilidad y mortalidad postoperatoria8.
El porcentaje de complicaciones postoperatorias encontradas en este trabajo fue del 32,5%; lo que concuerda con lo publicado previamente por nosotros para enfermos tratados sólo con cirugía19 y por Fujitani et al8 para un grupo de enfermos de similares características y con protocolo de quimiorradioterapia preoperatoria. Estos resultados demuestran, por lo tanto, que el tratamiento neoadyuvante, además de mejorar los resultados a largo plazo en cuanto a supervivencia y recidiva local3,7,20, no incrementa el índice de complicaciones postoperatorias precoces tras la cirugía.
A su vez, cuando analizamos la frecuencia de las complicaciones quirúrgicas postoperatorias mayores en los enfermos con quimiorradioterapia preoperatoria encontramos que los resultados están dentro de los publicados previamente por centros con experiencia en el mundo occidental, y el porcentaje para la fuga de anastomosis es del 1,2–8,1%; del 1,8–4,2% para el absceso intraabdominal; del 0,2–5,3% para la fístula pancreática; del 1,1–3,9% para la infección de herida y del 1,2–1,9% para la hemorragia intraabdominal postoperatoria.
Cabe destacar que la mayoría de las complicaciones se resolvieron bien con tratamiento médico. Las causas principales de reintervención fueron el absceso intraabdominal por fístula anastomótica y la hemorragia intraabdominal. Todos estos pacientes se recuperaron satisfactoriamente, sin mortalidad postoperatoria, aunque para algunos autores la necesidad de reintervención a causa de una fístula esofagoyeyunal o de un absceso intraabdominal son factores que incrementan significativamente la mortalidad postoperatoria18.
Revisiones de estudios no aleatorizados21 indican que la evolución de los pacientes con fuga de una anastomosis es mejor cuando el tratamiento de esta complicación es conservador con drenaje percutáneo. En cualquier caso, no parece, a la vista de nuestros resultados, que el tratamiento con quimiorradioterapia neoadyuvante incremente significativamente el riesgo de fístula (7,5%). Aunque somos conscientes de las limitaciones de este estudio, nuestros hallazgos apoyan esta evidencia hallada en la literatura médica8,22,23.
Hasta la fecha se han investigado las complicaciones postoperatorias en enfermos con cáncer gástrico en los que se realizó linfadenectomía D2. De todos éstos, la resección pancreática asociada a la cirugía gástrica fue el factor más destacado que se asocia a complicaciones24,25. Asimismo, algunos trabajos de la década de 1990 demostraron que la esplenectomía era un factor negativo en relación con la morbilidad y la mortalidad postoperatoria26,27. Este hecho fue posteriormente confirmado en 2 estudios europeos aleatorizados que comparaban la linfadenectomía D1 frente a la D224,28. En este sentido, en un trabajo publicado por nuestro grupo no encontramos diferencias significativas en cuanto a complicaciones postoperatorias cuando se comparaban la linfadenectomía limitada D1 frente a la ampliada D2, lo que mejora los resultados en cuanto a supervivencia para el abordaje D229.
En la actualidad, no está claro si los pacientes con tumores en estadios avanzados se benefician más de la preservación esplénica o de una esplenectomía en combinación con pancreatectomía distal como parte de una resección en bloque, tal como algunos cirujanos han propuesto. En este trabajo, la pancreatectomía y la esplenectomía resultaron ser factores de riesgo independientes de complicaciones, lo que confirma de esta manera nuestros hallazgos previos publicados en el año 2006 para 434 pacientes con cáncer gástrico tratados sólo con cirugía19. En 10 pacientes de los tratados con quimiorradioterapia preoperatoria resultó necesario realizar una esplenectomía o una pancreatectomía parcial por invasión tumoral.
Dada la escasez de evidencias acerca de la mejoría de la supervivencia en los estudios publicados en el mundo occidental y el incremento importante de las complicaciones derivadas de este tipo de intervención (como son la fístula pancreática, el absceso intraabdominal y la hemorragia), no es recomendable este procedimiento como estándar para los tumores avanzados. Nuestra tendencia en los últimos años fue disminuir la frecuencia de gastrectomías ampliadas, a pesar de presentar este estudio tumores con estadios clínicos avanzados. Este hecho viene avalado por la buena respuesta patológica encontrada en los pacientes con quimiorradioterapia preoperatoria.
Los factores relacionados con las características de los pacientes como son edad, sexo, riesgo anestésico ASA, localización tumoral y estadio TNM clínico resultaron ser irrelevantes en el estudio multivariante. El único factor asociado a un mayor riesgo de complicaciones postoperatorias fue el IMC superior a 25kg/m2. Este resultado confirma igualmente nuestros hallazgos para pacientes tratados solamente con cirugía19 y con los publicados por otros autores30. Más aún, es importante señalar que hemos encontrado una asociación significativa (p=0,027) entre obesidad e infección de herida (seroma e infección) probablemente debido a factores metabólicos o diabetes coexistente.
En resumen, las complicaciones más frecuentes encontradas en pacientes operados con cáncer de estómago fueron aquéllas no relacionadas específicamente con la cirugía, sino con complicaciones generales, como la neumonía y la infección asociada a catéteres. La utilización de quimiorradioterapia en pacientes seleccionados con adenocarcinoma gástrico localmente avanzado no se asocia a un mayor porcentaje de complicaciones iniciales postoperatorias. El estado preoperatorio de los pacientes, especialmente el IMC, y la extensión de la cirugía del páncreas y del bazo son los factores más determinantes de complicaciones postoperatorias, por lo que las decisiones sobre el tipo de cirugía por realizar y un mejor control preoperatorio de las variables dependientes del paciente están directamente relacionados con mejoras en los resultados.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.