De las posibles complicaciones tras una duodenopancreatectomía cefálica (DPC), la fístula pancreática postoperatoria (FPP) clínicamente relevante es la más importante, especialmente en enfermos con páncreas de consistencia blanda. El objetivo principal de este trabajo es analizar las diferentes complicaciones posquirúrgicas, haciendo especial hincapié en la tasa de FPP sobre páncreas blandos con riesgo de FPP moderado/alto, y su incidencia entre los dos tipos distintos de sutura empleados por nuestro grupo (clásica vs. anastomosis ducto-mucosa reforzada [REDMA]).
MétodosEstudio observacional retrospectivo, entre enero de 2017 y marzo 2020, de pacientes sometidos a DPC en nuestra unidad tras aplicar los criterios de inclusión y exclusión. Análisis de factores preoperatorios, intraoperatorios y de complicaciones postoperatorias observados durante el seguimiento.
ResultadosMuestra de 34 pacientes; el 67,6% (n = 23) de ellos bajo el protocolo clásico y el 32,4% (n = 11) con REDMA. La única complicación posquirúrgica en la que se obtuvo repercusión estadística, sin existir diferencias entre casos y controles en cuanto al riesgo de FPP, en favor de la anastomosis REDMA es el de FPP. Gracias a esta innovación quirúrgica, tanto las complicaciones a partir del estadio IIIb, según la clasificación de Clavien-Dindo, como la estancia media hospitalaria se han visto también reducidas con significación estadística.
ConclusionesAl reducir REDMA la tasa de FPP en pacientes con moderado/alto riesgo quirúrgico de la misma, consideramos que es una alternativa útil a tener en cuenta en la reconstrucción del tránsito tras una DPC.
Of the possible complications after a cephalic duodenopancreatectomy (CPD), the clinically relevant postoperative pancreatic fistula (PPF) is the most important, especially in patients with pancreas of a soft consistency. The main objective of this work is to analyze the different postsurgical complications, with special emphasis on the rate of PPF on soft pancreas with a risk of moderate/high PPF, and its incidence between the two different types of sutures used by our group (classic vs reinforced duct-mucosa anastomosis [REDMA]).
MethodsRetrospective observational study, between January 2017 and March 2020, of patients undergoing CPD in our unit after applying the inclusion and exclusion criteria. Analysis of preoperative, intraoperative factors and postoperative complications observed during follow-up.
ResultsSample of 34 patients; 67.6% (n = 23) of them under the classic protocol and 32.4% (n = 11) with REDMA. The only post-surgical complication in which we obtained statistical repercussion, without differences between cases and controls in terms of the risk of FPP, in favor of the REDMA anastomosis is that of FPP. Thanks to this surgical innovation, both the complications from stage IIIb, according to the Clavien-Dindo classification, and the mean hospital stay have also been reduced with statistical significance.
ConclusionsWhen REDMA reduces the rate of PPF in patients with moderate/high surgical risk of it, we consider it to be a useful alternative to consider in the reconstruction of transit after CPD.
La forma en la que se restablece la continuidad del tubo digestivo después de una duodenopancreatectomía cefálica (DPC) continúa siendo el día de hoy un importante desafío. Es sabido que la complejidad de los distintos tipos de reconstrucción empleados, dadas las características intrínsecas del páncreas, se asocia con un porcentaje no desdeñable de complicaciones1,2, siendo el talón de Aquiles de esta cirugía. Entre las posibles complicaciones, la fístula pancreática postoperatoria (FPP) clínicamente relevante es la más importante2,3, especialmente en enfermos con páncreas de consistencia blanda. Esta circunstancia es la que hizo plantear un cambio en el proceso anastomótico utilizado.
En este artículo se describe la modificación de la técnica de referencia (anastomosis pancreáticoyeyunal ducto-mucosa tutorizada con catéter externo), realizada en nuestra unidad. Esta innovación consiste en una sutura pancreáticoyeyunal con tutorización externa reforzada con malla biológica (Integra SurgiMend 1.0®, www.surgimend.com)4,5.
El objetivo principal de este trabajo es analizar las diferentes complicaciones posquirúrgicas, haciendo especial hincapié en la tasa de FPP sobre páncreas blandos con riesgo de FPP moderado/alto, y su incidencia entre los dos tipos distintos de sutura empleados (clásica vs. REDMA).
A este tipo de anastomosis la hemos denominado reinforced duct-mucosa anastomosis (REDMA).
MétodosSujetos de estudioSe presentan los primeros resultados de un estudio de cohortes histórico observacional y analítico, conformado por casos (muestra comprendida por los pacientes sometidos al nuevo protocolo de reconstrucción pancreatoyeyunal) y controles (muestra comprendida por los pacientes sometidos al protocolo clásico). Los datos se recogieron a partir de las historias clínicas entre enero de 2017 y marzo 2020, tras aplicar los criterios de inclusión (edad > 18 años y < de 80 años, patología [maligna o benigna] en la cabeza pancreática que precise DPC tipo Whipple, páncreas blando y con riesgo moderado/alto de FPP)6 y exclusión (páncreas duro) del estudio. A continuación, se exponen las variables recogidas en el estudio. Variables sociodemográficas: edad, sexo, índice de masa corporal (IMC), clasificación ASA y riesgo de FPP6. Variables preoperatorias: dolor abdominal, diabetes mellitus (DM), síndrome constitucional, ictericia, drenaje prequirúrgico de la vía biliar principal, hemoglobina, albúmina, CA 19.9, tomografía computarizada (TC), ecoendoscopia (USE), punción aspiración con aguja fina (PAAF) de la tumoración pancreática. Variables quirúrgicas: técnica quirúrgica, hemorragia intraoperatoria, consistencia del páncreas, tamaño del conducto de Wirsung y tipo de anastomosis para la reconstrucción del tránsito gastrointestinal. Variables postoperatorias: inicio de tolerancia oral, fístula pancreática, fístula biliar, pancreatitis del muñón, retraso del vaciamiento gástrico (RVG), hemorragia digestiva alta (HDA), hemorragia intraabdominal (HIA), colección intraabdominal, infección de herida quirúrgica, reintervención quirúrgica, estancia hospitalaria, éxitus, histología, número de ganglios y clasificación para las complicaciones posquirúrgicas de Clavien-Dindo7.
Técnica quirúrgicaEsta novedad técnica (REDMA) está indicada para todos aquellos pacientes sometidos a una DPC con riesgo moderado/alto de FPP y hallazgo operatorio de páncreas blando. Dado que en nuestro centro todavía no existe un método objetivo validado para la medición de la consistencia del páncreas, se decidió, basándonos en la bibliografía existente, que la evaluación de la textura pancreática se realizaría en el acto quirúrgico y de forma subjetiva por el equipo de cirujanos, ya que dicha medida es sabido que se correlaciona de forma adecuada con las medidas objetivas y el riesgo de aparición de FPP8.
SurgiMend® es una matriz dérmica acelular, esto le permite no provocar una respuesta inflamatoria aguda o crónica a cuerpo extraño que conduzca a la degradación o rechazo del implante, y por tanto, ofrece ventajas sobre los productos sintéticos y otros biológicos para la reconstrucción de tejidos blandos, como puede ser la glándula pancreática. Se genera a partir de la dermis bovina fetal o neonatal y está compuesta por colágeno tipo I y tipo III, lo que le aporta una excelente resistencia mecánica. Además, la matriz permite el secuestro de las células y factores de crecimiento, favoreciendo la rápida vascularización del mismo para un refuerzo prolongado. La cola quirúrgica Glubran 2® es un dispositivo médico quirúrgico de clase III (uso quirúrgico interno y externo), conforme a los requisitos de la Disposición Europea 93/42/CEE y sucesivas actualizaciones. Glubran 2® es un producto sintético con una base cianoacrílica, gracias a ello tiene unas marcadas propiedades hemostáticas y adhesivas. Además, una vez solidificada, realiza una eficaz barrera antiséptica frente a los agentes infecciosos o patógenos más frecuentes. En contacto con tejido vivo y en ambiente húmedo polimeriza rápidamente (de dos a 90 segundos), creando una película elástica e impermeable de elevada resistencia de tensión que garantiza una sólida adhesión de los tejidos. No se daña por la sangre ni por los líquidos orgánicos. La película, una vez solidificada, puede ser fácilmente atravesada con una aguja de sutura, ya que la polimerización del producto no da origen a agregados cristalinos. Una vez sólida, la cola ya no tiene ningún poder adhesivo.
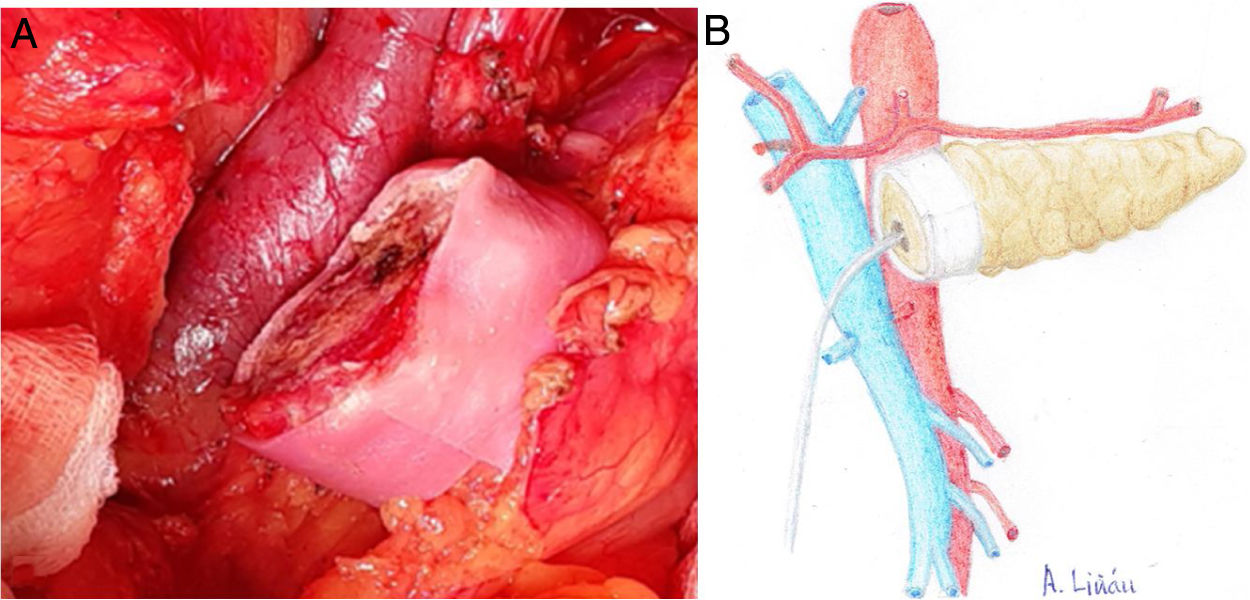
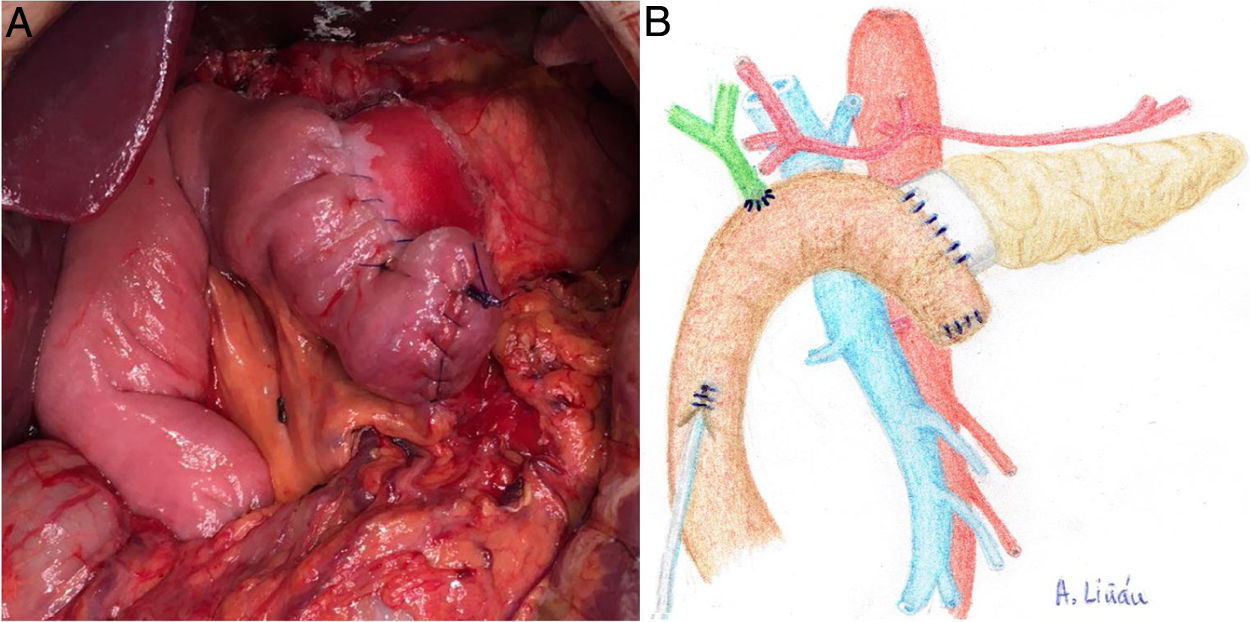
Una vez seccionado el páncreas a nivel del cuello quirúrgico, disecar la cara posterior (de la vena esplénica), el borde superior (de la arteria esplénica y vena gástrica) y el borde inferior (del retroperitoneo) del mismo en unos 2 y 3 cm de longitud, asegurando una correcta hemostasia para evitar problemas de mala adhesión de la malla biológica (Integra SurgiMend 1.0®). Se diseña un rectángulo de la misma una vez hidratada, cinco minutos en suero fisiológico, para su adecuado uso con las dimensiones apropiadas (el ancho de la misma será de entre 1 y 3 cm). Esto dependerá de las características de cada páncreas para poder abarcar todo su perímetro, a modo de bufanda. Acto seguido, se aplica la cola quirúrgica Glubran 2® en la parte media de una de las caras del rectángulo de la malla, para después aponerla contra la cara posterior del páncreas y comprimir ambas estructuras durante 30 segundos (fig. 1a, b). Una vez adherida, proceder a aplicar pegamento en el resto del rectángulo de malla para realizar la misma operación con el borde superior, inferior y la cara anterior del páncreas (fig. 2a, b). Cuando la malla se ha adherido al cuerpo pancreático, procederemos a realizar la sutura pancreáticoyeyunal termino-lateral ducto-mucosa con tutorización externa (fig. 3a, b) en los siguientes términos:
- -
Sutura cara posterior continua con monofilamento no absorbible 3/0.
- -
Sutura ducto-mucosa cara posterior a puntos sueltos con monofilamento absorbible 4-5/0.
- -
Tutorización externa con sonda nasogástrica pediátrica. Tamaño de la misma a demanda, según diámetro del conducto de Wirsung.
- -
Sutura ducto-mucosa cara anterior a puntos sueltos con monofilamento absorbible 4-5/0.
- -
Sutura cara anterior continua con monofilamento no absorbible 3/0.
a) Imagen intraoperatoria de la colocación de la malla biológica en cara posterior del cuerpo pancreático. b) Dibujo representativo de la fig. 1a.
a) Imagen intraoperatoria de la disposición final de la malla biológica en el remanente pancreático. b) Dibujo representativo de la fig. 2a.
a) Imagen intraoperatoria tras finalizar REDMA. b) Dibujo representativo de la fig. 3a.
El análisis estadístico de los datos se realizó empleando el programa SPSS® (versión 23.0; SPSS Inc., Armonk, NY, EE. UU.). El nivel de significación estadística se estableció al 5% (p < 0,05). El análisis descriptivo de las variables cualitativas se realizó mediante frecuencias y porcentajes. Las variables cuantitativas fueron analizadas para comprobar su normalidad usando el test de Shapiro-Wilks y se describieron usando medidas de tendencia central como medias y desviaciones típicas o medianas y rangos, según corresponda. Para estudiar la relación entre una variable cualitativa nominal dicotómica y una cuantitativa normal, se utilizó la prueba «T» de comparación de medias en grupos independientes, basada en la ley de Student-Fisher. Se utilizaron pruebas no paramétricas (U de Mann-Whitney en grupos independientes), cuando la distribución de alguna de las variables vulneraba los supuestos de normalidad e igualdad de varianzas. En el análisis bivariante, se utilizó la prueba de independencia para comparar proporciones observadas en grupos independientes (χ2, asociación entre dos variables cualitativas), verificándose las condiciones de aplicación (efectivos esperados no inferiores a cinco, o no inferiores a tres empleando corrección de Yates), cuando no se cumplieron las mismas se empleó la prueba exacta de Fisher.
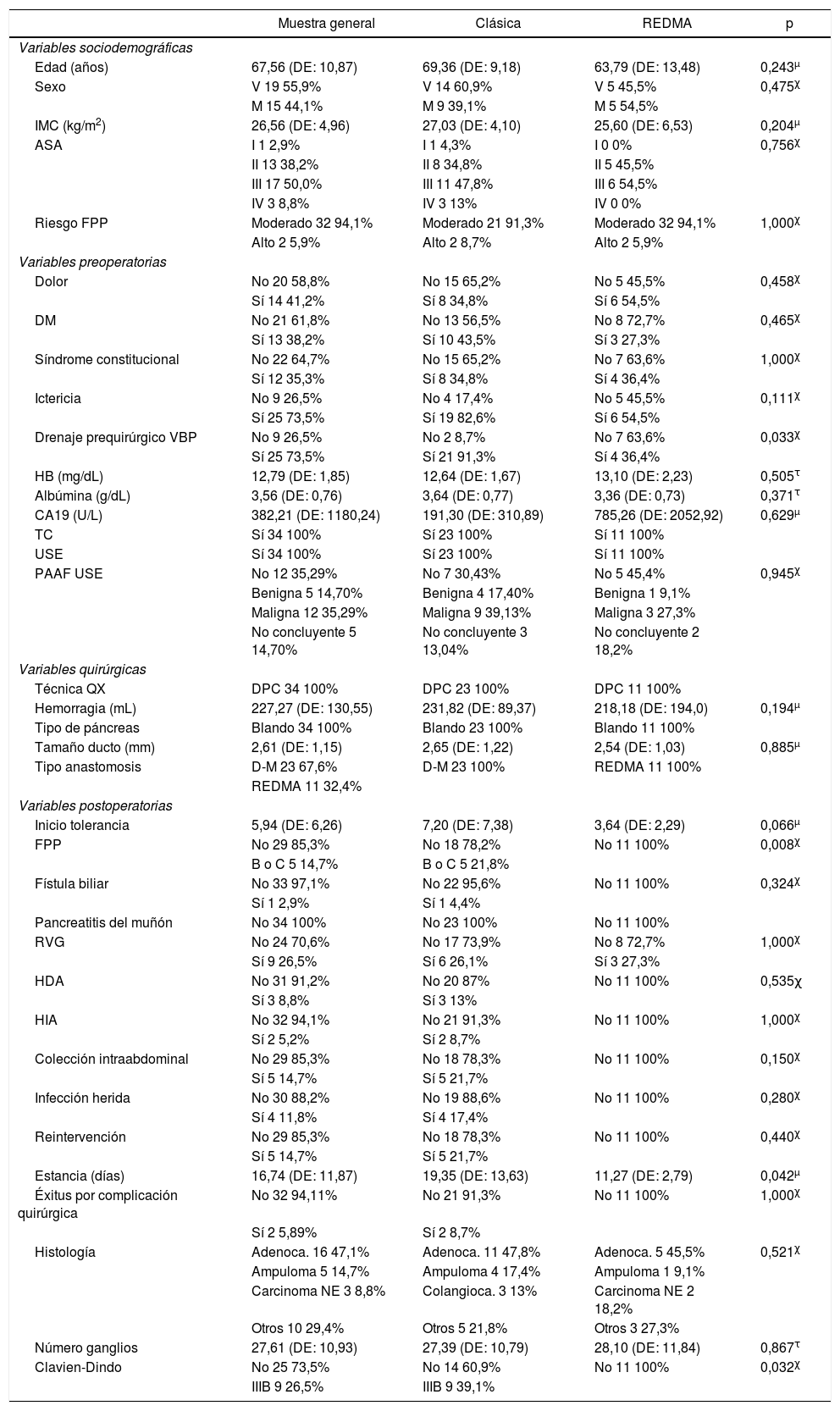
ResultadosSe obtuvo una muestra de 34 pacientes; el 67,6% (n = 23) de ellos bajo el protocolo clásico y el 32,4% (n = 11) con REDMA. En la muestra general, 55,9% (n = 19) de los pacientes son hombres. La edad media de la muestra general es de 67,56 años (DE: 10,87), no siguiendo una distribución normal (p = 0,011). La sintomatología más frecuentemente expresada al diagnóstico fue la ictericia 73,5% (n = 25) y el dolor 41,2% (n = 14). El diagnóstico anatomopatológico definitivo más frecuente fue el de adenocarcinoma de cabeza de páncreas, con un 47,1% (n = 16), seguido del de adenocarcinoma intraampular con un 14,7% (n = 5). En todos los casos, se realizó DPC, mediante abordaje laparotómico, tipo Whipple, con reconstrucción en Y de Roux. Solo un paciente precisó resección venosa y el 100% (n = 34) de los casos son pacientes con páncreas blandos (tabla 1).
Características de la muestra general, la sometida a anastomosis clásica y la realizada con REDMA. χ, τ, μ Comparaciones de casos y controles
| Muestra general | Clásica | REDMA | p | |
|---|---|---|---|---|
| Variables sociodemográficas | ||||
| Edad (años) | 67,56 (DE: 10,87) | 69,36 (DE: 9,18) | 63,79 (DE: 13,48) | 0,243μ |
| Sexo | V 19 55,9% | V 14 60,9% | V 5 45,5% | 0,475χ |
| M 15 44,1% | M 9 39,1% | M 5 54,5% | ||
| IMC (kg/m2) | 26,56 (DE: 4,96) | 27,03 (DE: 4,10) | 25,60 (DE: 6,53) | 0,204μ |
| ASA | I 1 2,9% | I 1 4,3% | I 0 0% | 0,756χ |
| II 13 38,2% | II 8 34,8% | II 5 45,5% | ||
| III 17 50,0% | III 11 47,8% | III 6 54,5% | ||
| IV 3 8,8% | IV 3 13% | IV 0 0% | ||
| Riesgo FPP | Moderado 32 94,1% | Moderado 21 91,3% | Moderado 32 94,1% | 1,000χ |
| Alto 2 5,9% | Alto 2 8,7% | Alto 2 5,9% | ||
| Variables preoperatorias | ||||
| Dolor | No 20 58,8% | No 15 65,2% | No 5 45,5% | 0,458χ |
| Sí 14 41,2% | Sí 8 34,8% | Sí 6 54,5% | ||
| DM | No 21 61,8% | No 13 56,5% | No 8 72,7% | 0,465χ |
| Sí 13 38,2% | Sí 10 43,5% | Sí 3 27,3% | ||
| Síndrome constitucional | No 22 64,7% | No 15 65,2% | No 7 63,6% | 1,000χ |
| Sí 12 35,3% | Sí 8 34,8% | Sí 4 36,4% | ||
| Ictericia | No 9 26,5% | No 4 17,4% | No 5 45,5% | 0,111χ |
| Sí 25 73,5% | Sí 19 82,6% | Sí 6 54,5% | ||
| Drenaje prequirúrgico VBP | No 9 26,5% | No 2 8,7% | No 7 63,6% | 0,033χ |
| Sí 25 73,5% | Sí 21 91,3% | Sí 4 36,4% | ||
| HB (mg/dL) | 12,79 (DE: 1,85) | 12,64 (DE: 1,67) | 13,10 (DE: 2,23) | 0,505τ |
| Albúmina (g/dL) | 3,56 (DE: 0,76) | 3,64 (DE: 0,77) | 3,36 (DE: 0,73) | 0,371τ |
| CA19 (U/L) | 382,21 (DE: 1180,24) | 191,30 (DE: 310,89) | 785,26 (DE: 2052,92) | 0,629μ |
| TC | Sí 34 100% | Sí 23 100% | Sí 11 100% | |
| USE | Sí 34 100% | Sí 23 100% | Sí 11 100% | |
| PAAF USE | No 12 35,29% | No 7 30,43% | No 5 45,4% | 0,945χ |
| Benigna 5 14,70% | Benigna 4 17,40% | Benigna 1 9,1% | ||
| Maligna 12 35,29% | Maligna 9 39,13% | Maligna 3 27,3% | ||
| No concluyente 5 14,70% | No concluyente 3 13,04% | No concluyente 2 18,2% | ||
| Variables quirúrgicas | ||||
| Técnica QX | DPC 34 100% | DPC 23 100% | DPC 11 100% | |
| Hemorragia (mL) | 227,27 (DE: 130,55) | 231,82 (DE: 89,37) | 218,18 (DE: 194,0) | 0,194μ |
| Tipo de páncreas | Blando 34 100% | Blando 23 100% | Blando 11 100% | |
| Tamaño ducto (mm) | 2,61 (DE: 1,15) | 2,65 (DE: 1,22) | 2,54 (DE: 1,03) | 0,885μ |
| Tipo anastomosis | D-M 23 67,6% | D-M 23 100% | REDMA 11 100% | |
| REDMA 11 32,4% | ||||
| Variables postoperatorias | ||||
| Inicio tolerancia | 5,94 (DE: 6,26) | 7,20 (DE: 7,38) | 3,64 (DE: 2,29) | 0,066μ |
| FPP | No 29 85,3% | No 18 78,2% | No 11 100% | 0,008χ |
| B o C 5 14,7% | B o C 5 21,8% | |||
| Fístula biliar | No 33 97,1% | No 22 95,6% | No 11 100% | 0,324χ |
| Sí 1 2,9% | Sí 1 4,4% | |||
| Pancreatitis del muñón | No 34 100% | No 23 100% | No 11 100% | |
| RVG | No 24 70,6% | No 17 73,9% | No 8 72,7% | 1,000χ |
| Sí 9 26,5% | Sí 6 26,1% | Sí 3 27,3% | ||
| HDA | No 31 91,2% | No 20 87% | No 11 100% | 0,535χ |
| Sí 3 8,8% | Sí 3 13% | |||
| HIA | No 32 94,1% | No 21 91,3% | No 11 100% | 1,000χ |
| Sí 2 5,2% | Sí 2 8,7% | |||
| Colección intraabdominal | No 29 85,3% | No 18 78,3% | No 11 100% | 0,150χ |
| Sí 5 14,7% | Sí 5 21,7% | |||
| Infección herida | No 30 88,2% | No 19 88,6% | No 11 100% | 0,280χ |
| Sí 4 11,8% | Sí 4 17,4% | |||
| Reintervención | No 29 85,3% | No 18 78,3% | No 11 100% | 0,440χ |
| Sí 5 14,7% | Sí 5 21,7% | |||
| Estancia (días) | 16,74 (DE: 11,87) | 19,35 (DE: 13,63) | 11,27 (DE: 2,79) | 0,042μ |
| Éxitus por complicación quirúrgica | No 32 94,11% | No 21 91,3% | No 11 100% | 1,000χ |
| Sí 2 5,89% | Sí 2 8,7% | |||
| Histología | Adenoca. 16 47,1% | Adenoca. 11 47,8% | Adenoca. 5 45,5% | 0,521χ |
| Ampuloma 5 14,7% | Ampuloma 4 17,4% | Ampuloma 1 9,1% | ||
| Carcinoma NE 3 8,8% | Colangioca. 3 13% | Carcinoma NE 2 18,2% | ||
| Otros 10 29,4% | Otros 5 21,8% | Otros 3 27,3% | ||
| Número ganglios | 27,61 (DE: 10,93) | 27,39 (DE: 10,79) | 28,10 (DE: 11,84) | 0,867τ |
| Clavien-Dindo | No 25 73,5% | No 14 60,9% | No 11 100% | 0,032χ |
| IIIB 9 26,5% | IIIB 9 39,1% | |||
χ: χ2; τ: t de Student; μ: U de Mann-Whitney.
IMC: índice de masa corporal; ASA: American Society of Anesthesiologists; FPP: fístula pancreática postoperatoria; DM: diabetes mellitus; DPC: duodenopancreatectomía cefálica; VBP: vía biliar principal; HB: hemoglobina; CA: antígeno carbohidrato; TC: tomografía computarizada; USE: ecoendoscopia digestiva alta; PAAF: punción aspiración con aguja fina; RVG: retraso del vaciamiento gástrico; HDA: hemorragia digestiva alta; HIA: hemorragia intraabdominal.
Partiendo de la base de que no existen diferencias estadísticas entre casos y controles en cuanto al riesgo de FPP utilizando el score clínico de Callery6, se exponen las complicaciones específicas de esta cirugía para cada uno de los grupos. En cuanto a la técnica clásica obtenemos que la FPP clínicamente relevante es del 21,8% (n = 5), siendo del tipo B 8,8% (n = 2) y del C 13% (n = 3). Por el contrario, acerca de la técnica REDMA los datos de FPP clínicamente relevante son del 0% con un 9,1% (n = 1) del tipo fístula bioquímica (tabla 1).
La única complicación posquirúrgica en la que se obtuvo repercusión estadística significativa en favor de la anastomosis REDMA, tras aplicar el análisis bivariante es el de FPP con p = 0,008 (p < 0,05). Derivado de esto, observamos que tanto las complicaciones posquirúrgicas a partir del estadio IIIb (basándonos en la clasificación de Clavien-Dindo), como la estancia hospitalaria, se vieron reducidas gracias a esta innovación con significación estadística, p = 0,032 y 0,042 (p < 0,05), respectivamente. Se pasa de un 39,1% (n = 9) al 0% en el caso de las complicaciones, y de 19,35 (DE: 13,63) días a 11,27 (DE: 2,79) (tabla 1).
DiscusiónEs notorio que la anastomosis pancreatoentérica es compleja y conlleva un riesgo de dehiscencia y de FPP que varía entre el 9,9 y el 28,5%, según las series y la definición de fístula utilizada1,2. Es más, si se analiza este porcentaje únicamente en pacientes con páncreas blandos, este se eleva considerablemente sobrepasando en algunos estudios el 40%2,9,10. Han sido muchos los intentos en los últimos años para reducir la incidencia de la misma, pero ninguna ha conseguido ser la anastomosis estándar para minimizarla, por ello existen diferentes técnicas para la realización de la anastomosis pancreaticoentérica, con el fin de limitar el riesgo de complicaciones inmediatas y de mejorar los resultados funcionales, pero en los últimos ensayos clínicos y metaanálisis que comparan dichas técnicas no se ha conseguido demostrar una eficacia claramente superior de una sobre las otras1,2. No existe, por tanto, ninguna técnica anastomótica que permita anular por completo el riesgo de FPP. En cuanto a la evidencia actual disponible sobre la utilización de sellantes de fibrina (independientemente del pegamento o parche) para reforzar la anastomosis pancreatoyeyunal tras la DPC, es incierta, ya que tras el análisis de los mismos no se puede asegurar que la utilización de éstos disminuya de forma significativa la FPP o el porcentaje de muerte posoperatoria11.
Independientemente de la técnica de anastomosis empleada, un procedimiento preciso y meticuloso es esencial para lograr buenos resultados. Se entiende que es prácticamente imposible reducir la tasa de FPP a cero, especialmente en pacientes con páncreas blando, pero sería un logro el acercarse a la tasa de aquellos pacientes con páncreas duro. De acuerdo con estudios recientes, la consistencia blanda del páncreas es probablemente el factor más determinante para la FPP6,12–14. Por ello, nuestra técnica persigue la idea de transformar intraoperatoriamente, como previamente se describe en el apartado técnica quirúrgica, un páncreas blando en uno duro sin añadir morbimortalidad y con un gesto técnico sencillo y reproducible. Se considera que además de la mejora en las técnicas quirúrgicas para reducir la incidencia y la morbimortalidad de dicha complicación, son necesarias diversas estrategias para obtener mejores resultados en pacientes de alto riesgo.
Son sabidas las limitaciones que tiene este estudio. Primero, el pequeño tamaño muestral, segundo, que la muestra es retrospectiva, tercero, que se trata de un trabajo unicéntrico, cuarto, que son tres cirujanos distintos los encargados de realizar la cirugía, y quinto, que la consistencia del páncreas es un parámetro subjetivo. Sin embargo, se considera necesario el poner en conocimiento REDMA por la baja tasa de morbimortalidad observada en pacientes con páncreas blando y con un riesgo de FPP moderado/alto, a pesar de todas las limitaciones enumeradas con anterioridad.
En conclusión, tras ser analizados los resultados de las complicaciones posquirúrgicas entre la técnica clásica vs. REDMA, se puede afirmar en favor de esta última, que existen diferencias estadísticamente significativas en cuanto a morbimortalidad. Ello hace pensar que REDMA podría llegar a ser una alternativa útil para la reconstrucción del tránsito tras una DPC en páncreas de consistencia blanda y riesgo moderado/alto de FPP. No obstante, se considera que estos resultados deben ser interpretados con cautela, ya que la finalización del estudio con el tamaño muestral para el cual fue diseñado, o el inicio de un ensayo clínico aleatorizado, podrán arrojar más información para determinar la superioridad o no de esta innovación quirúrgica y así poder valorar de forma independiente y objetiva estas impresiones.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.