La carcinomatosis peritoneal (CP) es una situación evolutiva de los cánceres intraabdominales que llega a presentarse hasta en el 7,7% de los pacientes (con cáncer de origen no ginecológico) en el momento de la cirugía inicial1. Es más, Brodsky et al2 comprobaron que tenían afección peritoneal entre el 25 y el 35% de los pacientes con cáncer colorrectal.
Sin tratamiento tiene una evolución fatal, con una supervivencia media si el primario es colorrectal de 8,5 meses, de 2,4 meses si es de páncreas y de 2,2 meses si gástrico3. Pero el resultado tampoco fue mucho mejor con la introducción del 5-fluorouracilo (5-FU), con una supervivencia media de 6,9 meses en los pacientes con cáncer colorrectal, de 2,9 meses para los de cáncer pancreático y de 6,5 meses para los de cáncer gástrico4.
La quimioterapia más reciente, basada en oxaliplatino, irinotecan y agentes biológicos, ha mejorado la supervivencia de los pacientes con cáncer de colon metastásico hasta los 16-20 meses5-7. Desgraciadamente, ninguno de estos ensayos aporta datos sobre los resultados en pacientes con carcinomatosis peritoneal, y simplemente se la considera otra forma de enfermedad diseminada. Sin embargo, la consideración de la CP como una situación de enfermedad locorregional ha abierto la posibilidad a nuevos y prometedores abordajes.
Ya en 1980 Spratt et al8 publicaron la utilización de tiotepa en un paciente con seudomixoma peritoneal y Speyer et al9 utilizaron 5-FU y metotrexato en 16 pacientes con CP. Poco después, Koga et al10 comunicaron la utilización de quimioterapia intraperitoneal con hipertermia en 23 pacientes con CP de origen gástrico.
Muchos estudios en fase II han explorado la vía intraperitoneal de administración de fármacos y muestran resultados prometedores en pacientes con CP. En el cáncer colorrectal con CP se alcanzan supervivencias medias de 16 a 35,9 meses, con tasas generales de supervivencia a 5 años entre el 25 y el 47%11-16. Verwaal y al17, en un estudio fase III, aleatorizaron a los pacientes con CP de origen colorrectal para cirugía paliativa y quimioterapia sistémica con fluorouracilo-leucovorin o para citorreducción máxima más quimioterapia intraoperatoria intraperitoneal hipertérmica (HIPEC) con mitomicina C y posterior quimioterapia sistémica. Ese trabajo mostró un beneficio significativo en la supervivencia en el brazo HIPEC, con una mediana de supervivencia de 22,2 meses frente a los 12,6 meses del grupo control.
Glehen et al18 recogieron retrospectivamente información de 506 pacientes con CP de 28 instituciones tratados mediante cirugía citorreductora y quimioterapia intraperitoneal perioperatoria. La mediana de supervivencia general llegó a 19,2 meses. Los pacientes en los que la citorreducción fue completa alcanzaron una mediana de supervivencia general de 32,4 meses frente a los 8,4 meses de los pacientes con citorreducción incompleta.
No hay duda de que está en aumento la evidencia clínica en la literatura médica que respalda el tratamiento combinado de cirugía citorreductora y quimioterapia intraperitoneal periope-ratoria19-23. En esos trabajos se constata el valor crucial de una citorreducción máxima, que debe eliminar todos los depósitos tumorales mayores de 1-2 mm24. En estudios univariable y multivariable, la citorreducción con residuo mínimo (depósitos tumorales ≤ 2,5 mm) es el principal factor pronóstico14-18.
Sin embargo, es necesario entender claramente la farmacología y la farmacocinética del uso perioperatorio de la quimioterapia en el tratamiento de la carcinomatosis peritoneal. Del análisis de los datos farmacológicos se puede conseguir una mayor seguridad y obtener importantes innovaciones terapéuticas.
La barrera peritoneoplasmáticaEl peritoneo es un complejo órgano tridimensional que recubre los órganos abdominopelvianos y la pared abdominal y contiene un gran espacio virtual. La descripción más detallada de la ultraestructura del peritoneo humano se la debemos a los trabajos de Baron25 allá por 1941.
Está compuesto por una capa simple de células mesoteliales sobre una membrana basal y cinco capas de tejido conectivo que llegan a alcanzar un espesor total de 90 µm. Las capas de tejido conectivo incluyen células intesticiales (fundamentalmente pericitos, células parenquimatosas y capilares sanguíneos) y una matriz de colágeno, ácido hialurónico y proteoglucanos.
Las funciones reconocidas del peritoneo son dos. Por un lado, reduce la fricción entre órganos intraabdominales y con la pared abdominal produciendo una sustancia lubricante a base de glucosaminoglucanos y fosfolípidos26. Por otro, es esencial, junto con los agregados linfocitarios dispersos por las vísceras y el peritoneo parietal, en la defensa del huésped contra las infecciones intraabdominales. También se ha propuesto una posible función del peritoneo en las neoplasias, actuando como primera línea de defensa contra la carcinomatosis peritoneal27. Cualquier rotura estimula la cascada de adhesióninvasión de las células tumorales, lo que facilita el desarrollo de nódulos tumorales en la superficie abdominopelviana28.
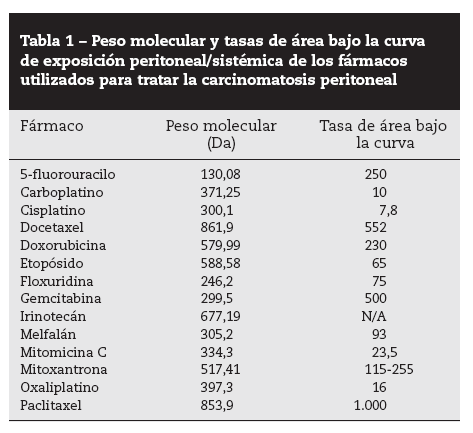
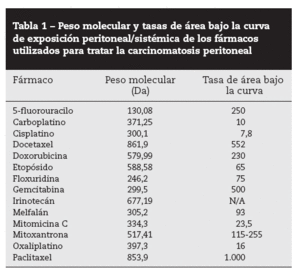
«Efecto farmacocinético» del peritoneoLa administración intraperitoneal de quimioterapia permite un tratamiento muy intensivo en cuanto a dosis. En investigaciones de diálisis peritoneal, Dedrick et al29 observaron que la permeabilidad peritoneal para varios fármacos antineoplásicos hidrófilos era considerablemente menor que su aclaramiento plasmático, lo que condiciona una concentración proporcionalmente muy superior en la cavidad peritoneal. Esto permite exponer a las células tumorales residuales, tras citorreducción, a altas dosis de fármaco, sin que con ello aumente su concentración y su toxicidad sistémicas. Esta ventaja queda reflejada por las tasas de área bajo la curva (ABC) de exposición intraperitoneal frente a la plasmática. La tabla 1 presenta el peso molecular y las tasas de ABC IP/IV de los fármacos utilizados clínica o experimentalmente en pacientes con CP30.
Tabla 1 – Peso molecular y tasas de área bajo la curva de exposición peritoneal/sistémica de los fármacos utilizados para tratar la carcinomatosis peritoneal
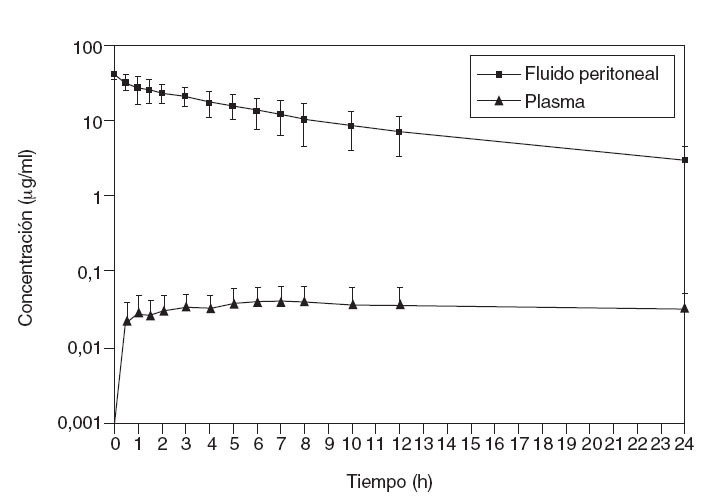
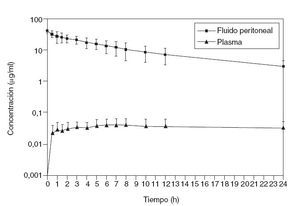
En la figura 1 se ilustra la elevada exposición de la superficie peritoneal a una solución de paclitaxel que, dados su alto peso molecular (853,9 Da) y un componente hidrófilo, atraviesa muy lentamente la membrana peritoneoplasmática. La tasa ABC es aproximadamente 1.000.
Fig. 1 – Estudio farmacocinético de concentración frente a tiempo para el paclitaxel intraperitoneal. Concentraciones de paclitaxel en fluido peritoneal y plasma durante las 24 h tras instilación lo más rápida posible de una dilución de 30 mg/m2 de fármaco en una solución de diálisis peritoneal de dextrosa al 1,5%.
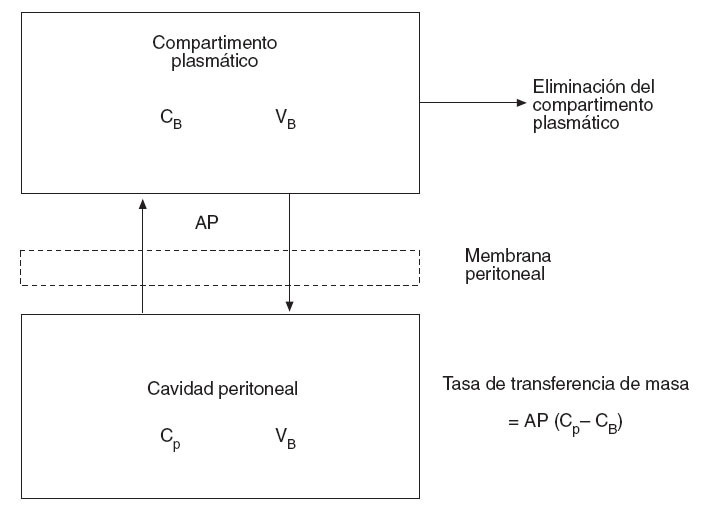
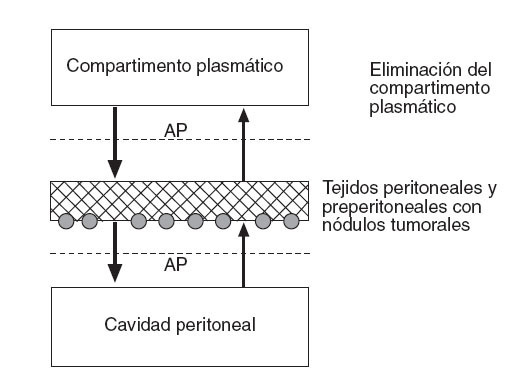
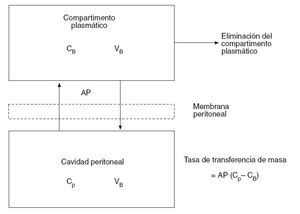
Flessner31 expresa este efecto membrana del peritoneo con un modelo matemático de difusión que considera el plasma como un compartimento único, separado por una membrana efectiva de otro compartimento único, la cavidad peritoneal (fig. 2). De ello deriva la siguiente ecuación:
Tasa de transferencia de masa = AP (Cp – CB)
donde AP es el área de permeabilidad (coeficiente de transferencia de masa ×superficie de contacto del fluido), Cp es la concentración en la cavidad peritoneal y CB es la concentración en sangre.
Fig. 2 – Modelo tradicional bicompartimental del transporte transperitoneal. El producto área de permeabilidad controla esta transferencia y se puede calcular midiendo la tasa de desaparición del fármaco de la cavidad y dividiéndolo por la diferencia total de concentración entre la cavidad peritoneal y la sangre (o plasma). CB: concentración de fármaco libre en sangre (o plasma); Cp: concentración de fármaco libre en la cavidad peritoneal; VB: volumen de distribución del fármaco en el cuerpo; VP: volumen de la cavidad peritoneal.
Esta fórmula ofrece un modelo conceptual simple del transporte y establece la importancia del área de exposición efectiva. Sin embargo, precisa de un cálculo empírico del AP de cada fármaco y no ofrece una visión de la penetración real a nivel de la membrana peritoneal. Tampoco predice la penetración de la quimioterapia en los nódulos tumorales, uno de los factores más importantes para determinar la respuesta al tratamiento farmacológico32.
El fármaco ideal para la quimioterapia intraperitoneal tiene una alta concentración en el tejido peritoneal, dada su administración intraperitoneal directa, y una alta penetración en el nódulo canceroso. Pero también precisa de una lenta difusión hacia el capilar endotelial y en profundidad hacia el espacio subperitoneal. Si además el fármaco es rápidamente metabolizado y excretado del organismo, se mantendrá una baja concentración sistémica, lo que supone una menor toxicidad.
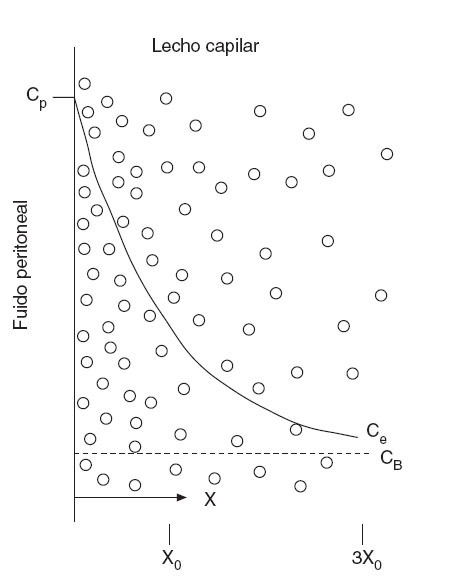
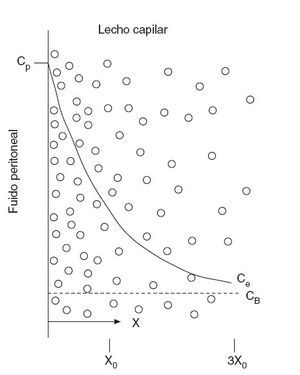
El modelo simplificado de dos compartimentos descrito anteriormente no proporciona un buen modelo teórico de la penetración de la quimioterapia intraperitoneal intraoperatoria en el espesor de la membrana peritoneal y los nódulos tumorales. Dedrick et al31 propusieron el modelo matemático de la figura 3, que muestra la penetración tisular de las moléculas de bajo peso molecular. El fármaco difunde desde su Cp hasta su CB con un gradiente de concentración exponencial sobre el peritoneo y los tejidos preperitoneales. La concentración extracelular (Ce) se puede calcular entonces según la siguiente fórmula:
C= CB + (Cp – CB) exp[–(k/D)1/2 x]
donde k (min–1) es una constante de eliminación del fármaco activo del tejido, D es la difusividad (cm2/min) y x, la distancia desde la superficie serosa (cm). Dedrick et al postularon que la distancia de penetración es igual a la raíz cuadrada del cociente entre la difusividad tisular y la constante de eliminación de fármaco desde el tejido (D/k)1/2.
Fig. 3 – Diagrama conceptual del tejido adyacente a la cavidad peritoneal. La línea continua muestra el descenso exponencial de la concentración en el tejido intersticial (Ce), a medida que el fármaco se difunde por el tejido intersticial y es retirado por la sangre. En la línea inferior se muestra la profundidad (X) y se marcan los puntos en los que la diferencia de concentración del fármaco entre el tejido intersticial y la sangre ha disminuido al 37% (X0) y al 5% (3X0) de su valor máximo. CB: concentración de fármaco libre en sangre (o plasma); CP: concentración de fármaco libre en el fluido peritoneal. (Modificado de: Dedrick RL, Flessner MF. Pharmacokinetic problems in peritoneal drug administration: tissue penetration and surface exposure. J Natl Cancer Inst. 1997;89:480-7.)
Este modelo implica que hay un descenso exponencial de la concentración del fármaco desde la cavidad abdominopelviana, a través de la membrana peritoneal, hasta el compartimento plasmático. Y si bien la penetración es variable con cada fármaco y cada tipo de tumor, la profundidad de penetración de una concentración efectiva de fármaco es muy escasa, unos 1-2 mm34,35. Ozols et al36 confirmaron que la adriamicina sólo penetra 4-6 capas celulares en un tumor diafragmático de un modelo murino.
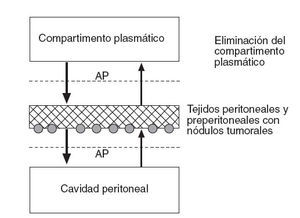
Bases farmacocinéticas del efecto de la quimioterapia intravenosa perioperatoria en el peritoneoPara entender la farmacocinética de la administración concomitante de quimioterapia intraoperatoria intraperitoneal e intravenosa, se precisa un nuevo modelo teórico, como se ilustra en la figura 4. En este caso, el peritoneo no se comporta como una simple barrera que es atravesada por las moléculas, sino que actúa como un verdadero compartimento independiente, capaz de retener parte de la solución y, por lo tanto, con un AP entre el plasma y la membrana peritoneal y otro AP entre la membrana peritoneal y el líquido peritoneal.
Fig. 4 – Modelo tricompartimental que considera la membrana peritoneal como otro compartimento independiente con capacidad para acumular fármaco. En este caso se representa una mayor velocidad de transferencia hacia la cavidad peritoneal que hacia el compartimento plasmático.
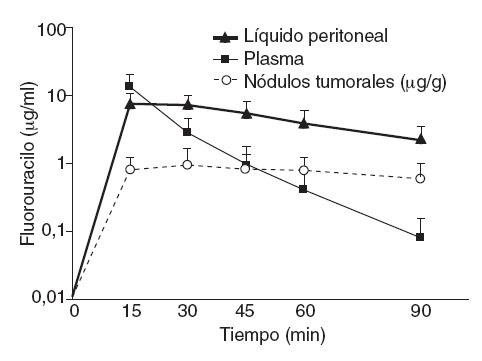
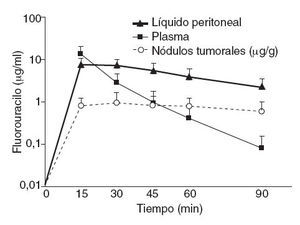
Según datos experimentales propios (fig. 5), el movimiento de las moléculas de fármaco desde la sangre hacia el líquido peritoneal a través del compartimento constituido por el peritoneo es rápido, mientras que el movimiento contrario es más lento. El fluorouracilo intravenoso pasa rápidamente del compartimento plasmático a la cavidad peritoneal, en ese momento aumentada de tamaño. Allí queda retenido, en la ascitis artificial creada por la HIPEC, durante un periodo considerable, al ser la velocidad de transferencia hacia el plasma mucho menor. Dado que el 5-FU plasmático se metaboliza y se elimina del organismo, la concentración en el líquido y la membrana peritoneales se mantiene proporcionalmente elevada respecto al plasma. Este efecto de diodo del peritoneo y de reservorio del líquido de HIPEC ofrece una ventaja farmacológica a la hora de eliminar células tumorales residuales tras la citorreducción.
Fig. 5 – Farmacodinámica de 400 mg/m2 de 5-fluorouracilo intravenoso durante quimioterapia intraperitoneal hipertérmica (HIPEC) con 3 l de solución.
Si bien no se conoce la causa de esta diferencia de flujo en un sentido u otro, se cree que la presión intracapilar puede ser la causa de este efecto. De hecho, experimentos en anima-les37,38 confirmaron el incremento de la acumulación intratumoral y del efecto antitumoral de la doxorubicina y el cisplatino cuando se aumentaba la presión intraabdominal. Mediciones de la concentración local de cisplatino a lo largo del radio de nódulos tumorales peritoneales mostraron la penetración del platino mucho más allá del límite de 1 mm propuesto por Los et al35. Por otro lado, observaciones sin D, la permeabilidad P, el área efectiva de membrana o disminuir la constante k. El efecto farmacocinético de alguno de estos factores se explica a continuación.
Extensión de la peritonectomíaEn contra de la intuición, la eliminación de la cobertura mesotelial, tal y como se realiza durante los procedimientos de peritonectomía, no altera significativamente las propiedades farmacocinéticas del peritoneo. Flessner et al39 demostraron en un modelo murino que la eliminación de la capa de fluido retenido y la del recubrimiento mesotelial no influyen en el coeficiente de transferencia de masa (MTC) de la barrera. En humanos se puede obtener evidencia indirecta de esta hipótesis por el hecho de que la extensión de la peritonectomía en pacientes con CP apenas altera la farmacocinética de la quimioterapia intraperitoneal con mitomicina C o 5-FU40,41.La investigación básica demuestra que la pared de los capilares sanguíneos y la matriz intersticial circundante forman las barreras para la transición de moléculas desde el espacio abdominopelviano42.
TemperaturaLa adición de hipertermia a la solución de quimioterapia intraperitoneal puede aumentar la respuesta tumoral al fármaco por varios mecanismos. Primero, el calor tiene per se un efecto antitumoral directo. La hipertermia por encima de los 41 °C induce citotoxicidad selectiva en las células malignas por un mecanismo desconocido, para el que se han propuesto varias teorías: alteración de la reparación de ADN, desnaturalización proteínica e inhibición del metabolismo oxidativo en el microambiente de las células malignas que conduce a un aumento de la acidez, activación lisosomal y aumento de muerte celular43,44. Sin embargo, también se sabe que las células reaccionan a la desnaturalización proteínica mediante la estimulación de las proteínas de choque térmico (heat shock proteins). Esto induce el desarrollo de tolerancia al calor en las células tumorales que puede ocasionar que la importancia clínica de este primer mecanismo sea poca45. Segundo, los efectos citotóxicos de algunos agentes quimioterápicos aumentan al aplicar una moderada hipertermia. Este mecanismo se ha demostrado para la doxorubicina46, los complejos del platino47,48, la mitomicina C46, melfalán49, docetaxel, irinotecán y gemcitabina50. Y tercero, este aumento en la respuesta puede ser consecuencia de una alteración en la profundidad de penetración del agente quimioterápico51,52.
PresiónComo se ha comentado antes, el aumento de la presión intraabdominal produce un aumento de la difusividad y, por lo tanto, de la distancia de penetración y el efecto citotóxico de la quimioterapia intraperitoneal. Sin embargo, el límite clínico a la utilización del aumento de la presión intraabdominal lo dicta la tolerancia respiratoria y hemodinámica. En la práctica, las aplicaciones clínicas de HIPEC con presiones intraabdominales controladas hasta ahora se han limitado a paliación de ascitis maligna debilitante mediante HIPEC laparoscópico a 10-15 mmHg53,54.
Soluciones portadorasSe han valorado distintas soluciones en diferentes protocolos terapéuticos intentando aumentar la exposición peritoneal y del tumor residual al quimioterápico. Esto es especialmente importante en el contexto de la quimioterapia intraperitoneal postoperatoria precoz (EPIC), donde el mantenimiento de un alto volumen de fluido intraabdominal durante largo tiempo aumenta la distribución del fármaco y la eficacia del tratamiento. Una solución de alto peso molecular tipo hetastarch o icodextrina, que mantiene una ascitis artificial, muestra una mayor disponibilidad de fármaco al aumentar el volumen de fluido peritoneal55-57.
Por contra, en la HIPEC, con un tiempo de permanencia intraabdominal relativamente corto, se podría esperar que un portador hipotónico aumentara la absorción tisular y tumoral. Sin embargo, Elias et al58 demostraron, con soluciones de dextrosa de 100 y 150 mOsm/l, que no sólo no aumenta la penetración tumoral, sino que además se produce una alta incidencia (50%) de sangrado peritoneal postoperatorio y trombocitopenia severa que han contraindicado el uso de portadores hipotónicos.
Agentes vasoactivosEstos agentes pueden contribuir a un retraso en el aclaramiento de la cavidad peritoneal porque el flujo sanguíneo de la red vascular peritoneal y subperitoneal controlará, en gran medida, el movimiento de moléculas a través de los tejidos peritoneales y subperitoneales. Los resultados obtenidos respecto a los efectos de los agentes vasoactivos son confusos y a veces contradictorios, debido a la variedad de sistemas experimentales, complejas interacciones de efectos locorregionales y sistémicas de los agentes vasopresores y grandes diferencias entre la neovascularización de los nódulos tumorales y los capilares normales32,59-63.
Dosificación de la quimioterapia intraperitonealRubin et al64 demostraron que no existe una correlación perfecta entre la superficie peritoneal, factor determinante en la absorción del fármaco, y la superficie corporal calculada. Sin embargo, el cálculo de la dosis de fármaco se realiza preferentemente en función de la superficie corporal, pues es un buen predictor del metabolismo del fármaco y, por lo tanto, es útil para estimar la toxicidad sistémica, y tanto más si el volumen de disolución también se determina por la superficie corporal65.
Distribución de la quimioterapia intraperitonealSe ha descrito una amplia variedad de métodos, abiertos y cerrados, de administración de la quimioterapia intraperito-neal66-70. El método abierto de distribución de la solución de quimioterapia se realiza intraoperatoriamente (como HIPEC), ya que es el cirujano quien distribuye la solución en el abdomen al agitar manualmente las asas intestinales. Por el contrario, el método cerrado se puede utilizar como HIPEC o como EPIC, aunque en este caso la distribución de la solución por el abdomen depende de cambios posturales. En ambos casos resulta fundamental la ausencia de adherencias para obtener la máxima distribución del fármaco.
Teóricamente, las técnicas de abdomen cerrado tienen una menor pérdida de calor durante la perfusión y un menor riesgo medioambiental para el equipo quirúrgico, mientras que las técnicas de abdomen abierto proporcionan una mejor distribución espacial de la solución por la superficie peritoneal y una distribución del calor más uniforme69. Sin embargo, hasta la fecha ningún estudio ha sido capaz de detectar ningún riesgo ocupacional para el personal sanita-rio71-73 ni se ha podido demostrar que haya diferencias de eficacia entre las distintas formas de distribución del fármaco, ya que en los estudios existentes hasta la fecha sólo la extensión de la CP, la ausencia de enfermedad extraperitoneal y la consecución de una citorreducción completa tienen correlación demostrada con la supervivencia.
Volumen de solución quimioterápicaSegún la ecuación descrita sobre la transferencia de masa de la membrana peritoneoplasmática, aumentando la superficie de contacto de la solución aumenta la transferencia de masa. Keshabiah et al74 demostraron un incremento en la transferencia de masa al aumentar el volumen de solución de diálisis. Elias et al75 y Sugarbaker et al65 comprobaron que a igual dosis total, una menor concentración de fármaco en la solución de quimioterapia condiciona una menor absorción y con ello una menor toxicidad sistémica, pero también una menor penetración en los nódulos cancerosos. Por ello concluyen que es necesario regular tanto la dosis de quimioterápico como el volumen de solución en función de la superficie corporal del paciente, y evitar la administración de volúmenes variables en función de la capacidad de la cavidad abdominal, que puede tener una superficie muy variable, con lo que resultan impredecibles la absorción total de fármaco y su toxicidad65.
Algunas instituciones que utilizan el método cerrado de HIPEC calculan la dosis de fármaco por litro según la superficie corporal y lo diluyen en un gran volumen de solución portadora (hasta 6 l), que se deja en un reservorio76-79. Con este método la cantidad de solución de quimioterapia que entra en contacto con la superficie peritoneal puede variar en función de distintas condiciones (el grado de distensión de la cavidad abdominal inducido por la solución de quimioterapia —2 a 6 l—, el sexo del paciente, la cantidad de ascitis preoperatoria o la extensión de la resección visceral), lo que hace menos predecibles la absorción de fármaco y, por lo tanto, la toxicidad.
DuraciónLa duración de la HIPEC variará entre 30 y 90 min en función de las características farmacocinéticas y la dosis total del fármaco empleado.
Macromoléculas portadorasLa modulación de la farmacocinética de los quimioterápicos administrados intraperitonealmente mediante macromoléculas portadoras es una alternativa en fase de experimentación, sin que los resultados obtenidos permitan obtener conclusiones de momento80,81.
Sensibilidad individual de los tumores al fármaco con o sin hipertermiaLa selección de los fármacos utilizados en quimioterapia perioperatoria se ha basado en investigaciones en las respuestas obtenidas con la administración sistémica, en las propiedades farmacodinámicas y farmacocinéticas del fármaco con la administración intraperitoneal, en el aumento de la citotoxicidad con la hipertermia y en la sinergia entre los agentes quimioterápicos. Sin embargo, los tumores son heterogéneos y tienen respuestas variables a los quimioterápicos82,83, incluso en el caso de muestras de CP84. Pero aunque en el futuro se pueda realizar selección individualizada de fármacos en pacientes con CP, aún no hay datos prospectivos que respalden una mejoría en los resultados clínicos mediante la selección del fármaco basado en tests de sensibilidad in vitro.
Coordinación de la quimioterapia con la cirugíaConsiderando el momento de aplicación de quimioterapia en relación con la cirugía en pacientes con CP, ésta se puede aplicar en cuatro momentos diferentes.
Quimioterapia de inducción intraperitoneal y/o intravenosaTambién denominada neoadyuvant intraperitoneal and systemic chemotherapy (NIPS), pretende reducir la cantidad de tumor a eliminar mediante cirugía citorreductora. Aunque se ha obtenido respuestas clínicas y radiológicas85-87, presenta algunas potenciales desventajas: adherencias de intervenciones quirúrgicas previas pueden interferir con una adecuada distribución del fármaco, son muy raras las respuestas completas o puede añadir morbilidad y mortalidad al tratamiento quirúrgico posterior88. Por ello actualmente está en fase de evaluación cuando no se considera posible una citorreducción completa.
Quimioterapia intraperitoneal intraoperatoriaHa sido la modalidad más utilizada, con mejorías clínicas constantes en muchos estudios en fase II y alguno en fase III11-23
. Bien con técnica abierta, bien con técnica cerrada, cada vez son más los autores que se decantan por una estrategia de quimioterapia intraoperatoria bidireccional que combine quimioterapia intraoperatoria intravenosa e intraperitoneal hipertérmica para crear un gradiente de difusión bidireccional que optimice el aporte del quimioterápico a los nódulos peritoneales diana60. Sin embargo, se debe depurar la combinación más eficaz de administración (perfusión continua frente a bolos frente a bolos repetidos), dosificación y combinación de fármacos en esta estrategia bidireccional.
Quimioterapia intraperitoneal postoperatoria precozUtilizada en condiciones de normotermia y combinada o no con HIPEC89, tiene algunas ventajas conceptuales: se administra tras la cirugía citorreductora en un momento con mínima enfermedad tumoral residual, se inicia antes de que cicatrice la herida, con lo que se minimiza el riesgo de alterar la distribución del fármaco por adherencias, y puede eliminar células atrapadas en depósitos de fibrina postoperatorios. La adecuada selección de agentes quimioterápicos según sus principios farmacológicos invita a utilizar fármacos específicos para el ciclo, como el 5-FU o los taxanes.
Quimioterapia combinada intraperitoneal y sistémica a largo plazoEsta estrategia, adyuvante y no perioperatoria, ha demostrado en ensayos fase III mejorar la supervivencia de pacientes con cáncer de ovario en estadio III óptimamente citorreducidos cuando se compara con quimioterapia exclusivamente intra-venosa90-92, si bien con importantes complicaciones que han limitado su utilización. También se puede emplear como un «puente quimioterápico» entre una cirugía incompleta inicial y la citorreducción definitiva.
ConclusionesLa administración de quimioterapia perioperatoria en pacientes con carcinomatosis peritoneal debe estar regida por principios farmacológicos. Los estudios de fracasos publicados sobre cirugía citorreductora más quimioterapia perioperatoria determinan que donde con más frecuencia recurre el cáncer es en la cavidad abdominopelviana93,94. Coordinar la quimioterapia como una parte programada del tratamiento quirúrgico es crucial para el éxito del tratamiento de pacientes con enfermedad mínima residual tras cirugía citorreductora.
*Autor para correspondencia.
Correo electrónico: antoniobarrasa@aecirujanos.es (A. Barrasa). 009-739X/$-see front matter © 2008 AEC. Publicado por Elsevier España, S.L. Todos los derechos reservados.